大球盖菇菌渣原位还田对土壤理化性质及真菌多样性的影响
洪 琦,张津京,郝海波,赵 静,陈 辉**,赵 勇
(1 上海海洋大学食品学院,上海 201306;2 上海市农业科学院食用菌研究所,农业农村部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,国家食用菌加工技术研发分中心,上海市农业遗传育种重点开放实验室,上海 201403;3 上海光明森源生物科技有限公司,上海 201408)
我国是食用菌生产大国,2019 年我国食用菌总产量已超过3 700 万t。 在食用菌产出的同时,食用菌栽培剩下的培养料(菌渣)随着食用菌产量的提高也逐年增加,目前已超过8 000 万t[1]。 菌渣中有大量的有机质,富含植物生长所需且易于吸收利用的氨基酸、维生素、碳氮化合物及其他微量元素,是一种良好的有机肥原料[2]。 目前,菌渣的循环利用率并不高,通常以丢弃或燃烧的方式进行处理,这不仅造成资源的浪费,也对环境造成污染。 因此,菌渣的循环利用是目前食用菌产业可持续发展亟需解决的问题。
研究表明,食用菌的废菌棒能够有效提高土壤的pH、有机质以及速效氮、磷、钾的含量,改善土壤的理化性质,提高肥力[3]。 香菇渣和平菇渣能够显著改善土壤肥力,尤其对提高速效钾和全磷的含量有显著效果,且能够降低土壤pH[4]。 菌渣与化肥混合施用不仅能够有效改良土壤,显著提高土壤中活性有机碳的质量分数(LOC)以及全氮、碱解氮和有效磷的质量分数[5],还能优化肥料在土壤中的转化过程[6]。菌渣还田对微生物和酶活性也有一定影响。 菌渣还田后,土壤中脱氢酶、磷酸酶、脲酶等活性显著提升,硝酸还原酶的活性受到抑制[7-10];土壤中细菌多样性水平得到显著提升,但真菌多样性受到菌渣种类和试验条件的影响呈现出不同的结果[7-9]。
大球盖菇(Stropharia rugosoannulataFarl. Ex Murrill),又名皱环球盖菇、酒红色球盖菇、斐氏球盖菇等,为球盖菇科球盖菇属食用菌[11]。 在我国,大球盖菇主要种植在西南地区和东北地区[12]。 大球盖菇中必需氨基酸种类齐全,含有多种生物活性物质,具有很高的营养价值,并且其抗氧化、降血糖的药理作用使其有发展成为药物和保健食品的潜力[13]。 同时,大球盖菇拥有良好的抗杂和抗逆能力,栽培技术不复杂,能高效降解纤维素和木质素等,可有效解决农林废弃物的循环利用问题[14]。 据中国食用菌协会2019年统计数据显示,2018 年大球盖菇产量为57 151.21 t,增长率为96.92%,呈快速增长趋势。 随着大球盖菇产量的快速增加,菌渣的产生量也迅速增长。 目前,对大球盖菇的研究多集中在栽培种植和生物活性方面,而对其菌渣利用及还田后对土壤理化性质和微生物多样性影响的报道甚少。 本试验研究大球盖菇菌渣还田对土壤理化性质和真菌多样性的影响,以期为大球盖菇菌渣还田及其有效利用提供理论依据。
1 材料与方法
1.1 大球盖菇栽培及菌渣还田后的土壤取样
采用稻秸秆作为栽培大球盖菇的培养料,其使用量为2.25 ×105kg∕hm2。 播种后,根据实际情况采取相应措施,使堆放发酵的温度保持在22—28 ℃,培养料含水量为70%—75%,覆土,调整其相对湿度至90%—95%,温度为12—25 ℃[15]。 采收后,剩余的菌渣量为2.7 ×104kg∕hm2。 在大球盖菇菌渣原位还田1 个月后,分别从种植过大球盖菇的土壤(处理组)和未种植大球盖菇的土壤(对照组,CK)中收集土壤样品。 按照十字取样法将处理组的土壤分为横向(HT)和纵向(ZT),在HT 和ZT 两个方向分别选取5 个点进行取样,将所取样品混合均匀,记为JZ,取土深度为0—20 cm。
1.2 土壤pH 的测定
参照NY∕T 1377—2007《土壤pH 的测定》,采用电位法测定土壤pH。
1.3 土壤有机质含量的测定
土壤有机质含量采用重铬酸钾氧化-外加热法测定。 在加热条件下,土壤中的有机质被过量重铬酸钾-硫酸溶液氧化,重铬酸钾中的Cr4+被还原为Cr3+,其含量与样品中有机质的含量成正比,用分光光度计于585 nm 波长处测定吸光度,计算有机质含量[16]。
1.4 土壤氮磷钾含量的测定
参照GB 7173—1987《土壤全氮测定法(半微量开氏法) 》测定土壤全氮含量;速效氮含量采用碱解扩散法测定[17];用混合酸高温消解土壤样品,采用钼锑抗比色法测定全磷含量[18];参照NY∕T 1121.7—2014《土壤检测 第7 部分:土壤有效磷的测定》测定速效磷含量;参照LY∕T 1234—2015《森林土壤钾的测定》测定全钾含量;速效钾含量采用醋酸铵浸提-火焰光度法测定[19]。
1.5 土壤酶活性的测定
土壤中性磷酸酶(S-NP)活性采用磷酸苯二钠比色法测定[7];土壤脱氢酶(S-DHA)活性采用TTC 比色法,用分光光度计于485 nm 处测定其吸光值[8]。
1.6 土壤真菌多样性的测定与分析
参考曹敏等[20]的方法,采用CTAB 法提取样本中的真菌DNA[21],提取的DNA 用1%琼脂糖凝胶电泳进行纯度和浓度的检测。 以各样品总DNA 为模板,根据测序区域的选择,使用带有barcode 的特异引物ITS1F(5’-CCTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)对样品ITS1区进行扩增。 PCR 条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸45 s,35 个循环;72 ℃延伸10 min。 每个样本重复5 次,将同一样本的PCR 产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA 凝胶回收试剂盒切胶回收PCR 产物,再用Tris-HCl 洗脱,用2%琼脂糖电泳检测。 根据电泳检测结果,将PCR 产物进行荧光定量,按PCR 产物测序量进行相应比例的混样。 在Illumina MiSeq 测序平台进行高通量测序,再过滤处理得到优化序列。 去除嵌合体序列后进行OTU 聚类分析,对OTU 的代表序列进行分类学分析。 样品DNA 由上海美吉生物医药科技有限公司完成测序。
1.7 数据分析
使用SPSS Statistics 26 软件对试验数据进行分析,P<0.05 为差异显著。
2 结果与分析
2.1 大球盖菇菌渣还田对土壤pH 的影响
大球盖菇菌渣原位还田后,处理组土壤pH 为7.45,与CK(pH 7.56)相比显著降低,表明大球盖菇菌渣原位还田能够降低土壤pH,中和土壤酸碱度。
2.2 大球盖菇菌渣还田对土壤有机质含量的影响
土壤有机质含量是衡量土壤肥力的重要指标之一,大球盖菇菌渣原位还田后,处理组土壤有机质含量为2.213%,与CK(有机质含量为1.720%)相比显著增加了28.66%,表明大球盖菇菌渣原位还田能够提高大田土壤的有机质含量,增加大田土壤肥力。
2.3 大球盖菇菌渣还田对土壤氮、磷、钾含量的影响
如表1 所示,处理组土壤中全氮、全磷、全钾、速效氮、碱性速效磷和速效钾含量分别为0.157%、0.347 mg∕g、5.750 mg∕g、30.992 mg∕kg、26.567 mg∕kg 和85.252 mg∕kg,比CK 分别提高了180.4%、46.4%、3.9%、71.4%、228.3%和33.6%,均差异显著,表明大球盖菇菌渣还田能够显著提高土壤养分含量。

表1 菌渣还田对土壤氮、磷、钾含量的影响Table 1 Effects of returning fungus residue to the field on the content of soil nitrogen,phosphorus and potassium
2.4 大球盖菇菌渣还田对土壤酶活性的影响
土壤磷酸酶是催化土壤有机磷化合物矿化的酶,其活性高低直接影响着土壤中有效磷的供应状况,是评价土壤磷素生物转化方向与强度的指标[7]。 研究发现:大球盖菇菌渣还田处理组土壤中性磷酸酶活性为3.927 μmol∕(d·g),比CK[2.700 μmol∕(d·g)]提高了45.4%,结合其碱性速效磷含量也显著高于CK,说明大球盖菇菌渣还田显著提高了土壤碱性速效磷的转化。
土壤脱氢酶属于氧化还原酶系,可以从一定的基质中析出氢或氢的供体进行氧化作用,能够反映土壤微生物新陈代谢的整体活性,常作为衡量微生物氧化还原能力的指标[22]。 大球盖菇菌渣还田处理组土壤脱氢酶活性为0.035 mg∕(d·g),比CK[0.026 mg∕(d·g)]提高了34.6%,差异显著。
综上,大球盖菇菌渣还田可以显著提高土壤中性磷酸酶和土壤脱氢酶的活性,进而增强土壤养分的分解和转化,提升土壤肥力。
2.5 大球盖菇菌渣还田对土壤真菌多样性的影响
主成分(PCA)分析可以反映样本间微生物群落组成的差异和距离,群落组成高度相似的样品彼此靠近,群落组成差异越大,样品间的距离越大。从图1 可以看出,第一主成分和第二主成分贡献度之和为83.73%,能够较好地反映样本中真菌群落结构的差异。 3 组样本的群落组成均比较集中,说明各组样本的内部差异小。 PC1 能解释65.39%差异的原因为处理组聚集在PC1 正轴,而CK 聚集在PC1 负轴,说明PC1 是区分CK 和处理组差异的主要因素;PC2 则体现了处理组的组内差异。
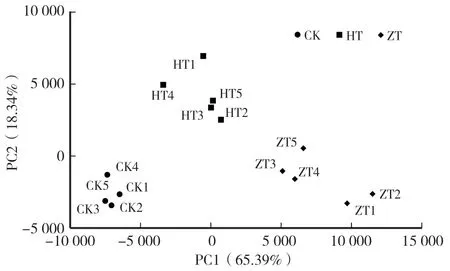
图1 土壤样品的PCA 分析Fig.1 PCA analysis of soil samples
Shannon-Wiener 曲线是利用各样本的测序数量在不同测序深度时的微生物多样性指数构建的曲线,能够反映各样本在不同测序数量时的微生物多样性。 从图2A 可以看出,曲线在测序基因数量为20 000 时已趋于平坦,说明测序数量已经足够大,可以反映样本中绝大多数的微生物信息。 从图2B 可知,处理组HT 和ZT 的Shannon 指数均低于CK,表明大球盖菇菌渣还田会降低土壤的真菌多样性水平。

图2 菌渣还田对土壤真菌多样性的影响Fig.2 Effects of fungus residue returning to the field on fungal diversity in soil
2.6 大球盖菇菌渣还田对土壤真菌群落结构组成的影响
如图3 所示,在3 组样本中,Hypocreales(肉座菌目)、Sordariales(粪壳菌目)、Ascomycota(子囊菌门)3种菌群是主要的优势菌群,相对丰度之和约占总丰度的60%。 与CK 相比,大球盖菇菌渣还田后,土壤中Hypocreales(肉座菌目) 的相对丰度明显增加,占总丰度的25%—50%;Capnodiales(煤炱目)、Saccharomycetales(酵母目)、Pezizales(盘菌目)、Russulaceae(红菇科)的相对丰度也大幅增加;Incertae_Sedis、Pseudoplatyophyra(拟匙口虫属)、Aleuria(网孢盘菌属)、Onygenales(爪甲团囊菌目)、Sordariomycetes(粪壳菌纲)、Trichosporon(丝孢酵母属)的相对丰度明显下降。

图3 菌渣还田对土壤真菌群落结构组成的影响Fig.3 Effects of fungus residue returning to the field on the structure and composition of fungal community in soil
2.7 大球盖菇菌渣还田后土壤真菌丰度分布分析
如图4 所示,与CK 相比,处理组土壤中优势菌群发生了改变,各组样本均有其不同于其他样本的优势菌群。 处理组土壤中Incertae_Sedis、Pseudoplatyophyra(拟匙口虫属)、Aleuria(网孢盘菌属)、Onygenales(爪甲团囊菌目)、Trichosporon(丝孢酵母属)、Sordariomycetes(粪壳菌纲)、Sordariales(粪壳菌目)、Basidiomycota(担子菌门)等菌群丰度减小,而Hypocreales(肉座菌目)、Russulaceae(红菇科)、Pezizales(盘菌目)、Saccharomycetales(酵母目)、Bursaria(袋形虫属)等菌群丰度增加,成为优势菌群。
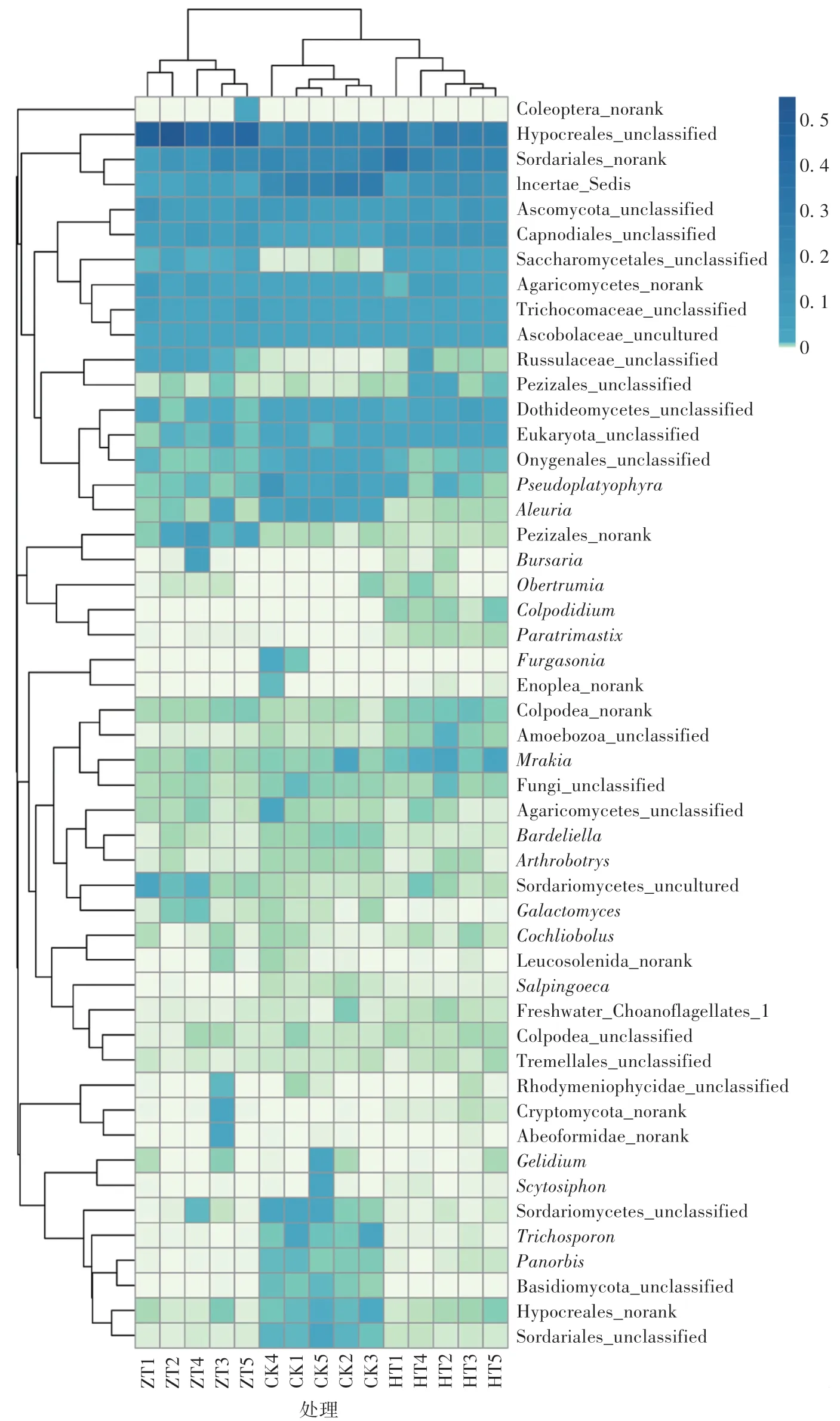
图4 菌渣还田后土壤真菌丰度分布分析Fig.4 Distribution of fungal abundance in soil after fungus residue returning to the field
3 讨论
本研究表明,大球盖菇菌渣还田对土壤理化性质和养分含量有着显著影响。 大球盖菇菌渣还田后,土壤pH 显著降低,表明大球盖菇菌渣对于降低土壤酸碱度有明显作用,与姜淑霞等[23]研究结果一致。土壤有机质含量对土壤的理化性质有着重要影响,不仅影响土壤的结构、持水量和吸热、散热能力[24],还与土壤中氮、磷等含量有显著相关性[25],在衡量培肥效果时,土壤有机质的提高量是一个重要指标[26]。与CK 相比,处理组土壤中有机质和氮、磷、钾及其速效成分含量均显著增加。 前人[9,27-29]研究表明:大球盖菇能够使土壤中有机质和有效磷含量持续增加,菌渣的施用能够有效增加水稻生长中后期土壤中有效钾的供应能力,与本试验结果一致。
土壤酶参与有机质的降解、矿化及营养元素循环等过程,是土壤中最活跃的有机成分之一,是与土壤肥力和环境质量息息相关的重要指标。 本研究中,处理组土壤中的磷酸酶和脱氢酶活性均显著高于CK,推测是因为菌渣本身的营养物质分解后改善了土壤性状,并且菌渣中含有大量的菌体蛋白,为土壤微生物的生长繁殖提供了大量的碳源和氮源,使得土壤微生物数量增加、活性增强,从而促进了酶活性的提高[8]。 可见,大球盖菇菌渣还田能够提高土壤酶的活性,增强土壤肥力,有利于土壤生态环境的改善。 多项研究表明,菌渣还田能够提高土壤中脲酶、磷酸酶、脱氢酶、几丁质酶等大多数土壤酶的活性[7-9]。 但有一些土壤酶在不同研究中呈现不同的结果:胡留杰等[9]研究认为,菌渣还田抑制了土壤过氧化氢酶和蔗糖酶的活性;邓欧平等[10]研究表明,菌渣还田能够显著提高土壤蔗糖酶的活性,且酶活性与土壤养分之间有良好的相关性;而谢放等[7]研究认为,香菇菌渣还田对土壤蔗糖酶的活性影响不明显。 以上研究结果不同可能与菌渣种类、土壤类型、种植制度及气候条件等因素有关。
高通量测序分析表明:菌渣还田处理的土壤真菌群落结构发生了明显变化,与CK 差异明显。 大球盖菇菌渣还田对真菌的生长有一定的抑制作用,与CK 相比,处理组土壤真菌多样性降低,这在一定程度上增强了土壤的抑病能力,说明菌渣还田可有效改善农田土壤的生态环境,与胡留杰等[9]、贾明等[30]研究结果一致。 但有研究认为,菌渣还田显著增加了土壤真菌数量[31],其原因可能与菌渣种类、土壤结构以及土壤性质有关,有待进一步研究。
综上,大球盖菇菌渣还田一方面为土壤提供营养物质,提高了土壤中有机质和氮、磷、钾的含量;另一方面大球盖菇菌丝作为一种真菌进入土壤提高了土壤的酶活性,促进了土壤营养物质的转化。 同时,大球盖菇菌丝进入土壤抑制了土壤中其他真菌的生长,使土壤真菌多样性降低,减少了植物病原菌的数量,增强了土壤的抑病能力。

