黄芽白菜核基因雄性不育系的选育及其败育特征分析*
付家伟,丁 丁,岳艳玲
(云南农业大学 园林园艺学院,云南 昆明 650201)
大白菜(Brassica rapaL.ssp.pekinensis)为十字花科(Brassicaceae)芸薹属(Brassica)大宗叶用蔬菜作物,原产中国,分布广泛,类型丰富,在调节蔬菜市场供应和稳定菜价中起着重要作用。黄芽白菜属于大白菜类型,质地脆嫩,品质极佳,是云南省外销和出口的重要品类。黄芽白菜主要以常规种为主,品种混杂严重,种子纯度不高。随着栽培面积的扩大,黄芽白菜品种也逐渐受到关注,一些利用自交不亲和系配制的F1代杂交种子进入市场,母本系自交亲和能力偏高,制种管理技术不高,杂种纯度仍然无法保证,给生产带来一定的风险。
雄性不育系是实现大白菜杂种优势的重要途径,以不育系做母本配制杂交种可以保证杂交种子纯度为100%[1]。目前,广泛应用的大白菜雄性不育系有胞质雄性不育和细胞核雄性不育[2]。课题组前期育成的KAB5 是一类快菜核基因雄性不育两用系,不育株花药败育彻底,不育性稳定,雌蕊发育正常,无不良性状伴生。本研究根据复等位基因遗传假说[3]及定向转育雄性不育基因的方法[4],将雄性不育基因向黄芽白菜中进行转育,以期育成黄芽白菜核基因雄性不育系,为快速培育高纯度黄芽白菜F1杂交种提供材料支撑。
1 材料与方法
1.1 材料
雄性不育源:快菜核不育两用系KAB5,由云南农业大学白菜研究室选育,不育株与可育株1∶1 分离,基因型分别为MsMs 和MsfMs,系统内兄妹交,后代可育株和不育株保持1∶1 分离;可育株自交,后代中可育株与不育株3∶1 分离。
待转育品系:黄芽白菜自交系H249,由云南农业大学白菜研究室选育。
1.2 试验方法
1.2.1 测交
以 KAB5 不育株为母本、自交系H249 为父本系进行测交,测交种子于2 ℃冰箱中通过春化后播种育苗,花期鉴定育性,移栽环境温度小于28 ℃,常规水肥管理。其他转育各世代栽培管理方法与上述测交后代相同。
1.2.2 转育方法
根据测交鉴定结果,按照待转育材料与不育源基因互补原则,凑齐复等位基因Msf、Ms 和ms,在各世代中选择与待转育品系性状一致且含有Msf和Ms 基因的个体,并与待转育品系进行连续回交,直至性状稳定(图1)。
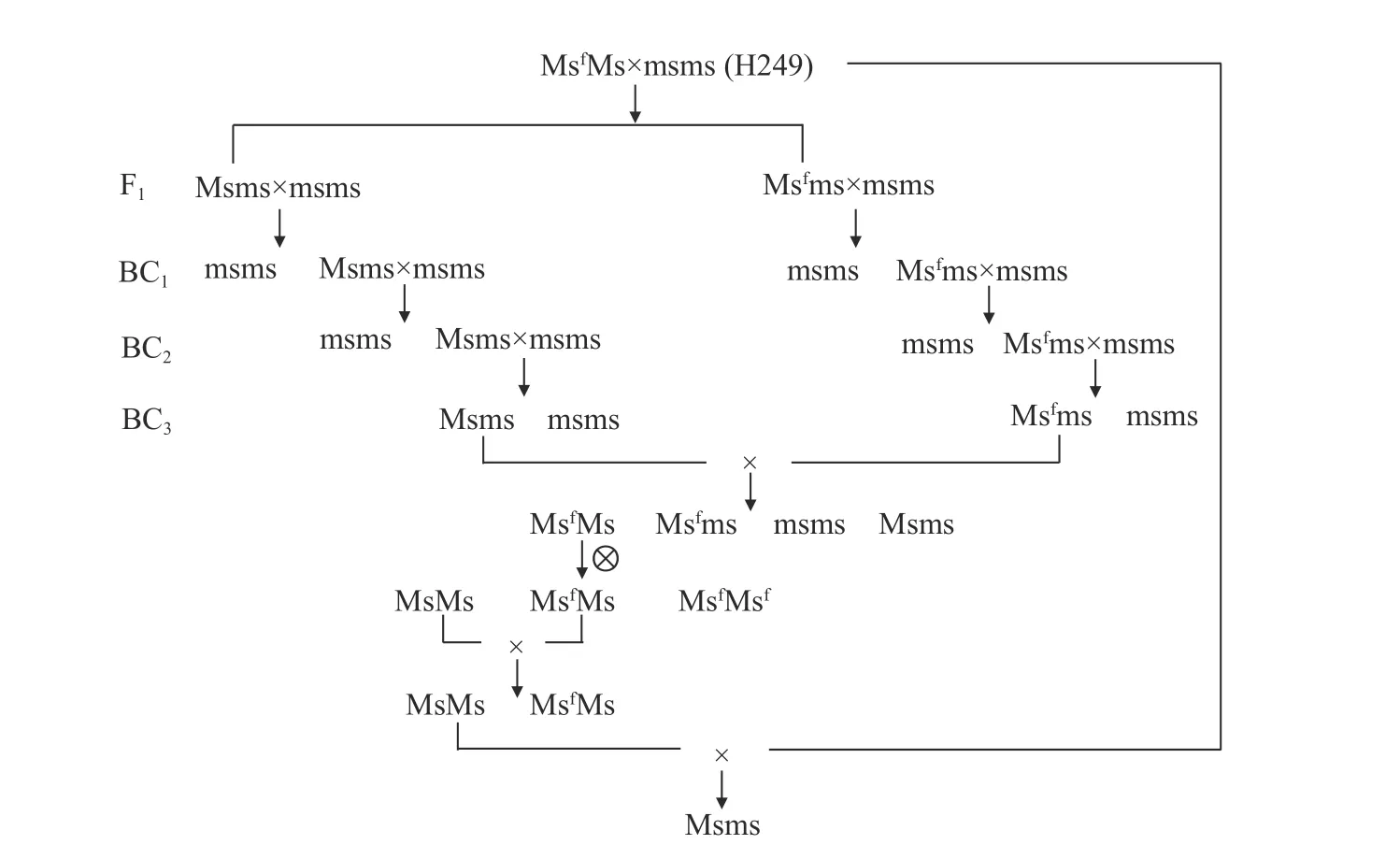
图1 黄芽白菜核基因雄性不育系转育方法Fig.1 Transferring and breeding method of genic male sterile line in Huangya Chinese cabbage
采用常规有性杂交、自交、回交和测交方法实施转育,育性与园艺性状同时选育,套袋隔离,常规手工授粉。样本容量(n)按公式n≥lg0.01/lg(1-P)[5]计算,式中:P为目标基因发生概率。X2适合性检验按公式X2=∑(|A-E|-0.5)2/E[6]计算,式中:A为实际观察数;E为理论期望数;|A-E|为实际观察数与理论期望数之差的绝对值。自由度df=1 时,X20.05,1=3.84。
1.2.3 花器表型测定
黄芽白菜H249 及其雄性不育系HA1 于2 ℃冰箱春化15 d,播种40 d 始花,于盛花期随机选取5 株,取其花序用电子数显卡尺测量不同发育时期花蕾的纵径和横径;取刚开放的花测定花瓣、萼片、雄蕊和雌蕊的长度。将已经测量的花蕾用镊子小心剥去萼片和花瓣,取出花药置于载玻片上,用镊子挤压释放小孢子或花粉,经苏木素染色后在光学显微镜下观察花粉发育过程。
2 结果与分析
2.1 H249 基因型鉴定结果
分别以3 株KAB5 不育株为母本、3 株黄芽白菜自交系H249 为父本进行测交,测交后代鉴定72 株,全为不育株(表1),说明待转育品系H249 的基因型为msms,即MsMs×msms→Msms。
2.2 黄芽白菜核基因雄性不育系转育结果
由于待转育品系中缺少Msf和Ms 基因,因此可用KAB5 可育株(基因型MsfMs)为不育源与待转育品系H249 进行杂交,即:msms×MsfMs→Msfms,Msms,杂交后代可育株与不育株1∶1 分离(表1)。在杂交后代不育株中选择3 株分别与待转育品系H249 进行回交,回交后代有50%不育株分离(表2),即Msms×msms→Msms,msms。每代选3 株不育株与待转育品系进行回交,H249 作为轮回亲本,各回交后代均有50%不育株分离(表2)。
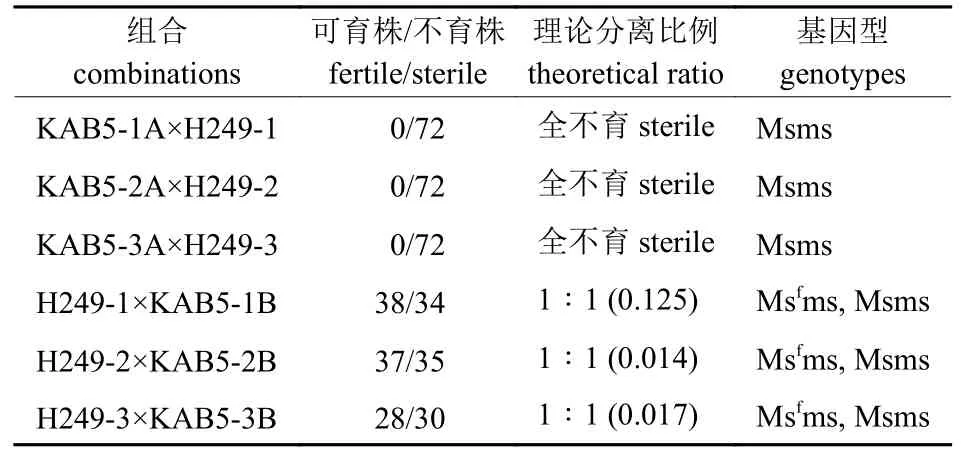
表1 H249 与KAB5 杂交后代育性分离结果Tab.1 Results of fertility segregation of hybrid progeny of crossing H249 and KAB5
KAB5 可育株与H249 杂交后代的可育株各选择3 株与H249 进行回交,后代均为可育株(表2),在其中选择7 株与H249 进行回交,H249作为轮回亲本,同时7 株可育株分别与KAB5 不育株进行测交,以区分Msfms 和msms 基因型,结果(表3)显示:((H249-1×KAB5-1B)-1B×H249)-4、-5、-7 及(((H249-1×KAB5-1B)-1B×H249)-5×H249)-1、-3 与KAB5 不育株进行测交,测交后代可育株与不育株表现为1∶1 分离,说明((H249-1×KAB5-1B)-1B×H249)-4、-5、-7 及(((H249-1×KAB5-1B)-1B×H249)-5×H249)-1、-3 的基因型是Msfms,选择其与H249 进行回交,后代基因型为Msfms 和msms。
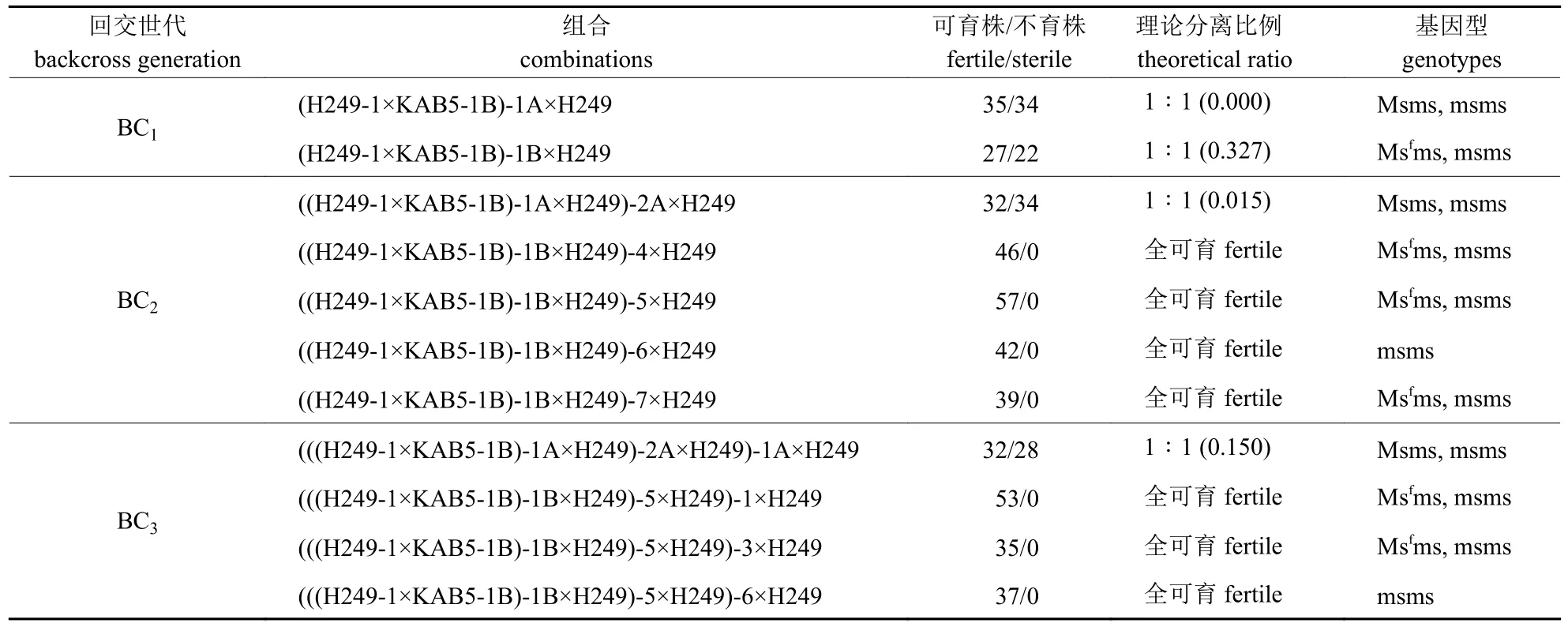
表2 H249 各回交后代育性表现Tab.2 Fertility expression of progenies from H249 backcrossing

表3 各世代Msfms 基因型测交结果Tab.3 Test cross results of genotyping of Msfms in different generations
将回交3 代(((H249-1×KAB5-1B)-1A×H249)-2A×H249)-1A×H249 不育株(基因型Msms)与(((H-249-1×KAB5-1B)-1B×H249)-5×H249)-1×H249的Msfms 基因型植株进行杂交,后代可育株与不育株3∶1 分离,选择可育株进行自交,自交后代育性分离结果(表4)显示:12 个自交处理中,有8 个处理自交后代全为可育株,4 个处理自交后代出现可育株与不育株3∶1 分离,说明这4 个处理自交产生MsfMsf、MsfMs 和MsMs;选5 株可育株分别与同系不育株杂交,后代出现全可育或1∶1 分离,1∶1 分离的HAB1、HAB2和HAB6 即为新的甲型两用系(表5)。将新甲型两用系不育株与H249 杂交,后代100%不育株,即HA1、HA2 和HA3 为新的黄芽白菜雄性不育系。
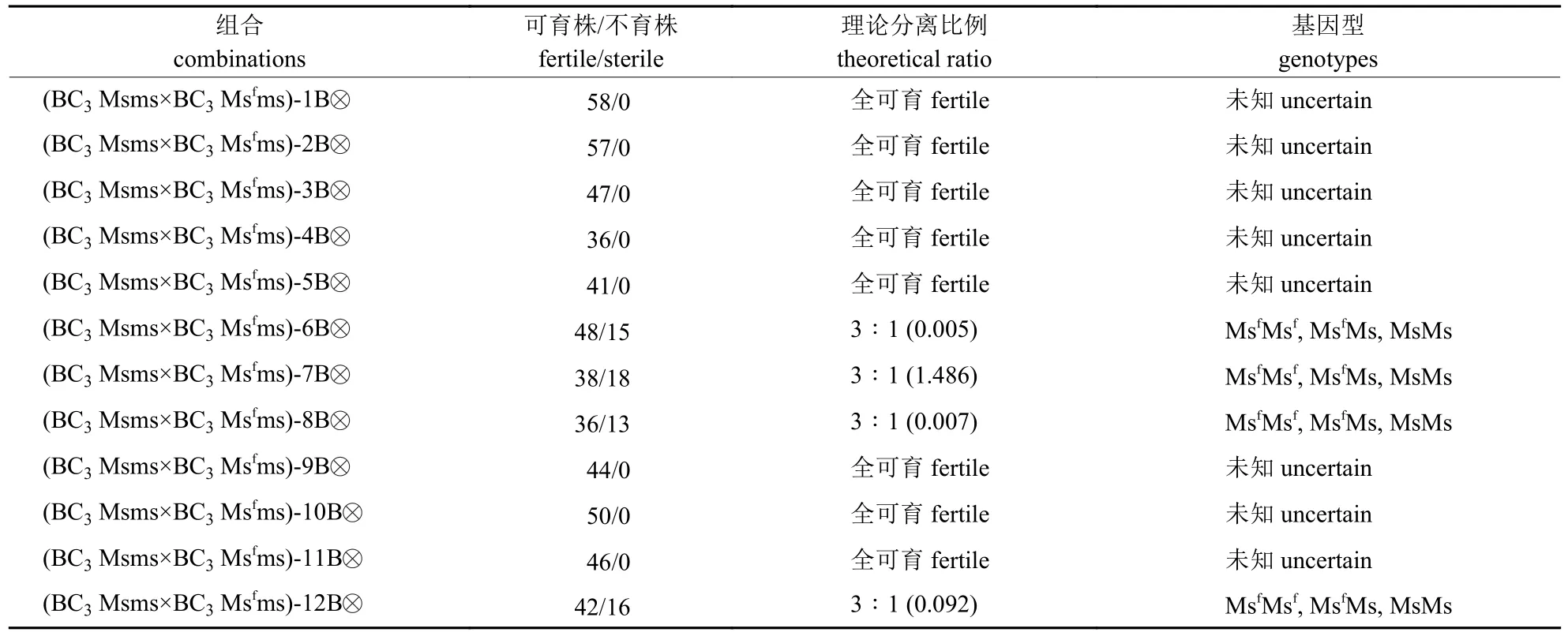
表4 BC3Msms×BC3Msfms 自交后代育性分离比率Tab.4 Fertility segregation ratio of selfing offspring from BC3Msms×BC3Msfms
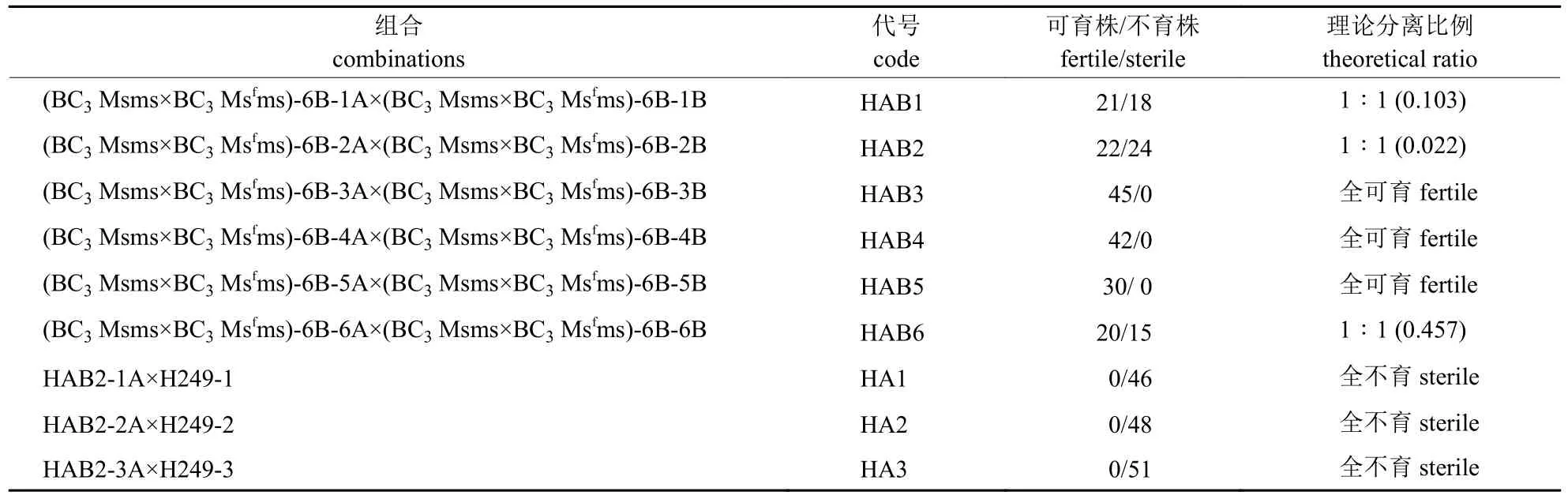
表5 黄芽白菜新甲型两用系及新不育系测配结果Tab.5 Results of the test crosses for breeding new genic male sterile line and AB lines in Huangya Chinese cabbage
2.3 黄芽白菜核基因雄性不育系的败育特征
黄芽白菜不育系花器表型检测结果(表6)发现:不育花瓣长、花瓣宽、长雄蕊高和柱头高极显著低于H249 (P<0.01),萼片长与H249 差异不显著。不育花变小,花丝和花药颜色变白,花丝缩短,花药变小(图2)。

图2 黄芽白菜核基因雄性不育系HA1 和可育系H249 的花Fig.2 Flower of genic male sterile line HA1 and fertile line H249 of Huangya Chinese cabbage

表6 HAB2 可育和不育的花器官形态Tab.6 Flower organ form between fertile and sterile plants of HAB2 mm
可育品系H249 花药和花粉均能正常发育,花粉母细胞经过正常的减数分裂(图3a)形成四分体,呈饱满球形(图3b);包裹四分体的胼胝质降解后,释放单核小孢子,球形,染色深,可见表面有外壁物质形成(图3c);至花粉成熟期,形成成熟的花粉粒和花粉外壁,染色极深(图3d)。同一发育时期,黄芽白菜不育系HA1 的花蕾均小于H249;HA1 花粉母细胞可完成减数分裂形成四分体(图3e),但四分体形状不规则 (图3f),说明此时小孢子已经开始败育;到单核期可观察到HA1 皱缩的小孢子(图3g),但之后再观察不到完整的小孢子细胞,小孢子发生完全败育。

图3 黄芽白菜不育系HA1 及可育品系H249 花药发育时期的小孢子Fig.3 Microspores of genic male sterile line HA1 and fertile line H249 of Huangya Chinese cabbage during the development of anther
3 讨论
云南省地处中国西南边陲,境内沟壑纵横,形成了立体气候条件,可实现大白菜周年生产和供应。黄芽白菜在外销批发市场及电商平台上均占有较大比重,其杂种优化是实现杂种优势利用及保障生产和品质的重要前提。目前,市场上部分黄芽白菜是采用自交不亲和系配制而成的F1杂交种,杂种纯度80%,母本种子混杂严重。分析其纯度低的原因可能为:一方面,用于配制杂交种的自交不亲和系自交亲和指数高,致使制种时母本自交结种量较高;另一方面,制种条件控制较差,制种后期采种量占比较高,导致假杂种比例升高。因此,在使用自交不亲和系制种时,很难控制杂种纯度为100%。复等位核基因雄性不育系雄蕊败育彻底,无环境敏感性,无胞质副效应[6],应用具有100%不育株率的复等位核基因雄性不育系进行制种,其成本低、过程安全、管理简单、杂种纯度100%,是较理想的雄性不育源[1]。黄芽白菜雄性不育系的育成,使利用雄性不育系生产黄芽白菜杂交种成为可能,将解决黄芽白菜杂种纯度低的难题,对提高黄芽白菜育种水平和保障其生产供应具有重要意义。
根据植株育性的改变,植物雄性不育系花器官的结构和表现形式也发生改变,大致可分为以下4 类:雄蕊退化或变形或发生瓣化[7-8];小孢子母细胞发育异常或小孢子发育异常,不能产生正常花粉,花粉畸形或败育;花药畸形不能正常开裂,可产生部分败育花粉和少量正常花粉[9];花粉形态正常,但不能正常萌发[10]。植物育性的改变会使雄性不育植株形态发生变化,其中,花蕾、花瓣、雄蕊和雌蕊等变化较大。有研究发现:小孢子的发育时期与花蕾形态指标(如花蕾长、花药长和花瓣长)密切相关[11]。黄芽白菜转入不育基因后,不育系花小,花丝和花药变白,花丝缩短,花药变小,彻底败育,在显微镜下无法看见完整的小孢子,说明黄芽白菜育性改变伴随着花形态的变化。
对150 种植物败育的调查发现:70%以上的植物败育发生在四分体时期到单核时期[12]。孙日飞等[13]认为:大白菜细胞核雄性不育系败育发生在小孢子四分体时期,由于绒毡层细胞异常膨大,挤压四分体,使四分体不能分开,不能形成正常的花粉粒,从而导致败育。叶纨芝等[14]也观察到同样的结果,并发现四分体不分离后,小孢子内不断有颗粒状的物质流出,最终使小孢子萎缩变空,不能形成花粉。谢潮添等[15]则认为:大白菜发生雄性不育,小孢子母细胞及小孢子首先出现异常,而后绒毡层细胞才出现异常;花药形成早期的造孢细胞核仁分布不均,减数分裂后四分体细胞核分布异常;包裹小孢子的胼胝质壁降解后,小孢子外壁不均匀,导致小孢子收缩败育。韩玉珠等[16]对大白菜细胞质雄性不育两用系花药的研究发现:不育系花药发育受阻于孢原细胞阶段,不形成药室,属无花粉型。花药发育受阻于孢原细胞分化期,没有孢原细胞的分化,不能形成药室。王福青等[17]研究发现:大白菜雄性不育两用系88-3 的小孢子母细胞不能进行减数分裂,从而导致小孢子不能正常发育直至败育。可见,不同大白菜不育材料的败育时期不尽相同。黄芽白菜核基因雄性不育表型发生在四分体时期,四分体不能进一步发育成单核小孢子,之后的败育过程中不能检测到完整的小孢子,是育种应用中比较可靠的一类雄性不育源,其败育机制的深入研究将有利于该优良不育源的应用。
4 结论
本研究采用定向转育方法成功将不育基因转入黄芽白菜,育成黄芽白菜核基因雄性不育系。该不育系雌蕊发育正常,雄蕊败育彻底,不育度高,不育株率100%,败育发生在四分体时期,不能形成花粉。

