四川省猪源支气管败血波氏杆菌的分离鉴定及耐药基因和毒力基因检测分析*
赵梦溪,聂民财,徐 雷,朱 玲,徐志文
(四川农业大学 动物医学院,四川 成都 611130)
支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)是一种需氧型革兰氏阴性球杆菌,是潜在的人畜共患病原体,主要引起人和其他动物的呼吸系统疾病[1]。Bb 大多仅感染患免疫抑制类疾病的人群,感染动物可引起犬传染性呼吸道综合征、猫支气管炎、猪萎缩性鼻炎和兔鼻炎[2-5]。在养猪业中,Bb 是引起猪呼吸道疾病综合征和猪萎缩性鼻炎的主要病原菌,临床轻度症状表现为支气管炎、结膜炎、鼻炎和下颌淋巴结肿大,重症表现为鼻甲骨萎缩和严重肺炎,一旦感染将给猪场造成严重的经济损失[6]。Bb 常与其他病原混合感染导致猪群发病,如Bb 与多杀性巴氏杆菌混合感染导致猪群出现萎缩性鼻炎[7],与链球菌和副猪嗜血杆菌混合感染可以增强后者的呼吸道定植[8],还可同猪繁殖与呼吸综合征病毒以及猪流感病毒相互作用,增加呼吸道病理损伤的严重程度,Bb 已经成为严重危害养猪业的重要病原菌之一[9]。
Bb 的毒力因子包括黏附素和毒素两大类,黏附素包括丝状血凝素(filamentous hemagglutinin,FHA)、菌毛(fimbriae,fla)和百日咳杆菌黏附素(pertactin,prn)等,毒素包括腺苷酸环化酶溶血素(adenylate cyclase toxin,ACT)、皮肤坏死毒素(dermonecrotic toxin,dnt)和Ⅲ型分泌系统(type-Ⅲ secretion system)等[10]。prn 可介导Bb 与免疫细胞的相互作用从而增加炎症因子的释放,导致细菌脱落造成细菌在宿主群体之间传播[11];cyaA基因编码的ACT 不仅具有溶血素活性,而且具有腺苷酸环化酶活性,还可增强Bb 对细胞的侵袭活性[12];dnt 能使Bb 在猪的鼻腔中高水平定植,并能抑制鼻甲骨成骨细胞分化能力,导致猪的萎缩性鼻炎[13]。这些毒力因子具有很强的免疫原性,在Bb 致病过程中发挥重要作用。
Bb 是引起猪呼吸道疾病的主要病原体,但关于Bb 的流行病学报道较少,持续监测猪源Bb 的流行情况、抗生素耐药性、耐药基因和毒力特征,有利于预防和控制该病原引起的疾病。本研究对四川省部分猪场呼吸道疾病的患病猪进行支气管败血波氏杆菌分离鉴定,对分离菌株进行药敏试验、耐药基因和毒力基因检测及小鼠致病性试验,探讨Bb 的耐药基因与表型以及毒力基因与致病性的相关性,为进一步研究其致病机制和该病的诊断治疗提供参考依据。
1 材料与方法
1.1 病料及试验动物
2020 年9 月—2021 年11 月从四川省部分猪场收集患呼吸道疾病病猪的肺组织、气管、鼻拭子和心包积液共56 份样品。试验动物为6 周龄昆明雌性小鼠,购自成都达硕实验动物有限公司。
1.2 主要试验材料与菌株
胰蛋白大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤(TSB)、烟酰胺腺嘌呤二核苷酸(NAD)、新生牛血清及高保真 PCR Mix (2×)预混液、DNA凝胶回收试剂盒、pUCm-T 载体和T4 DNA 连接酶购自生工生物工程有限公司;DNA 基因组提取试剂盒购自杭州科菲特生物科技公司;DNA Marker DL 2000 购自宝生物工程有限公司;Bb标准菌株由四川农业大学动物医学院动物生物技术中心保存。
1.3 试验方法
1.3.1 细菌分离培养及染色镜检
将肺组织、鼻拭子和气管等样品划线接种于TSA 平板,37 ℃倒置培养18~24 h;挑取可疑菌落接种于TSA 平板进行纯化培养,挑取单菌落进行革兰氏染色,观察其菌落形态并纯化培养。
1.3.2 PCR 鉴定
参照DNA 提取试剂盒说明书,提取1.3.1 节纯化的疑似Bb 的DNA。以细菌16S rRNA 保守区域的通用引物(27-F:5'-AGAGTTTGATCMTGGCTCAG-3 ',1492-R:5 '-GGTTACCTTGTTACGACTT-3 ')进行PCR 扩增,其预期大小为1 542 bp。PCR 反应体系为:高保真 PCR Mix(2×)预混液 25 μL,10 μmol/L 上、下游引物各2 μL,DNA模板1 μL,ddH2O补足至50 μL。PCR 反应程序为:94 ℃预变性4 min;94 ℃变性10 s,56 ℃退火10 s,72 ℃延伸30 s,35 个循环;72 ℃延伸5 min。PCR 产物经1%琼脂糖凝胶电泳检测后,经回收、连接至pUCm-T 载体后委托上海生工生物工程有限公司完成测序。
1.3.3 同源性及进化树分析
将菌株16S rRNA 序列与NCBI 同源序列进行比对。使用MEGA 6.0 将10 株分离菌株的16S rRNA 序列与从GenBank 数据库中获得的13 株Bb 16S rRNA 参考序列进行比对,并采用最大似然法以Boostrap 值(1 000 次)构建系统发育树。参考菌株为Bb 美国分离株(CP050967.1、CP022-962.2、CP019934.1、CP020651.1、CP024171.1、CP02-4173.1、CP024175.1、CP025069.1 和CP049918.1)、Bb 中国分离株(MN082542.1)、Bb 波兰分离株(MT040725.1)以及Bb 英国分离株(LR134480.1和LR134326.1)。
1.3.4 生化鉴定试验
根据细菌的理化特性,将纯化后的菌株接种到细菌微量生化反应管中,37 ℃培养24 h 并观察结果。
1.3.5 分离菌株的药敏试验
挑取单个菌落于2 mL 含有5%新生牛血清的TSB 中,37 ℃振荡培养12 h;吸取菌液100 μL至TSA 平板,使用玻璃涂布器均匀涂布;采用Kirby-Bauer 纸片扩散法,选取青霉素、氨苄西林、头孢曲松、羧苄西林、头孢唑啉、头孢他啶、头孢氨苄、卡那霉素、新霉素、利福平、氧氟沙星、左氧氟沙星、多西环素、复方新诺、红霉素、林可霉素、多粘菌素和氯霉素等18 种药敏纸片进行贴片,然后将平板倒置于37 ℃恒温培养箱中培养24 h,测量抑菌直径。参考实验室标准协会的标准,以抑菌圈直径作为敏感度的标准,将菌株分为耐药、敏感和中介3 种类型,计算各菌株的耐药率:耐药率=对某种抗菌耐药的菌株数/总菌数×100%。
1.3.6 耐药基因和毒力基因的检测
根据细菌临床耐药情况和相关文献[14-16]报道,设计合成19 种耐药基因引物(表1),包括四环素类(tetA、tetB、tetC)、磺胺类(sul1、sul2)、β-内酰胺类(Bla-TEM、Bla-SHV)、喹诺酮类(gyrA、parC)、大环内酯类和林可胺类(mefA、ermA、ermB)、氯霉素类(fexA、floR、cmlA、catA1、catB3)、氨基糖苷类(aadA2、aadB);针对猪源支气管败血波氏杆菌毒力基因丝状血凝素(fhaB)、百日咳杆菌黏附素(prn)、腺苷酸环化酶-溶血素毒素(cyaA)、皮肤坏死毒素(dnt)和Ⅲ型分泌系统效应器A (bteA)及鞭毛(fla)基因[17-18],设计并合成引物(表1)。以细菌DNA 为模板,对10 株Bb 进行检测,PCR 反应体系和程序同1.3.2 节。
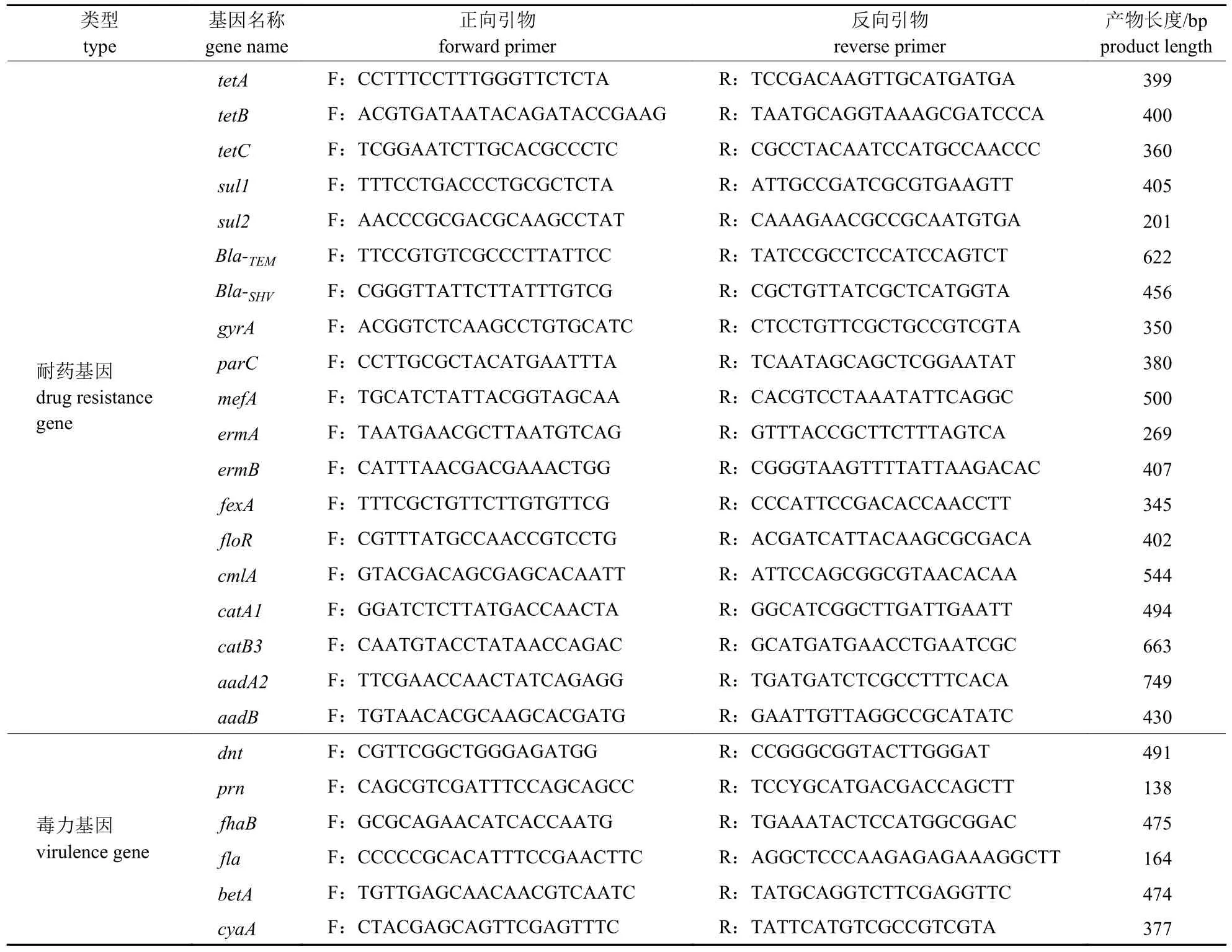
表1 耐药基因和毒力基因引物序列Tab.1 Drug resistance gene and virulence gene primer sequences
1.3.7 分离菌对小鼠的致病性
选取66 只SPF 昆明小鼠,随机分为11 组,第1~10 组为分离菌液处理组,第11 组为对照组。采用麦氏比浊法稀释纯培养的分离菌菌液,使其密度约为1×109CFU/mL,第1~10 组小鼠分别腹腔注射分离菌株0.2 mL,第11 组注射等量PBS。小鼠自由采食和饮水,定时观察,记录小鼠精神状态和死亡率。对死亡小鼠进行解剖,并无菌采集其肝脏和肺脏进行细菌分离,观察其菌落形态并进行革兰氏染色镜检。
2 结果与分析
2.1 细菌分离结果
分离并获得10 株支气管败血波氏杆菌,分别命名为Bb-1~Bb-10,其中从鼻拭子分离2 株,气管分离3 株,肺脏组织分离5 株。分离菌株在TSA 平板上呈光滑的黄白色圆形菌落,革兰氏染色可见红色、成对或分散排列在两端钝圆的细小球杆菌(图1)。

图1 菌落形态(左)及革兰氏染色(右)镜检结果(1 000×)Fig.1 Colony morphology (left) and Gram stain (right)microscopy results
2.2 分离菌株的PCR 鉴定结果
16S rRNA 扩增结果显示:在约1 500 bp 处存在明显的目的条带(图2)。测序和NCBI 数据库比对结果表明:10 株分离菌株与支气管败血波氏杆菌参考菌株序列的同源性为98%~100%。
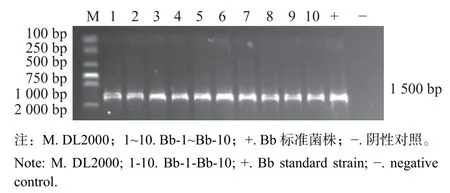
图2 支气管败血波氏杆菌16S rRNA PCR 鉴定Fig.2 Identification ofBordetella bronchisepticaby 16S rRNA PCR
2.3 遗传进化分析
由图3 可知:分离菌株Bb-5 单独为一支,Bb-2 和Bb-6 汇成一簇在同一分支;其余菌株与Bb 美国株 (CP022962.2)、Bb 波兰分离株(MT-040725.1)、Bb 英国分离株(LR134480.1)和Bb 中国分离株(MN082542.1)亲缘关系近,处在同一分支。以上结果进一步证明这些菌株为支气管败血波氏杆菌。
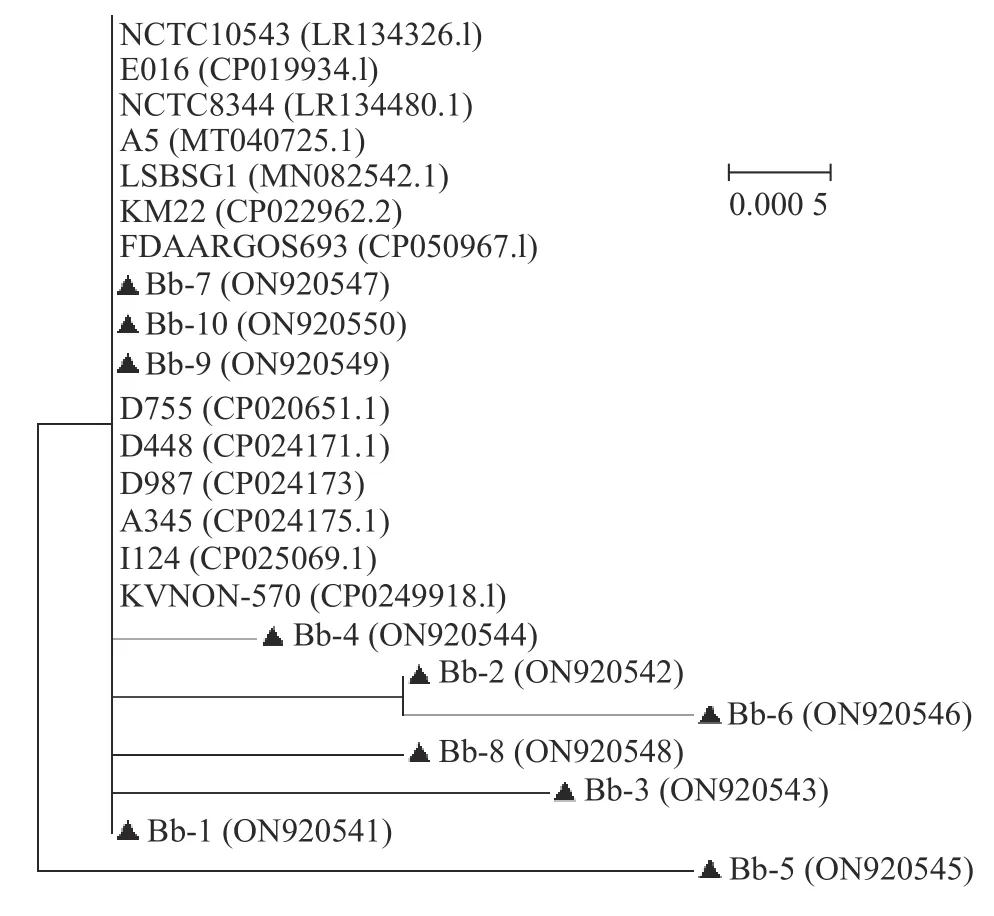
图3 Bb 分离菌株进化关系Fig.3 Evolutionary relationship of Bb isolates
2.4 生化鉴定结果
10 株分离菌株与支气管败血波氏杆菌的特征相符,主要为:尿素酶试验均为阳性;甲基红和VP (Voges-Proskaurer)试验均为阴性;不产生靛基质,不发酵葡萄糖、木糖和棉子糖;不发酵山梨醇、枸橼酸盐、鸟氨酸和赖氨酸。
2.5 分离菌株的药物敏感性
10 株支气管败血波氏杆菌对临床上常用的18 种抗菌药物产生不同程度的多重耐药性,对青霉素、氨苄西林、羧苄西林、头孢氨苄、复方新诺明和林可霉素的耐药率为100%;对头孢唑啉、头孢他啶、多西环素和利福平的耐药率超过50%;对红霉素、头孢曲松、卡那霉素和多粘菌素B 的耐药性,为20%~50%;对新霉素、氧氟沙星、左氧氟沙星和氯霉素100%敏感或中介(表2)。
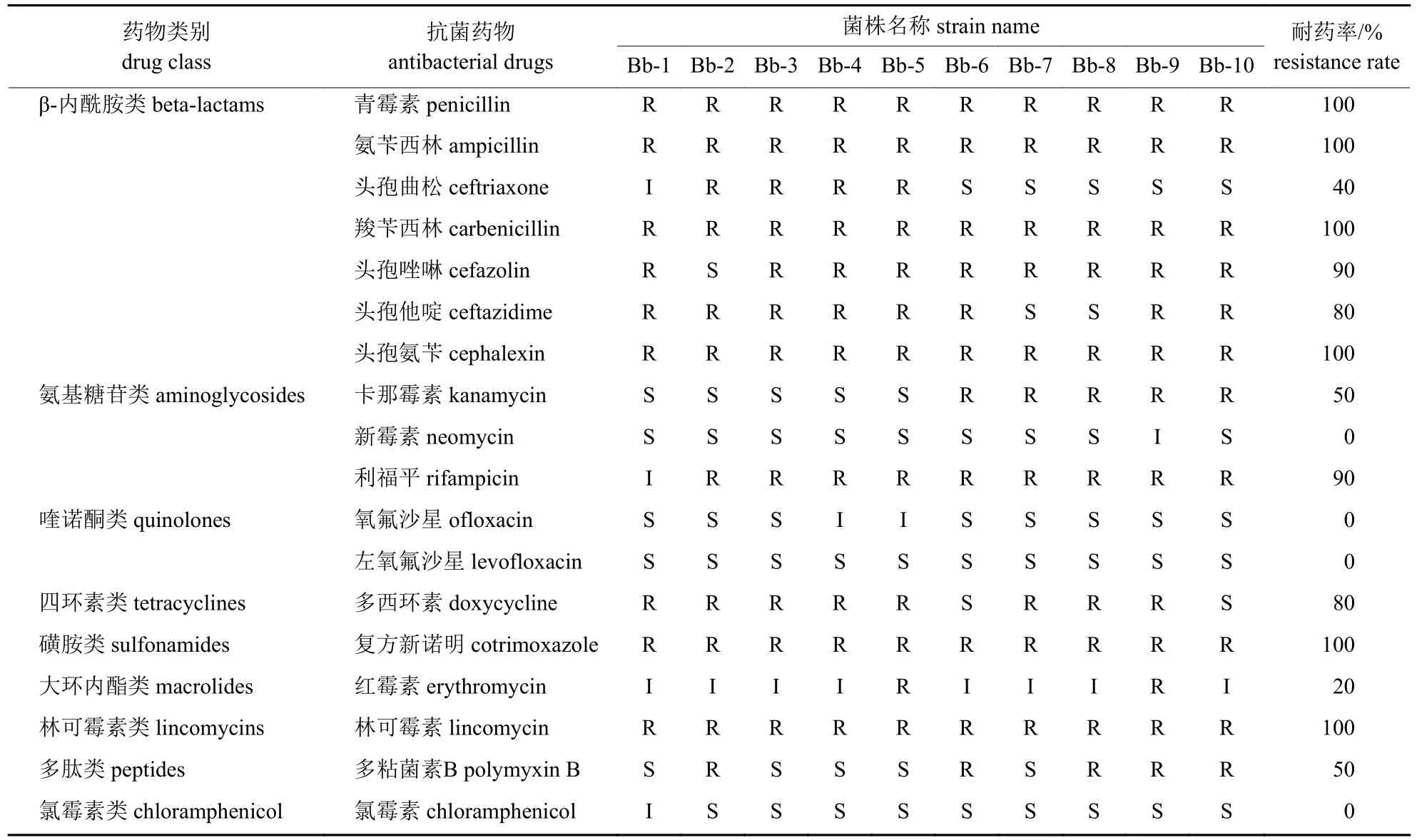
表2 临床分离株药物敏感性Tab.2 Drug susceptibility of clinical isolates
2.6 耐药基因的检测结果
由表3 可知:从分离株中检测到耐药基因9 种,其中gyrA、sul1和tetC的检出率分别为90%、70%和60%,parC、tetA、tetB、ermB、floR和catB3的检出率为10%~20%,其余10 种耐药基因未检测到。
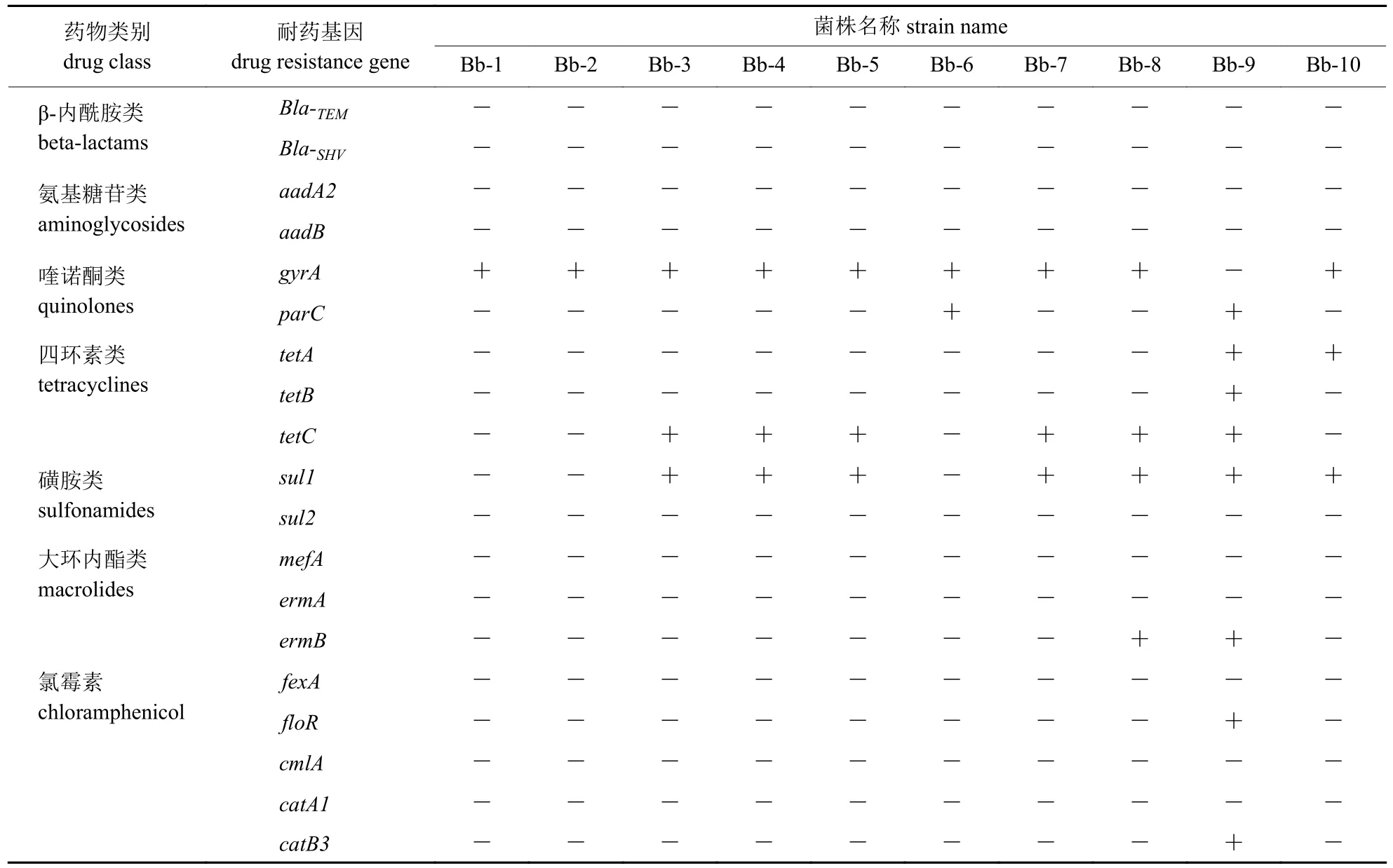
表3 耐药基因检测结果Tab.3 Detection results of drug resistance genes
2.7 10 株支气管败血波氏杆菌的致病性
致病性检测结果显示:Bb-1、Bb-3、Bb-6和Bb-9 分离株感染小鼠的死亡率为100%,Bb-7、Bb-8 和 Bb-10 感染小鼠的死亡率分别为 83.3%、33.3%和66.6%,死亡小鼠均表现出明显的临床症状,即:精神萎靡、呼吸困难、背毛凌乱、扎堆和停止进食;Bb-2、Bb-4 和Bb-5 感染小鼠后第2 天出现明显的临床症状,但第4 天时临床症状逐渐消失,感染小鼠的死亡率为0。死亡小鼠剖检均可见肺脏有密集的出血点,胸腔积液,脾脏肿大,肝脏肿大、有淤血,肾脏出血(图4)。
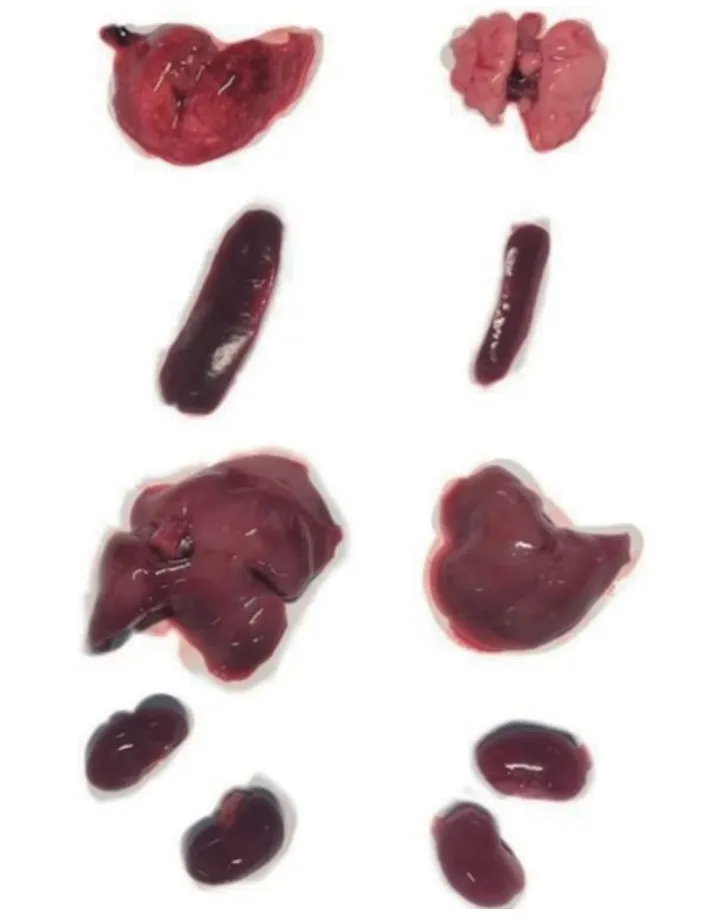
图4 Bb 攻毒小鼠器官剖检比较Fig.4 Comparison of necropsy organs of Bb-challenged mice
2.8 分离菌株毒力基因的检测
细菌毒力基因检测结果(图5)显示:Bb-4 未检测到betA毒力基因;Bb-8 和Bb-10 未检测到cyaA毒力基因;其余菌株均含有6 种毒力基因。
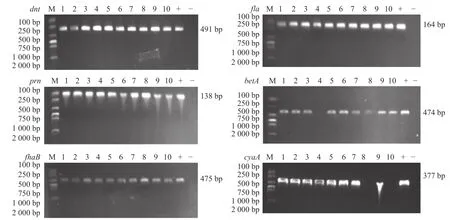
图5 毒力基因的PCR 扩增结果Fig.5 PCR amplification results of virulence genes
3 讨论
本研究对56 份四川省部分养猪场中患呼吸道疾病的猪只样本进行支气管败血波氏杆菌分离鉴定,共分离出10 株Bb,分离率为17.86%。诸明欣等[19]从四川省5 个猪场16 份具有呼吸道症状的猪鼻拭子中分离出4 株Bb,分离率为25%;2018—2020 年有学者从中国14 个省的4 259 例呼吸道疾病病死猪肺脏样品中分离到181 株Bb,分离率为4.25%[17],说明Bb 在全国的分离率较低,在四川省广泛流行和存在。遗传进化树说明分离的Bb 无明显的地域性且亲缘关系接近。
细菌的耐药机制复杂多样,耐药基因是其主要机制之一,对分离的病原菌进行耐药性和耐药基因检测并筛选合适的敏感药物,对临床治疗具有重要意义。研究发现:Bb 对大多数药物的最低抑菌浓度(MIC 值)较低,但对β-内酰胺类抗生素和大环内酯类抗生素的MIC 值较高[15],本研究中10 株分离株呈多重耐药性,9 重及以上耐药菌株达到100%,可见耐药现象十分严重。本研究中分离得到的10 株Bb 对β-内酰胺类、林可酰胺类、磺胺类和一代头孢具有较强的耐药性,这与张彦兵等[18]和诸明欣等[19]的报道一致,临床上不建议使用这些药物;但与张慧等[20]和ZHANG等[17]报道的Bb 对多粘菌素B 100%敏感不同,本研究的部分菌株已经对多粘菌素产生耐药,可能Bb 在传播过程中整合了耐药基因。此外,部分菌株已对红霉素、卡那霉素、头孢唑啉和头孢曲松产生不同程度的耐药性,说明支气管败血波氏杆菌部分菌株已经演化,开始对部分氨基糖苷类、大环内酯类、头孢类和多肽类抗生素具有耐药性。本研究的耐药基因检测结果与药敏试验结果不完全一致,所有分离菌株均对β-内酰胺类和部分氨基糖苷类药物具有耐药性,但均未检测出耐药基因Bla-TEM、Bla-SHV、aadA2和aadB,推测可能是其他耐药基因发挥了主要的耐药作用;分离株均对喹诺酮类药物和氯霉素敏感,但其中9 株仍能检测出喹诺酮耐药基因gyrA,其中1 株Bb 检测到氯霉素耐药基因catB3,说明耐药基因的存在并不一定导致细菌耐药,推测其原因可能是储存在核苷酸序列中的遗传信息经过转录和翻译后,转变为具有生物活性的蛋白质分子才能表现耐药,而耐药基因未表达导致不表现耐药性。KADLEC 等[15]鉴定了Bb 对四环素类药物产生极高耐药性的主要原因是Bb 携带tetA、tetC或tet31基因,而本研究的10 株Bb 分离株中有2 株检测出tetA基因,6 株检测出tetC基因,1 株检测出tetB基因,推测是四环素类药物在不同细菌中导致耐药的基因不同。分离菌株均对磺胺类药物耐药,仅有7 株可检测出磺胺类药物sul1耐药基因,但未检测到sul2基因,而sul1和sul2均编码磺胺类不敏感的二氢蝶酸盐合成酶[15],推测耐药现象是多种机制所致,具体的耐药机制还有待进一步研究。
毒力因子是致病菌引起机体发病的重要因素,其表达有助于增强支气管败血杆菌对宿主的侵袭力。张彦兵等[18]研究表明:所有Bb 分离株的fla、dnt和prn毒力基因携带率为100%,ZHANG 等[17]2018—2020 年对中国猪支气管败血波氏杆菌的毒力基因检测结果显示:毒力基因fhaB、prn、cyaA、dnt和betA的阳性率大于90%,且同时含有这5 种毒力基因的菌株约占84.36%,与本研究结果基本一致,说明携带这些毒力基因是支气管败血波氏杆菌的普遍特征。Bb-4 不含betA,Bb-8 和Bb-10 不 含cyaA,Bb-1、Bb-3、Bb-6、Bb-7 和Bb-9 含有全部6 种毒力基因,接种Bb-4、Bb-8 和Bb-10 的小鼠死亡率均低于接种Bb-1、Bb-3、Bb-6、Bb-7 和Bb-9 的小鼠死亡率,推测Bb 携带毒力基因的数量和致病性可能存在一定的相关性。Bb-2 和Bb-5 也含有全部6 种毒力基因,但接种Bb-2 和Bb-5 的小鼠虽表现明显的症状,但未出现小鼠死亡,推测影响Bb 对小鼠致病性的因素可能不仅仅是这6 种毒力因子,还可能存在其他毒力因子,如Ⅲ分泌系统的其他效应蛋白、膜蛋白和胞外多糖等。
4 结论
支气管败血波氏杆菌在患呼吸道疾病的猪肺样本中分离率较高,大多分离株携带多种毒力基因且致病力较强,多重耐药现象严重。因此,临床预防和治疗过程中应做到科学合理、规范使用抗菌药物,可选择敏感药物如红霉素、左氧氟沙星和氯霉素等交替用药,以达到更好的治疗效果。

