规模化鹅场主要病毒核酸检测结果与分析
邵震,刁有祥
规模化鹅场主要病毒核酸检测结果与分析
邵震,刁有祥
山东农业大学动物科技学院,山东泰安 271000
【目的】经长期对中国国内各省市的规模化鹅场常见病毒性疫病核酸检出率进行调查,发现国内许多规模化鹅场均可同时检出多种病毒核酸,并且这种现象非常普遍,鉴于目前国内关于规模化鹅场多种病毒性疫病核酸同时检出的相关数据较为匮乏,论文旨在了解规模化鹅场多种病毒性疫病核酸同时检出的情况并进行分析,为规模化鹅场病毒性疫病的防控提供理论指导和科学依据。【方法】2021年5—10月,自山东、黑龙江、四川、吉林、广西、河南、安徽、辽宁、河北、贵州、湖南及内蒙古等省市的47个规模化鹅场采集737份病料,对其采用普通PCR及RT-PCR方法进行番鸭呼肠孤病毒(muscovy duck reovirus, MDRV)、鸭呼肠孤病毒(duck reovirus, DRV)、鹅星状病毒(goose astroviruses, GAstV)、禽腺病毒(fowl adenovirus, FAdV)、禽网状内皮增生病毒(reticuloendotheliosis virus, REV )、新城疫病毒(newcastle disease, ND)、鹅细小病毒(goose parvovirus, GPV)、鹅圆环病毒(goose circovirus, GoCV)、鹅出血性多瘤病毒(goose hemorrhagic polyomavirus, GHPV)、坦布苏病毒(tembusu virus, TMUV)及H9亚型禽流感病毒(avian influenza virus H9, H9-AIV)等11种规模化鹅场常见病毒性疫病的检测。每份病料剖取完整的肝脏、脾脏、肺脏及肾脏,利用Trizol 法提取总 RNA;以总RNA为模板逆转录合成cDNA的一条链,而后以cDNA为模板继续扩增获得完整的cDNA,随后以该cDNA为模板利用番鸭呼肠孤病毒、鸭呼肠孤病毒、鹅星状病毒、禽腺病毒、禽网状内皮增生性病毒、新城疫病毒、鹅细小病毒、鹅圆环病毒、鹅出血性多瘤病毒、坦布苏病毒及H9亚型禽流感病毒的特异性引物,通过普通PCR反应扩增目的片段;所有扩增片段均进行琼脂糖凝胶电泳,对部分阳性样品进行测序;将所获得的测序结果与GenBank上发表的相应病毒基因序列进行比较,应用MEGA 6.0软件中的邻接法(neighbor-joining, NJ)绘制系统发育进化树进行分析。【结果】番鸭呼肠孤病毒、鸭呼肠孤病毒、鹅星状病毒、禽腺病毒、禽网状内皮增生性病毒、新城疫病毒、鹅细小病毒、鹅圆环病毒、鹅出血性多瘤病毒、坦布苏病毒及H9亚型禽流感病毒感染情况检测结果显示,GAstV核酸检出率最高,为58.21%;REV及NDV核酸检出率最低,分别为1.36%及1.50%;鹅群不同程度上均可同时检出多种病毒核酸,尤其以2种或3种病毒核酸同时检出的情况较为普遍,占样品总数的67.44%。两种病毒核酸同时检出率中GAstV与GoCV同时检出所占比例最大,为18.44%;3种病毒核酸同时检出率中MDRV、GAstV及GPV同时检出所占比例最大,为36.28%。【结论】明确了我国规模化鹅场可以同时检测到多种病毒核酸这一特征,这可能是我国规模化鹅场病毒性疫病复杂化和防控难度加大的重要原因之一。
规模化鹅场;核酸检测;遗传进化分析
0 引言
【研究意义】中国是世界第一养鹅大国,2020年我国商品鹅出栏量达6.39亿只, 2021年我国商品鹅出栏量达6.61亿只。但随着养殖规模和密度的不断增加,鹅病的发生率大幅上升,经常可在病鹅体内检测出多种病毒核酸,鹅病的预防、诊断和控制面临着重大挑战。因此,加强对规模化鹅场多种病毒性疫病核酸的检测,可为了解鹅病的流行情况提供流行病学资料,为鹅病的防控提供理论依据。【前人研究进展】 CHEN等[1]为了解GAstV的流行情况,于2018年1月至2019年4月从湖北、安徽、河南等地的7个规模化鹅场中收集了165份病料。检测结果显示,GAstV检出阳性的病料中,均可以同时检出鹅细小病毒(GPV)及番鸭呼肠孤病毒(MDRV);TING等[2]调查了台湾40个规模化鹅场,结果显示44.6%的雏鹅和66.7%的成年鹅群中均可同时检出GPV与GoCV核酸;LIU等[3]对采集自中国12个规模化鹅场的病料进行了GPV、FAdV、TMUV、GHPV等病毒的检测,检测结果显示这些雏鹅皆可同时检测出GPV和GAstV病毒核酸,且GPV的存在会使痛风加重。在此研究基础上,WANG等认为雏鹅痛风是由GAstV与其他病毒共同作用导致的。【本研究切入点】目前规模化鹅场大部分可同时检出多种病毒核酸,对我国养鹅业的危害较大。为了解当前我国规模化鹅场中病毒性疫病的流行情况,笔者从华东、华南、华中、东北、西南等地区的规模化鹅场采集病料,对规模化鹅场新型鹅星状病毒(GAstV)、鸭呼肠孤病毒(DRV)、番鸭呼肠孤病毒(MDRV)、鹅细小病毒[4](GPV)、鹅圆环病毒(GoCV)、禽腺病毒(FAdV)、坦布苏病毒[5-6](TMUV)、禽流感H9亚型病毒(AIV-H9N2)、鹅多瘤病毒(GHPV)、新城疫病毒(NDV)、禽网状内皮增生病毒(REV)等常见病毒性疫病的核酸检出情况进行调查,并对代表毒株测序、分析。【拟解决的关键问题】确定规模化鹅场常见病毒性疫病病毒核酸的同时检出情况,为鹅病的防控提供理论依据。
1 材料与方法
1.1 病料采集
2021年5—10月自山东、黑龙江、四川、吉林、广西、河南、安徽、辽宁、河北、贵州、湖南及内蒙古等省市的47个规模化鹅场采集737份病料。
1.2 主要试剂及仪器
Tris平衡酚、SDS、蛋白酶K购自北京索来宝生物科技有限公司;RNA 提取试剂 Trizol Reagent 购自北京全式金生物技术有限公司。高速冷冻离心机(美国贝克曼尔有限公司),PCR仪(杭州朗基科学仪器有限公司)。
1.3 引物设计与合成
参考GenBank已发表的病毒基因序列设计特异性引物。GPV引物参考登录号NC_001701.1的GPV毒株VP3基因设计;GoCV引物参考GoCV/375/GD/2020(登录号MT831941.1)毒株的V1基因设计;GHPV引物参考JY141Ma(登录号MG670535.1)毒株的Large T基因设计;MDRV引物参考ZJ99(登录号AY619690.1)毒株的σC基因设计;H9-AIV引物参考HU10-1708(登录号为LC500398.1)毒株的Segment 4设计。引物序列见表1,引物由青岛华大基因公司合成。
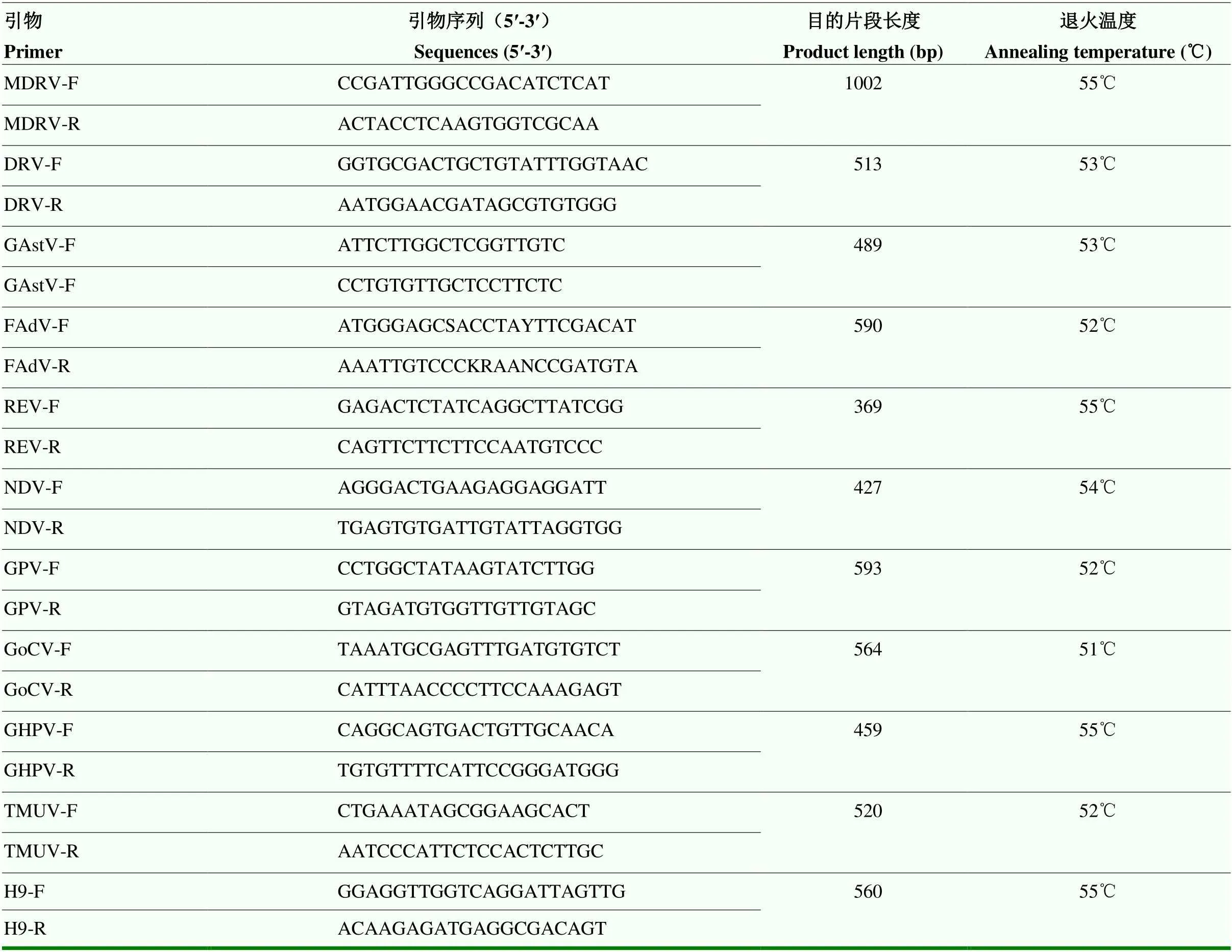
表1 引物序列
1.4 核酸提取
采用Trizol法进行RNA的提取:取组织置于离心管中加入Trizol;离心弃沉淀;加入氯仿静置;离心吸取水相;加入异丙醇静置;离心弃上清;加入乙醇,离心弃上清;晾管;加入30 μL RNA-free ddH2O溶解。
采用酚—氯仿法提取DNA:取组织液置于离心管中加入蛋白酶K,56 ℃水浴;加入平衡酚与氯仿;离心吸取上清液;加入无水乙醇,-20 ℃沉淀;离心加入冷乙醇;离心,弃去乙醇;晾干后ddH2O溶解沉淀。
1.5 (RT-)PCR扩增及序列分析
反转录体系按照下列比例配制:dNTP Mix,4 μL;Primer Mix,2 μL;RNA Template,7 μL;5×RT Buffer,4 μL;DTT,2 μL;HiFiScript,1 μL 。cDNA按照下列程序合成:42 ℃ 50 min,85 ℃ 5 min。
PCR扩增体系如下:DNA或cDNA 1 µl;上、下游引物各1 µl;2×Master Mix 12.5 µl,ddH2O 9.5 µl。PCR程序:94 ℃预变性10 min;94 ℃ 30 s,退火温度见表1 30 s,72 ℃延伸、延伸时间根据各片段长度设定,共35个循环;72 ℃终末延伸 10 min。取7 µL PCR产物进行琼脂糖凝胶电泳并挑选PCR产物送至青岛擎科公司测序。
1.6 遗传进化分析
根据测序结果采用MEGA 6.0软件的邻接法(Neighbor-Joining),p-distance算法,Bootstrap 1000次绘制遗传进化树,进行遗传进化分析。
2 结果
从12个省共采集病料737份,病料样品信息见表2—4。
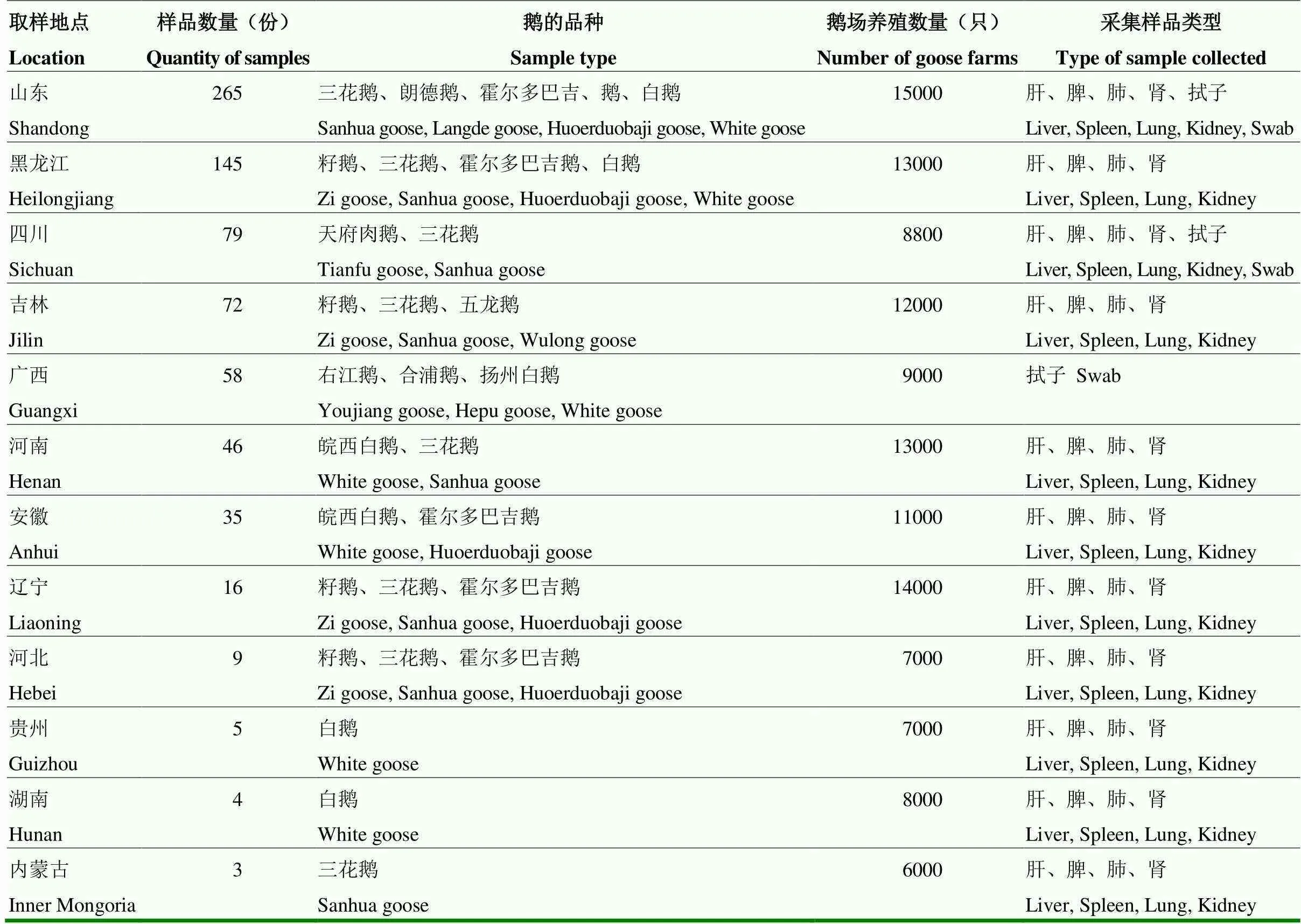
表2 病料样品信息
2.1 不同病原检测结果
不同病原检测结果见表5。结果显示,GAstV检出最多,为429份,阳性检出率达58.21%;其次为DRV和MDRV,检出量分别为319份和288份,阳性检出率为43.28%和39.08%;REV检出量最少,为10份,阳性检出率为1.36%。结果表明,GAstV、DRV及MDRV在规模化鹅场中流行最为广泛。
2.2 不同病原核酸的检测结果
不同病原核酸同时检出的结果见表6。结果显示,仅100份样品只检出唯一一种病毒核酸,所占比例13.7%;多达632份样品同时检测出2种或2种以上病毒核酸,所占比例高达85.75%,由此表明大部分规模化鹅场均可同时检出2种或2种以上病毒核酸。在多种病毒核酸同时检出的病例中,同时检出2种病毒核酸样品数为282份,所占比例为38.26%;同时检出3种病毒核酸样品数为215份,所占比例为29.17%;同时检出4种病毒核酸样品数为111份,所占比例为15.06%。结果表明,大部分鹅场均可同时检出两种或3种病毒核酸。

表3 不同月份病料采集情况

表4 不同日龄段病料情况
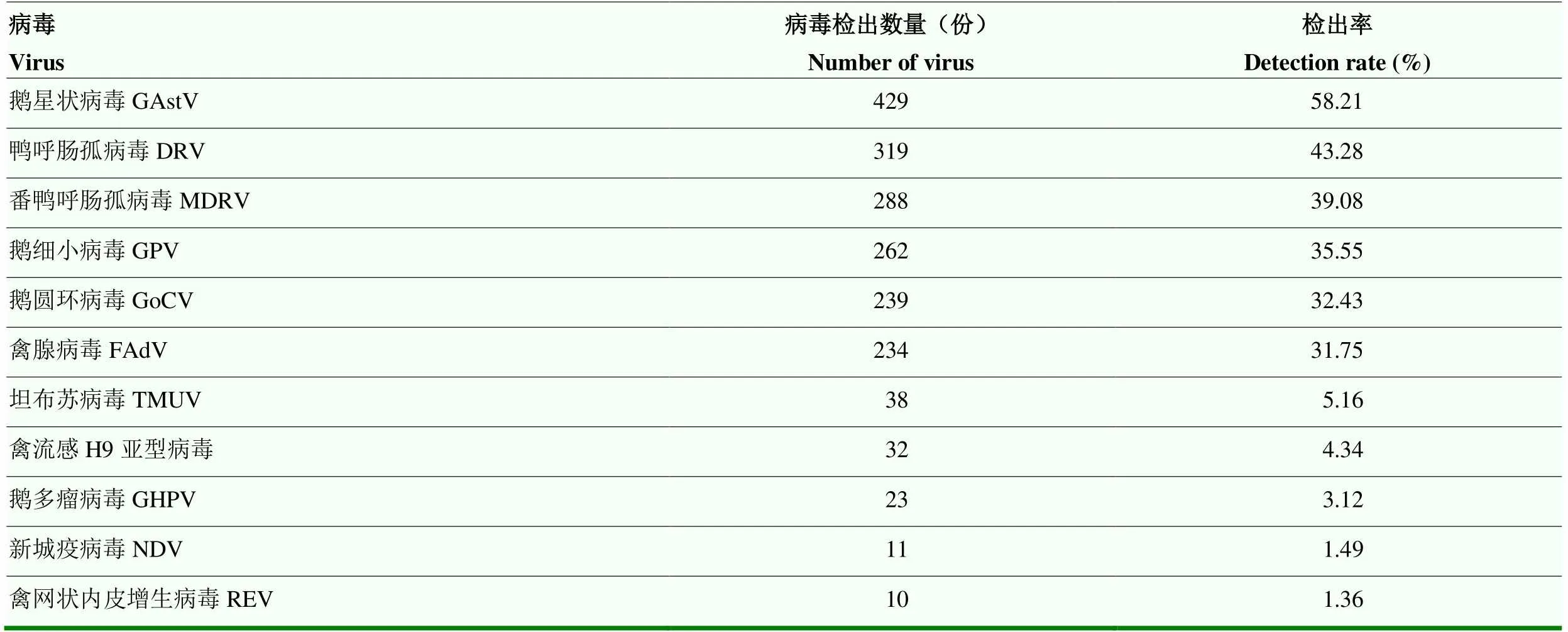
表5 不同病毒检测
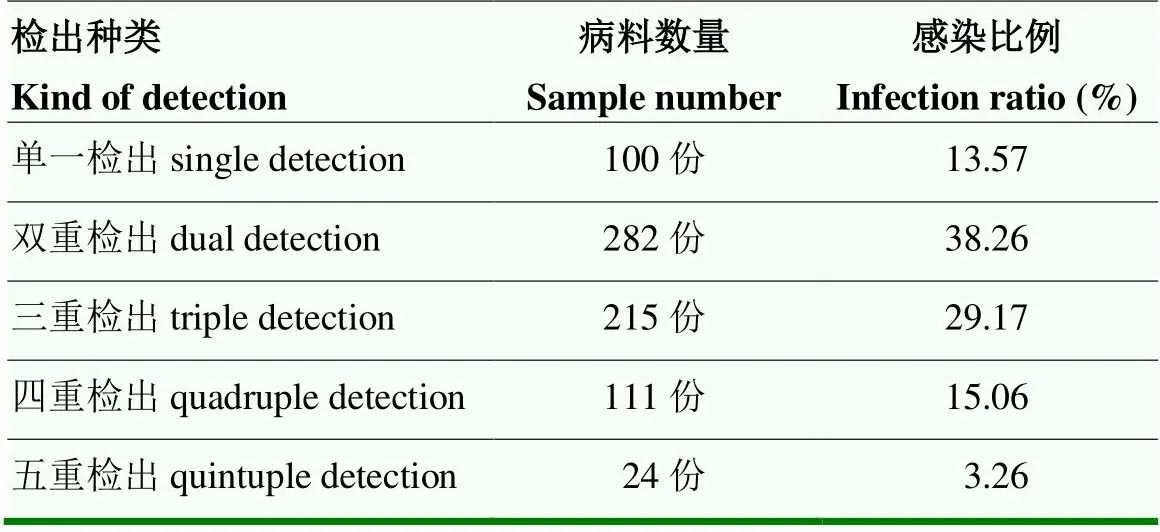
表6 不同病原核酸的检测
2.2.1 不同病原单一病毒核酸检测 不同病原单一病毒核酸检测结果见表7。结果显示,以GAstV的检出率最高,达42.00%,之后依次为GoCV和DRV,检出率分别为27.00%和14.00%。
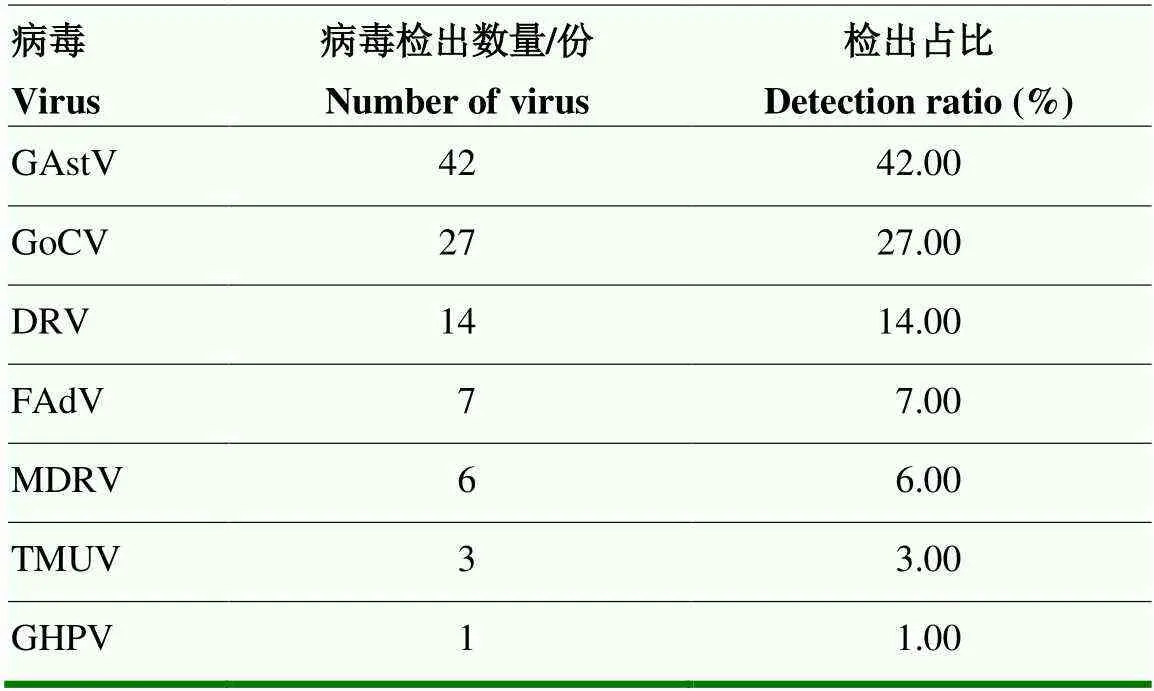
表7 不同病原单一病毒核酸检测
2.2.2 不同病原双重病毒核酸检测 不同病原双重病毒核酸检测结果见表8。结果显示,GAstV与GoCV 2种病毒的混合检出率最高,为18.44%;其次是DRV与GoCV,检出率为16.67%。由于GoCV是免疫抑制性病原,猜测当鹅群感染GoCV后,鹅群免疫力下降,甚至疫苗免疫失败,从而继发感染其他病原,造成较大损失。
2.2.3 不同病原三重病毒核酸检测 不同病原三重病毒核酸检测结果见表9。结果显示,MDRV、GAstV及GPV的检出率最高,为25.28%。其中约94.88%的三重病毒核酸检测出了MDRV或DRV,因此需要重视水禽呼肠孤类病毒对规模化鹅场的威胁。
2.2.4 不同病原四重病毒核酸检测 不同病原四重病毒核酸检测结果见表10。结果显示,MDRV、DRV、FAdV及GPV检出率最高,为22.52%。
2.2.5 不同病原五重病毒核酸检测 不同病原五重病毒核酸检测结果见表11。结果显示,MDRV、DRV、GPV、GAstV及FAdV检出率最高,为33.33%。
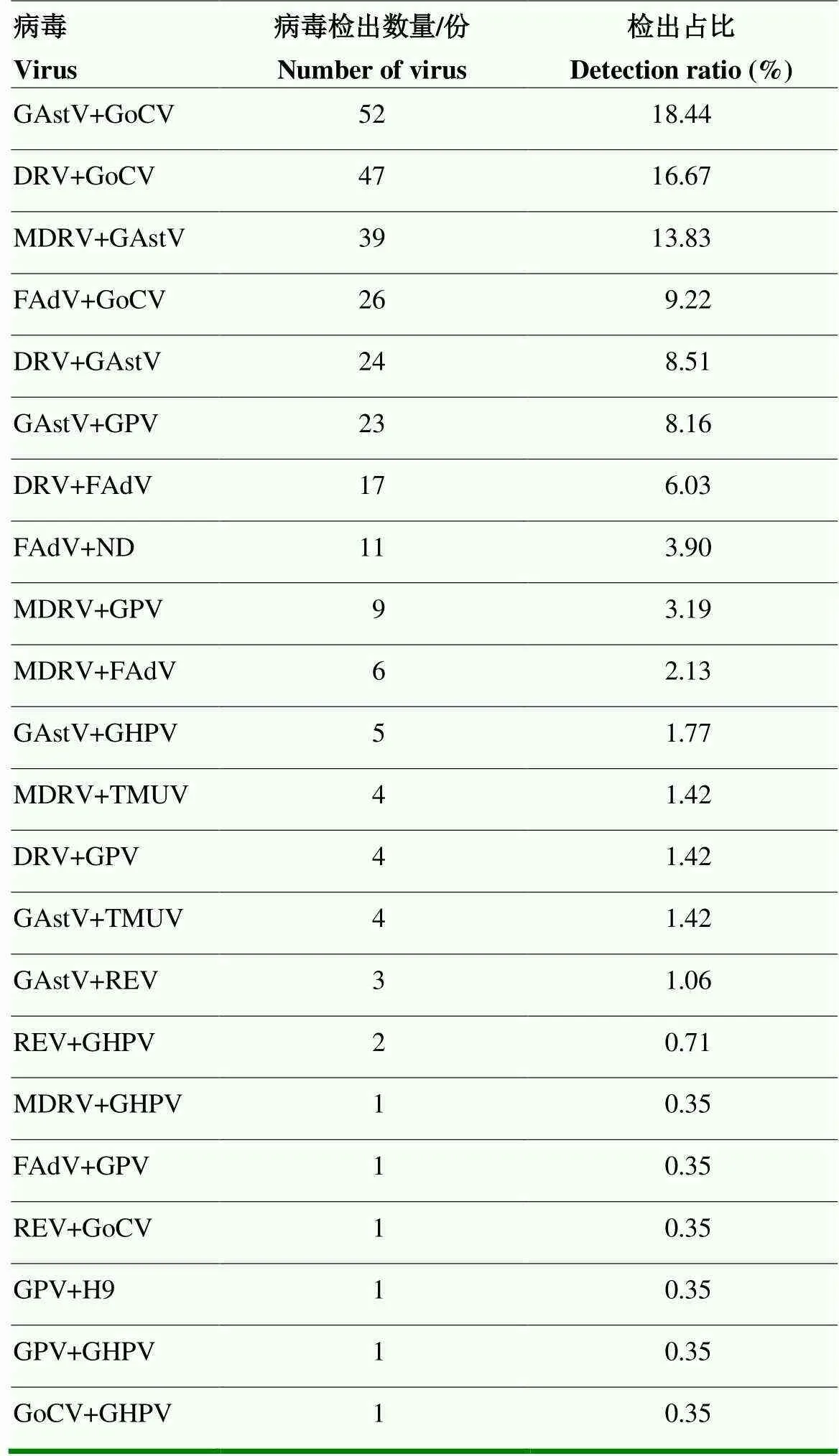
表8 不同病原双重病毒核酸检测
2.3 不同日龄鹅群病毒核酸检测
不同日龄段鹅群病毒核酸检测结果表明(图1)。不同日龄段的鹅均可检出病毒核酸,但情况各异。MDRV在不同日龄段鹅体内的检出率均较高,以青年鹅群最高;DRV、FAdV在青年鹅群检出数最多,雏鹅和成年鹅的检出量相近;GAstV在雏鹅中检出量远高于青年鹅和成年鹅;REV、GHPV在不同日龄段鹅群中检出量相似;NDV只在雏鹅中检出;GPV主要在雏鹅和青年鹅中检出,成年鹅检出较少;GoCV主要从雏鹅中检出,青年鹅和成年鹅也有检出,但相对较少;TMUV病毒核酸主要从成年鹅体内检出。
2.4 不同季节鹅群的检测结果
为调查规模化鹅场流行病与季节的关系,对不同季节规模化鹅场病毒性疫病进行检测。检测结果表明(表12),H9亚型禽流感病毒在气温变化幅度较大的季节(春季)检出数量更多,呈现明显的季节规律; TMUV感染主要发生在夏季。
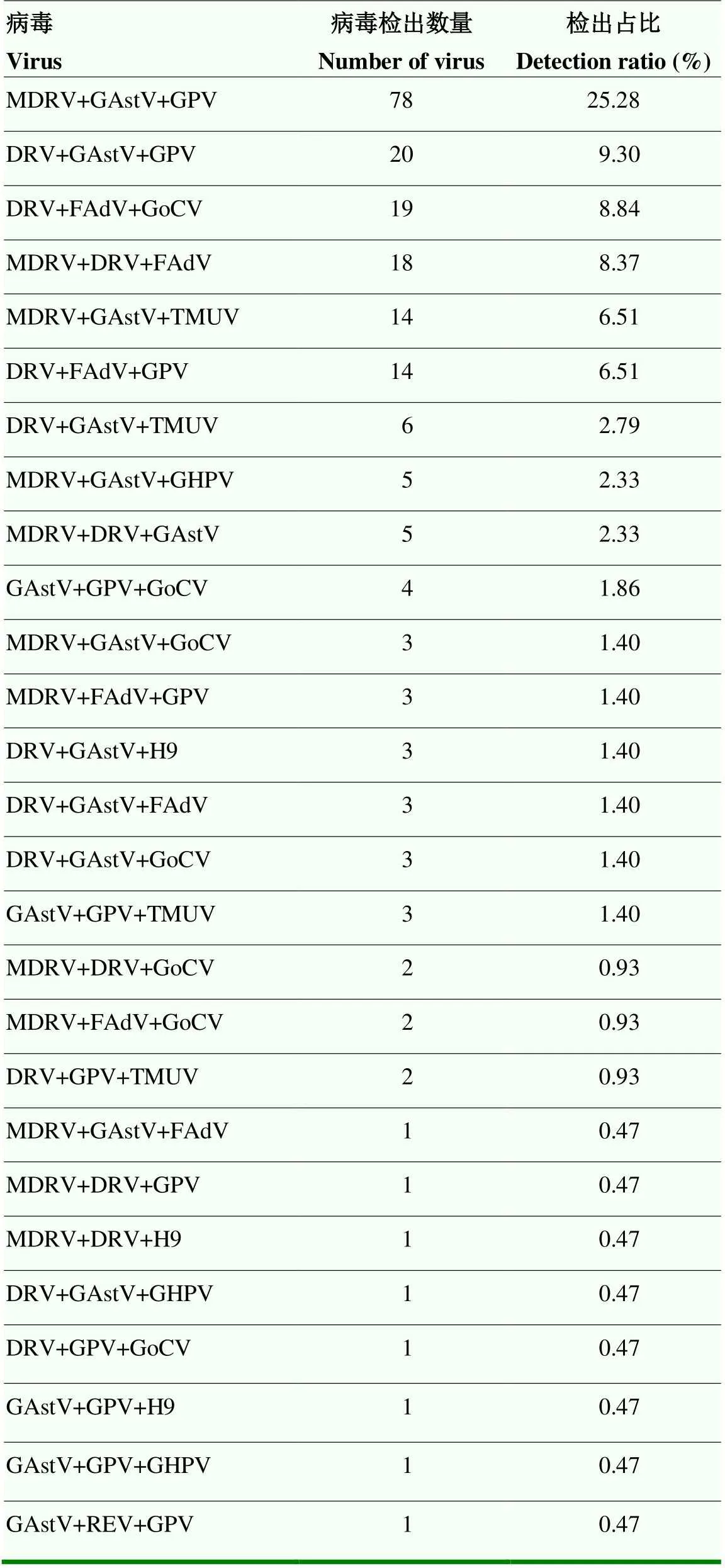
表9 不同病原三重病毒核酸检测结果
2.5 不同病原主要基因遗传变异分析
2.5.1 GPV VP3基因遗传变异分析 GPV VP3基因在不同来源GPV毒株之间的变异情况较为保守。对GPV VP3基因进行遗传变异分析,由图2可见,GPV分离株LC2021(分离自2021.07.19从山东省聊城市阳谷县采集的棉拭子中)和HD2021(分离自2021.05.13从河北省邯郸市采集的脾脏中)与参考毒株GPV HB15株的遗传关系最近,与MDPV DY株、PT株处于同一分支,但与中国大陆GPV疫苗株(GD,SYG61及SYG26-35)处于完全不同的分支[7],有较远的遗传距离[8]。
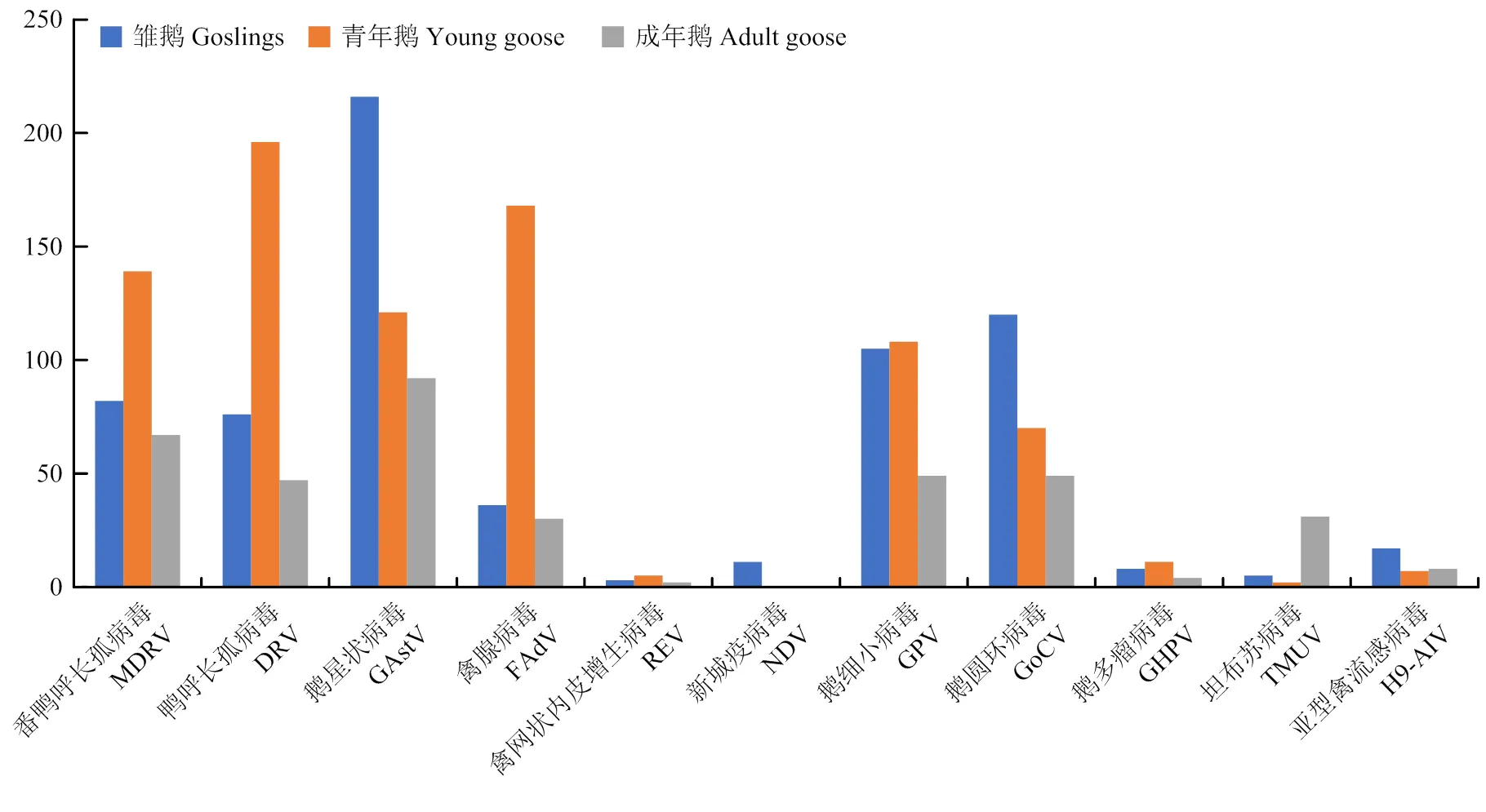
图1 不同日龄段检测结果

表10 不同病原四重病毒核酸检测结果
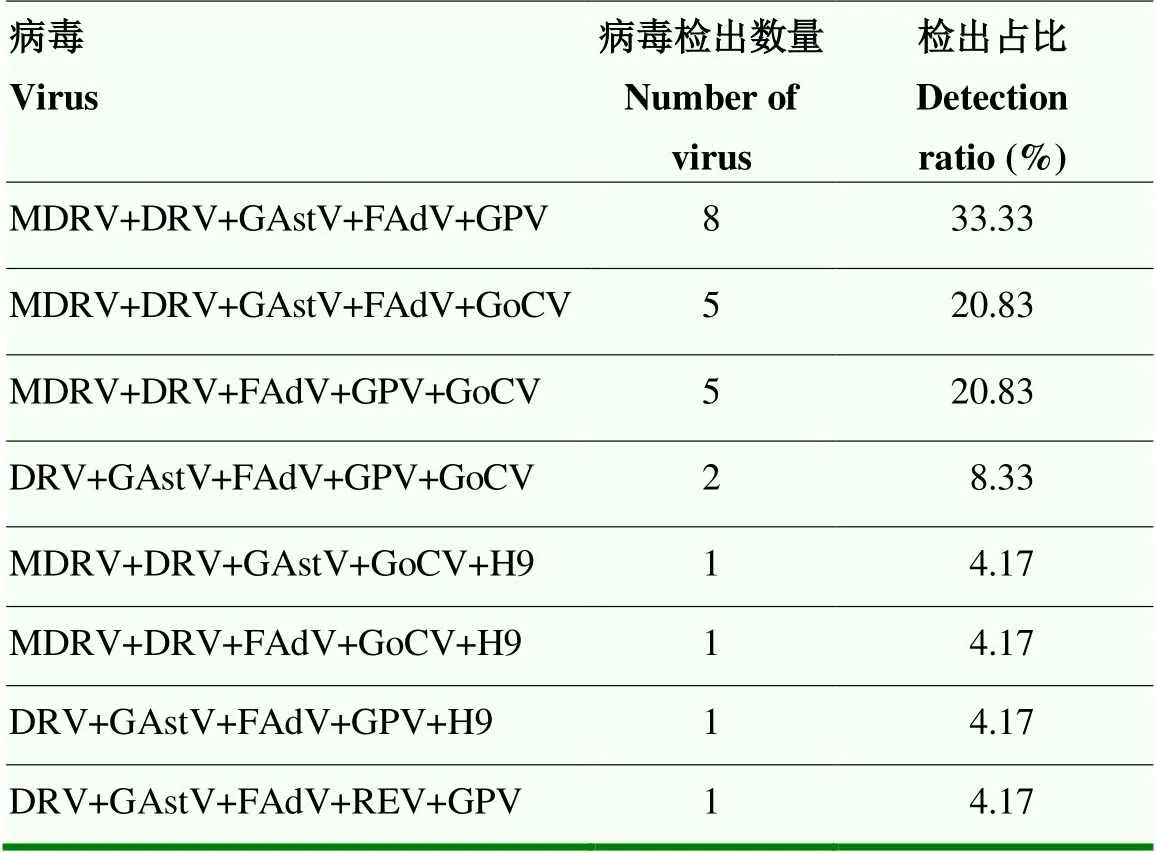
表11 不同病原五重病毒核酸检测结果
2.5.2 GoCV V1基因遗传变异分析 由图3可见,GoCV分离株ZB2021(分离自2021.09.18从山东省淄博市沂源县采集的脾脏中)、YG2021(分离自2021.07.19从山东省聊城市阳谷县采集的棉拭子中)与鹅源GoCV大陆参考分离株处于同一个小分支,与鹅源中国台湾参考分离株处于完全不同的分支上,表明大陆鹅源GoCV分离株之间亲缘关系较近,但与台湾GoCV鹅源分离株亲缘关系较远。
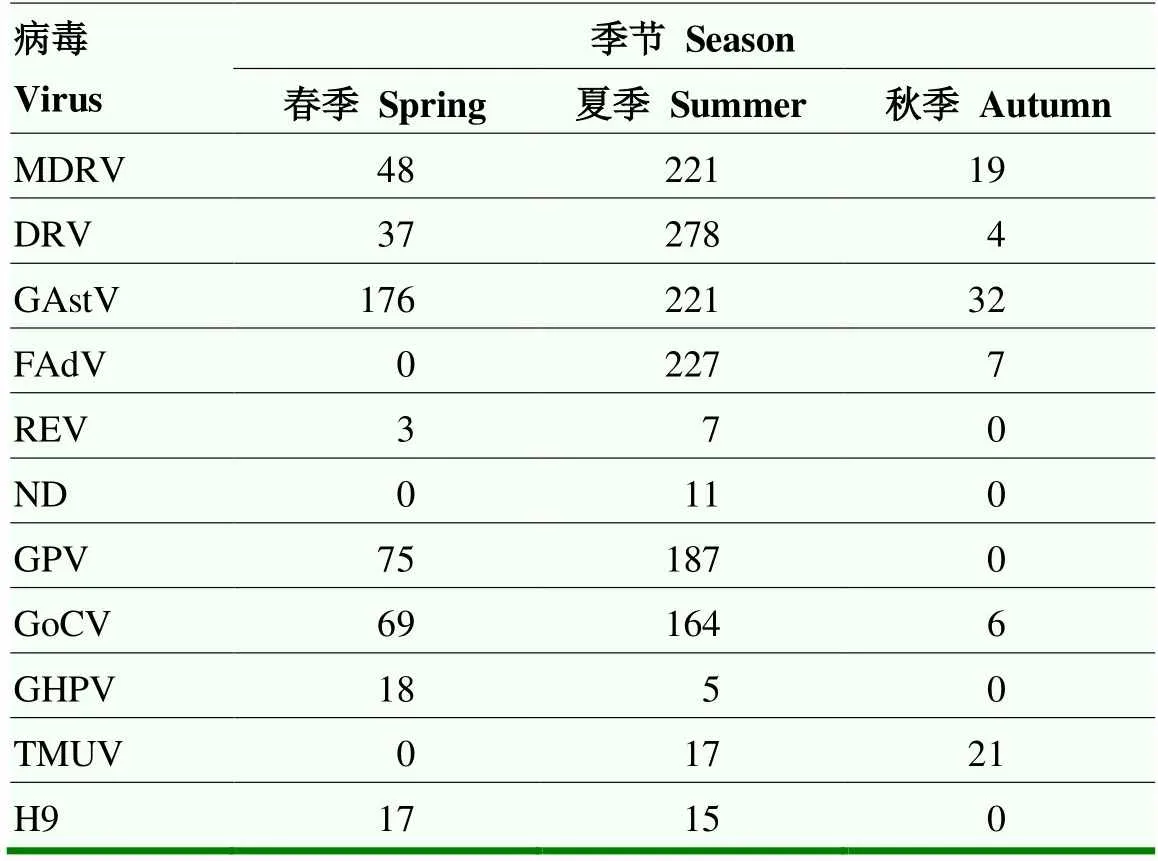
表12 不同季节检测结果
2.5.3 GHPV Large T基因遗传变异分析 对GHPV Large T基因进行遗传变异分析,结果见图4,GHPV分离株XC2021(分离自2021.05.10从河南省项城市采集的脾脏中)与世界各地(中国、匈牙利、法国)水禽源GHPV分离株(鹅源、番鸭源、樱桃谷鸭源、北京鸭源及鸭源)均处于同一分支,与非水禽源的GHPV毒株处于不同分支上。
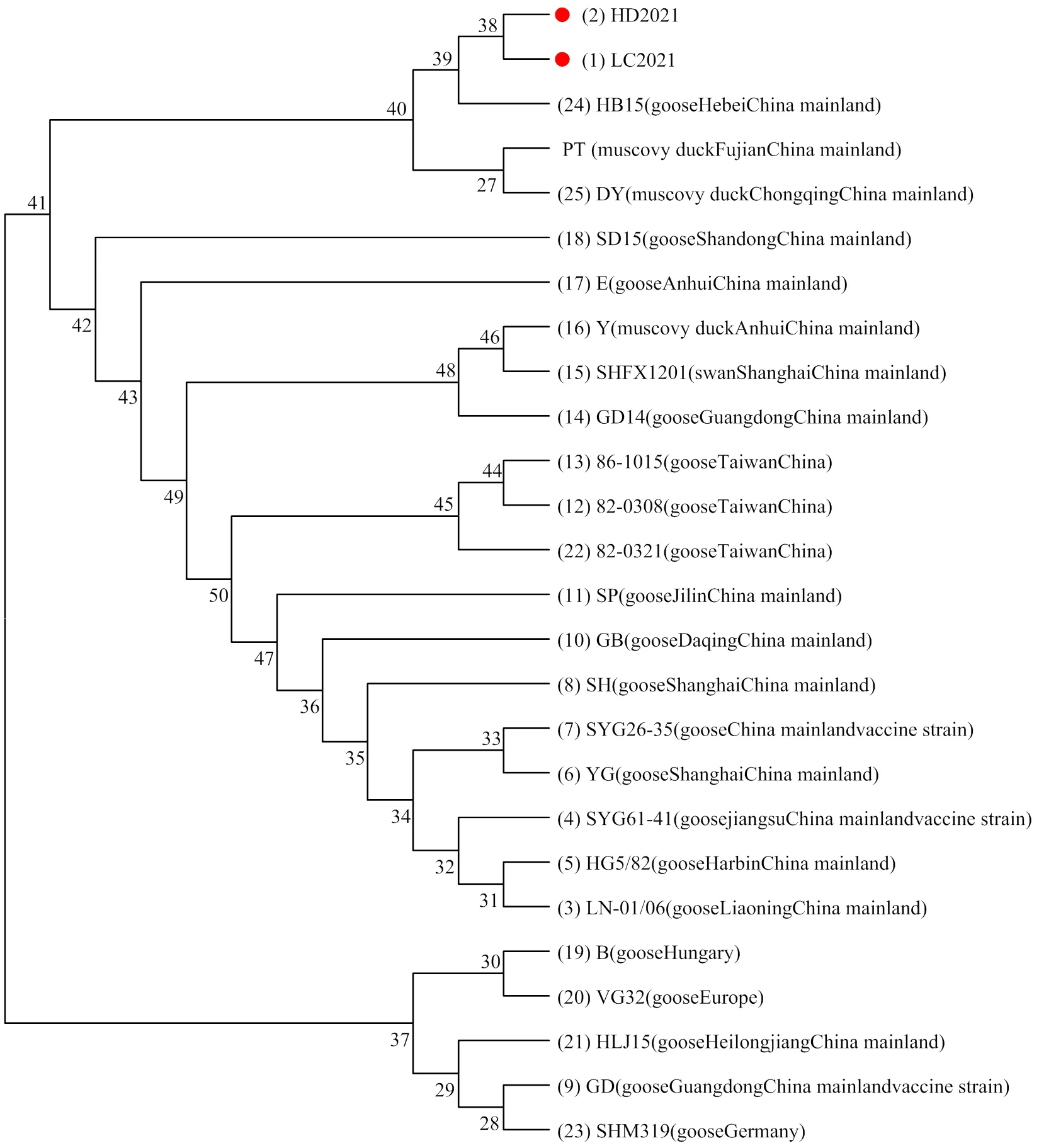
图2 基于GPV VP3基因的遗传进化图
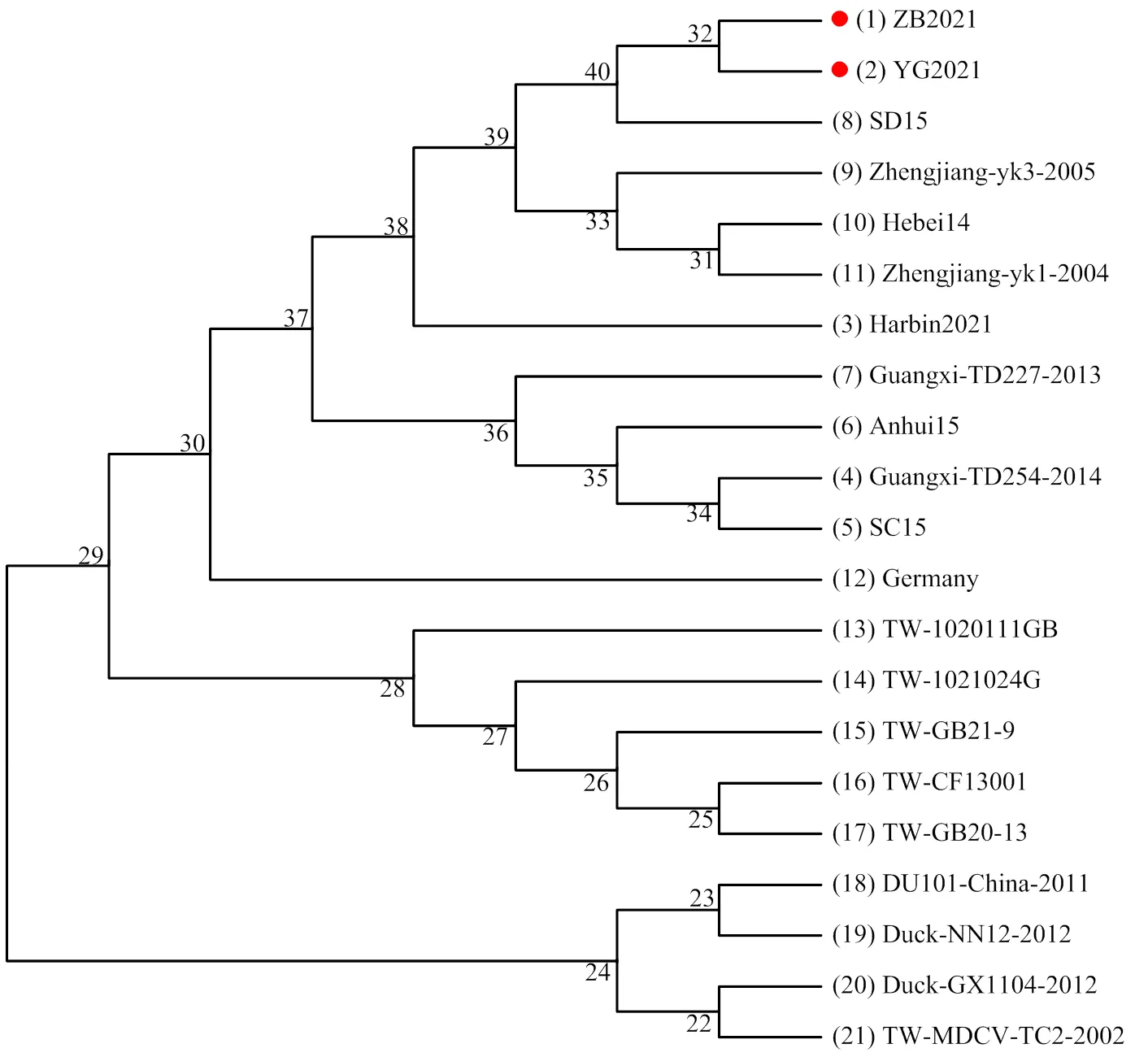
图3 基于GoCV V1基因的遗传进化图
2.5.4 MDRV σC基因遗传变异分析 由图5可见,分离株SDDZ2021(分离自2021.06.19从山东省德州市采集的肝脏中)与MDRV参考毒株汇为独立分支,与DRV及ARV参考毒株处于不同分支,相互之间遗传距离较远。SDDZ2021与MDRV中国经典分离株ZJ2000M[9]遗传距离最近。
3 讨论
H9-AIV、NDV、TMUV、GoCV及GPV病毒是威胁规模化鹅场的重要病原,给其带来较为严重的经济损失[10-13]。这些病毒如果同时或先后感染可造成鹅群多样的临床症状和病理变化,使鹅病防控形势日益严峻。因此,通过调查了解规模化鹅场病毒性疫病的共感染情况,可为鹅病防控提供理论依据。
3.1 调查的规模化鹅场以同时检出2种或3种病毒核酸为主
本研究对我国部分地区规模化鹅场病毒性疫病核酸的同时检出情况进行了初步调查,结果表明,仅仅检出一种病毒核酸的情况较少,以同时检出多种病毒核酸为主且类型复杂。其中以同时检出2种病毒核酸的情况居多,尤其以GAstV与GoCV所占比例最大(18.44%);同时检出3种病毒核酸以MDRV、GAstV、GPV居多;同时检出4种病毒核酸以MDRV、DRV、GPV、FAdV较为常见;同时检出5种病毒核酸的情况较少。
笔者认为诸如GoCV、GHPV及MDRV等免疫抑制性病毒的感染是我国部分规模化鹅场检测到多种病毒核酸同时存在的主要原因之一。免疫抑制性病毒的存在会大大降低鹅群的群体免疫力,使鹅群更容易感染常见的流行病,同时增加了鹅群感染新发疫病的风险。免疫抑制性病毒症状通常易被继发病毒症状掩盖,造成诊疗人员的误判、漏判,使诊疗的方案、物力、人力向继发病毒倾斜,忽视对免疫抑制性病毒的诊疗,导致继发感染难以净化完全,鹅群反复感染、反复治疗,体内始终共存多种病毒核酸。其次,笔者查阅病料采集记录详情本后发现,有些病料的来源鹅场刚刚进行过疫苗接种,疫苗毒株核酸的存在也可能是此次调查检测出多种病毒核酸的原因之一。同时,笔者通过电话回访发现,一些规模化鹅场的种鹅来源于曾经发生过多重病毒共感染的疫区或疫源国,垂直、交叉感染情况较为严重,一部分雏鹅出生即死,死亡雏鹅体内可检测到多种病毒核酸;一部分雏鹅通过加强免疫及治疗勉强存活,剖检后也可检测到多种病毒核酸,笔者推测这也是本次调查检测出多种病毒核酸的原因之一。
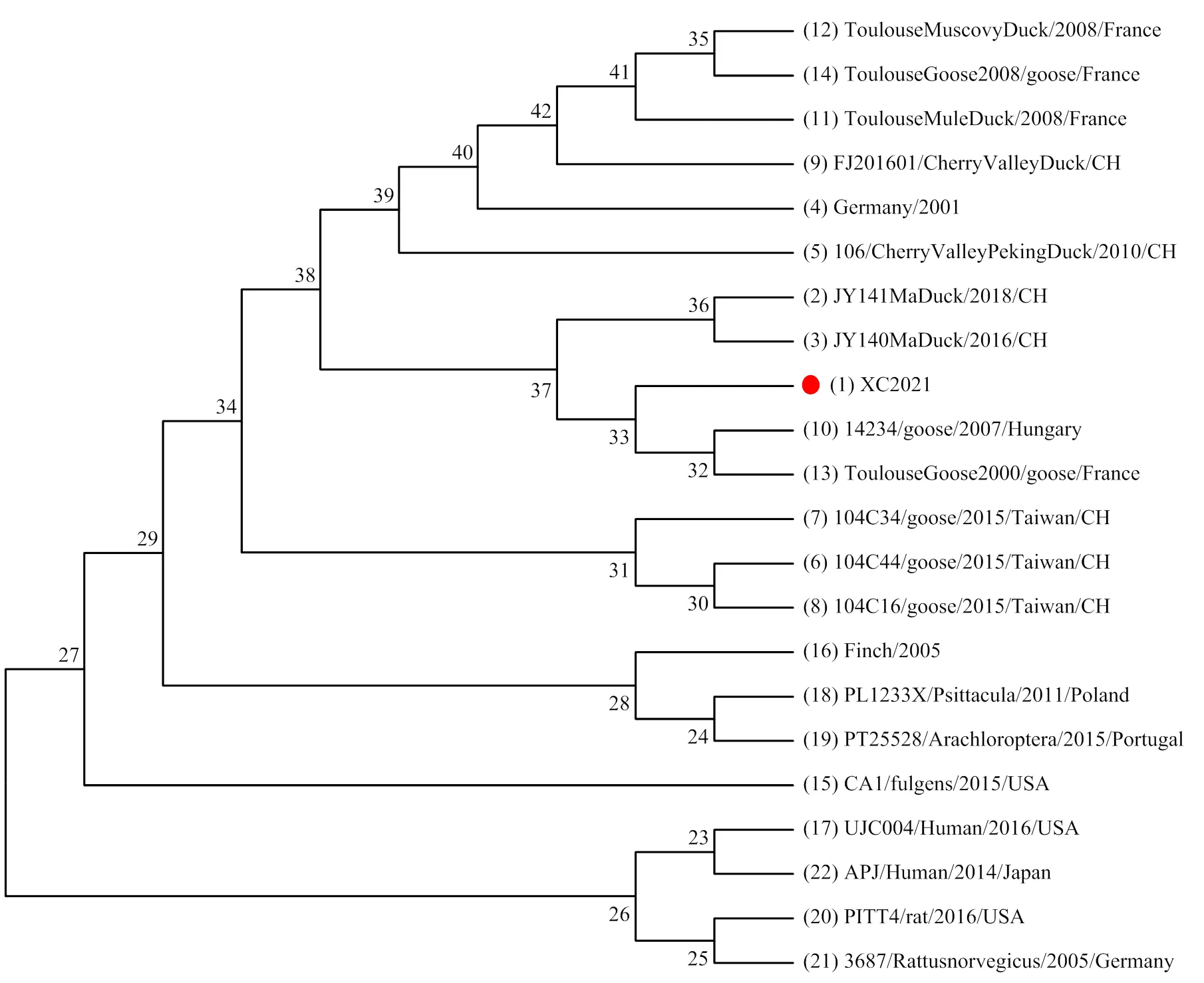
图4 基于GHPV Large T基因的遗传进化图
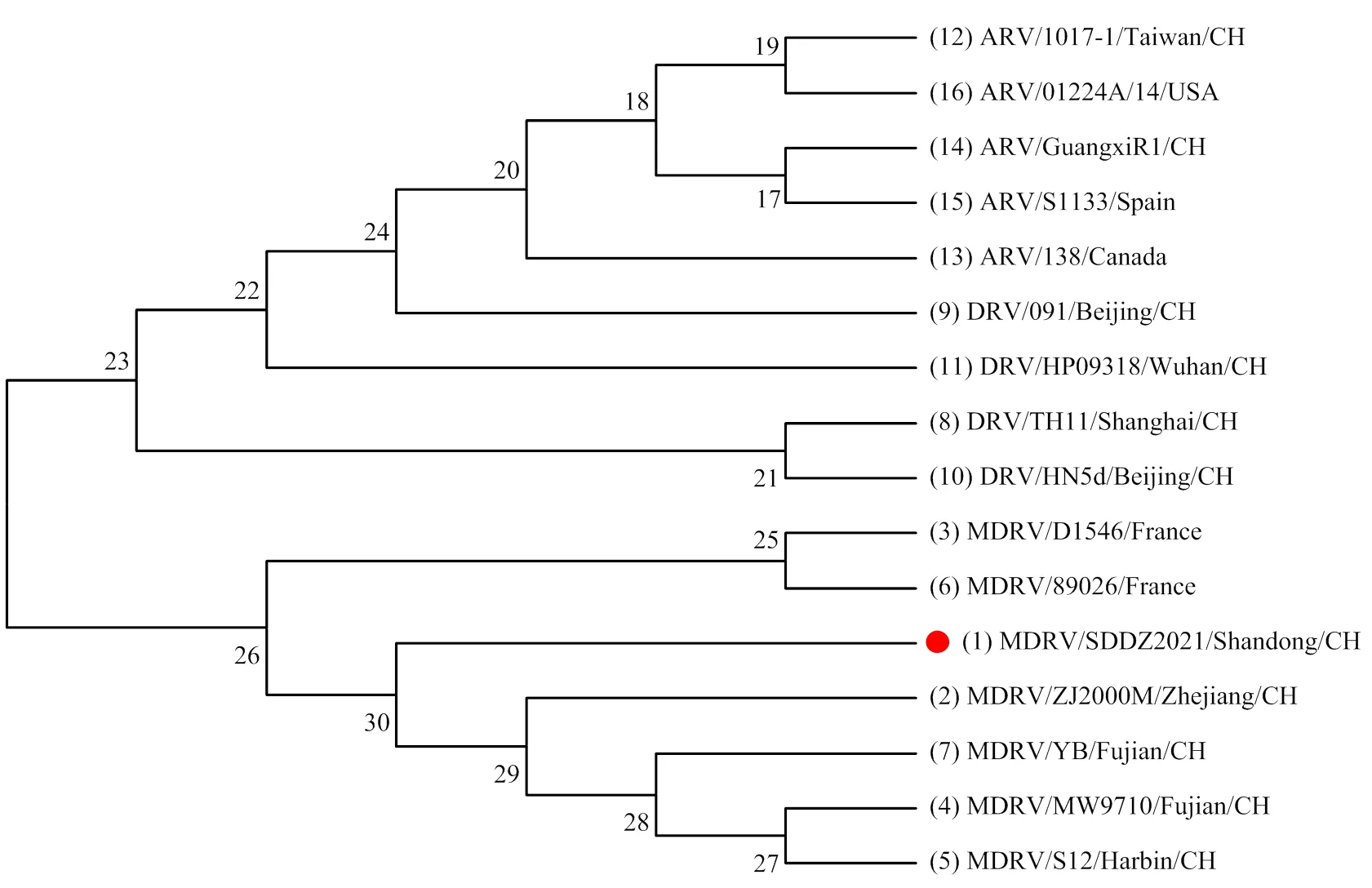
图5 基于σC基因的遗传进化图
据此,针对本次调查中鹅群检测出多种病毒核酸共存这一事实,笔者认为如果不能完全自繁自养,做好病毒净化,首先应做好引种检疫关,坚决不从发生过多种病毒流行的疫源地引种,避免垂直传播和交叉感染的发生。其次,规模化鹅场发生感染及死亡后,不能仅从症状推导疾病,应尽可能进行病毒核酸的检测,有条件的情况下还应针对检测出的病毒进行分离培养及易感动物的回归实验,以此排除疫苗毒株病毒核酸的干扰。明确实际感染的病毒种类,以此制定科学合理的治疗方案,循序渐进,标本兼治,避免遗漏、忽略任何一种病毒,尤其是免疫抑制性病毒。同时,笔者认为良好的饲养管理、全进全出及完善的消杀措施是重中之重,以此增强和保障鹅群的整体免疫力处于较高的水平。对于检测出的多种共存病毒,应针对性预防,如TMUV的重要传播媒介是蚊虫,则规模化鹅场夏季应做好灭蚊、防蚊工作;GAstV的重要传播媒介是野生水禽、涉禽,则规模化鹅场要做好隔离措施,选址尽量避开候鸟迁徙路线,水源尽可能洁净、独立,以此避免野生水禽、涉禽与鹅群发生直接或间接的接触。
3.2 共同检出多种病毒核酸与更严重的后果联系密切
本研究未检出只有GPV病毒核酸单一存在的情况,但GPV的检出率却高达35.55%,说明GPV以与其他病毒核酸共同检出为主,其中GPV与MDRV、GAstV、GoCV及FAdV共同检出的情况居多。WU等[2]调查了台湾规模化鹅场GPV与GoCV的检出情况,调查结果显示约12 000只鹅被感染,GPV与GoCV的同步检出率为53.26%,发病率为70%—80%,死亡率为20%—30%,远高于GPV或GoCV单一入侵所造成的发病率或死亡率[14];LIU等[3]调查了中国12个规模化鹅场,结果显示GAstV与GPV的同步检出率达到96.15%,远远超过GAstV或GPV的单一检出率,表明在GPV存在的条件下,规模化鹅场鹅群检出GAstV的概率大幅上升。NIU等[15]调查了中国11个省规模化鹅场的GPV检出情况,发现GPV与GoCV的同步检出率为21.7%;同时许多被调查的规模化鹅场并未流行过GPV,说明这些鹅场或许存在着GPV的隐性感染或垂直感染。因此除了常规的疫苗防控外,对种鹅群进行GPV的净化同样非常重要。此外,以往的研究报道了GPV与MDPV之间存在着明显的基因重组,并且已经出现了可导致鸭喙萎缩与侏儒症(BADS)的新型鸭源GPV,这表明GPV已可以跨宿主感染鸭群[8, 16-18]。
H9亚型AIV对鹅为低致病性[19],但当H9-AIV与其他病原体共同入侵宿主时,会使鹅群的死亡率大大增加。LIN等[20]调查结果显示鹅群单一检出H9-AIV时,发病率仅为10%,且无死亡现象,胸腺也未见明显病理变化,但当H9-AIV与MDRV共同检出后,鹅群发病率骤升至90%,死亡率攀升至70%,胸腺萎缩且出现局部坏死,表明H9-AIV与MDRV协同配合降低鹅群免疫力;HASSAN等[21]调查了埃及H9-AIV的检出情况,他们发现当H9-AIV与传染性支气管炎病毒(IBV)同步检出时,不仅H9-AIV的临床症状加重[22],IBV亦出现致死病例;GOWTHAMAN等[23]调查了印度南部37个农场的NDV与H9-AIV的共同检出情况,结果显示H9-AIV与NDV的共同检出率可达100%,死亡率比NDV、H9单一检出的情况皆高出30%以上,疫病持续时间多出4—6周,并继发大肠杆菌和支原体感染[24];YU等[25]调查了山东省H9-AIV与I群禽腺病毒血清4型(FAdV-4)共同检出的情况,结果显示H9-AIV与FAdV-4同步检出率为24.30%,由此推测免疫抑制性疫病会破坏群体免疫,为其他病原入侵提供有利条件。本研究H9-AIV于春季检出数量最多,原因可能与昼夜温差过大、天气寒冷导致鹅抵抗力下降有关。H9-AIV雏鹅检出数量较多,但死亡率却很低。成年鹅检出数量和死亡率相对较低,可能由于成年鹅的免疫系统发育成熟,可以抵抗H9-AIV的入侵[26]。但成年鹅可能出现隐性带毒的情况,尤其当H9-AIV与其他病毒共同入侵宿主机体时,可使鹅群的死亡率大幅增加。
NDV对鹅同样具有致病性,且发病率和死亡率居高不下。雏鹅更容易检出NDV,青年鹅和成年鹅NDV检出数量较少,可能由于青年鹅和成年鹅免疫系统较为完善。NDV大部分是单一检出,可能与其发病急、死亡率高有关;NDV多与H9-AIV共同检出,两者相互作用可使鹅群发病率升高。因此合理的免疫计划、标准的饲养管理可以最大程度降低NDV的危害。
本研究GHPV检出率仅为3.12%,尚未对我国鹅群构成威胁[27],但GHPV病毒在欧洲是非常重要的传染病原体之一[28-29]。规模化鹅场一旦检出GHPV病毒核酸就很难彻底净化[28, 30-31]。因此从国外引种、购买活鹅或鹅制品时要做好检验检疫,从源头上阻止GHPV传入我国。同时加强饲养管理,避免水禽混养、家禽野禽接触,并进行定期的彻底消毒,以上措施可在一定程度上防控GHPV对规模化鹅场造成危害。
TMUV入侵宿主机体具有明显的季节特征,夏季检出数量较多,因为夏季蚊虫较多利于该种虫媒病毒传播[32],因此在夏季规模化鹅场应注意灭蚊灭虫,从传播途径上减少鹅群接触TMUV的几率。TANG等[33]在规模化鹅场周边的麻雀体内检测到TMUV,以此提出麻雀可作为TMUV的传播媒介,这一点提示我们要做好规模化鹅场周边的防鸟措施,严禁家鹅与野禽、野鸟接触。本研究TMUV以与其他病毒核酸的共同检出为主(92.11%),其中又以TMUV、MDRV双重病毒核酸检出数量最多,2种病毒之间可能存在协同配合作用。因此,对TMUV的防控不能局限于对鹅群进行免疫接种,同时应加强饲养管理、建立健全生物安全综合防控体系。
GoCV病毒是一种免疫抑制性病毒[34],鹅感染GoCV后会继发其他病原感染,使其临床症状加重、复杂,导致发病率和死亡率急剧升高,是我国规模化鹅场病毒性疫病反复感染、不易控制的主要原因之一。本研究的GoCV检出率为32.43%,常与MDRV、GAstV、GPV、FAdV、H9等病毒核酸同时检出,各季节、各日龄段的鹅均易检出GoCV病毒核酸。雏鹅中GoCV检出数量较多,可能与垂直传播有关,应加强对种鹅群GoCV的净化。
3.3 规模化鹅场同时检出多种病毒核酸的现象需要得到更多的关注
本研究表明,我国部分地区规模化鹅场可以持续同时检测出多种病毒核酸,笔者猜测这或许是规模化鹅场病毒性疫病防控复杂化的原因之一。当2种或2种以上病毒同时或先后感染鹅时,会产生协同作用,常会导致临床症状与病理变化复杂化,极易造成误判与漏判,使鹅群感染率与死亡率升高,造成较为严重的经济损失。因此,除了常规的疫苗防控及药物治疗外,应根据每种病毒性疫病的传播特点及相互之间的作用规律制定合理的防控计划,加强引种检疫与种源净化,减少垂直传播。此外,切断传播途径及媒介,对免疫抑制性病原加强监控,定期监测抗体水平,通过多种手段综合保障规模化鹅场的生物安全。
4 结论
(1)解释了多种病毒核酸共存的原因,提出了针对生产的意见。
(2)对规模化鹅场进行了11种病毒核酸的检测,观察到数种病毒核酸同时检测出的现象(85.89%),以2种(38.26%)或3种(29.17%)病毒核酸同时检出的情况居多。
(3)规模化鹅场中GAstV、DRV、MDRV、GPV、GoCV、FAdV等病毒核酸的检出率较高,均在30.00%以上。
[1] CHEN Q X, XU X, YU Z L, SUI C G, ZUO K J, ZHI G L, JI J, YAO L G, KAN Y C, BI Y Z, XIE Q M. Characterization and genomic analysis of emerging astroviruses causing fatal gout in goslings. Transboundary and Emerging Diseases, 2020, 67(2): 865-876.
[2] TING C H, LIN C Y, HUANG Y C, LIU S S, PENG S Y, WANG C W, WU H Y. Correlation between goose circovirus and goose parvovirus with gosling feather loss disease and goose broke feather disease in southern Taiwan. Journal of Veterinary Science, 2021, 22(1): e1.
[3] LIU H M, HU D M, ZHU Y Q, XIONG H F, LV X, WEI C Q, LIU M M, YIN D D, HE C S, QI K Z, WANG G J. Coinfection of parvovirus and astrovirus in gout-affected goslings. Transboundary and Emerging Diseases, 2020, 67(6): 2830-2838.
[4] 陈柳, 余斌, 倪征, 华炯钢, 叶伟成, 云涛, 张存. 表达小鹅瘟病毒VP2蛋白重组鸭瘟病毒的构建及其生物学特性. 中国农业科学, 2016, 49(14): 2813-2821.
CHEN L, YU B, NI Z, HUA J G, YE W C, YUN T, ZHANG C. Construction and characterization of a recombinant duck enteritis virus expressinggene of goose parvovirus. Scientia Agricultura Sinica, 2016, 49(14): 2813-2821. (in Chinese)
[5] 王小蕾, 刘月焕, 段会娟, 刘立新, 杨志远, 赵际成, 潘洁, 刘瑞华, 赵文奇, 田方杰, 吕金宝, 林健. 鸭坦布苏病毒的血凝性. 中国农业科学, 2019, 52(23)4415-4422.
WANG X L, LIU Y H, DUAN H J, LIU L X, YANG Z Y, ZHAO J C, PAN J, LIU R H, ZHAO W Q, TIAN F J, LÜ J B, LIN J. Hemagglutinating activity of duck tembusu virus. Scientia Agricultura Sinica, 2019, 52(23)4415-4422. (in Chinese)
[6] 潘金金, 邹晓艳, 李鑫, 宿春虎, 柴茂, 姜逸, 胡艳芬, 赵国, 王彦红, 石火英, 陈素娟, 彭大新. 鹅源坦布苏病毒SHYG株的分离与鉴定. 中国农业科学, 2013, 46(5): 1044-1053.
PAN J J, ZOU X Y, LI X, SU C H, CHAI M, JIANG Y, HU Y F, ZHAO G, WANG Y H, SHI H Y, CHEN S J, PENG D. Isolation and identification of tembusu virus strain SHYG from goose. Scientia Agricultura Sinica, 2013, 46(5): 1044-1053. (in Chinese)
[7] WANG K, WANG C J, PAN L, WANG G J, QI K Z, LIU H M. Isolation and characterization of a goose parvovirus fromgoose. Acta Virologica, 2016, 60(3): 333-335.
[8] CHEN H, DOU Y G, TANG Y, ZHANG Z J, ZHENG X Q, NIU X Y, YANG J, YU X L, DIAO Y X. Isolation and genomic characterization of a duck-origin GPV-related parvovirus from cherry valley ducklings in China. PLoS One, 2015, 10(10): e0140284.
[9] YUN T, YU B, NI Z, YE W C, CHEN L, HUA J G, ZHANG C. Isolation and genomic characterization of a classical Muscovy duck reovirus isolated in Zhejiang, China. Infection, Genetics and Evolution, 2013, 20: 444-453.
[10] HAN K K, HUANG X M, LI Y, ZHAO D M, LIU Y Z, ZHOU X B, YOU Y, XIE X X. Complete genome sequence of goose tembusu virus, isolated from Jiangnan white geese in Jiangsu, China. Genome Announcements, 2013, 1(2): e00236-12.
[11] LEE D H, PARK J K, YUK S S, ERDENE-OCHIR T O, KWON J H, LEE J B, PARK S Y, CHOI I S, LEE S W, SONG C S. Complete genome sequence of a natural reassortant H9N2 avian influenza virus found in bean goose (): direct evidence for virus exchange between Korea and China via wild birds. Infection, Genetics and Evolution, 2014, 26: 250-254.
[12] SUN Y J, DING N, DING S S, YU S Q, MENG C H, CHEN H J, QIU X S, ZHANG S L, YU Y, ZHAN Y, DING C. Goose RIG-I functions in innate immunity against Newcastle disease virus infections. Molecular Immunology, 2013, 53(4): 321-327.
[13] WANG A Q, SUN L P, WANG M S, JIA R Y, ZHU D K, LIU M F, SUN K F, YANG Q, WU Y, CHEN X Y, CHENG A C, CHEN S. Identification of IFITM1 and IFITM3 in goose: gene structure, expression patterns, and immune responses against tembusu virus infection. BioMed Research International, 2017, 2017: 1-13.
[14] KARDOĞAN Ö, MÜŞTAK H K, MÜŞTAK İ B. The first detection and characterization of goose parvovirus (GPV) in Turkey.Tropical Animal Health and Production, 2020, 53(1): 1-4.
[15] NIU X, WANG H, WEI L, ZHANG M, YANG J, CHEN H, TANG Y, DIAO Y. Epidemiological investigation of H9 avian influenza virus, Newcastle disease virus, Tembusu virus, goose parvovirus and goose circovirus infection of geese in China. Transboundary and Emerging Diseases, 2018, 65(2): e304-e316.
[16] SHEN H X, ZHANG W, WANG H, ZHOU Y, SHAO S H. Identification of recombination between Muscovy duck parvovirus and goose parvovirus structural protein genes. Archives of Virology, 2015, 160(10): 2617-2621.
[17] WANG S, CHENG X X, CHEN S Y, LIN F Q, CHEN S L, ZHU X L, WANG J X. Evidence for natural recombination in the capsid geneof Taiwanese goose parvovirus. Archives of Virology, 2015, 160(8): 2111-2115.
[18] ZHU Y M, ZHOU Z Q, HUANG Y, YU R S, DONG S J, LI Z, ZHANG Y S. Identification of a recombinant Muscovy duck parvovirus (MDPV) in Shanghai, China. Veterinary Microbiology, 2014, 174(3/4): 560-564.
[19] CHEN S, WANG A Q, SUN L P, LIU F, WANG M S, JIA R Y, ZHU D K, LIU M F, YANG Q, WU Y, SUN K F, CHEN X Y, CHENG A C. Immune-related gene expression patterns in GPV- or H9N2-infected goose spleens. International Journal of Molecular Sciences, 2016, 17(12): 1990.
[20] LIN F Q, GAO C, CHEN S Y, ZHU X L, CHENG X X, WANG S, CHEN S L, CAI X, LI Z, MA C Q, ZHAO J R. Immunosuppression effect of co-infection with MDRV and H9 AIV on thymus in Muscovy ducks. Wei Sheng Wu Xue Bao, 2011
[21] HASSAN K E, ALI A, SHANY S A S, EL-KADY M F. Experimental co-infection of infectious bronchitis and low pathogenic avian influenza H9N2 viruses in commercial broiler chickens. Research in Veterinary Science, 2017, 115: 356-362.
[22] ELADL A H, MOSAD S M, EL-SHAFEI R A, SALEH R M, ALI H S, BADAWY B M, ELSHAL M F. Immunostimulant effect of a mixed herbal extract on infectious bursal disease virus (IBDV) vaccinated chickens in the context of a co-infection model of avian influenza virus H9N2 and IBDV. Comparative Immunology, Microbiology and Infectious Diseases, 2020, 72: 101505.
[23] GOWTHAMAN V, SINGH S D, DHAMA K, RAMAKRISHNAN M A, MALIK Y P S, GOPALA KRISHNA MURTHY T R, CHITRA R, MUNIR M. Co-infection of Newcastle disease virus genotype XIII with low pathogenic avian influenza exacerbates clinical outcome of Newcastle disease in vaccinated layer poultry flocks.VirusDisease, 2019, 30(3): 441-452.
[24] ROUSSAN D A, HADDAD R, KHAWALDEH G. Molecular survey of avian respiratory pathogens in commercial broiler chicken flocks with respiratory diseases in Jordan. Poultry Science, 2008, 87(3): 444-448.
[25] YU G L, LIN Y, DOU Y G, TANG Y, DIAO Y X. Prevalence of fowl adenovirus serotype 4 and Co-infection by immunosuppressive viruses in fowl with hydropericardium hepatitis syndrome in Shandong Province, China. Viruses, 2019, 11(6): 517.
[26] CHEN S, ZHOU Q, CHENG B B, YAN B, YAN X L, ZHAO Q R, WANG M S, JIA R Y, ZHU D K, LIU M F, CHEN X Y, CHENG A C. Age-related development and tissue distribution of T cell markers (CD4 and CD8a) in Chinese goose. Immunobiology, 2015, 220(6): 753-761.
[27] WAN C H, CHEN C T, CHENG L F, LIU R C, FU G H, SHI S H, CHEN H M, FU Q L, HUANG Y. Genomic analysis of Sheldrake origin goose hemorrhagic polyomavirus, China. Journal of Veterinary Science, 2018, 19(6): 782.
[28] GARMYN A, VERLINDEN M, BOSSELER L, ADRIAENSEN C, MARTEL A. Persistent goose hemorrhagic polyomavirus infection on a Belgian goose farm. Avian Diseases, 2017, 61(4): 536-538.
[29] MÉSZÁROS I, TÓTH R, BÁLINT A, DÁN A, JORDAN I, ZÁDORI Z. Propagation of viruses infecting waterfowl on continuous cell lines of Muscovy duck () origin. Avian Pathology: Journal of the W V P A, 2014, 43(4): 379-386.
[30] CORRAND L, GELFI J, ALBARIC O, ETIEVANT M, PINGRET J L, GUERIN J L. Pathological and epidemiological significance of Goose haemorrhagic polyomavirus infection in ducks. Avian Pathology, 2011, 40(4): 355-360.
[31] PINGRET J L, BOUCRAUT-BARALON C, GUÉRIN J L. Goose haemorrhagic polyomavirus infection in ducks. Veterinary Record, 2008, 162(5): 164.
[32] TANG Y, DIAO Y, CHEN H, OU Q, LIU X, GAO X, YU C, WANG L. Isolation and genetic characterization of a tembusu virus strain isolated from mosquitoes in Shandong, China. Transboundary and Emerging Diseases, 2015, 62(2): 209-216.
[33] TANG Y, DIAO Y, YU C, GAO X, JU X, XUE C, LIU X, GE P, QU J, ZHANG D. Characterization of a tembusu virus isolated from naturally infected house sparrows () in northern China. Transboundary and Emerging Diseases, 2013, 60(2): 152-158.
[34] YU X P, ZHU C, ZHENG X T, HE S C, LIU X N. Genome analysis and epidemiological investigation of goose circovirus detected in Eastern China. Virus Genes, 2007, 35(3): 605-609.
Investigation and Analysis of Nucleic Acid Detection Results of Viral Viruses in Large-Scale Goose Farms
SHAO Zhen, DIAO YouXiang
College of Animal Science and Technology, Shandong Agricultural University, Tai′an 271000, Shandong
【Objective】The author’s research group has long investigated the nucleic acid detection rate of common viral diseases in scaled goose farms in various provinces and cities in China, and found that many large-scaled goose farms in China could detect multiple viral nucleic acids at the same time, and this phenomenon was very common. In view of the lack of relevant data on the simultaneous detection of multiple viral diseases in large-scale goose farms in China, the purpose of this paper was to understand and analyze the simultaneous detection of nucleic acids of multiple viral diseases in large-scaled goose farms, so as to provide the theoretical guidance and scientific basis for the prevention and control of viral diseases in scaled goose farms. 【Method】From May 2021 to October 2021, 737 diseased materials were collected from 47 scaled goose farms in Shandong, Heilongjiang, Sichuan, Jilin, Guangxi, Henan, Anhui, Liaoning, Hebei, Guizhou, Hunan and Inner Mongolia. These samples were detected for Muscovy duck reovirus (MDRV), duck reovirus (DRV), goose astroviruses (GAstV), fowl adenovirus (FAdV), reticuloendotheliosis virus (REV), Newcastle disease (NDV), goose parvovirus (GPV), goose circovirus (GoCV), goose hemorrhagic polyomavirus (GHPV), Tembusu virus (TMUV) and H9 subtype avian influenza virus (H9-AIV) by ordinary PCR and RT-PCR. The liver, spleen, lung and kidney were dissected from each sample, and total RNAs were extracted by Trizol method; a strand of cDNA was synthesized by reverse transcription with total RNA as the template, and then the complete cDNA was obtained by continuous amplification with cDNA as the template. Using these cDNA as template, the specific primers of MDRV, DRV, GAstV, FAdV, REV, NDV, GPV, GoCV, GHPV, TMUV and H9-AIV were used to amplify the target fragment by ordinary PCR reaction. All amplified fragments were analyzed by agarose gel electrophoresis, and some positive samples were sequenced. The obtained sequencing results were compared with the corresponding virus gene sequences published on GenBank, and the phylogenetic tree was drawn by Neighbor-Joining (N-J) method in MEGA 6.0 software for analysis. 【Result】MDRV, DRV, GAstV, FAdV, REV, NDV, GPV, GoCV, GHPV, TMUV and H9-AIV showed that the detection rate of GAstV was the highest, with the value of 58.21%; the detection rates of REV and NDV were the lowest, with the value of 1.36% and 1.50%, respectively. A variety of viral nucleic acids could be detected simultaneously in geese to varying degrees, especially in two or three viral nucleic acids, accounting for 67.44% of the total samples. In the simultaneous detection rate of nucleic acids of the two viruses, GAstV and GoCV accounted for the largest proportion, which was 18.44%; MDRV, GAstV and GPV accounted for 36.28% of the simultaneous detection rates of the three virus nucleic acids. 【Conclusion】It was further confirmed that multiple viral nucleic acids could be detected simultaneously in large-scaled goose farms in China. It was speculated that this might be one of the important reasons for the complexity of viral diseases and the difficulty of prevention and control in large-scaled goose farms in China.
scaled goose farm; nucleic acid test; phylogenetic analysis

10.3864/j.issn.0578-1752.2023.10.016
2022-01-13;
2022-05-23
现代农业产业技术体系建设专项资金(CARS-42-19)
邵震,Tel:15526836071;E-mail:1250101253@qq.com。通信作者刁有祥,Tel:13605386443;E-mail:yxdiao@163.com
(责任编辑 林鉴非)

