血清尿酸水平对紫癜性肾炎患儿病情评估的意义*
危莉,金皎,张涛,周燕,饶静,杨彬,贾丽丹,艾戎,张力*
(贵州医科大学附属医院 儿科,贵州 贵阳 550001)
紫癜性肾炎(henoch-schönlein purpura nephrities,HSPN)是儿童最常见的继发性肾小球肾炎,约20%~55%发生肾脏损害,该病预后良好,但仍有约2%~5%的HSPN可能进展为终末期肾脏病[1]。因此,早期识别、早期诊断和治疗对提高HSPN的生活质量尤为重要。HSPN诊断的金标准是肾脏病理组织活检,但该检查属于有创操作,风险大、检查费用昂贵及活检条件要求高,故寻找可用于评估肾脏损伤严重程度的无创、操作简便的评估指标仍然是一大热点。血清尿酸(serum uric acid,SUA)是体内嘌呤代谢的产物,由于生活水平的提高,致使高尿酸血症(hyperuricemia,HUA)的发生越来越多[2]。有研究表明,HUA已成为慢性肾脏病(chronic kidney disease,CKD)发生、发展及影响预后的危险因素[3],但其与HSPN方面的研究仍较少。本研究通过对HSPN患儿SUA水平与免疫功能、尿蛋白、肾脏病理等进行分析比较,探讨SUA对HSPN病情评估的临床意义。
1 对象与方法
1.1 研究对象
选取2017年1月—2022年12月确诊的HSPN患儿。纳入标准:(1)符合2016版中华医学会儿科学分会肾脏病学组制定的HSPN诊断标准[4];(2)年龄≤18岁。排除标准:(1)IgA肾病(IgA nephropathy,IgAN)、狼疮性肾炎、乙肝病毒相关性肾炎及抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody,ANCA)相关性血管炎等其他肾脏疾病;(2)存在其他导致血尿酸增高的代谢性疾病;(3)肾穿刺前使用降尿酸药物治疗。共纳入患儿136例,男性82例、女性54例,按照SUA数值高低将HSPN患儿分为HUA组(n=42)和非HUA组(n=94),2组患儿一般临床情况见表1。
1.2 研究方法
1.2.1一般临床资料 收集2组HSPN患儿入院行肾脏病理活检时的年龄、性别、SUA、免疫指标、血肌酐、尿素、胱抑素C、补体C3、补体C4、免疫球蛋白(immunoglobulin,Ig)、24 h尿蛋白定量、尿微量蛋白、尿α1-微球蛋白、尿蛋白IgG、尿转铁蛋白及肾脏病理活检结果。
1.2.2SUA检测及结果判定 采集2组HSPN患儿低嘌呤饮食第3天清晨空腹静脉血3 mL,采用全自动血生化分析仪Cobas 702(罗氏)检测SUA;HUA的诊断标准为SUA高于同年龄、同性别的正常高值[5],即1~12月龄>500 μmol/L,1~10岁>320 μmol/L,11~15岁男性>470 μmol/L、女性>350 μmol/L,15 岁以上男性>420 μmol/L、女性>357 μmol/L,依据此标准将HSPN患儿分为HUA组和非HUA组。
1.2.3细胞免疫的检测 取“1.2.2”项下2组HSPN患儿静脉血置于EDTA管抗凝,采用流式细胞分析仪(FACSCanto TM,美国BD公司)检测外周血中相应的荧光,将自然杀伤(natural killer ,NK)细胞、CD3+T、CD4+T、CD8+T、CD3+CD19+淋巴细胞从淋巴细胞中区分出来,继而获取淋巴细胞各亚群的百分比。
1.2.4肾脏病理结果判定及分级 2组HSPN患儿在超声定位下完成肾脏穿刺制作标本,依据2016年中华医学会儿科学分会肾脏病学组制定的 HSPN诊断标准[4]进行肾小球病理分级:Ⅰ级为肾小球轻微异常;Ⅱ级为单纯系膜增生,分为局灶节段和弥漫性;Ⅲ级为系膜增生,伴有<50%肾小球新月体形成和(或)节段性病变(硬化、粘连、血栓及坏死),其系膜增生可为局灶节段和弥漫性;Ⅳ级病变同Ⅲ级,50%~75%的肾小球伴有上述病变,分为局灶节段和弥漫性;Ⅴ级病变同Ⅲ级,>75%的肾小球伴有上述病变,分为局灶节段和弥漫性;Ⅵ级为膜增生性肾小球肾炎。
1.3 统计学分析
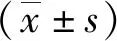
2 结果
2.1 一般临床资料
HUA组HSPN患儿42例,中位年龄12.0岁;非HUA组94例,中位年龄11.0岁;2组性别、年龄差异比较,差异无统计学意义(P>0.05);HUA组HSPN患儿血清肌酐、尿素氮、尿转铁蛋白、24 h尿蛋白定量水平高于非HUA组(P<0.05),但尿蛋白IgG、尿α1-微球蛋白、尿微量蛋白等指标比较,差异无统计学意义(P>0.05)。见表1。
2.2 免疫功能
HUA组患儿CD4+T淋巴细胞比例高于非HUA组,NK细胞比例低于非HUA组,差异有统计学意义(P<0.05);2组患儿CD19+细胞比例、CD3+T淋巴细胞比例、CD8+T淋巴细胞比例、CD4/8、补体C3、补体C4、IgA、IgG及IgM比较,差异无统计学意义(P>0.05)。见表2。

表2 HUA组与非HUA组HSPN患儿的免疫功能指标Tab.2 Immune function indexes of HSPN children in HUA and non-HUA groups
2.3 肾脏病理分级
依据肾小球病理检查结果,将HSPN患儿分为Ⅲb以下及Ⅲb及以上两部分,结果显示HUA组患儿病理分级在Ⅲb级及以上占比更多,2组之间病理分级差异有统计学意义(Z=-2.025,P=0.043)。见表3。
2.4 影响HSPN患儿病理结果严重程度的多因素分析
纳入年龄、性别、尿素氮、血清肌酐、血清尿酸、NK细胞比例、CD4+T细胞比例作为自变量,肾脏病理分级是否≥Ⅲb级(病理分级≥Ⅲb级=1,<Ⅲb级=0)为因变量,构建二元多因素logistic回归方程。结果表明,血清尿酸(OR=1.007,95%CI为1.001~1.012,P=0.025)是HSPN患儿病理结果严重程度的影响因素,差异有统计学意义(P<0.05)。见表4。

表3 HUA组与非HUA组HSPN患儿的肾脏病理分级Tab.3 Renal pathological grading of HSPN children in HUA and non-HUA groups
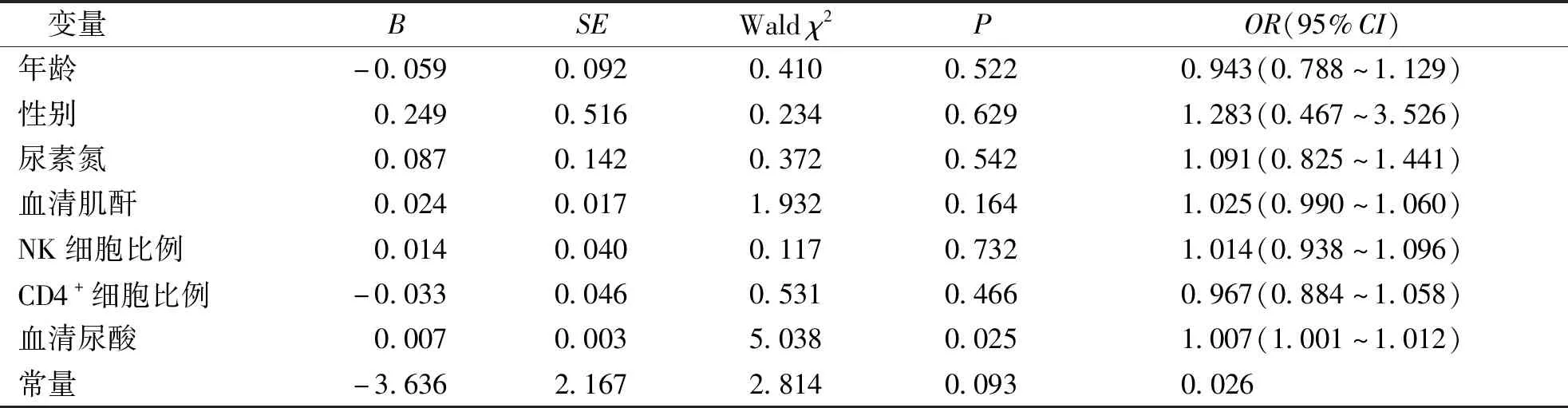
表4 HSPN患儿病理结果严重程度的影响因素Tab.4 Influencing factors of pathological severity in HSPN children
3 讨论
过敏性紫癜(henoch-schönlein purpura,HSP)是儿童最常见的全身性小血管炎,属自限性疾病,HSPN是HSP最严重的并发症,目前该病发生机制仍不能明确,可能与细菌或病毒感染、免疫紊乱等有关[6]。HSPN占儿科住院泌尿系统疾病中的第3位,大部分预后良好,但部分患儿仍可能进展为终末期肾病[7]。HSPN诊断的金标准是病理活检,由于该检查属于有创性操作,患儿家属难以接受,因此,寻找可重复的、无创的评估指标对于早期诊断、治疗以及防止疾病恶化以期改善预后显得尤为重要。
SUA作为人体内嘌呤核苷酸代谢的产物,大部分通过肾脏排泄,生成过多或者排泄减少都可能会导致HUA[8]。近年来由于生活水平的不断提高,HUA的发生越来越多。既往研究证明SUA可形成尿酸盐晶体沉积于肾脏造成直接损害,也可通过多种途径致使肾脏损伤[9]。SUA浓度升高可引起肾素-血管紧张素-醛固酮系统激活,导致系统性及肾小球性高血压,并使得肾脏血流动力学和组织学改变[10-11]。基线水平估计肾小球滤过(estimate glomerular filtration rate,eGFR)正常且无蛋白尿的10 677名中国居民队列研究结果表明,随访6年后较高的SUA水平增加了肾脏疾病发生的风险并影响eGFR,提示SUA增高可能导致肾功能的改变[12];有研究显示,伴有HUA的模型大鼠足细胞损伤且出现了明显的蛋白尿 ,提示HUA可导致肾小球足细胞损伤,进而导致肾脏损伤[13];国内研究有显示,合并HUA的HSPN患儿尿蛋白定量高于正常组[14]。本研究中,HUA组患儿血清肌酐、尿素氮、尿转铁蛋白、24 h尿蛋白定量水平高于非HUA组,与之前的研究一致,推测SUA的增高可能损伤肾脏,致使肾功能发生改变。本研究2组患儿间尿微量白蛋白、尿α1微球蛋白以及尿IgG蛋白水平无差异,原因有待进一步研究。
SUA可通过激活的免疫细胞诱导炎症因子的产生导致机体损伤,如SUA可刺激先天性免疫细胞,诱使以巨噬细胞为主的大量炎症细胞浸润肾小管[15-16];SUA也可通过多种途径刺激树突状细胞、巨噬细胞及T细胞来激活免疫系统,并通过免疫细胞分泌炎症因子,最终对肾小球产生损害作用[17]。研究表明,SUA可降低T细胞激活的阈值,可在没有抗原提呈细胞的情况下直接激活T细胞,并使CD4+T细胞高表达[18]。此外,SUA可诱导树突状细胞(Cy6C+、CD11b+)活化,从而促进2型T辅助性(T helper 2,Th2)细胞介导的免疫反应[19];Th2细胞的大量增殖使Th1细胞减少,导致白细胞介素-2(interleukin-2,IL-2)分泌减少,NK细胞数量也相应减少;既往研究已经表明,NK细胞能够增强B细胞作用导致IgA分泌增多[20],而HSP发病与IgA升高形成大分子复合物IgA1沉积有关,猜测NK细胞与肾脏受损的免疫激活可能存在潜在关系。有研究显示,与单纯型HSP患儿相比,HSP伴肾脏损害患儿NK细胞比例较低,NKp46表达较低,推测NK细胞比例越低越较容易进展为HSPN[21];HSPN回顾性研究表明,HSPN患儿CD4+T细胞比例高于单纯型HSP,而NK细胞比例低于单纯型HSP,患儿CD4+T细胞的增殖和NK细胞的减少与肾脏损害相关[22]。本研究结果表明,与非HUA组相比,HUA组患儿CD4+T淋巴细胞比例升高,NK细胞比例降低。与之前的研究一致,推测SUA可通过NK细胞影响HSPN的发病。
有研究表明,高尿酸环境可增加系膜细胞数目及其DNA合成速率,促进肾小球系膜细胞的增生[23];HUA组HSPN患儿病理分级为Ⅰ~Ⅱ级的比例低[24];本研究结果与上述结果一致,与非HUA组相比,HUA组患儿肾小球病理活检Ⅲb级及以上占比较多,提示合并HUA的患儿肾脏病理损伤更严重。有研究提示,血尿酸与成人HSPN病理存在具有独立相关性(P<0.05)[25]。本研究纳入年龄、性别、血肌酐、尿素氮、SUA、NK细胞比例、CD4+T细胞比例作为自变量,肾脏病理结果分级是否≥Ⅲb级为因变量构建二元多因素logistic回归方程,结果同样表明SUA是HSPN患儿病理严重程度的影响因素(OR=1.007,95%CI为1.001~1.012,P=0.025),SUA越高,导致肾脏病理改变更严重的风险越大。因此,尿酸可作为评估HSPN患儿的一个重要指标。
综上所述,合并有HUA的HSPN患儿,机体免疫功能紊乱较明显,肾脏病理改变更严重,SUA可作为HSPN病情的一项指标。当然,目前HUA引起的肾损伤的明确机制尚不完全清楚,未来需要进一步研究,同时治疗HUA对改善HSPN预后是否有效仍需进一步进行前瞻性研究。

