α-硫辛酸对大鼠腹膜纤维化的作用及机制*
都元洪,甘平*
(贵州医科大学 临床医学院,贵州 贵阳 550004)
腹膜透析(peritoneal dialysis,PD)是慢性肾病有效的替代疗法,但可导致腹膜间皮细胞层丢失、腹膜下间皮层增厚和血管生成[1],引起腹膜纤维化(peritoneal fibrosis,PF)而使其应用受到限制[2]。研究表明,在PD治疗过程中高渗葡萄糖透析液不仅对间皮细胞有毒性作用,而且还能促进免疫细胞凋亡[3]。转化生长因子β1(transforming growth factor β1,TGF-β1)作为一种重要的纤维化因子,在腹膜间皮细胞暴露于高浓度葡萄糖的透析液中被诱导[4],TGF-β1/Smad3信号通路在肝纤维化发生发展过程中有重要作用[5]。α-硫辛酸(alpha-lipoic acid,α-LA)是一种天然的抗氧化剂,能够调节线粒体活性、能量代谢和细胞生长,已被应用于糖尿病多发外周神经病变、肝硬化、心脏纤维化和系统性硬化的治疗[6]。此外,α-LA可通过抑制肺上皮-间质转化减轻SiO2诱导的肺纤维化[7]。然而,α-LA是否能在腹膜纤维化中调节TGF-β1/Smad3信号转导仍有待研究。因此,本研究探讨α-LA对高糖腹膜透析液诱导的PF大鼠的作用及可能机制,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1实验动物 健康雄性SD大鼠30只,SPF级,体质量(160±20) g,由贵州医科大学实验动物中心提供[许可证号SCXK(黔)2018-0001],大鼠饲养于(22~25) ℃、湿度(50±5)%的SPF层流罩中。
1.1.2主要试剂及仪器 α-LA注射液购自德国史达德大药厂,4.25%葡萄糖腹膜透析液(PD solution,PDS)购自美国Baxter医疗,α-SMA、Collagen Ⅰ一抗购自英国Abcam,TGF-β1兔克隆抗体、p-Smad3兔克隆抗体购自美国Abclonal,p-Smad2兔克隆抗体(AF3450)、生物素化山羊抗兔IgG(H+L)购自美国Affinity,Western细胞裂解液、BCA蛋白浓度测定试剂盒购自上海碧云天生物公司;AU5800全自动生化分析仪购自贝克曼库尔特(苏州),BA210Digital型数码三目摄像显微镜购自麦克奥迪实业集团有限公司,JY200C型电泳仪购自北京君意东方电泳设备有限公司,TE22型蛋白质转膜仪购自美国 Hoefer公司,5200型化学发光凝胶成像仪购自上海天能科技有限公司。
1.2 实验方法
1.2.1分组与建模 大鼠适应性饲养1周后,随机分为空白对照组(A组)、模型组(B组)、α-LA腹腔注射高剂量组(400 μmol/L,C组)、α-LA腹腔注射中剂量组(300 μmol/L,D组)、α-LA腹腔注射低剂量组(200 μmol/L,E组)、α-LA灌胃组(300 μmol/L,F组),每组5只。A组腹腔注射生理盐水20 mL,B、C、D、E、F组腹腔注射4.25% PDS 20 mL(轻揉按摩),1次/d,连续4周;C、D、E组在造模同时经腹腔注射相应剂量α-LA、1次/d,F组在造模同时灌胃α-LA(300 μmol/L,1次/d),A、B组腹腔注射等量生理盐水,连续4周[8],记录处理前后大鼠体质量。
1.2.2腹膜组织取样 各组大鼠末次干预后,腹腔注射4.25%PDS(轻揉按摩)2 h;之后,腹腔注射1%戊巴比妥钠(35 mg/kg)、颈椎脱臼处死、开腹(注意避开左下腹注射部位),取大鼠右下腹近白线处壁腹膜组织5 mm×4 mm×3 mm各3份,1份保存于-20 ℃冰箱内,1份保存于液氮中,1份固定于4%多聚甲醛。
1.2.3HE、Masson's染色观察腹膜组织形态 取腹膜组织用4%甲醛固定、石蜡包埋、切片,HE和Masson's染色,二甲苯脱蜡透明,中性树胶封固,HE染色切片、显微镜下观察组织病变,Masson's染色切片、显微镜下观察胶原纤维情况,并采用Image-Pro Plus 6.0图像分析软件对胶原纤维面积进行半定量分析,纤维组织表达面积(%)=蓝色胶原纤维的面积/(视野总面积-空腔面积)×100% 。
1.2.4检测α-SMA、Collagen Ⅰ蛋白表达 取腹膜组织固定、石蜡包埋和切片,3%H2O2中孵育30 min,山羊血清封闭,置于一抗α-SMA(1∶200)、Collagen Ⅰ(1∶100)中4 ℃孵育,洗涤后在室温下与二抗孵育1 h,苏木素染色,镜检观察,并采用Image-Pro Plus 6.0图像分析系统计算 α-SMA、Collagen Ⅰ的平均光密度值(IOD),IOD=腹膜组织阳性细胞光密度总和/阳性面积。
1.2.5检测 TGF-β1、p-Smad 2及p-Smad 3蛋白表达 取大鼠腹膜组织加入含有蛋白酶抑制剂的裂解液RIPA裂解,14 000 r/min于4 ℃离心10 min后收集上清液,BCA法测蛋白质浓度;蛋白样品用SDS-PAGE分离,转移到聚偏氟乙烯膜上,用5%脱脂牛奶溶液室温下封闭1 h,然后置于一抗TGF-β1(1∶2 000)、p-Smad 2(1∶2 000)、p-Smad 3(1∶2 000)和β-actin(1∶100 000)中 4 ℃孵育过夜,之后用山羊抗兔二抗(1∶20 000)孵育1 h、TBST清洗,使用凝胶成像分析仪和天能GIS软件V2.0对条带进行曝光扫描,以β-actin为内参,目的蛋白相对表达量=目的蛋白积分光密度值(IOD目的)/内参积分光密度值(IOD内参)。
1.3 统计学分析
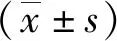
2 结果
2.1 大鼠体质量
处理前各组大鼠体质量组间比较,差异均无统计学意义(P>0.05),活动均未见异常;处理后C组大鼠体质量较A、B、F组低(P<0.05)。见表1。
2.2 大鼠腹膜组织学改变
A组大鼠腹膜组织结构较为完整、清晰,未见明显增厚;B组大鼠腹膜组织明显增厚,表面单层上皮细胞排列紊乱,由扁平状变为圆形或柱状,部分区域间皮缺失,间皮下大量纤维组织增生、伴少量炎性细胞浸润,新生毛细血管数量明显增多,局部区域出血;C组大鼠腹膜组织结构较为完整,未见明显增厚,表面被覆单层扁平上皮,排列较为整齐,间皮下少量纤维组织增生伴极少量炎性细胞浸润;D组大鼠腹膜组织轻微增厚,表面间皮由扁平上皮变为圆形,间皮下少量纤维增生,见少量成纤维细胞,胞质染色较为均匀;E组大鼠腹膜组织增厚,表面单层上皮细胞排列紊乱,由扁平状变为圆形或柱状,间皮下纤维组织增生,见少量成纤维细胞;F组大鼠腹膜组织增厚,表面间皮细胞由扁平状变为圆形或柱状,间皮下纤维组织增生,见少量成纤维细胞聚集。见图1。

表1 处理前后各组大鼠体质量Tab.1 Body mass index of rats in each group
2.3 大鼠腹膜组织纤维化
Masson's结果显示,与A组比较,B组腹膜组织内纤维化表达面积百分比升高(P<0.05);与B组相比,C、D、E组腹膜组织内纤维化表达面积百分比降低(P<0.05);与F组比较,C、D、E组腹膜组织内纤维化表达面积百分比降低(P<0.05)。见表2、图2。

表2 各组大鼠腹膜纤维组织表达面积百分比Tab.2 Percentage of peritoneal fibrous tissue expression area in each

注:黑色箭头表示腹膜增厚;绿色箭头表示纤维组织增生;蓝色箭头表示出血。图1 各组大鼠腹膜组织形态(HE)Fig.1 Peritoneal histomorphology of rats in each group (HE)

注:黑色箭头表示纤维化表达。图2 各组大鼠腹膜组织纤维化(Masson染色,×200)Fig.2 Peritoneal tissue fibrosis in all groups (Masson stainig,×200)
2.4 大鼠腹膜组织α-SMA、CollagenⅠ蛋白表达
免疫组化染色检测结果显示,与A组比较,B组腹膜组织α-SMA、Collagen Ⅰ表达升高(P<0.05);与B组相比,C、D、E、F组腹膜组织α-SMA表达降低(P<0.05),C、D组腹膜组织Collagen Ⅰ表达降低(P<0.05);与F组比较,C、D组腹膜组织α-SMA、Collagen Ⅰ表达降低(P<0.05)。见图3、表3。
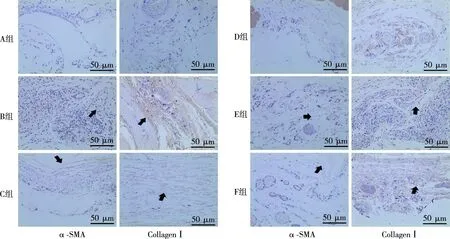
注:图中黑色箭头表示呈黄色或棕黄色的阳性细胞。图3 各组大鼠腹膜组织α-SMA及CollagenⅠ蛋白表达(免疫组化染色,×20)Fig.3 Expressions of α-SMA and CollagenⅠprotein in peritoneal tissues of rats in each group (immunohistochemical staining,×20)

表3 各组大鼠腹膜组织α-SMA及CollagenⅠ的相对表达Tab.3 Relative expressions of α-SMA and CollagenⅠ in peritoneal tissues of each
2.5 大鼠腹膜组织TGF-β1/Smads信号通路变化
与A组比较,B组腹膜组织TGF-β1、p-Smad 2、p-Smad 3蛋白表达升高(P<0.05);与B组相比,C、D、E、F组腹膜组织TGF-β1蛋白表达降低(P<0.05),C、D、F组腹膜组织p-Smad 2蛋白表达降低(P<0.05),C、D组腹膜组织p-Smad 3蛋白表达降低(P<0.05);与F组比较,C、D组腹膜组织TGF-β1、p-Smad 2蛋白表达降低(P<0.05),C组p-Smad 3蛋白表达降低(P<0.05)。见图4。
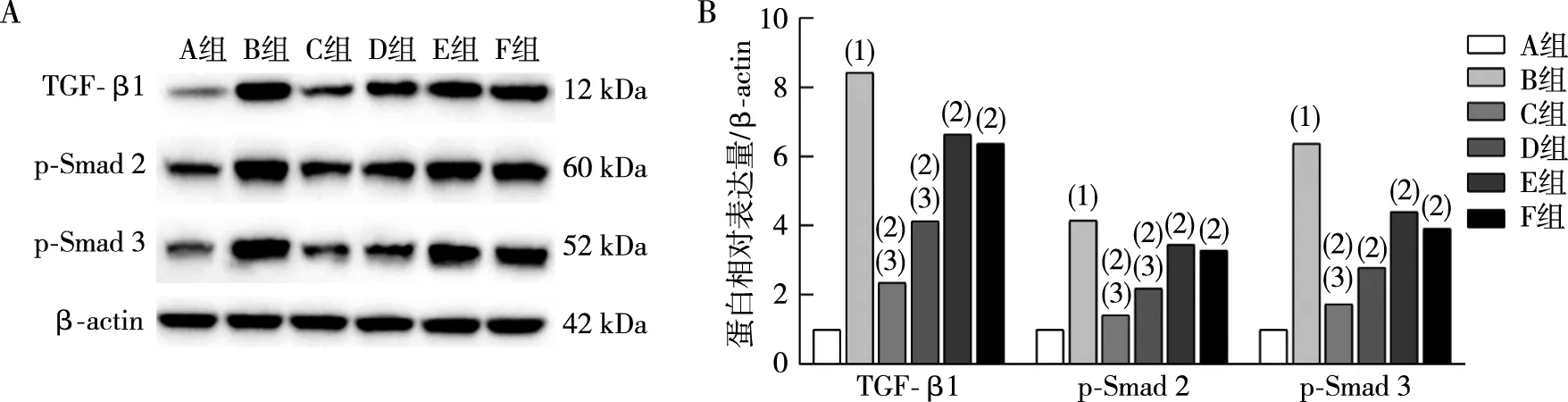
注:A为Western blot检测TGF-β1、p-Smad 2、p-Smad 3蛋白免疫印迹条带,B为TGF-β1、p-Smad 2、p-Smad 3蛋白表达;(1)与A组相比,P<0.05;(2)与B组相比,P<0.05;(3)与F组相比,P<0.05。图4 各组大鼠腹膜组织TGF-β1、p-Smad 2及p-Smad 3蛋白表达Fig.4 Expressions of TGF-β1,p-Smad 2,and p-Smad 3 protein of peritoneal tissues in each group
3 讨论
在终末期肾脏病接受PD治疗的患者中,PF的发生率和程度随着透析时间的延长而增加,是导致患者退出PD治疗、PD技术存活率降低和患者死亡率升高的主要危险因素[10]。目前临床大规模使用的高浓度PDS,在与腹膜间皮细胞的长期接触过程中,因其生物相容性不佳,导致间皮细胞产生活性氧、分泌炎症因子,使腹膜局部组织细胞长期处于慢性炎症状态,并诱发腹膜间皮细胞间充质转化(epithelial mesenchymal transition,EMT),启动新生血管形成,促进细胞凋亡,最终引起腹膜组织纤维化,透析效能下降[11-12]。4.25%PDS腹腔注射诱导的大鼠PF能更接近终末期肾病接受腹膜透析患者的腹膜环境,近年来已成为研究PD所致纤维化的成熟造模方法[13]。在本研究中,造模大鼠的腹膜组织明显增厚、细胞排列紊乱,此外还观察到血管增生;α-LA腹腔高剂量注射干预后腹膜组织形态学表型改善,纤维化表达面积百分比小于α-LA灌胃组。Yung等[14]研究报道,高浓度的葡萄糖及其降解产物和晚期糖基化终末产物是EMT和PF的关键媒介;本研究结果显示4.25%PDS导致了大鼠PF,α-SMA及Collagen Ⅰ表达量增加,与王乙安等[15]研究结果一致,支持这一结论。在α-LA腹腔注射(高、中)剂量组干预后,腹膜组织α-SMA及Collagen Ⅰ表达降低,表明α-LA腹腔注射可能抑制了透析液诱导的PF过程。
TGF-β1是TGF-β蛋白超家族中的一员,主要由巨噬细胞、成纤维细胞和血小板产生,在体外可通过加热、低pH、蛋白水解或脱糖作用从TGF-β1-LAP复合物中活化和解离,因此,低pH水平的PDS可能有助于腹膜TGF-β1的活化[16]。Heo等[17]研究表明,间皮细胞是腹膜腔内产生TGF-β1的主要细胞,且在TGF-β1的刺激下发生巨噬细胞移植并促进PF。有关研究表明TGF-β1及其下游调控信号与心肌纤维化和其他多个脏器纤维化疾病相关[18-20]。Akhmetshina等[21]研究显示TGF-β1还可以通过激活Wnt信号介导纤维化。此外,抑制TGF-β1信号被证明可以抑制肺纤维化[22]。同样,在PF过程中,TGF-β1/Smads信号通路的激活是导致PF的主要机制之一[23]。TGF-β1与其受体结合后以磷酸化受体调节Smad2、Smad3,然后磷酸化的Smad2、Smad3复合物易位到细胞核中调节EMT相关基因的表达,下调E-钙粘着蛋白表达,上调波形蛋白和α-SMA的表达,致细胞外基质积累甚至PF,最终导致腹膜超滤衰竭[24-25]。本研究结果表明在PF大鼠模型中,TGF-β1/Smad3信号通路被激活,而高剂量α-LA腹腔注射可抑制腹膜组织TGF-β1/Smad3信号激活,抑制α-SMA及Collagen Ⅰ的表达,这与Xiong等[26]研究结果一致。此外,本研究结果显示α-LA腹腔注射较灌胃对大鼠PF和腹膜组织TGF-β1/Smad3信号抑制效果更好,这可能是由于腹腔注射药物通过腹膜吸收面积大,药物直接吸收入血并快速调动机体先天免疫系统进而抑制TGF-β1/Smad3激活,减轻PF,而灌胃给药影响药物吸收的因素较多,从而在一定程度上影响药效[27]。本研究中处理前各组大鼠体质量组间差异无统计学意义(P>0.05),而处理后C组较A、B、F组大鼠体质量低,可能是由于腹腔注射α-LA使大鼠食欲下降进而体重减轻所致[28-29]。
综上所述,腹腔注射α-LA可有效地减轻高糖透析液诱导的大鼠PF,并能减轻TGF-β1/Smads信号通路激活程度,具有预防或治疗PF的作用。

