全长朊粒蛋白淀粉样纤维引发细胞毒性的机制研究*
王利强 袁菡烨 陶 菁 郝苗苗 陈 杰 朱海丽 梁 毅**
(1)细胞稳态湖北省重点实验室,武汉大学生命科学学院,武汉大学泰康生命医学中心,武汉 430072;2)湖北科技学院基础医学院,咸宁 437100)
朊病毒病(prion disease),又被称为传染性海绵状脑病(TSEs),是一类由朊粒蛋白(PrP)在神经细胞中发生错误折叠、聚集成具有致病能力的PrPSc诱发的致死性神经退行性疾病。此疾病可在多种哺乳动物之间传播,病死率很高。人类患有朊病毒病的临床症状常常表现为运动功能障碍、痴呆和脑淀粉样病变等[1-4]。1997年诺贝尔生理或医学奖得主Stanley B. Prusiner 最先描述了朊病毒(prions),即蛋白质感染因子[1-2]。常见的朊病毒病包括在牛群中传播的疯牛病(bovine spongiform encephalopathy,BSE)、羊的瘙痒病(Scrapie)以及人类之间少量存在的克雅氏病(Creatzfeldt-Jakob disease,CJD)等[1-8]。该疾病的潜伏期很长,一般可达到数十年,发病周期很短,病人一旦发病,往往在一年内死亡。
尽管朊病毒病是一种罕见的神经退行性疾病,但由于它独有的生物学特征及其种间传播的性质,一直是近年来研究的热点[3,9]。朊病毒是一类可以自我复制、具有感染性的蛋白质聚集体,其可在大脑中积累沉淀,影响中枢神经系统的正常功能,其病变特征包括神经元丢失、脑中海绵状变形及神经胶质细胞病变等[10]。朊病毒病的发病机制主要是细胞型朊粒蛋白(PrPC)发生构象重排,形成具有致病能力的PrPSc,PrPSc可以与PrPC发生相互作用,紧密结合在一起,诱导PrPC发生构象转化,从而导致蛋白质错误折叠和聚集的级联反应,这些特征是朊病毒在宿主间传播的基础[1-2,4,11]。
近年来,随着冷冻电镜(cryo-EM)技术的发展,科学家们已逐步揭示了朊病毒的致病构象转化机制[12-13]。本实验室和中国科学院生物与化学交叉研究中心刘聪教授实验室合作,利用cryo-EM的方法解析了全长人野生型朊病毒淀粉样纤维及其家族遗传型朊病毒病病理突变体E196K 的淀粉样纤维结构[12-13],发现两种纤维都是由两根原纤维丝以左手螺旋的方式相互缠绕而成,野生型PrP纤维通过两对盐桥发生相互作用紧密结合在一起,PrP C端氨基酸170~229组成PrP纤维核心的6个β折叠结构[12],而E196K 两股原纤维通过4 对盐桥发生相互作用,形成一个长的既亲水又疏水的原纤维界面,纤维核心由其C端氨基酸175~217组成,包含5个β折叠结构[13]。
体外形成的淀粉样纤维和PrPSc具有相似特征,如主要具有β 折叠结构,并且具有蛋白酶K 抗性等[14-17]。用体外形成的淀粉样原纤维注入到过表达人PrP的转基因小鼠活体脑组织中,经过长时间的孵育后,小鼠出现具有朊病毒病特征的神经变性,表明其具有潜在的致病能力[18-20],但是,体外形成PrP淀粉样纤维致病的分子机制仍不是很清楚。因此,本文利用生物化学和细胞生物学方法在细胞和动物水平揭示了体外组装的PrP淀粉样纤维的细胞毒性和潜在的感染机制。
1 材料与方法
1.1 PrP纯化
编码全长人源PrP(23~231)的质粒是中国科学院武汉病毒研究所肖庚富博士赠送。利用载体pET-30a(+)表达PrP 23~231序列,将载体转化到大肠杆菌BL21(DE3)细胞(Novagen,Merck,Darmstadt,Germany)中进行培养,用终浓度为1 mmol/L 的IPTG 溶液诱导PrP 表达,收集菌体,用裂解缓冲液(10 mmol/L Tris-HCl,150 mmol/L NaCl, 2 mmol/L EDTA, 0.1% TritonX-100,pH 7.4)裂解菌体并进行超声破碎,将裂解液在17 000g条件下离心30 min,弃上清,收集包涵体沉淀,将包涵体用缓冲液1(10 mmol/L Tris-HCl,0.5% Triton X-100,pH 7.4)、缓冲液2(10 mmol/L Tris-HCl, 2 mol/L NaCl, pH 7.4)、 缓 冲 液3(10 mmol/L Tris-HCl,2 mol/L Urea,pH 7.4)依次洗涤,并使用包涵体溶解液(10 mmol/L Tris-HCl,100 mmol/L Na2HPO4·12H2O, 8 mol/L Urea,pH 7.4)溶解包涵体。使用Ni-Sepharose 纯化,获得纯度较高PrP 蛋白,将PrP 蛋白在蛋白质复性缓冲 液(100 mmol/L Tris-HCl,6 mol/L Urea,pH 8.0)中透析过夜,然后采用高效液相色谱C4 柱(Shimadzu,Kyoto,Japan)纯化,可获得高纯度PrP 蛋白[12,16,21]。将重组的PrP 在5 mmol/L Tris-HCl 缓冲液(pH 7.4)中透析,浓缩后于-80℃保存。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和质谱分析证实,纯化的人源PrP纯度较高,且具有完整的二硫键。使用NanoDrop One 微体积紫外可见分光光度计(Thermo Scientific,Waltham,MA)测其在280 nm处的吸光度,根据蛋白质组成计算的摩尔消光系数(2.535)(http://web.expasy.org/protparam/) 来计算获得人PrP的浓度。
1.2 PrP纤维种子的制备
将120 µmol/L全长重组人源PrP在含有2 mol/L盐酸胍(GdnHCl)和20 mmol/L Tris-HCl 缓冲液(pH 7.4) 中孵育,在37°C 下180 r/min 振荡9~11 h,收集PrP 原纤维。使用细胞破碎仪低功率条件超声使纤维片段化形成种子,超声5 s停5 s,超声5 min。然后将纤维在5 mmol/L NaAc 缓冲液(pH 5.0) 中透析去除盐酸胍。使用NanoDrop OneC微体积紫外可见分光光度计测量其在280 nm处的吸光度,然后根据PrP组成计算的摩尔消光系数(2.535)(http://web.expasy.org/protparam/)来测定PrP原纤维的浓度。
1.3 透射电镜观察PrP纤维形态
将10 µl的PrP纤维样品(~13 µmol/L)滴在铜网上,孵育30 s,用滤纸吸走,再用H2O洗涤10 s。然后用2%(w/v)醋酸铀酰染色30 s,在25°C的空气中干燥。负染样品使用JEM-1400 Plus 透射电子显微镜(JEOL,东京,日本)进行观察。
1.4 细胞培养和转染
HEK-293T 细 胞、 RK13 细 胞 和SH-SY5Y细胞使用Dulbecco's modified Eagle's medium(Gibco,Invitrogen,Mulgrave,VIC,Australia)培养基培养,在培养基中添加10%(v/v)胎牛血清(Gibco)、100 U/ml 链霉素和100 U/ml 青霉素。然后将细胞放入含5% CO2的37℃细胞培养箱培养。利用慢病毒载体表达系统(pHAGE-puro)构建稳定表达带FLAG标签的全长人PrP的HEK-293T细胞系和稳定表达全长人PrP 的SH-SY5Y 细胞系。将目标cDNA 片段插入慢病毒载体,将含有目标cDNA、pVSVG和p976的质粒用Lipofectamine®2000(Invitrogen,Carlsbad,CA)按2∶1∶1 的比例包装在HEK-293T 细胞中。脂质体与DNA 的比例为2∶1。转染48 h后,收获并过滤病毒,用包装好的慢病毒分别感染HEK-293T 和SH-SY5Y 细胞2 次,每次感染12 h,间隔12 h。为了建立稳定的细胞系,用嘌呤霉素筛选过表达细胞。蛋白质免疫印迹(Western blot)检测各蛋白质的表达情况。
1.5 MTT实验
将稳定表达带FLAG 标签的全长人PrP 的HEK-293T细胞接种在96孔板中。培养24 h后,将PrP 纤维种子(溶解于pH 5.0 的5 mmol/L NaAc 缓冲液中,母液浓度为100 µmol/L)以终浓度为0.01、0.1、1、10 µmol/L的浓度加入培养基中培养48 h。将MTT 原液(5 g/L)用PBS 稀释后加入孔中孵育4 h,直至细胞内形成甲酰胺。MTT终浓度为0.5 g/L。最后,用二甲亚砜溶解深蓝色甲醛晶体,然后使用Thermo Multiskan MK3 微孔板阅读器(Thermo Scientific,Waltham,MA)测量其在492 nm处的吸光度。细胞活力用含有PrP纤维处理过的样品吸光度除以5 mmol/L NaAc 缓冲液(pH 5.0)处理过的样品吸光度得到的百分比表示。其最终数据用5 次独立实验所得值的平均值±SD(标准差)表示。
1.6 Western blot检测细胞内PrP聚集
稳定表达带FLAG 标签的全长人PrP 的HEK-293T细胞培养1 d后,加入1~10 µmol/L PrP原纤维种子(溶解于pH 5.0 的5 mmol/L NaAc 缓冲液中,母液浓度为100 µmol/L)孵育2 d。收集HEK-293T细胞,在含有1% Triton X-100、50 mmol/L Tris、150 mmol/L NaCl、1 mmol/L 苯甲磺酰氟和蛋白酶抑制剂的裂解缓冲液(pH 7.6)中重悬细胞半小时。将细胞裂解液10 000g离心10 min。留出一半上清,另一半上清与1% 十二烷基肌氨酸钠(Sarkosyl)在37℃下孵育半小时。然后将混合物在150 000g下超离心半小时,并用PBS(pH 7.4)洗涤沉淀一次。将Sarkosyl 不溶性蛋白在SDSPAGE 上样缓冲液中煮沸15 min,另一半上清作为总蛋白质样品,也在SDS-PAGE上样缓冲液中煮沸15 min。样品用12.5% SDS-PAGE 分离,然后进行Western blot。用抗FLAG单克隆抗体对这些细胞的Sarkosyl 不溶性PrP 聚集体进行检测,并用抗FLAG和抗β-actin抗体对细胞裂解液进行检测。使用BCA 蛋白质定量试剂盒(Beyotime)将细胞裂解液进行定量。为了计算Sarkosyl 不溶性PrP 的数量,使用ImageJ 软件(NIH,Bethesda,MD)确定PrP 条带的密度,进而计算Sarkosyl 不溶性PrP聚集体占总蛋白质的比例。Sarkosyl不溶性实验由3次独立实验获得的平均值±SD表示。
1.7 Western blot检测小鼠前额叶组织中PrP聚集
选取7~14 d的新生小鼠,断颈处死,放入75%乙醇中浸泡消毒,迅速分离全脑。在预冷的培养基中分离前额叶,使用McIlwain 组织切片机将分离的前额叶进行横断切片,厚度固定为400 μm,将切好脑片置于Millicell-Cell Culture Inserts微孔膜上(0.4 μm,Millipore),放入6 孔板中,然后加入1 ml包含2% B27、98% Neurobasal-A Medium(Thermo scientific,Rockford,IL,USA)以及100 U/ml 青霉 素 和 100 mg/L链霉素 (Gibco (Thermo scientific),Rockford,IL,USA)的培养基,脑片不需要其他处理,2 d 后,更换新鲜培养基。向脑片上接种10 μl、1 μmol/L PrP 纤维种子(溶解于pH 5.0 的5 mmol/L NaAc 缓冲液中),继续培养5 d。取出脑切片,在含有1% Triton X-100、50 mmol/L Tris、150 mmol/L NaCl、1 mmol/L 苯甲磺酰氟和蛋白酶抑制剂的裂解缓冲液(pH 7.6)中重悬细胞半小时,使用超声进一步破碎细胞。10 000g的转速进行离心10 min 处理,将裂解液的上清小心用移液枪吸出保留,组织中不溶性沉淀遗弃。在上清中取出150 µl 用于测定内源PrP 表达量,剩余细胞裂解液加入终浓度为1% Sarkosyl,室温静置30 min,在4℃下10 000g的转速进行离心10 min,收集上清。将上清在4℃下150 000g条件下超速离心30 min,吸去上清,将沉淀用PBS重悬,在4℃下150 000g再次离心30 min。沉淀中含有PrP 聚集体,用60 µl SDS-PAGE 上样缓冲液重悬。在预留的细胞裂解液中加入5×SDS-PAGE 上样缓冲液,和重悬的沉淀一起煮沸10 min,用于后续实验。配置12.5%的SDS-PAGE变性胶,利用电泳分离蛋白质样品。使用抗8H4 抗体(Sigma-Aldrich)探测小鼠前额叶中Sarkosyl 不溶性PrP 蛋白。之后的转膜、封闭、孵育抗体等步骤和1.6相同。
1.8 原子力显微镜(AFM)观察PrP淀粉样纤维的形态
取10 µl 人野生型PrP 纤维样品滴入云母片表面上孵育2 min,然后用10 µl 纯净水冲洗3次以去除未结合的原纤维,并在室温下干燥。采用AFM(Bruker)的scanassist 模式在空气中对云母表面的原纤维进行探测。测量采用SCANASYST-AIR 探针。以1 Hz的扫描速率获得固定分辨率(256×256数 据 点) 的AFM 图 像, 并 使 用NanoScope Analysis 2.0软件(Bruker)进行分析。
1.9 线粒体超薄切片
选取没有内源PrP 表达的RK13 细胞研究PrP纤维对线粒体形态结构的影响,将构建的稳定表达外源PrP 的RK13 细胞平铺在6 孔板中培养1 d,然后加入0或10 µmol/L野生型PrP纤维种子(溶解于pH 5.0 的5 mmol/L NaAc 缓冲液中,母液浓度为100 µmol/L)共同培养3 d,用加入含有5 mmol/L NaAc 缓冲液(pH 5.0)的细胞作为阴性对照。在用含3%多聚甲醛和1.5%戊二醛的PBS(pH 7.4)溶液固定后,收获细胞,用1%锇酸冰浴固定1 h,然后将样品在分级丙酮中脱水,并包埋在812树脂中。使用Leica Ultracut S 显微镜制备细胞超薄切片,并用2%醋酸铀和柠檬酸铅进行阴性染色。使用JEM-1400 Plus透射电子显微镜(JEOL)观察细胞超薄切片中线粒体形状、线粒体嵴完整性以及是否存在空泡化等。所有实验均通过生物重复实验进一步证实。
1.10 细胞氧化压力实验
稳定表达全长人PrP的SH-SY5Y细胞在6孔板中培养1 d,然后加入终浓度为10 µmol/L PrP 纤维种子(溶解于pH 5.0 的5 mmol/L NaAc 缓冲液中,母液浓度为100 µmol/L)孵育2 d,利用活性氧(ROS)检测试剂盒(碧云天,南通,中国)检测细胞ROS水平。具体过程如下:用PBS洗涤细胞2次,将ROS 试剂盒中DCFH-DA 探针用培养基稀释,比例为1∶2 000,然后加入到细胞中,放于细胞培养箱中静置20 min。吸去含有ROS 探针的上清,在细胞中加入培养基,进行短暂孵育,用移液枪吸走,重复该步骤3 次。在细胞中加入胰酶消化,用灭菌的PBS将细胞进行重悬处理,使用低转速1 000g离心收集在离心管底部的细胞沉淀。在EPICS XL-MCL流式细胞仪(Beckman Coulter)上使用EXPO32 MultiComp 软件(Beckman Coulter)测定含有ROS 的细胞总数(~10 000)的百分比(ROS水平)。以用5 mmol/L NaAc缓冲液(pH 5.0)孵育的稳定表达全长人PrP 的SH-SY5Y 细胞为对照。ROS水平表示为3个独立实验所得值的平均值±SD。
1.11 流式细胞术检测细胞凋亡实验
稳定表达全长人PrP的SH-SY5Y细胞在6孔板中培养1 d,然后加入终浓度为10 µmol/L PrP 纤维种子(溶解于pH 5.0 的5 mmol/L NaAc 缓冲液中,母液浓度为100 µmol/L)孵育2 d。使用Annexin V-FITC 细胞凋亡检测试剂盒(Beyotime)染色后流式细胞术检测凋亡细胞。用2.5 g/L 胰蛋白酶(Promega,Madison,WI)消化后收获细胞,在4°C下用PBS洗涤,并用185 µl的结合缓冲液重悬。然后将样品与5 µl 的Annexin V-FITC 和10 µl 的PI 在4°C 的黑暗中孵育10 min。使用EPICS XL-MCL 流式细胞仪(Beckman Coulter,Fullerton,CA)分析Annexin V 的结合,收集~2×104个细胞,计算凋亡细胞的百分比。以用5 mmol/L NaAc 缓冲液(pH 5.0)孵育的稳定表达全长人PrP 的SH-SY5Y细胞为对照。凋亡细胞百分比用3次独立实验的平均值±SD表示。
1.12 数据分析
实验数据均以平均值±SD 表示,P值采用Student'st检验确定。P<0.05 为具有显著性差异。以下标准贯穿全文:*P<0.05,**P<0.01,***P<0.001。
2 实验结果
2.1 PrP纤维对内源PrP聚集的影响
将全长人野生型PrP 与含有2 mol/L 盐酸胍的20 mmol/L Tris-HCl 缓冲液(pH 7.4)中共同孵育,放入在37℃摇床中振荡9~11 h,获得平台期的PrP淀粉样纤维。利用透射电子显微镜观察发现PrP形成的淀粉样纤维无明显分叉和聚集现象,纤维长而直(图1a)。进一步利用AFM轻敲模式检测了人野生型PrP淀粉样纤维的结构,从图中可以明显看出PrP 形成了均一性和分散性较好的纤维样聚集体(图2)。图2b 是2a 中方框区域局部放大图像,从中可以看到大部分纤维都是以左手螺旋的方式缠绕生长,纤维长而直,并未有分叉现象,这种特征和利用透射电子显微镜观察的结果相吻合。
为了研究PrP淀粉样纤维的致病机制,本文构建了稳定表达含有FLAG 标签的PrP HEK-293T 细胞系,通过MTT 实验检测了外源加入PrP 纤维对稳定表达PrP 的HEK-293T 细胞活力的影响。加入0.01~10 µmol/L PrP 纤维处理后的细胞活性与对照细胞的活性比值依次为94.54%、93.87%、89.32%和66.02%(图1b)。通过显著性定量分析发现,在0.1 μmol/L 和1 μmol/L PrP 纤维处理条件下,细胞活性与对照组相比降低约10%,而10 μmol/L PrP纤维处理使得细胞活力降低约30%,表明PrP纤维可以降低细胞活力,且其影响具有浓度依赖效应,即浓度越高引起的细胞毒性越强(图1b)。接着,用变性剂Sarkosyl溶解细胞中的PrP单体和寡聚体,通过超速离心分离细胞中Sarkosyl 不溶性聚集体,进一步使用Western blot定量检测了各PrP纤维处理条件下细胞中聚集体的含量,发现在HEK-293T细胞中,1 μmol/L PrP 纤维处理条件下PrP 聚集体相对含量和不加PrP纤维条件相比没有明显差异,而10 μmol/L PrP纤维处理则使得细胞内PrP聚集体显著增多(图1c)。通过显著性分析发现,10 μmol/L PrP 纤维处理条件下形成的PrP 聚集体相对含量为对照组的2.7倍(图1e)。这些实验表明,PrP纤维具有和PrPSc类似的性质,引起细胞毒性,同时诱导内源PrP发生错误折叠,形成聚集体。
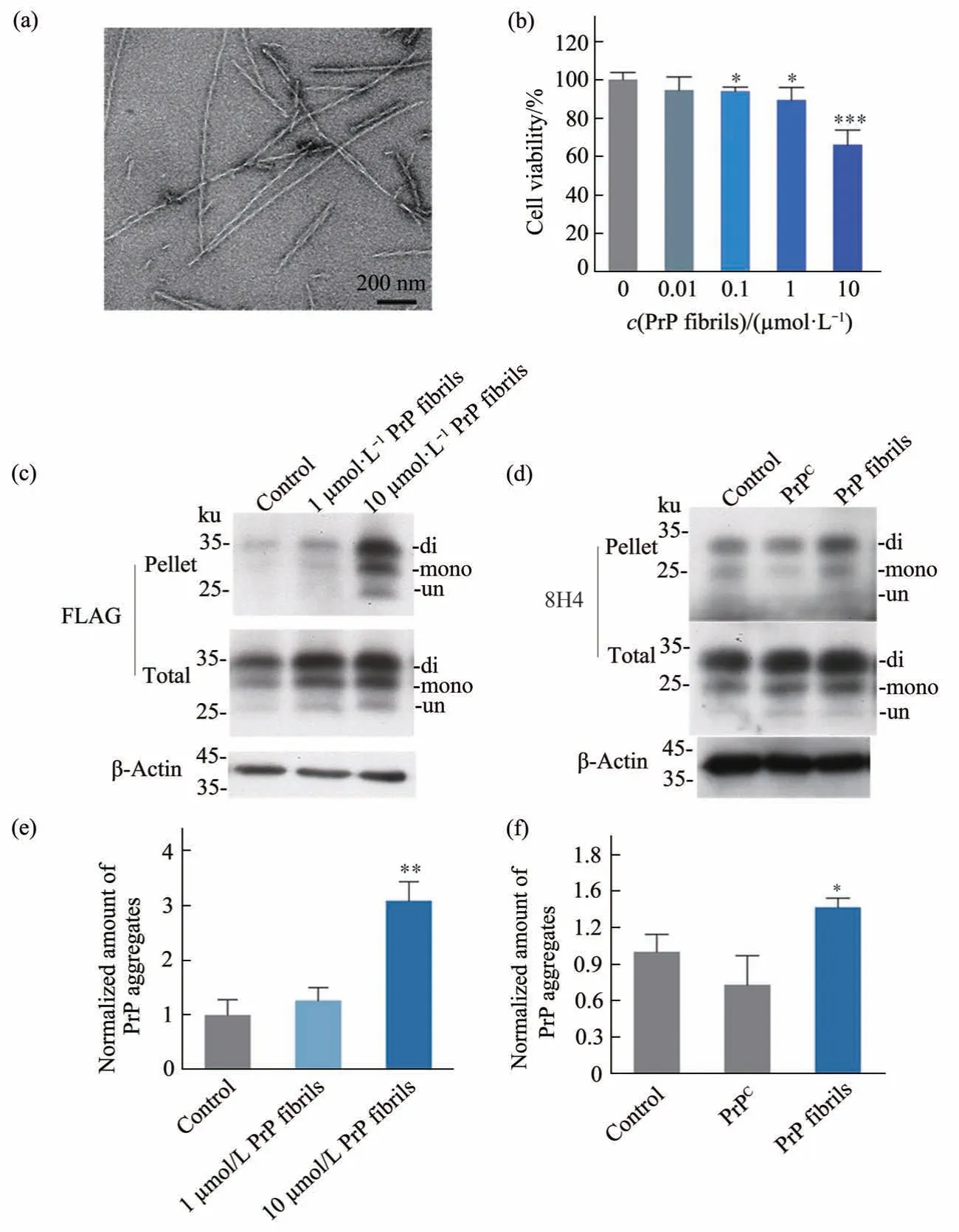
Fig. 1 PrP fibrils are cytotoxic,and transmissible to induce the misfolding of endogenous PrPC in cells and in the frontal cortices of infant mice

Fig. 2 High-resolution AFM images of PrP fibrils
2.2 PrP纤维对小鼠前额叶内源PrP聚集的影响
在细胞水平,实验表明PrP纤维具有和PrPSc类似的性质,可以诱导细胞内PrP发生错误折叠,形成聚集体,那么在更复杂的脑组织中PrP纤维是否会诱导内源PrP 聚集?研究发现,使用variant CJD病人的PrPSc感染小鼠过程中,PrPSc在小鼠前额叶皮层中会有大量积聚[22],因此本文选择分离新生小鼠前额叶皮层进行研究。
使用去垢剂Sarkosyl 溶解前额叶中的PrP 单体和寡聚体,通过超速离心分离细胞中Sarkosyl不溶性聚集体,进一步使用Western blot 定量检测前额叶细胞中PrP 聚集体的含量。发现在前额叶皮层中,1 μmol/L PrPC处理条件下PrP 聚集体相对含量与对照组相比无明显差异,而1 μmol/L PrP纤维处理则使得前额叶皮层中PrP 聚集体显著增多(图1d),通过显著性分析发现,1 μmol/L PrP纤维处理条件下形成的PrP聚集体相对含量为对照组的1.4倍(图1f,P=0.018),这表明PrP纤维可以诱导小鼠前额叶皮层中内源PrP的聚集。
2.3 PrP纤维对细胞内氧化压力和细胞凋亡的影响
研究表明,蛋白质在细胞中发生错误折叠、聚集会引起线粒体中氧化压力的升高,进而影响细胞功能使其紊乱,引起神经元死亡[23-25]。那么外源加入PrP纤维是否会引起细胞内氧化压力升高呢?本文利用DCFH-DA 活性氧检测试剂盒检测了PrP 纤维对细胞内氧化压力水平的影响,DCFH-DA 是一种ROS探针,在细胞内被分解为DCFH,进而可以与细胞中的活性氧反应产生具有荧光的DCF。
选用稳定表达外源人PrP 的SH-SY5Y 细胞进行氧化压力测定,SH-SY5Y细胞是神经母瘤细胞,其神经细胞的特征使实验结果更可信。在细胞中加入终浓度为10 μmol/L PrP 纤维处理细胞48 h(图3b),对照组加入等体积的5 mmol/L NaAc(pH 5.0)(图3a),利用流式细胞技术检测细胞内氧化压力。发现PrP纤维处理的实验组和5 mmol/L NaAc(pH 5.0)处理的对照组相比,细胞内氧化压力值从2.12%(图3a)上升至64.46%(图3b),细胞内氧化压力显著升高(P=0.000 41)(图3c)。这些结果表明,PrP纤维可能是通过诱导细胞内源PrP发生聚集,进一步诱导引起的细胞内氧化压力升高。
本文的实验结果证实,PrP 纤维可以诱导细胞内较高氧化压力水平,过高的ROS 对细胞造成的损伤可能会通过诱导细胞凋亡水平来反映,因此,进一步检测了PrP 纤维对稳定表达外源人PrP 的SH-SY5Y 细胞凋亡水平的影响。在SH-SY5Y 稳转细胞中加入终浓度为10 µmol/L PrP 纤维处理48 h后,细胞早期凋亡、晚期凋亡和总凋亡水平依次为2.96%、 10.00% 和12.96% (图3e), 相 较 于5 mmol/L NaAc(pH 5.0)处理的对照组细胞(分别为3.20%、2.34%和5.54%)(图3d),其晚期凋亡水平显著升高(P=0.000 13)(图3f)。
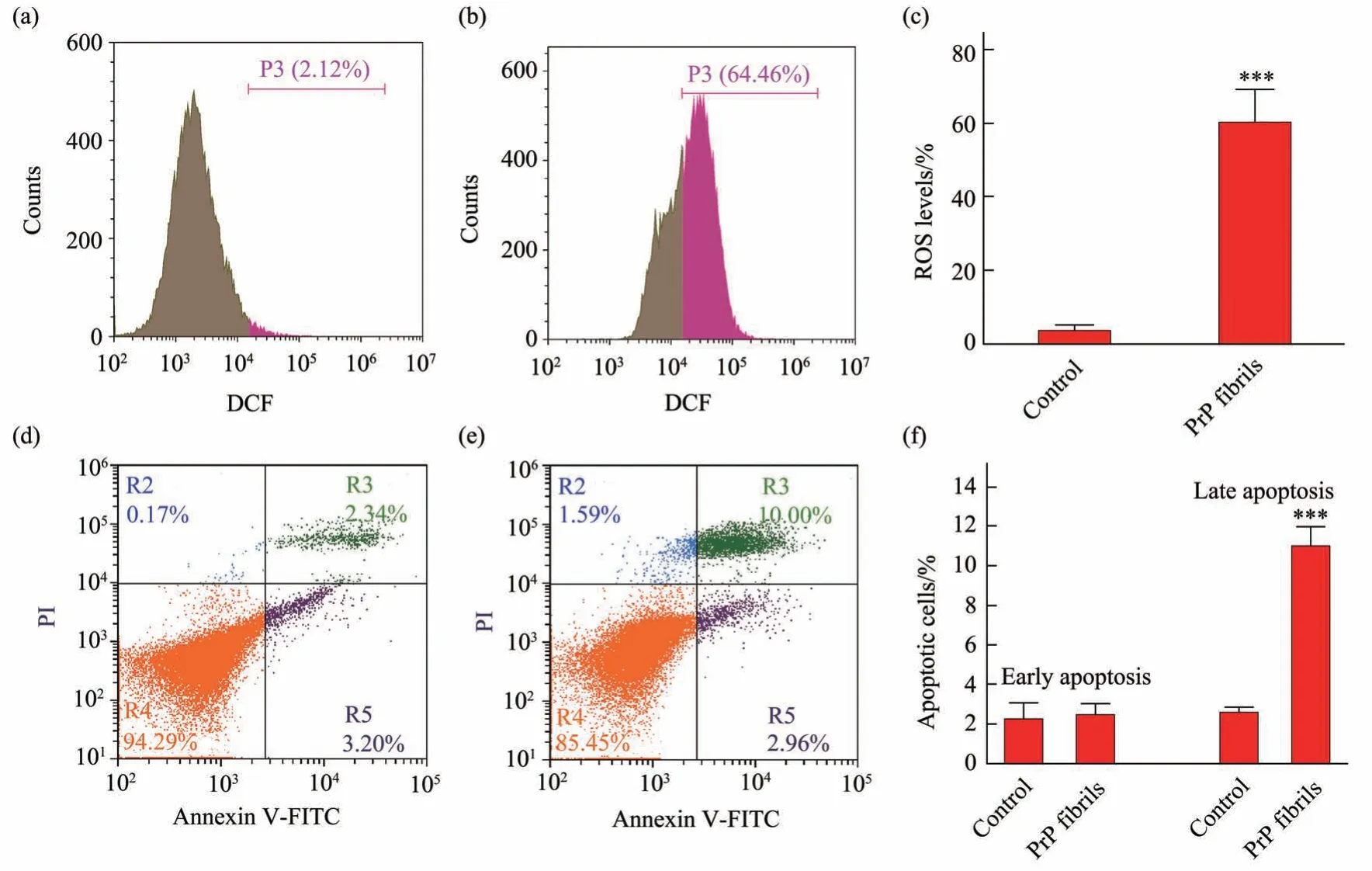
Fig. 3 PrP fibrils induce severe ROS production(P=0.000 41)and late apoptosis(P=0.000 13)in cells stably expressing PrPC
2.4 PrP纤维对线粒体损伤的影响
蛋白质在细胞中的异常聚集会引起细胞中氧化压力应激反应,导致大量的氧自由基产生,会造成细胞中线粒体的损伤诱发一系列疾病的发生[26]。已经发现PrP 纤维可以诱导细胞内PrP 发生错误折叠形成聚集体,同时诱导氧化压力增强,那么其对线粒体形态结构是否会有影响?使用超薄切片技术结合透射电子显微镜观察检测了PrP纤维引起的线粒体损伤。实验结果表明,对照组人野生型PrP稳转RK13细胞中(图4a,b),大部分线粒体呈现管状或球形,线粒体嵴较完整(白色箭头标注)。而当用10 μmol/L PrP 纤维处理细胞后(图4c,d),线粒体损伤水平较对照组明显增多(图4e),形成多种形态,线粒体内的嵴发生断裂,且排列错乱,逐步出现空泡化现象(黄色箭头标注)(图4c,d)。

Fig. 4 PrP fibrils induce severe mitochondrial damage in cells stably expressing PrPC
3 讨 论
蛋白质错误折叠引起的神经退行性疾病一直是近几十年的研究热点,但是对于体内相关样本的采集和研究一直存在着各种各样的制约因素,对于朊病毒病,由于PrPSc高度传染性,使得研究其致病机制和解析其三维结构的危险系数大大增加,因此在体外模拟PrP 的聚集过程,研究PrP 纤维的致病机制是十分有必要的。诺贝尔奖得主Prusiner教授课题组进行了一系列研究,发现在过表达PrP的转基因小鼠脑组织中接种PrP纤维,在经过长时间的孵育后,转基因小鼠会表现出朊病毒病相关的神经退行性症状[18-20]。不同之处为病理条件下的PrPSc比体外形成PrP 纤维具有更强的致病性[3-4]。在前期的研究中,利用Cryo-EM 的方法,本课题组解析了高分辨率PrP纤维的三维结构,揭示了PrPC发生错误折叠聚集形成PrP纤维过程中其构象的转化分子机制,在这个过程中PrPCC 端的α2 和α3 发生构象重新折叠,形成6个β 折叠结构,分子内的二硫键(Cys179 和Cys214 之间)可以稳定PrP 纤维结构形态[12]。那么体外组装形成的PrP纤维是否可以诱导内源PrP聚集?是否具有细胞毒性?这些问题都值得探索。因此,本文进一步深入到细胞水平和动物水平研究PrP 纤维对细胞内源PrP 积聚的影响,揭示PrP纤维诱导内源PrP积聚和毒性的机制。
首先,利用超速离心结合Western blot 实验研究PrP 纤维对内源PrP 聚集能力的影响,朊病毒假说认为,PrPSc可以作为模板诱导细胞型PrPC发生错误折叠,形成PrPSc[1-2,4,11]。实验选用稳定表达含Flag标签的人野生型PrP HEK-293T细胞进行研究,发现10 μmol/L PrP纤维处理都使得细胞内PrP聚集体显著增多,PrP 聚集体相对含量为对照组的3 倍左右,表明PrP纤维具有和PrPSc类似的性质,可以诱导内源PrP发生错误折叠,形成聚集体。
其次,利用MTT、流式细胞技术和细胞超薄切片等方法研究了PrP 纤维诱导的细胞内氧化压力、细胞凋亡水平和线粒体损伤的影响。选用了RK13 细胞、SH-SY5Y 细胞和HEK-293T 细胞进行PrP 纤维引起的细胞毒性方面的研究发现,PrP 纤维可以诱导SH-SY5Y 稳转细胞中氧化压力升高;通过流式细胞检测技术检测凋亡实验发现,PrP纤维可以诱导细胞发生晚期凋亡;通过细胞超薄切片结合透射电子显微镜观察发现,PrP纤维可以引起细胞中线粒体形态结构的异常,空泡化严重,这可能会进一步导致细胞功能体系异常,引起代谢功能紊乱。这些实验结果表明,PrP纤维可以通过诱导内源PrP的聚集,引起细胞内氧化压力的升高和线粒体损伤,同时PrP纤维还可以诱发细胞凋亡的产生。但是,对于PrP纤维诱导细胞氧压升高和凋亡的机制仍不清楚。
最后,在动物水平研究了PrP纤维对前额叶皮层内源PrP聚集的影响。朊病毒病的病理特征为脑组织出现海绵样病变,其主要发病部位会随着疾病的不同而发生改变,如对于CJD、格斯特曼氏综合征(Gerstmann-Sträussler-Scheinker,GSS)病和人的库鲁病(Kuru),PrPSc主要位于海马和大脑皮层,相比之下,致死性家族性失眠(fatal familial insomnia,FFI)中PrPSc主要集中在丘脑[3]。研究人员用人源的Kuru和vCJD疾病的PrPSc去感染稳定表达人野生型PrP 的小鼠,发现PrPSc在前额叶皮层、海马组织的丘脑中有大量沉积[22]。因此,本实验选择分离新生小鼠前额叶作为研究对象,因为新生小鼠的神经元尚未完全分化,较敏感,相对容易被感染。将新生小鼠前额叶皮层进行横断切片,接种PrP 纤维进行培养,通过超速离心结合Western blot实验发现,PrP纤维可以诱导新生小鼠前额叶中内源PrP 的聚集,具有类似于PrPSc的性质。
研究表明,PrPC主要定位于细胞膜上,细胞膜上的PrPC可以通过其N 端的柔性区域KKRPKP 与低密度脂蛋白受体相关蛋白1 (low-density lipoprotein receptor-related protein 1,LPR1)发生相互作用,通过内吞途径进入胞质[27-28]。体外重组的PrP 纤维和PrPSc的N 端柔性区域KKRPKP 具有和PrPC相似的特征,都可以通过其N端的柔性序列KKRPKP与LPR1发生相互作用,诱导细胞发生内吞,进入细胞质[12-13,29-32]。本文中,体外组装的人源PrP纤维结构表明,其N端的KKRPKP处于无序结构游离在纤维表面[12],因此接种在脑片上的PrP 纤维和接种于细胞中的PrP 纤维种子都可以通过内吞作用进入细胞内,进而诱导内源PrP发生聚集,引起细胞毒性。
本文的研究结果从细胞和动物两个层面证明了PrP 纤维可以诱导内源PrP 的聚集。根据这些实验结果,本文提出了一种PrP 纤维致病机制的模型:PrP 纤维通过与细胞内源PrP 相互作用,诱发细胞内PrP 发生错误折叠,形成聚集体,PrP 纤维聚集体可以诱导细胞内氧化压力升高和细胞凋亡,同时引起线粒体损伤,这会进一步诱发细胞代谢功能紊乱,引发一系列朊病毒病相关临床症状(图5)。

Fig. 5 PrP fibrils prepared in vitro exhibit cytotoxicity to mammalian cells and are transmissible to induce the misfolding of endogenous PrPC
4 结 论
本文在细胞和动物水平证实体外组装的PrP淀粉样纤维具有细胞毒性和潜在的感染性。这些淀粉样纤维不仅可以在细胞水平诱导PrP发生错误折叠,还可以诱导新生小鼠前额叶内源PrP发生错误折叠。

