卡瑞利珠单抗联合仑伐替尼治疗不可切除肝细胞癌的疗效和安全性
钱厚龙 李阳 朱翔 路逵
我国肝细胞癌(HCC)的发病率在各种恶性肿瘤中占第4位,大多继发于慢性乙型肝炎和肝炎后肝硬化[1-2]。肝切除是HCC首选的根治方法,可使患者获得长期生存[3]。大多数HCC确诊时已处于疾病的中晚期,靶病灶肿瘤体积相对较大,剩余肝体积不足,加上不同程度的肝硬化,无法进行大范围肝切除术,经典化疗方案、单独或联合应用经肝动脉化疗栓塞术(TACE)、射频消融和放疗等方法的效果也不尽如人意[4]。近年来,晚期HCC的分子靶向治疗和免疫治疗等全身系统治疗得到快速发展[5]。仑伐替尼是一种新型的多激酶抑制剂,能抑制多种细胞因子生成,是晚期HCC的一线分子靶向药[6];卡瑞利珠单抗作为新一代程序性死亡受体-1(PD-1)抑制剂,能抑制T细胞和多种细胞因子水平,调节免疫功能[7]。仑伐替尼联合PD-1对HCC具有显著的抗肿瘤活性,能提高晚期HCC的肝切除转化率[8]。本研究探讨仑伐替尼联合卡瑞利珠单抗对不可切除HCC的临床疗效和可行性。
资料与方法
一、一般资料
选择2020年1月至2021年12月泰州市第二人民医院肿瘤科收治的不可切除HCC患者33例,经过筛选后将26例作为研究对象。使用计算机SAS统计软件进行随机数字表示法,并征得根患者的知情同意,分为观察组(n=15)与对照组(n=11)。观察组中男性11例,女性4例;年龄46~70岁;体质量41~75 kg;病程2~10个月;BCLC分期为B期3例,C期12例;Child-Pugh分级为A级11例,B级4例;ECOG评分0~2分;合并HBV感染4例,合并血管侵犯5例。对照组中男性8例,女性3例;年龄47~68岁;体质量42~77 kg;病程2~10个月;BCLC分期为B期2例,C期9例;Child-Pugh分级为A级8例,B级3例;ECOG评分0~2分;合并HBV感染3例,合并血管侵犯4例。两组一般资料比较,差异均无统计学意义(P>0.05)。该研究经医院伦理委员会审批(海人医学伦理号:20190218)。
二、病例选择
经穿刺活检或手术病理检查,符合《原发性肝癌诊疗规范(2019年版)》中的诊断标准[9]。纳入标准:年龄18~70岁,巴塞罗那临床肝癌分期(BCLC)为B期或C期,肝功能Child-Pugh分级为A级和B级,美国东部肿瘤协作组行为能力评分(ECOG)为0~2分,预计生存期≥3个月;重要脏器和骨髓功能良好,具有相应的经济负担能力。排除标准:其他类型的肝癌,既往患恶性肿瘤和器官移植史;肝功能衰竭期,肝性脑病;血液性、免疫性疾病,凝血功能障碍,不可控制的心脑血管疾病,药物过敏和使用禁忌证。剔除标准:资料不完整,中途退出研究,生存期<3个月。
三、研究方法
(一)治疗方法 一般处理:所有患者给予高蛋白饮食、生活干预和健康干预;改善肝肾功能和凝血功能,加强营养供给,积极防治药物不良反应和各种并发症。对照组给予甲磺酸仑伐替尼胶囊(卫材中国药业公司,进口注册证号:H20180052)治疗,每次8 mg,每天同一时间段口服1次。观察组在对照组的基础上加用卡瑞利珠单抗(苏州盛迪亚生物医药公司,国药准字号:S20190027)治疗,从治疗周期的第1天开始,将200 mg卡瑞利珠单抗复溶稀释后经外周中心静脉导管缓慢静脉滴注,每2周给药1次。疗程为4个周期,或者达到转化成功标准行肝切除术。
(二)随访 采用门诊复查、上门家访、电话或微信等多种形式进行随访,了解患者的服药、临床症状、生活质量和肿瘤进展情况。每2周进行1次实验室检查,包括血常规、尿常规、粪常规、肝功能、肾功能、血糖、甲状腺功能、心肌酶谱、电解质、肿瘤标志物、皮质醇和促肾上腺素皮质激素水平等;治疗开始后每2个月进行1次全腹部MRI和(或)CT以及胸部CT检查,观察靶病灶肿瘤生长变化情况和评估临床疗效。随访截止时间为2021年12月31日。
四、观察指标
①肿瘤标志物:分别于治疗前、治疗后1个月和3个月时,采集静脉血样,采用化学发光法测定血清甲胎蛋白(AFP)和异常凝血酶原(PIVKA-Ⅱ)水平。②临床疗效指标:根据实体瘤疗效评价标准(RE-CIS)1.1版进行评价[10],分为完全缓解(CR,靶病灶或增强病灶消失)、部分缓解(PR,病灶减少70%)、疾病进展(PD,病灶直径增加20%)、病情稳定(SD,介于PR和PD之间)。客观缓解率(ORR)=(CR+PR)/总例数×100%;局部控制率(DCR)=(CR+PR+SD)/总例数×100%。观察中位应答时间(mRT)、中位缓解持续时间(mDR)和转化切除率。肝切除指标为合并肝硬化患者剩余肝体积≥40%,非肝硬化患者≥30%,可实现R0切除[11]。③随访生存指标:中位随访时间(mFUP)、中位总体生存期(mOS)、中位无进展生存期(mPFS)、截至末次随访的靶病灶长径缩小程度和病死率。④主要药物不良反应:根据美国国立癌症研究院通用毒性反应5.0标准(NCI-CTC5.0)[12],评价和记录3~5级等主要药物不良反应发生情况。
五、统计学方法

结 果
一、肿瘤标志物水平变化的比较
治疗前两组的AFP 和PIVKA-Ⅱ水平差异无统计学意义(P>0.05)。治疗1个月和3个月时,两组的肿瘤标志物水平均较前下降,观察组下降的幅度高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组肿瘤标志物水平变化的比较(±s)
二、临床疗效指标的比较
观察组的OOR、DCR和转化切除例数高于对照组,mRT短于对照组,mDR长于对照组,差异有统计学意义(P<0.05)。见表2。
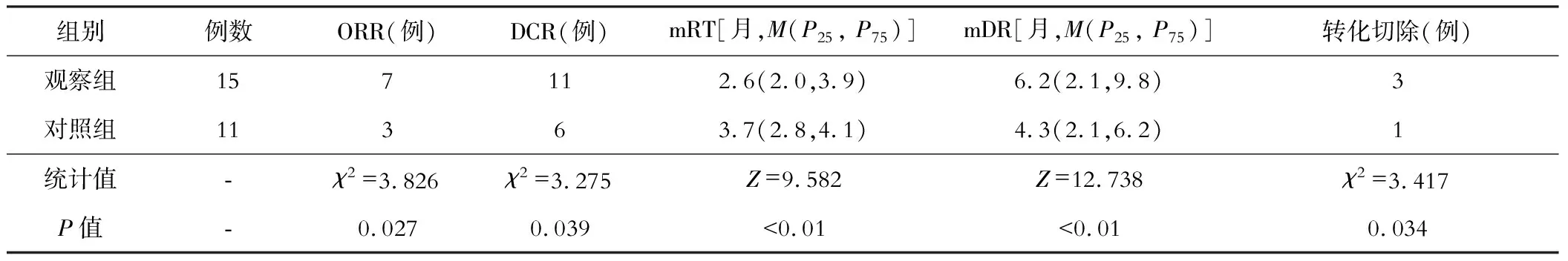
表2 两组临床疗效指标的比较
三、随访生存指标的比较
观察组的mFUP、mOS、mPFS和靶病灶长径缩小程度高于对照组,病死例数少于对照组,差异有统计学意义(P<0.05)。见表3。
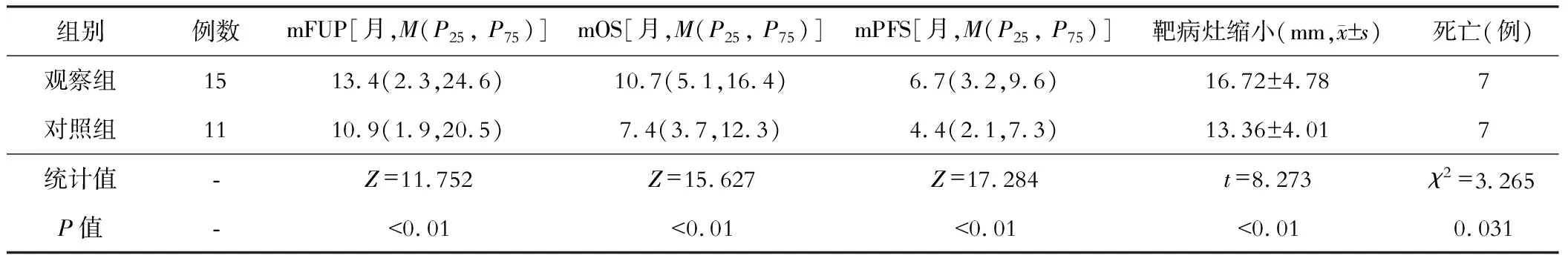
表3 两组随访生存指标的比较
四、主要药物不良反应的比较
两组均未出现5级药物不良反应。观察组3~4级不良反应6例,其中肝功能损伤1例,高血压1例,甲状腺功能减退1例,消化道出血1例,白细胞减少1例,贫血1例;对照组3~4级不良反应3例,其中肝功能损伤1例,高血压1例,肾功能损伤1例,差异无统计学意义(χ2=0.427,P=0.385)。
讨 论
HCC的发生是一个多基因参与和多途径调控的复杂生理病理过程,基因调控和免疫抑制在疾病的发生和发展过程中具有重要的作用[13]。随着医药生物科技的快速发展,对恶性肿瘤的药物治疗方法不断提高更新[14]。以索拉非尼和仑伐替尼为代表的分子靶向药,以及信迪利单抗、替雷利珠单抗和卡瑞利珠单抗为代表的PD-1抑制剂的免疫治疗,为中晚期HCC患者带来较高的生存获益[5]。
AFP是目前诊断HCC最早和应用最广泛的肿瘤标志物[15];PIVKA-Ⅱ是肝脏癌变和凝血酶原前体的羧基化异常时合成的无活性异常凝血酶原,与肿瘤的血管侵袭和肝内外转移密切相关;AFP联合PIVKA-Ⅱ检测可作为HCC诊断、病情进展和疗效评估,以及预测肿瘤复发的标志物[16]。仑伐替尼的靶目标为血管内皮和成纤维生长因子,可以抑制血管侵犯和肝外转移,是晚期HCC的一线分子靶向药[17];卡瑞利珠单抗能抑制T细胞受体信号的传导,减弱T细胞存活和增殖,抑制多种细胞因子的产生,促进肿瘤消退和延长生存期[18]。本研究显示,观察组治疗1个月和3个月时的AFP和PIVKA-Ⅱ均显著低于对照组,有效降低了HCC患者的肿瘤标志物水平。徐彬等[11]对6例不可切除HCC患者在行门静脉栓塞术的基础上加用仑伐替尼联合PD-1治疗,使大多患者明显获益,与本研究结果一致。
本研究显示,观察组的ORR、DCR和转化切除率高于对照组,mRT短于对照组,mDR时间高于对照组,提示对于不可切除的HCC患者分别采用卡瑞利珠单抗联合仑伐替尼治疗,抗肿瘤活性作用更明显,能提高临床治疗效果。实验表明,仑伐替尼可增加肿瘤细胞中的T淋巴细胞数量,降低巨噬细胞和单核细胞数量,发挥良好的免疫调节作用,联合PD-1抑制剂可显著提高疗效,能将DCR提高到85%[19]。2020年ASCO研讨会报道,纳武利尤单抗联合仑伐替尼治疗晚期肝癌患者的ORR和中位应答时间分别为76.7%和1.87个月[20]。徐彬等[21]对不可切除或进展期HCC患者采用卡瑞利珠单抗等PD-1联合仑伐替尼治疗,提高了转化切除率,改善了疾病预后。
本研究中观察组的mFUP、mOS、mPFS和靶病灶长径缩小程度高于对照组,病死率低于对照组,提示联合用药能有效延长生存期,改善疾病预后。2019年ESMO会议报道,采用帕博丽珠单抗联合仑伐替尼一线治疗不可切除的晚期肝癌患者,ORR、mOS和mPFS分别为46%、22个月和9.3个月[22]。陈孝强[12]对中晚期原发性肝癌患者分别采用PD-1抑制剂联合仑伐替尼一线治疗以及单用索拉非尼治疗,mOS和mPFS显著提高。徐彬等[21]采用卡瑞利珠单抗等PD-1联合仑伐替尼一线治疗不可切除或进展期HCC的基线靶病灶肿瘤长径比率明显提高,随访期间病死率为46.5%,均与本研究结果相近。
有研究报道,仑伐替尼的不良反应相对较轻,主要有高血压和食欲减退、腹泻等胃肠道症状;卡瑞丽珠单抗的不良反应多为1~2级,3~4级较少,一般无需停药或更改治疗方案[23-24]。两种药物联合应用,在抗多种细胞生长因子的同时降低肿瘤微环境中的免疫抑制,发挥协同增效作用,降低药物使用剂量和周期,同时可减少药物不良反应[25]。本研究显示,两组均未发生5级不良反应,3~4级不良反应无差异,提示联合用药具有较高的安全性,与陈孝强[12]和王东旭[26]研究结果一致。
综上所述,对不可切除的HCC患者采用卡瑞丽珠单抗联合仑伐替尼治疗,能明显提高治疗效果,延长生存时间,改善预后,使患者获益,而且不良反应相对可控,安全性较高。但本研究为回顾性研究,样本量较少,未能多中心分组,尚需在以后的临床工作中进一步扩大样本量,严格细化分组,进行多中心研究,以期获得更为科学的研究结果。
利益冲突声明:所有作者均声明不存在利益冲突。