陆基推水集装箱循环水养殖系统中浮游植物群落结构特征
赵秀侠,方婷,陈金良,高娜,陈诚,卢文轩*
(1.安徽省农业科学院水产研究所,合肥 230001;2.水产增养殖安徽省重点实验室,合肥 230001;3.安徽有机良庄农业科技股份有限公司,安徽 太和 236629)
传统的水产养殖业存在环境污染、资源浪费与设施落后等问题,已不符合现代渔业绿色发展需求。陆基推水集装箱循环水养殖模式因具有节水节地、集约化生产便利等优势而引起关注[1]。陆基推水集装箱养殖系统一般包括养殖集装箱体与3 个进阶式净化处理塘,集装箱养殖尾水经过滤、沉淀、增氧、净化、除菌等处理流程后,重新进入箱体用于水产养殖或水生蔬菜培育等,从而实现养殖尾水循环利用。与传统池塘养殖相比,集装箱养殖模式具有节约用水95%,节省用地75%以上,养殖过程实现自动化控制和精细化管理,不改变土地属性,抗灾性强,养殖密度高等优势[2-3]。集装箱养殖技术的发展避免了传统池塘养殖业存在的一系列缺陷[4],促进了我国水产养殖业的绿色智能发展与渔业转型升级。
目前关于陆基集装箱养殖研究多集中在水产品的质量研究,如集装箱养殖模式下大西洋鳕鱼(Gadus morhua)、乌鳢(Channa argus)、草鱼(Ctenopharyngodon idella)、马口鱼(Opsariichthys bidens)等在肌肉营养价值、组织结构、营养物质利用效率、经济效益方面优于传统池塘养殖模式与溪流养殖模式[5-8];集装箱养殖大口黑鲈(Micropterus salmoides)时,投喂策略与水温等因素会影响饲料利用率和尾水净化效果等[3]。关于集装箱养殖尾水净化及对河流水质影响等方面的研究,如鲑鱼(Salmon)集装箱养殖尾水改变了河流中溶解态有机质(DOM)的浓度与细菌降解水平[9]。有研究基于AQUATOX 构建的串联型尾水净化塘,模拟了培植沉水植物和添加低密度滤食性鱼类的生物处理方法,为集装箱式循环水养殖模式的喂养结构调整与水生态系统组分调控等提供了借鉴[10]。有研究采用Ulva 方法筛选目标物种与菌株等进行集装箱养殖尾水中浮游植物生物修复等[11-12]。但目前关于集装箱养殖系统养殖尾水净化处理工艺中水质、浮游植物群落结构等系统性研究鲜见报道。鉴于此,本文通过对集装箱养殖水体与净化塘中水质状况、浮游植物群落结构特征进行调查分析,并运用冗余分析探讨浮游植物群落组成与环境因子的关系,为集装箱循环水养殖模式的水质调控及系统维护运行提供科学依据。
1 材料与方法
1.1 养殖尾水处理系统与处理流程
试验于2021 年10 月29 日在阜阳市太和县双浮镇安徽有机良庄农业科技股份有限公司陆基集装箱循环水养殖基地进行,养殖集装箱底部呈10°斜面(宜于集污),箱体规格均为6.1 m(长)×2.4 m(宽)×2.9 m(高),有效养殖水体每箱约为25 m3。
陆基集装箱循环养殖系统(图1)由集装箱养殖区、微滤机、沉淀池、明渠、三级尾水净化塘与水泵组成。养殖尾水采用异位处理方法,尾水处理流程为:集装箱底部排出的养殖尾水经PVC(聚氯乙烯)暗管进入沉淀池沉淀预处理,上层水经过微滤机固液分离,以去除90%以上大于0.125 mm 的颗粒固体废弃物,尾水进入一级沉淀池,然后通过二级塘(设有生态浮床)净化,经过滤坝流入三级塘,三级塘水用于养殖、灌溉等用途,完成养殖水体循环利用。
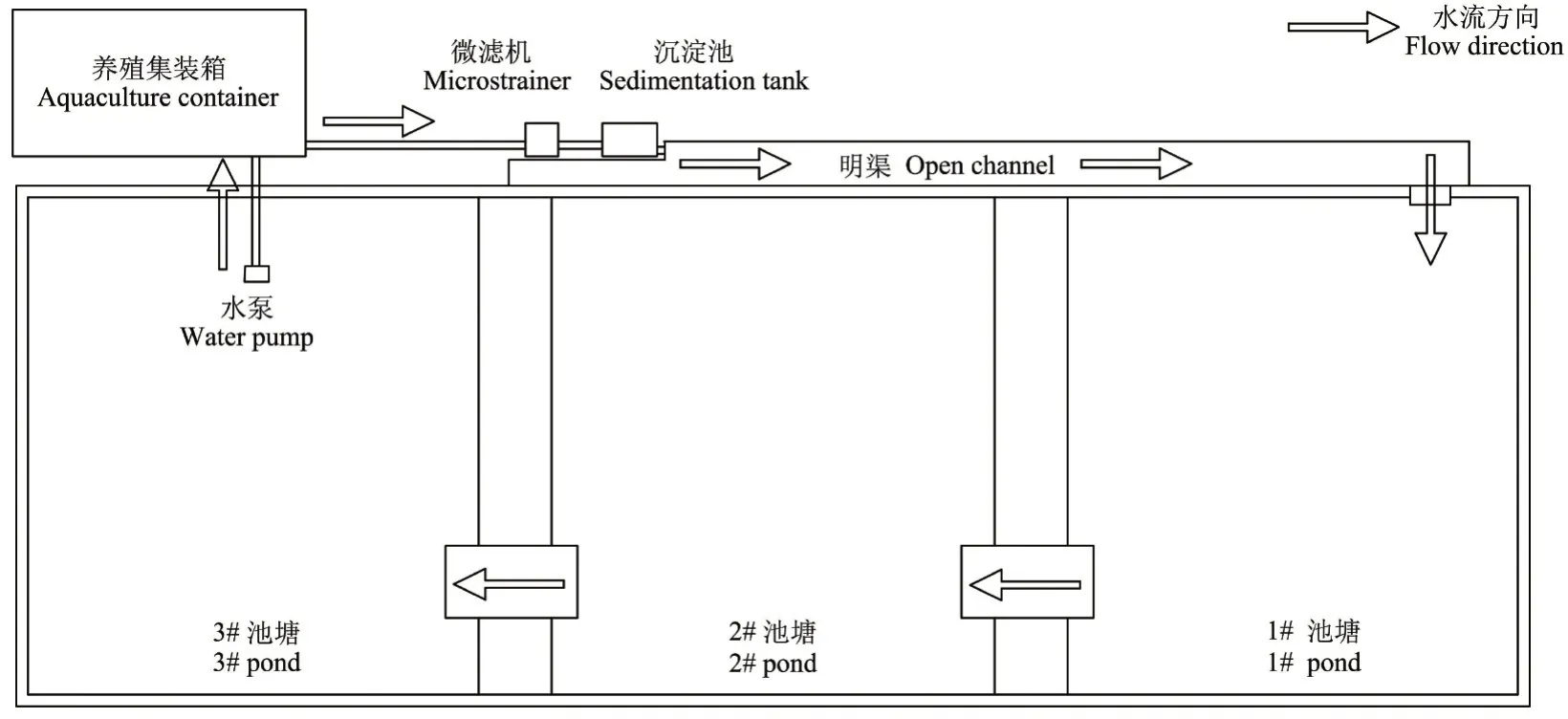
图1 陆基推水集装箱养殖系统结构示意图Figure 1 The structure diagram of land-based container with recycling water system
集装箱养殖种类为中华鲟(Acipenser sinensis),投放规格为750 g·尾-1,放养数量为1 800尾·箱-1,日投喂2次,饵料系数约为0.9,投喂饲料为特种水产饲料。养殖用水为符合国家渔业水质标准的地下水,地下水经抽滤、曝气后用于养殖。养殖期间补充因渗漏、蒸发等损失的养殖用水,箱体内的水每5 h循环1次。
1.2 样品采集与测定方法
根据集装箱养殖尾水处理工艺共设置4 个采样点,分别是集装箱内1 个,净化系统中1#池塘、2#池塘、3#池塘各1 个。采用1 L 有机玻璃采水器采集集装箱内养殖水与净化塘内表层水(0~50 cm),每个采样点随机采集3~4 次后取混合水样,水样编号:箱体内养殖水记作YS-1,净化系统中水体记作JH1、JH2、JH3(分别为一、二、三级净化塘)。
浮游植物样品采集及鉴定方法参照《中国淡水藻类——系统、分类及生态》[13]和《淡水浮游生物研究方法》[14]。定性样品用25#浮游生物网(孔径为64 μm)在上层水体呈“∞”字形捞取3~5 min,将滤取的样品放入样品瓶中,并加入鲁哥试剂固定;定量样品用有机玻璃采水器采集1 L 水样(表层水与底层水混合),加入水样体积1.5%的鲁哥试剂固定,实验室沉淀、浓缩,定容为30 mL。同时每个采样点采集混合水样1 L,4 ℃保存用于水质参数分析。
浮游植物样品经浓缩、定容后,用细小虹吸管移出上清液,最后定容为30 mL。吸取0.1 mL 样品注入0.1 mL 浮游生物计数框内,在OlymbusBX53 显微镜(400 倍)下进行种类鉴定与细胞计数;计数方法为目镜视野法,每个样本重复计数2~3次,每次观察100个视野,取其平均值,然后换算成单位体积中浮游植物的细胞密度。浮游植物生物量采用细胞体积法推算。
现场采用便携式多参数水质分析仪(YSI Pro-Plus)测定溶解氧(DO)、pH、电导率(Cond)、比电导率(SPC)、水温(WT)、化学需氧量(COD)、氧化还原电位(ORP);采用透明盘测定水体透明度(SD)。叶绿素a(Chl.a)、总氮(TN)、总磷(TP)、氨氮(-N)、硝态氮(-N)、亚硝态氮(-N)指标在实验室内参照相关文献测定[15]。
1.3 数据处理
运用Margalef 物种丰富度指数(D)、Shannon-Wiener 物种多样性指数(H′)、Pielou 均匀度指数(J)及浮游植物优势度等参数分析浮游植物群落结构特征。优势度Y≥0.02 的藻类定为优势种[16]。各参数计算公式如下:
式中:S为浮游植物总种数;N为浮游植物个体总数;ni为第i种浮游植物个体数;fi为第i种浮游植物各采样点出现频率。
水质判定标准:D≥4.0 为水质清洁,3.0≤D<4.0 为寡污型,2.0≤D<3.0为β-中污型,1.0≤D<2.0为α-中污型,D<1.0 为重污型;H′值≥4.0 为清洁,3.0≤H′<4.0 为轻污染,2.0≤H′<3.0 为β-中污染,1.0≤H′<2.0 为α-中污染,H′<1.0 为重污染;0.8≤J<1.0 为清洁,0.5≤J<0.8为轻污染,0.3≤J<0.5为中污染,0≤J<0.3为重污染[16]。
采用Canoco 5.0 软件对浮游植物和环境因子进行冗余分析,筛选出相对生物量至少在一个样点大于1%且在各样点的出现频率大于25%的种类进行排序。将浮游植物生物量与水质指标进行lg(x+1)转换处理,使数据符合正态分布。
2 结果与分析
2.1 水体理化特征
试验期间,集装箱养殖水与净化系统水体水质指标情况见表1。养殖水与净化系统水体水温基本保持一致,组间差异不显著;净化系统JH1、JH2、JH3 中溶解氧含量逐渐增加,总氮、总磷、氨氮、亚硝态氮略有下降,但差异均不显著。
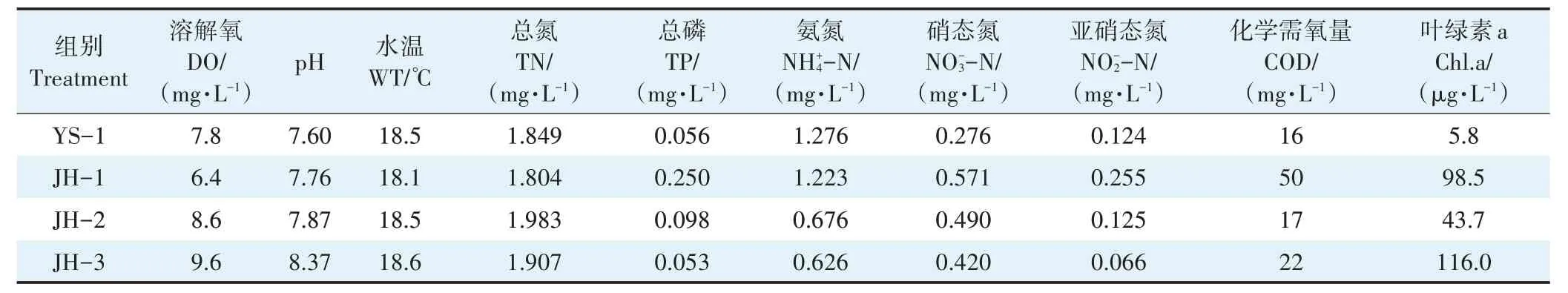
表1 集装箱养殖水体与生态净化系统水体水质因子情况Table 1 Water quality factors of aquaculture tail water in the land-based container and ecological purification pond
2.2 浮游植物种类组成与优势种
调查期间,从中华鲟集装箱式养殖水体YS-1 中共鉴定出浮游植物4门17属21种,从净化系统水体中共鉴定出浮游植物8门51属93种,其中,JH-1共鉴定出8门38属60种,JH-2共鉴定出8门42属71种,JH-3共鉴定出7门26属46种(表2)。净化系统水体中浮游植物种类均以绿藻门(Chlorophyta)和硅藻门(Bacillariophyta)为主。从浮游植物种类组成分析,净化系统水体中浮游植物种类数显著大于集装箱养殖水体中的种类数(r=0.918,P<0.01)。
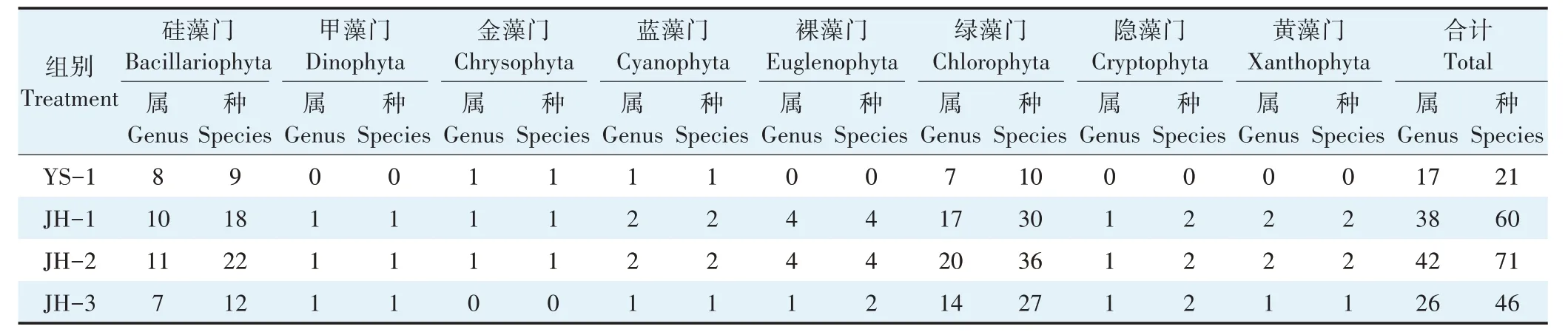
表2 集装箱养殖尾水与生态净化塘系统水体中浮游植物主要种类组成Table 2 Species composition of phytoplankton of aquaculture tail water in the land-based container and ecological purification
调查期间,Y≥0.02 的浮游植物有19 种(表3),主要为绿藻门的被甲栅藻(Scenedesmus armatus)、顶锥十字藻(Crucigenia apiculata)、二形栅藻(Scenedesmus dimorphus)、平壁克里藻(Klebsormidium scopulinum)、小空星藻(Coelastrum microporum)等,硅藻门的颗粒直链藻极狭变种(Melosira granulatavar.angustissima)、尖针杆藻(Synedra acus)及蓝藻门的细小平裂藻(Merismopedia minima)、类颤鱼腥藻(Anabaena oscillarioides)等。其中,养殖水体浮游植物优势种为类颤鱼腥藻和颗粒直链藻极狭变种等,生态净化塘水体浮游植物优势种为栅藻(Scenedesmus)、变异直链藻(Melosira varians)、尖针杆藻、细小平裂藻等。
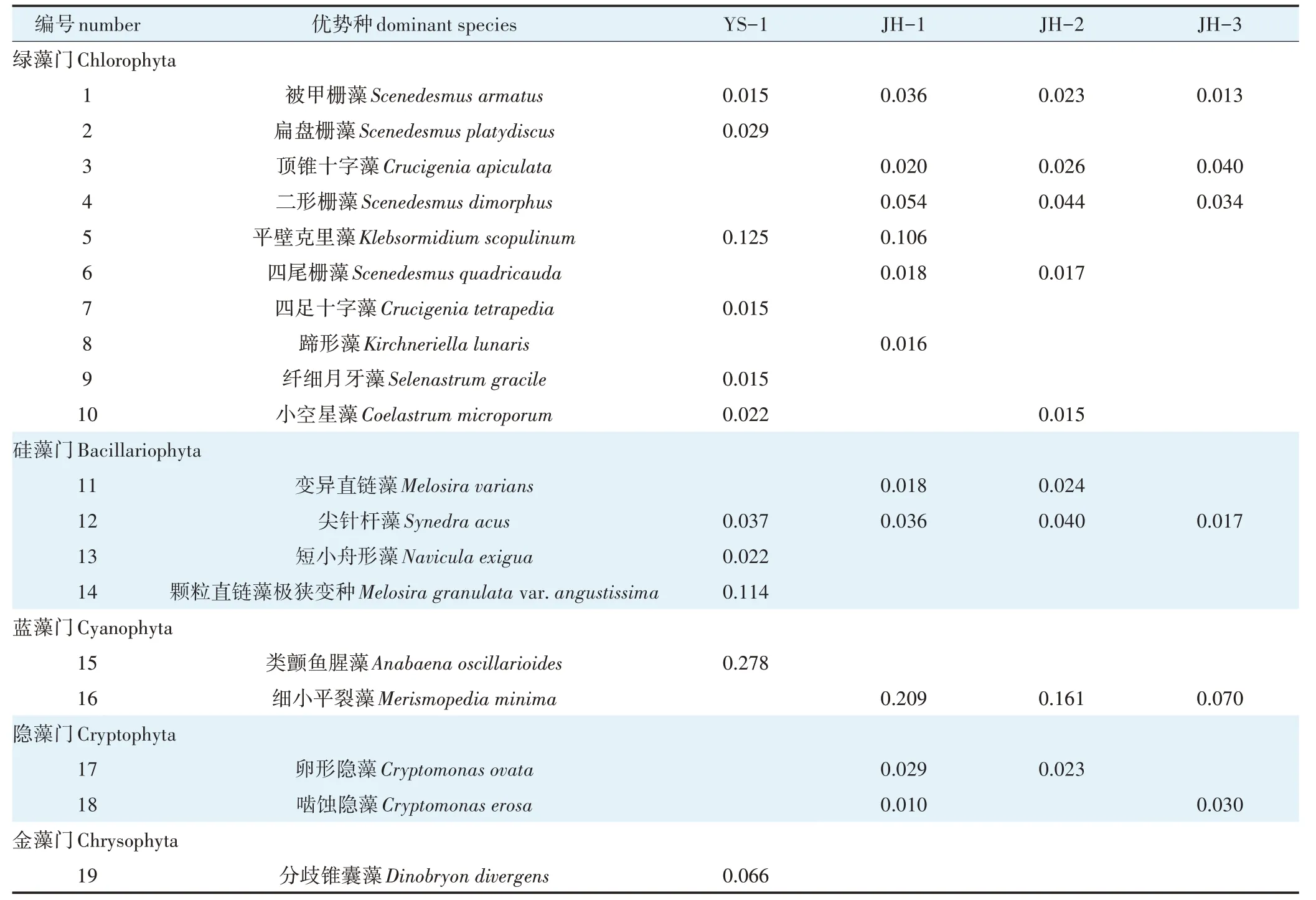
表3 集装箱养殖尾水与净化系统水体中浮游植物优势种组成Table 3 Composition of phytoplankton dominant species in aquaculture tail water of the land-based container and purification pond
2.3 浮游植物丰度与生物量
如图2 所示,调查期间,集装箱养殖水体浮游植物细胞丰度为2.816×105cells·L-1,净化系统水体细胞丰度范围为1.023×106~1.229×106cells·L-1,平均值为1.135×106cells·L-1,净化系统JH-1、JH-2、JH-3 浮游植物细胞丰度显著高于养殖系统(P<0.01)。浮游植物细胞丰度在一级净化塘内开始升高,三级净化塘中略有下降,净化系统水体内浮游植物细胞丰度总体变化趋势为JH-2>JH-1>JH-3。从浮游植物细胞丰度组成类群可以看出,养殖水体浮游植物细胞丰度主要由蓝藻门、绿藻门与硅藻门类群构成;净化系统水体浮游植物细胞丰度主体为绿藻门、蓝藻门、硅藻门、隐藻门类群。
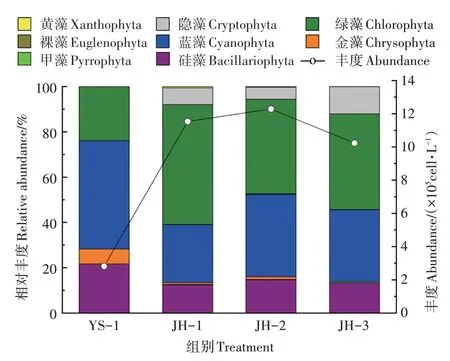
图2 集装箱养殖水体与生态净化系统水体中浮游植物丰度Figure 2 Phytoplankton density in the land-based container water and ecological purification pond
如图3 所示,调查期间,集装箱养殖系统水体中浮游植物生物量为0.021 mg·L-1,净化系统水体中浮游植物生物量范围为0.703~0.821 mg·L-1,平均值为0.763 mg·L-1,净化系统JH-1、JH-2、JH-3浮游植物生物量显著高于养殖系统(P<0.01)。浮游植物生物量在生态净化塘水体内的变化趋势为JH-3>JH-1>JH-2。从浮游植物生物量主要组成类群分析,集装箱养殖系统水体中浮游植物生物量主要类群为硅藻门、绿藻门与金藻门类群,而净化系统水体中浮游植物生物量主体为硅藻门、绿藻门与隐藻门类群。
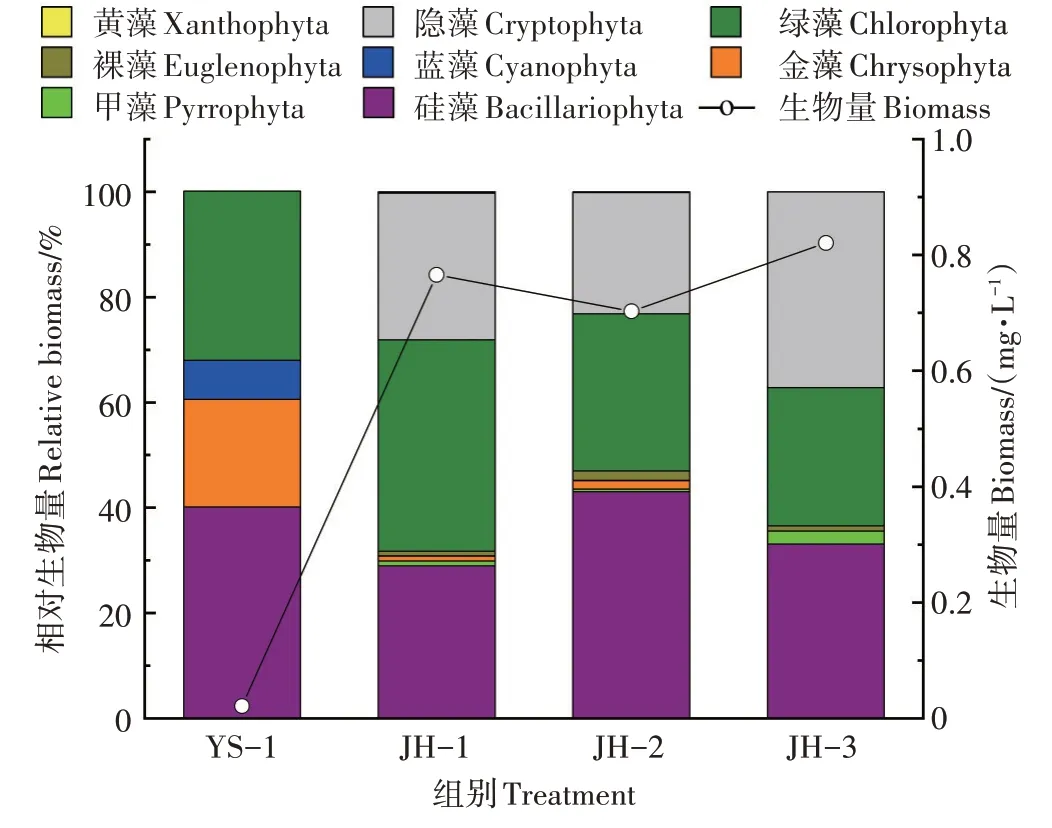
图3 集装箱养殖水体与生态净化系统水体中浮游植物的生物量Figure 3 Phytoplankton biomass in the land-based container water and ecological purification pond
2.4 浮游植物多样性指数
多样性指数分析结果显示(图4),集装箱养殖系统水体中浮游植物的D值显著低于净化系统水体(P<0.05),净化系统样点间浮游植物H′、J差异不显著(P>0.05)。调查期间,集装箱与净化系统水体H′的范围为2.78~4.00,D的范围为3.57~8.42,J的范围 为0.63~0.68,其中H′和J的最大值均出现在净化系统JH-1,D最大值出现在JH-2。综上分析,养殖系统水体中D、H′、J均低于净化系统水体。结合多样性指数与均匀度指数所指示的水质状况分析,养殖水体水质为β-中污染水平,净化系统水质为轻污染水平,净化系统水质总体优于养殖水体水质。
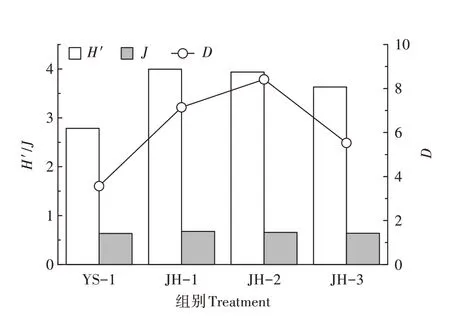
图4 集装箱养殖水体与生态净化系统水体中浮游植物α多样性指数Figure 4 Phytoplankton alpha diversity indexes in the land-based container water and ecological purification pond
2.5 浮游植物群落相似性
为掌握样点间浮游植物种群差异程度与亲缘关系的远近,用样点间的浮游植物群落相似性指数进行判别分析。根据Venny 相似性系数得出不同样点间相似性值,结果显示(图5):JH-2 浮游植物群落相似性最高,为37.8%;其次为JH-1,相似度为35.0%;JH-3 相似度为24.5%;YS-1 相似度最低,为11.2%;JH-1与JH-2浮游植物相似性为1.6%,JH-2与JH-3、YS-1与JH-1 之间相似性均为1.1%,JH-1 与JH-3 相似性为1.6%。上述分析说明样点空间格局的差异会影响浮游植物群落结构的组成。
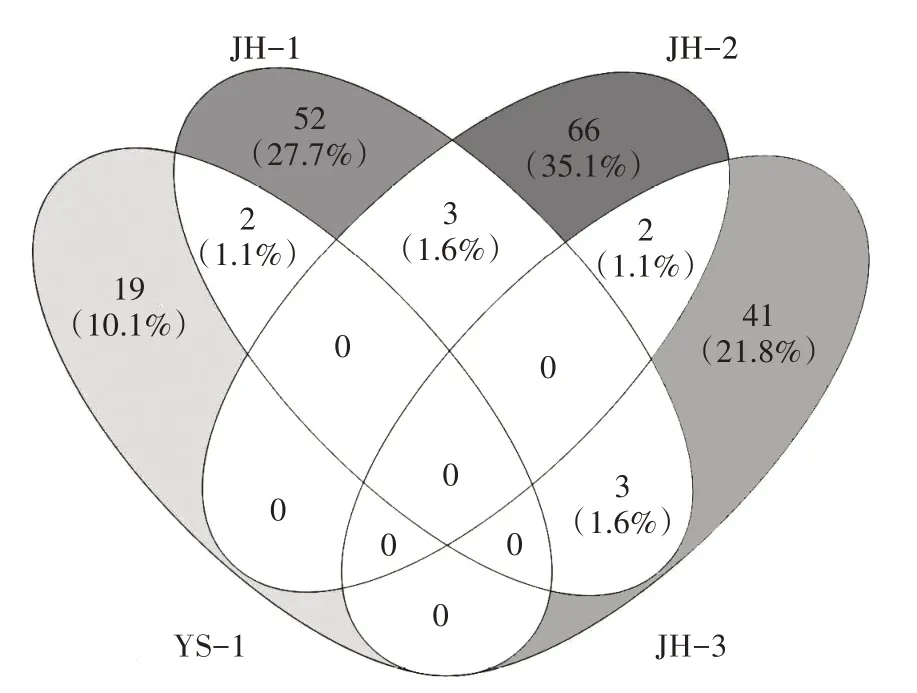
图5 集装箱养殖水体与净化系统水体中浮游植物群落结构相似性分析Figure 5 Analysis of phytoplankton community similarity by Venny in the land-based container water and ecological purification pond
2.6 浮游植物与环境因子的相关性分析
为进一步明确影响浮游植物群落分布的环境因子,将浮游植物物种与环境因子进行RDA 分析。结果表明(图6),影响养殖系统与净化系统水体中浮游植物群落结构的主要环境因子为-N、DO、SPC、Cond、pH 与ORP 等,其中,影响浮游植物丰度组成的主要因子为-N、SPC、pH等,影响浮游植物生物量结构的主要环境因子为-N、DO 与ORP。与净化系统JH-1、JH-2 浮游植物群落丰度及生物量组成有显著性相关的环境因子为-N(P<0.05)。浮游植物丰度分布分析表明,RDA1 轴的解释量为72.5%,RDA2 轴的解释量为18.9%;在生物量分布分析中,RDA1 轴的解释量为51.7%,RDA2 轴的解释量为38.2%。其中,在浮游植物丰度结构中,RDA1与pH正相关,相关系数为0.958,RDA2与-N正相关,相关系数为0.917;在浮游植物生物量分布分析中,RDA1与DO正相关,相关系数为0.936,RDA2与-N负相关性最大(-0.896),与ORP正相关性最大(0.898)。
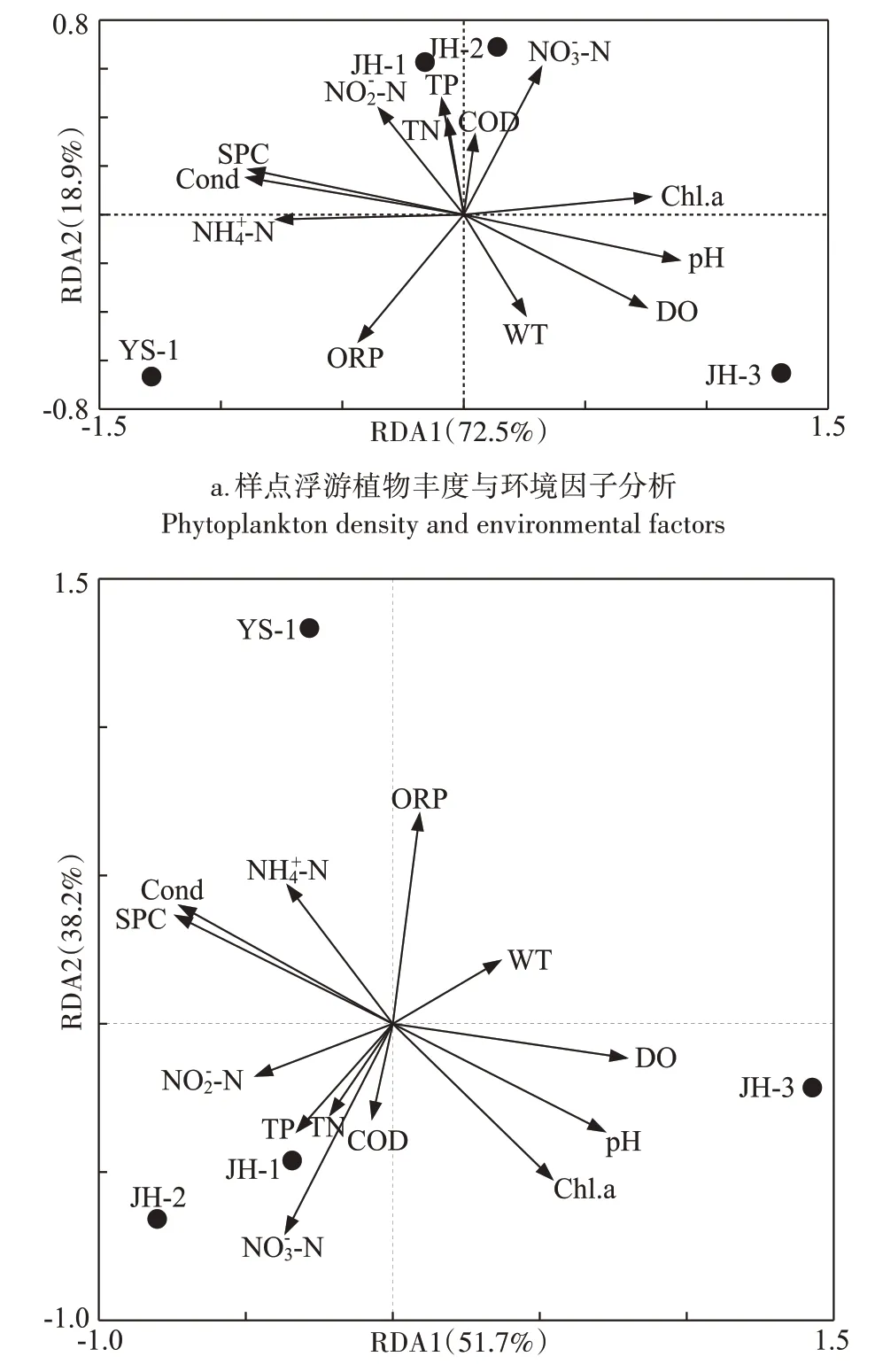
图6 集装箱养殖水及净化系统浮游植物群落与理化因子RDA分析Figure 6 RDA of phytoplankton community and physicochemical factors in the land-based container water and purification pond
3 讨论
3.1 养殖系统与净化系统水体中浮游植物群落结构特征
浮游植物优势种种类及其数量对浮游植物群落结构的稳定性存在一定的影响[17]。本研究中,养殖系统与净化系统水体中浮游植物群落优势类群有明显区别,以浮游植物丰度计算优势类群,与养殖系统水体中的蓝藻门类群(累积物种相对丰度占比为47.79%)相比较,净化系统水体的优势类群为绿藻门、蓝藻门与硅藻门等,其中绿藻门物种相对丰度占比均超过41%,净化系统水体中浮游植物优势类群较多,群落结构趋于稳定状态。有研究表明浮游植物优势类群占比可以用于指示水体的污染状态,蓝-绿藻型是水质营养化程度较高的表征[18],由此可见,集装箱养殖系统水质营养程度较高。本研究养殖系统水体中的浮游植物主要功能群为鱼腥藻(Anabaena)和直链藻(Melosira)等,其可以适应水体长期混合搅动、低含氮量、光限制等生态习性[19-20];且养殖对象中华鲟营底栖的生态习性对底层水体搅动与水循环扰动等因素可能是养殖系统水体中浮游植物群落以蓝藻类群为主的原因,这也进一步说明养殖系统水体营养程度较高。
湿地净化技术是目前水产养殖尾水处理应用较为有效的方法之一[21],该技术主要利用多功能生态系统的物理过滤、化学吸附、沉淀、植物过滤等方法[22],可有效去除水产养殖尾水中氮、磷等营养元素[23-24]。本研究结果表明,净化系统JH-2 浮游植物物种属数和优势种较多,且均优于养殖系统。有研究表明生态浮床可以有效去除系统中的营养物质,与浮游植物生长形成竞争,通过上行效应调控浮游植物群落结构组成,达到改善浮游植物群落结构、提高系统稳定性等的效果[25],这一结论在本研究中得到证明。
3.2 净化系统水体中浮游植物群落多样性
浮游植物群落α 多样性指数与水质状况有明显相关性,是反映群落结构稳定性的主要指标[26-27],一般情况下,α 多样性指数越高,说明水体健康状况越好[28]。有研究表明在鱼菜共生池塘设置生态浮床能显著提升浮游植物Shannon-Wiener 指数与均匀度指数[29];在草鱼养殖池塘设置陶粒浮床具有改善水质、提高浮游植物Shannon-Wiener 指数与Simpson 指数的作用[30];在泥鳅养殖池塘,有浮床组的浮游植物物种数明显高于对照组[31]。上述结论都充分说明生态浮床通过营养盐竞争、根系附着微生物降解等促进了浮游植物物种丰富度,使其群落结构趋于稳定。在本研究中,净化系统水体中浮游植物丰富度指数、多样性指数与均匀度指数均高于养殖系统水体,这与上述研究结论相似,也进一步说明净化系统水体中浮游植物群落结构稳定,水质趋于健康。
多样性指数是群落结构稳定性的主要指标,也与水体健康状况相关[32]。本研究结果发现,养殖系统水体中浮游植物多样性较低,各指数较低;净化系统从前段到后端,水体中浮游植物多样性指数变化趋势基本一致,Shannon-Wiener 指数与Pielou 均匀度指数均表现为JH-1>JH-2>JH-3>YS-1,依据Shannon-Wiener 多样性指标对水质状况的评价标准,净化系统水体中浮游植物多样性指数均高于养殖系统,表明水质经过净化系统后得到改善。从多样性指数对水质指标指示状况分析可知,养殖系统水质为β-中污染水平,净化系统水质为轻污染水平,说明净化系统对于集装箱养殖尾水的生态调控效果较好。
3.3 净化系统水体中浮游植物群落结构与环境因子的关系
浮游植物类群具有不同的生理特征,因此适宜生存的环境也有所差异,当水体被扰动时系统中的浮游植物群落结构会受到显著影响[33]。浮游植物物种与丰度主要与水体营养盐、WT、光照、pH 等因素有关[34]。有研究表明,不同浮游植物种类生长繁殖所适宜的pH 范围不同,弱碱性水体中浮游植物的光合作用效率较高[35],因此浮游植物对营养盐的利用效率受水体pH 影响,且浮游植物光合作用可以进一步提高水体pH[36]。本研究冗余分析结果显示pH、SPC、DO与NO-3-N 是影响净化系统水体中浮游植物群落结构的环境因子,浮游植物丰度及生物量与pH、DO 呈显著的正相关关系,说明浮游植物数量、生物量等指标与水体pH 为同向性关系,这一结果在太湖流域浮游植物功能类群研究中也得到验证[37]。
已有研究表明,水体氮、磷营养盐元素是浮游植物生长必需的大量元素,因此水体氮、磷营养元素含量会影响浮游植物群落结构[38-39]。综合本研究RDA排序结果可知,净化系统JH-1、JH-2 浮游植物优势类群为直链藻(Melosira)、针杆藻(Synedra)、栅藻(Scenedesmus)等,丰度及生物量均与NO-3-N、NO-2-N显著正相关。有研究表明浮游植物对不同质量浓度及形态氮源的利用效率不同[40],相比较其他形式的氮源,硅藻类群更倾向硝酸盐浓度较高的水体[41-42]。本研究结果也验证了这一结论。有研究表明硅藻类群偏好低温环境[43],试验期间,净化系统水体的平均WT为18 ℃左右,这可能是净化系统水体中硅藻类群为主要优势种的另一原因。
光照是浮游植物光合作用的必需资源,不同浮游植物类群对光强的耐受性和光照变化等衍生出不同生理、生态适应性策略等习性,进而影响浮游植物的种群动态与种间竞争[44]。本研究表明,净化系统水体中浮游植物丰度与生物量相较于养殖系统水体均有显著增加,可能由于集装箱内光照条件限制和高密度的鲟鱼养殖活动对水体悬浮物的扰动等,抑制了浮游植物的光合作用。有研究发现,蓝藻为低光照耐受型浮游植物,栅藻为高光强耐受类浮游植物[45-46],因此集装箱养殖系统水体中优势类群为蓝藻,而净化系统水体中优势类群为绿藻。
4 结论
(1)养殖系统水体中浮游植物优势类群为鱼腥藻(Anabaena)、直链藻(Melosira),净化系统水体中主要为直链藻(Melosira)、针杆藻(Synedra)、栅藻(Scenedesmus)等。
(2)净化系统能增加陆基集装箱养殖尾水中的浮游植物种类,并提高优势类群的多样性,降低养殖尾水的营养化程度,有利于水质稳定。
(3)养殖与净化系统水体中浮游植物丰度、生物量主要与水体pH、比电导率、溶解氧、NO-3-N 等影响因子有关。在实际生产运行中,可通过调控水体理化因子控制养殖与净化系统水体中浮游植物群落结构组成,维护集装箱循环水养殖系统良好运行。

