枯萎病菌毒素粗提液对美洲南瓜幼苗生长及生理的影响
刘 佳,柴改凤,郭风清,张树武,徐秉良
(甘肃省农作物病虫害生物防治工程实验室·甘肃农业大学植物保护学院 兰州 730070)
美洲南瓜(Cucurbita pepo)是葫芦科南瓜属一年生蔓性草本植物,因其营养成分种类多,药用和食用价值极高,在我国很多地区都有种植[1-2]。甘肃省武威市是美洲南瓜重要的育种基地,美洲南瓜也是当地重要的经济作物之一,生产的南瓜籽远销海外[3]。
瓜类枯萎病(Fusariumwilt)是由镰孢菌引起的土传病害,也是瓜类生产中的毁灭性病害[4]。其中,以西瓜发病最为严重,其次是南瓜,一般发病率为20%~30%,严重时达80%[5],有时在连作地甚至造成全田死亡。因此,瓜类枯萎病是瓜类生产上的一大难题,也是限制美洲南瓜生产的重要因素之一[6]。前人研究表明,引起甘肃省武威市美洲南瓜枯萎病的致病菌为尖孢镰孢菌(Fusarium oxysporum)[5]。
镰孢菌引起植物发生枯萎病的生理水平上致病机制,一种是导管阻塞,另一种是致病毒素。镰孢菌产生的毒素-镰刀菌酸损伤宿主植物根系细胞膜,增强细胞的通透性,同时降低线粒体活性氧的含量、阻止ATP 合成,从而导致植物根系水分吸收受阻,生长受到抑制[7]。目前发现的镰孢菌可以产生最重要的3 类真菌毒素(伏马菌素、单端孢霉烯族毒素和玉米赤霉烯酮),也能够产生包括恩镰孢菌素、串珠镰刀菌素和白僵菌素在内的新型真菌毒素[8]。
同一种镰孢菌在人工培养基和植物体内的产毒种类可能存在差异,同时在人工培养条件下的产毒能力也受到培养基成分、温度、湿度等环境条件的影响[9-10]。如苦瓜枯萎病菌毒素发酵的最佳培养液为Czapek 培养液,最佳培养时间为14 d,装液为100 mL。该毒素发酵滤液在高温高压下具有较好的稳定性[11]。
也有研究结果表明,拟轮枝镰孢菌毒素粗提液对玉米不同品种的发芽率、幼苗生长均有显著影响[12]。孔前前等[13]研究表明,尖孢镰孢菌QD3-2 产生的毒素对苜蓿种子萌发和胚根生长均具有抑制作用。庄敬华等[14]研究发现甜瓜枯萎病菌毒素粗提液对甜瓜胚根的生长具有显著的抑制作用,诱发甜瓜幼苗表现典型的枯萎病萎蔫症状,推测该病原菌产生的粗毒素中含有甜瓜生长的抑制性物质。
前人研究发现,尖孢镰孢菌侵入寄主后分泌的毒素物质,改变了寄主植物细胞膜的透性、抑制植物根的生长,而低量毒素又能诱导植物合成植保素[15]。陈慧杰等[16]研究表明,菊花枯萎病菌毒素可抑制切花菊幼苗根、茎的正常生长,增加幼苗根系的细胞膜透性以及根系组织中可溶性糖、脯氨酸和MDA 的含量,在短时间内提高根系保护酶POD、PAL 和PPO 活性。有关美洲南瓜枯萎病菌产生毒素的培养条件以及毒素粗提液对幼苗影响的研究相对较少。
因此,笔者通过探究影响美洲南瓜枯萎病菌产毒的各项培养条件,研究病原菌产生的毒素粗提液对美洲南瓜幼苗生长和生理的影响,以期为探索美洲南瓜枯萎病菌致病机制奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试药品及试剂盒 马铃薯、葡萄糖、自来水、KNO3、蔗糖、蛋白胨、无菌水、KH2PO4、MgSO4、NaNO3、KCl、FeSO4、琼脂等。苯丙氨酸解氨酶(PAL)活性、丙二醛(MDA)含量检测试剂盒均购自上海优选生物科技有限公司。
1.1.2 供试仪器和用具 超净工作台、恒温培养箱、pH 计、酶标仪、离心机、灭菌锅、电导仪、电子天平、摇床、烘箱、各种量程的移液器及吸头、各种规格的离心管、研钵、锤形瓶、96 孔UV 板、圆形玻璃瓶等。
1.1.3 供试病原菌及品种 试验于2020 年6
月至2021 年5 月在甘肃农业大学植物保护学院植物病毒与分子生物学实验室进行。植物供试病原菌:美洲南瓜枯萎病菌(Fusarium oxysporum,尖孢镰孢菌),是甘肃农业大学植物保护学院植物病害及生物防治课题组前期从甘肃省武威市金苹果有限责任公司种质资源试验基地患枯萎病的美洲南瓜中分离得到,由甘肃农业大学植物保护学院植物病毒与分子生物学实验室分离鉴定与保存。供试美洲南瓜品种:金苹果2 号,由甘肃省武威市金苹果有限责任公司提供。
1.2 方法
1.2.1 病原菌的纯化 用接种针从菌种冻存管中挑取美洲南瓜枯萎病菌,在PDA 培养基中进行菌种接种,接种5~10 皿,转移至25 ℃恒温培养箱中进行纯化培养。
1.2.2 病原菌毒素粗提液的制备 取纯化好的病原菌,用直径为0.7 cm 的打孔器打取菌饼,用接种环接入150 mL 三角瓶80 mL 培养液中,进行灭菌处理,灭菌后在超净工作台上进行操作,每个三角瓶内用接种环接入8 个菌饼,试验进行3 次重复。将三角瓶放在28 ℃、180 r·min-1的恒温摇床中连续震荡15 d 后,将培养液中的菌丝体用纱布过滤掉,接着用6 层纱布进行过滤,准备若干50 mL 离心管,将毒素滤液收集其中,3000 r·min-1离心30 min,最后弃去沉淀,将上清液装在另一个离心管中,置于沸水浴中水浴10 min,得到毒素粗提液[17]。
1.2.3 培养液对病原菌产毒的影响 设置3 种不同培养液:理查(Richard)培养液,硝酸钾5.00 g,硫酸亚铁5 mg、磷酸二氢钾2.50 g、蔗糖2.50 g、硫酸镁0.25 g、蒸馏水500 mL;改良察氏(Czapek)培养液,蔗糖15.00 g、硝酸钠1.00 g、磷酸二氢钾0.50 g、氯化钾0.25 g、硫酸亚铁5 mg、硫酸镁5 mg、蒸馏水500 mL;察氏蛋白胨(PSC)培养液,蔗糖15.00 g、硫酸镁0.25 g、蛋白胨5.00 g、磷酸二氢钾0.50 g、硫酸亚铁5 mg、氯化钾0.25 g、蒸馏水500 mL;以马铃薯葡萄糖(PD)培养液为对照培养液,即葡萄糖10.00 g、马铃薯100 g、蒸馏水500 mL。
将病原菌菌饼接种于上述3 种不同培养液和对照培养液(PD 培养液)中,振荡培养(25 ℃,15 d),制备毒素粗提液,处理催芽的美洲南瓜种子,人工气候培养箱中培养(28 ℃,48 h),测定美洲南瓜种子胚根生长抑制率,试验进行3 次重复。
1.2.4 培养时间对病原菌产毒的影响 在1.2.3 筛选出的最佳培养液的基础上(下同),将接有菌饼的培养液于25 ℃震荡培养5、10、15、20、25 d,培养至相应时间时制备毒素粗提液,处理催芽的美洲南瓜种子,在人工气候培养箱中培养(28 ℃,48 h),测定美洲南瓜种子胚根生长抑制率,试验进行3 次重复。
1.2.5 培养方式对病原菌产毒的影响 将接有菌饼的培养液置于25 ℃摇床中,设置全天振荡培养、振荡12 h+静置12 h、全天静置3 种处理,每组培养15 d,制备毒素粗提液,处理催芽的美洲南瓜种子,在人工气候培养箱中培养(28 ℃,48 h),测定美洲南瓜种子胚根生长抑制率,试验进行3 次重复。
1.2.7 光照对病原菌产毒的影响 将接有菌饼的培养液在25 ℃下,分别在连续光照、连续黑暗、12 h光暗交替处理下振荡培养15 d,制备毒素粗提液,处理催芽的美洲南瓜种子,在人工气候培养箱中培养(28 ℃,48 h),测定美洲南瓜种子胚根生长抑制率,试验进行3 次重复。
1.2.8 毒素粗提液的热稳定性测定 将制备好的毒素粗提液设置高温处理(121 ℃灭菌,20 min)和不进行高温处理两种。处理后处理催芽的美洲南瓜种子,在人工气候培养箱中培养(28 ℃,48 h),测定美洲南瓜种子胚根生长抑制率,试验进行3次重复。
1.2.9 胚根的生长抑制率的测定方法 美洲南瓜种子用清水充分冲洗干净,然后用1%的次氯酸钠溶液处理种子表面,清水充分冲洗,将种子装在烧杯中,倒入超过种子2/3 的蒸馏水,设置水浴锅温度为55~60 ℃,种子在水浴锅中水浴10 min,其间不断搅拌,水浴后取出搅拌至水温至室温,将种子置于28 ℃恒温箱浸泡4~5 h 后,将种子平铺在底层铺有无菌滤纸的培养皿中,置于28 ℃的人工气候恒温箱内进行催芽处理(芽长长度为2~3 mm 时),将美洲南瓜种子胚芽向下均匀放在铺满无菌滤纸且灭菌的培养皿内,用移液枪加5 mL 毒素粗提液于培养皿内的美洲南瓜种子。以空白培养液处理为对照。25 ℃下培养,48 h 后测定并计算胚根生长抑制率。每处理20 粒种子,试验进行3 次重复。
胚根生长抑制率/%=(对照胚根长度-处理胚根长度)/对照胚根长度×100。(1)
1.2.10 病原菌毒素粗提液对美洲南瓜幼苗生长及生理的影响 选取长势一致的美洲南瓜幼苗小心取出,清洗干净,轻剪伤根,浸入设置的不同倍数毒素粗提液中,毒素粗提液设置5 个不同梯度:100%、80%、60%、40%、20%毒素粗提液各10 mL;以蒸馏水10 mL 为对照。在上述粗提液中处理24 h 后,将植株移栽入塑料杯中,分别于5、7、9、11、13 d 取样测定美洲南瓜幼苗相关生理指标。每个处理20株,3 次重复。
(1)美洲南瓜幼苗株高、茎粗、根长的测定:用直尺测量美洲南瓜幼苗的株高和根长,游标卡尺测量幼苗的茎粗,试验进行3 次重复。
(2)美洲南瓜幼苗叶片和根系电导率的测定:将幼苗的叶片和根系洗净晾干,取1 g 叶片或者根系放入装有10 mL 超纯水的试管内,静置12 h,测定每管电导率,再在沸水浴30 min,之后测定每管的电导率,试验进行3 次重复。
细胞膜透性=35 ℃水浴条件下外渗液的电导率值/沸水浴条件下外渗液的电导率值×100%。(2)
(3)美洲南瓜幼苗叶片PAL 酶活性和MDA 含量的测定:均参照相应的活性检测试剂盒说明书进行,试验进行3 次重复。
从国外电力市场运行目标来看:其总收益要补偿所有需量机组的总成本。对应到云南煤电机组,其在系统中的作用主要为保安全和枯水期备用,所以保安全的机组和枯水期备用容量机组的全成本需要得到补偿。目前由于云南省内能量市场尚不完善,能量市场不足以补偿的部分应设定一定的补偿机制进行补偿,以弥补电能市场的不足。
1.3 数据分析
采用Microsoft Excel 2016 软件进行数据处理和图表制作,差异显著性分析依据LSD 最小显著性差异法,由SPSS 21.0 专业版完成。
2 结果与分析
2.1 培养条件对美洲南瓜枯萎病菌产毒的影响
2.1.1 培养液对病原菌产毒的影响 由图1 可知,美洲南瓜枯萎病菌最适宜产毒的培养液是Czapek培养液,对美洲南瓜种子胚根生长抑制率为67.51%,其次是PD 培养液,胚根生长抑制率为47.71%。Czapek 培养液对胚根生长抑制率与PD培养液、PSC 培养液和Richard 培养液对胚根生长抑制率差异显著。

图1 培养液对美洲南瓜枯萎病菌产毒的影响
2.1.2 培养时间对病原菌产毒的影响 由图2 可知,美洲南瓜枯萎病菌在Czapek 培养液中培养5 d时,毒素粗提液对美洲南瓜胚根生长抑制率为19.78%,培养10 d 时胚根生长抑制率上升至28.17%。培养15 d 时,毒素粗提液对美洲南瓜胚根生长抑制率的影响最大,胚根生长抑制率达到67.17%,此时的胚根抑制率是培养5 d 时的3.40倍。培养20 d 和25 d 时,毒素粗提液对美洲南瓜胚根生长抑制率分别为41.45%和48.25%,不同处理间差异均显著。
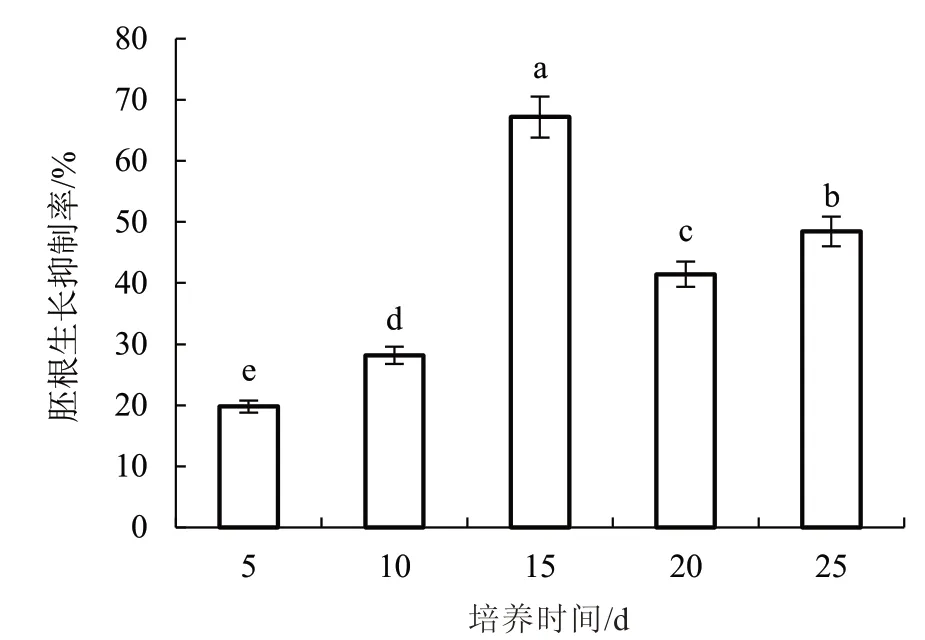
图2 培养时间对美洲南瓜枯萎病菌产毒的影响
2.1.3 培养方式对病原菌产毒的影响 由表1 可知,美洲南瓜枯萎病菌在Czapek 培养液中,全天振荡培养方式下,毒素粗提液对美洲南瓜种子具有明显抑制作用,胚根生长抑制率最高,为73.67%,振荡12 h+静置12 h 培养、静置培养下,胚根生长抑制率依次降低。3 种培养方式的胚根生长抑制率存在显著差异。

表1 培养方式对美洲南瓜枯萎病菌产毒的影响
2.1.4 pH 值对病原菌产毒的影响 由图3 可知,pH 值为4~6 时,病原菌毒素粗提液对美洲南瓜的胚根抑制率分别为51.12%、48.40%、52.24%,3 个处理间差异不显著。pH 值为7 时毒素粗提液对美洲南瓜胚根生长的抑制作用最强,胚根生长抑制率为69.26%,与pH 值为4~6 的3 个处理差异显著。
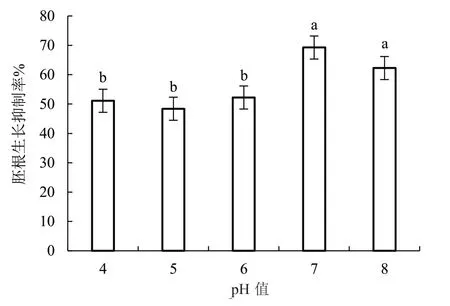
图3 pH 值对美洲南瓜枯萎病菌产毒的影响
2.1.5 光照对病原菌产毒的影响 由图4 可知,美洲南瓜枯萎病菌在连续黑暗、12 h 光暗交替和连续光照3 种方式下培养产生的毒素粗提液均对美洲南瓜胚根有抑制作用。其中,在连续光照条件下最有利于产毒,胚根生长抑制率为65.57%,相比连续黑暗和12 h 光暗交替培养时,胚根生长抑制率分别提高109.22%和176.43%,连续光照和其他2 个处理差异显著。

图4 光照对美洲南瓜枯萎病菌产毒的影响
2.1.6 毒素粗提液的热稳定性 由表2 可知,高温灭菌的病原菌毒素粗提液处理美洲南瓜胚根生长抑制率为43.32%,未经高温灭菌处理的胚根生长抑制率为44.75%。高温灭菌的病原菌毒素粗提液和未经高温灭菌的毒素粗提液处理美洲南瓜种子胚根生长抑制率无显著差异,表明毒素粗提液的热稳定性较好。

表2 病原菌毒素粗提液的热稳定性
2.2 美洲南瓜枯萎病菌毒素粗提液对美洲南瓜幼苗生长及生理的影响
2.2.1 病原菌毒素粗提液对美洲南瓜幼苗株高茎粗的影响 纯毒素粗提液(100%)处理的美洲南瓜幼苗全部枯萎死亡,对其他4 个处理和对照进行比较分析。由图5-A 可知,幼苗株高均呈现随着毒素粗提液处理浓度的增加逐渐下降趋势。在处理第5天时,对照处理的美洲南瓜幼苗的株高最高,为124.52 mm,80%毒素粗提液处理下幼苗的株高最低,为102.34 mm,4 个毒素粗提液处理间株高存在显著性差异。处理13 d 时,对照处理下幼苗株高最高,为146.22 mm,而80%毒素粗提液处理下株高仅为110.31 mm,相差35.91 mm,各处理间株高存在显著差异。
由图5-B 可知,幼苗茎粗均呈现随着毒素粗提液处理浓度的增加呈逐渐下降趋势,病原菌毒素粗提液浓度越大,对幼苗茎粗的影响也越大。在处理第5 天时,80%毒素粗提液处理下茎粗最小,为3.37 mm,对照处理幼苗茎粗最大,为4.28 mm,各处理间茎粗差异显著。处理13 d 时,对照茎粗显著高于4 个毒素粗提液处理,20%和40%毒素粗提液处理下茎粗差异不显著,但均显著高于60%和80%毒素粗提液处理。
由图5-C 可知,幼苗根长均呈现随着毒素粗提液处理浓度的增加逐渐下降趋势,且各处理间根长差异显著。处理第5 天时,80%毒素粗提液处理下的根长为103.74 mm,与对照相比降低60.92 mm。处理第13 天时,80%毒素粗提液处理下幼苗根长为119.14 mm,与对照相比降低了93.98 mm。

图5 枯萎病菌毒素粗提液对美洲南瓜幼苗株高、茎粗及根长的影响
2.2.2 病原菌毒素粗提液对美洲南瓜幼苗根系和叶片细胞膜透性的影响 由表3、4 可以看出,除40%毒素粗提液处理7 d 的美洲南瓜幼苗根系外,毒素粗提液浓度越大,幼苗根系或叶片的电导率越高,细胞膜透性也相对越高。处理11 d 时,80%毒素粗提液处理下,美洲南瓜幼苗根系和叶片的细胞膜透性分别达到了62.71%和62.31%,均显著高于其他浓度毒素粗提液处理,且与对照差异显著。
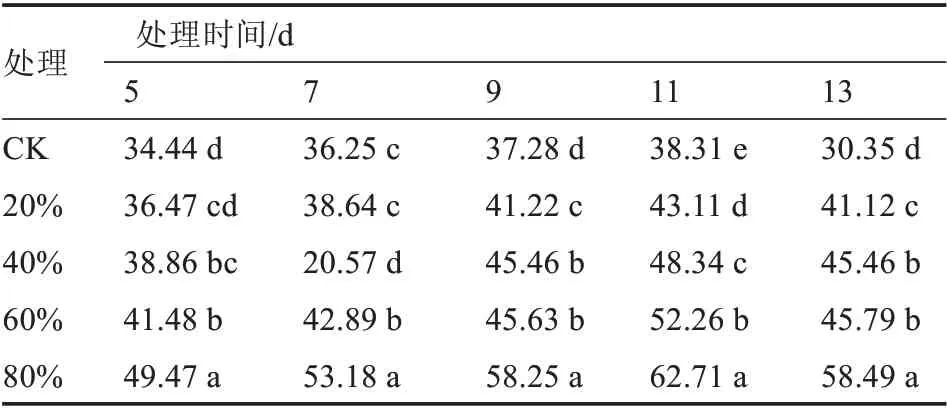
表3 枯萎病菌毒素对美洲南瓜幼苗根系细胞膜透性的影响%

表4 枯萎病菌毒素对美洲南瓜幼苗叶片细胞膜透性的影响%
2.2.3 病原菌毒素粗提液对美洲南瓜幼苗叶片丙二醛(MDA)含量的影响 由图6 可知,在各处理时间,美洲南瓜叶片中MDA 含量均呈现随毒素粗提液处理浓度的增大逐渐增高趋势,在相同处理时间时,毒素粗提液浓度越大,MDA 含量越高。处理11 d时,60%和80%毒素粗提液下的叶片MDA 含量分别为29.57 μmol·g-1和31.49 μmol·g-1,分别为对照的2.45 倍和2.61 倍,均显著高于其他浓度处理。
2.2.4 病原菌毒素粗提液对美洲南瓜幼苗叶片苯丙氨酸解氨酶(PAL)活性的影响 由图7 可以看到,随着处理时间的增加,不同浓度毒素粗提液处理的美洲南瓜叶片中PAL 活性均呈现先逐渐升高后降低的趋势,且均在11 d 时达到峰值。处理第11 天时,80%毒素粗提液处理下叶片PAL 活性最高,为84.25 U·g-1,是对照处理PAL 酶活性的2.09 倍。在相同处理天数时,毒素粗提液浓度越大,PAL 活性越高。
3 讨论与结论
尖孢镰孢菌毒素的粗提取和产毒条件的筛选,是研究枯萎病致病机制的理论基础,也是致病毒素研究中的热点[15]。最佳产毒条件的筛选,对于研究病原菌产毒至关重要,而影响病原菌产毒的关键因素是培养液的种类[18]。前人研究表明培养液不同,产毒量也不同,如向日葵黄萎病菌在Czapek 培养液培养,以获得毒素粗提液[19];香蕉枯萎病菌在Richard 培养液中产毒能力最强[20]。
除了培养液影响产毒的多少外,其他因素如培养时间、培养液的酸碱度、培养温度等对病原菌产毒也有很大的影响[21]。前人研究发现,大豆根腐病菌产毒的最适条件是在25 ℃、连续振荡培养15 d,而培养基的种类和光照影响不大[22];玉米穗腐病菌产毒的最适条件是25 ℃、pH 值为5 的Richard 培养基中培养10 d[23];玉米苗枯病菌的最佳产毒条件为25 ℃、pH 值为9 的PD 培养液、12 h 光暗交替培养10 d[24];赤霉病菌在PD 培养液中,25~30 ℃培养15 d 具有较强的产毒能力,光照和连续振荡培养有利于产毒,但pH 值对产毒影响不显著[25];27 ℃最有利于番茄枯萎病菌产毒[26]。番茄褐斑病菌最佳产毒条件为光照12 h、25 ℃、pH 值为6 时、振荡培养15 d,培养基对病原菌产毒能力影响不显著[27]。由此可知,病原物的产毒条件根据病原菌的特性不同而异,相同的病原菌产毒的条件亦存在差异,发病寄主不同,产毒量也不同。笔者研究发现,美洲南瓜枯萎病菌在Czapek 培养液中,pH 值为7 时,连续光照条件下振荡培养15 d,产生的毒素粗提液对美洲南瓜种子的胚根生长抑制率最高。
田雪亮等[28]研究发现黄瓜枯萎病菌粗毒素对黄瓜胚根生长和侧根分化均有抑制作用,且随着毒素粗提液处理浓度的升高,抑制现象越明显。黄铭慧等[29]研究发现,尖孢镰孢菌粗毒素对大豆不同抗性品种的胚根生长均有显著的抑制作用,25%的毒素粗提液明显抑制了大豆感病品种胚根的伸长和侧根的生长。笔者的研究也得到相似的研究结果,美洲南瓜枯萎病菌毒素粗提液处理能够抑制美洲南瓜幼苗根、茎的生长,且抑制程度与病原菌毒素粗提液浓度呈正相关,80%的病原菌毒素粗提液对植株的抑制效果最强。
MDA 含量的变化与细胞膜脂过氧化程度的高低呈正相关,因此,MDA 含量常被作为膜脂过氧化指标之一[30]。笔者的试验结果表明,美洲南瓜在受到枯萎病菌毒素粗提液处理时,叶片中MDA 含量上升,且毒素粗提液处理浓度越高,MDA 含量越高。说明美洲南瓜枯萎病菌产生的毒素粗提液使寄主植物细胞的质膜系统受到损伤,影响了植物正常的生理活动。80%毒素粗提液处理下,美洲南瓜幼苗根系和叶片的细胞膜透性分别达到了62.71%和62.31%,均显著高于对照,这与陈慧杰等[16]的研究结果一致。说明病原菌毒素粗提液破坏了美洲南瓜根系和叶片的细胞膜,导致组织细胞膜透性增大,对幼苗造成了一定程度的伤害。40%毒素粗提液处理第7 天,美洲南瓜幼苗根系细胞膜透性短暂降低,第9 天细胞膜透性又迅速上升,分析原因可能是美洲南瓜幼苗对毒素粗提液影响的感应略微滞后。
参与植物体内多种生理代谢过程的苯丙氨酸解氨酶(PAL)与植物防卫反应及抗病性密切相关,是衡量植物体内防卫反应的重要指标[31]。孙淑琴等[32]研究表明草坪草高羊茅叶片经草坪草褐斑病菌粗毒素液处理后,PAL 活性均有不同程度的提高,高浓度毒素处理酶活性较低,低浓度毒素处理的酶活性高。笔者的研究结果表明,随着处理时间的增加,不同浓度病原菌毒素粗提液处理下的美洲南瓜叶片中,PAL 的活性呈现先上升后下降趋势,均在11 d 时达到峰值,毒素粗提液的浓度越大,叶片中PAL 的酶活性越高,推测美洲南瓜枯萎病菌毒素在短期内可以通过提高防御酶活性,提高寄主的抗性。对于美洲南瓜枯萎病菌产生毒素的类型进行分析是笔者下一步的主要研究方向。
笔者的研究结果表明,使用pH 值为7 的Czapek 培养液,在连续光照、振荡培养15 d 的条件下,美洲南瓜枯萎病菌可以产生的毒素粗提液对美洲南瓜胚根的生长具有明显的抑制作用,并且毒素粗提液有较好的热稳定性。随着处理时间的增加,不同浓度的美洲南瓜枯萎病菌毒素粗提液可以抑制美洲南瓜幼苗的生长,增加幼苗根系和叶片的细胞膜透性和叶片MDA 含量,一定程度上提升PAL 的酶活性。研究结果可为揭示美洲南瓜枯萎病菌的致病机制提供理论基础。
——以渤海S油田为例

