公民逝世后器官捐献供肾移植中巨细胞病毒感染情况及治疗的分析
马寅锐,宋文彬,胡伟,尹利民,宋永琳,孙洵(.昆明市第一人民医院甘美医院泌尿外科,云南 昆明 65005;.昆明市第一人民医院甘美医院药学部,云南昆明 65005; 昆明市第一人民医院甘美医院检验科,云南 昆明 65005)
巨细胞病毒(cytomegalovirus,CMV)是肾移植术后主要的机会性感染病毒之一,感染后的症状和体征并不典型[1],可以在全身多处器官发生,带来相应的器官功能障碍,更对移植肾及人的长期存活带来严峻挑战。术后CMV 感染因素是较为复杂的,观察CMV 感染的表现,以及充分认识受者CMV 感染风险、CMV-DNA 及CMV-pp65 监测的必要性、与他克莫司(tacrolimus,Tac)谷浓度(C0)关系,以及是否抢先进行治疗,最大限度地为移植肾长期存活创造条件是临床医师需要关注的重点。本文总结自2018 年1 月1 日至2021 年12 月30 日期间,在本院首次行DD 异体肾移植并符合研究标准的90 例患者资料,分析DD 肾移植术后CMV 感染的临床特点,对比观察术后CMV 感染与Tac(C0)相关性、CMV-pp65 抗原血症结果与CMV-DNA 的一致性,以及预防、抢先治疗的安全性和有效性等。
1 资料与方法
1.1 一般资料及免疫诱导方案:90 例受者术前群体反应性抗体均≤3%、血清淋巴毒均阴性、CMV-DNA 及CMV-pp65 抗原血检测,供者按照DBD 流程获取相应器官。受者术后前8 周每周1 次,第9 至24 周每2 周1 次复查肝肾功能、血常规、CMV-DNA 及pp65、细胞免疫状态等。三组患者使用T 细胞多克隆抗体rATG 或巴利昔单抗诱导。三组患者术后均口服Tac〔0.05 ~0.15 mg/(kg·d)分两次口服〕+麦考酚钠肠溶片(规格:180 mg)1080 mg 分2 次口服+醋酸泼尼松维持免疫。
1.2 受者分组及纳入、排除标准:根据受者术后血CMV-DNA 结果,分为CMV 预防治疗组(A 组)40 例,其中男性26 例,年龄为17 ~58 岁,平均年龄为(39.11±11.81)岁;女性14 例,年龄23 ~50 岁,平均年龄为(32.44±8.84)岁。CMV感染抢先治疗组(B 组)共34 例,其中男性21 例,年龄11 ~57 岁,平均年龄为(38.11±12.45)岁,女性13 例,年龄为26 ~59 岁,平均年龄为(41.88±10.91)岁。全阴对照组(C 组)16 例,男性9 例,年龄24 ~55 岁,平均年龄为(47.33±11.65)岁,女性7 例,年龄32 ~46 岁,平均年龄为(39.12±9.89)岁。纳入标准A 组:在患者血中发现103≤CMV ≤105copies/ml 不伴临床症状[2],B 组[3]:CMV >105copies/ml 不伴临床症状。C 组:无CMV 感染证据及临床症状。排除标准[4]:观察期间发生失访、合并BK 病毒感染、受者CMV 病、研究资料不完善者不纳入研究。A、B 两组首次CMV 阳性时间:以受者术后第1 天开始计算,至首次出现CMV ≥103copies/ml或/和CMV-pp65(+)的时间,以天(d)计。三组患者在性别、年龄等方面比较差异无显著性(P >0.05)。本研究经医院伦理委员会批准(批准号:YLS2021-17)。
1.3 检验方法:三组患者在前8 周每周1 次,第9 至24 周每2 周1 次复查肝肾功能、血常规、CMV-DNA 及pp65、Tac(C0)、CD4+T 细胞/CD8+T细胞(Th/Ts)比值及CD4+T 细胞(Th/Ti)绝对值,上述项目由本院检验科完成。检验科通过BD Multitest 溶血素将裂解红细胞、固定、渗透一步完成,然后用SANTA 公司抗HCMV-pp65 单克隆抗体(1-L-11)及Biosharp 公司FITC 标记羊抗鼠IgG 抗体采用间接免疫荧光法检测CMV-pp65 抗原。
1.4 观察指标
1.4.1 CMV 感染特点、与首次感染时Tac(C0)、免疫诱导剂的相关性:观察各组患者CMV 感染发生时间、比例及与Tac(C0)、移植前诱导剂使用情况相关性。
1.4.2 CMV-pp65 抗原血症检测结果与CMV-DNA的一致性:观察A、B 两组患者CMV-pp65 抗原血症结果与CMV-DNA 的一致性。
1.4.3 A、B、C 三组患者的CD4+T 细胞/CD8+T 淋巴细胞(Th/Ts)比值及CD4+T 细胞(Th/Ti)绝对值计数:统计各组患者的免疫细胞计数,包括CD4+T 细胞/CD8+T 淋巴细胞(Th/Ts)比值及CD4+T 细胞(Th/Ti)绝对值。
1.4.4 经预防感染或抢先治疗后,两组患者CMV感染的变化情况:对A 组患者,根据实验室给出的内生肌酐清除率(creatinine clearance,Ccr)结果,给予盐酸缬更昔洛韦450 mg/d 或450 mg/2 d 1 次,口服3 个月或者连续2 次复查血清相关指标转阴停药,B 组患者予更昔洛韦5 ~8 mg/(kg·d),1 d 2 次静脉滴注,维持治疗2 ~3 周,观察两组患者CMV 感染的转归。
1.4.5 三组患者移植肾AR、不良反应、人肾存活、肾功能对比。
1.5 统计学方法:采用GraphPad Prism 7 软件对研究数据进行统计学分析。计量资料以均数±标准差(±s)表示,比较采用配对t 检验。计数资料比较采用配对资料卡方检验检验,应用Logistic回归分析CMV 感染的独立危险因素。多组计量资料的比较应选用F 检验,P <0.05 表示差异具有统计学意义。
2 结 果
2.1 A 组及B 组患者CMV 感染特点及与免疫诱导剂关系的对比:CMV 感染在DD 移植术后总发生率为82.22% (74/90),其中A 组发生率为44.44%(40/90),与B 组发生率为37.78%(34/90)比较(P >0.05)。发生于术后3 个月内的比例:A 组为90%(36/40),B 组为94.11%(32/34)(χ2=0.0481,P >0.05)。3 ~6 个月内的A 组感染率为10%(4/40)、B 组为5.8%(2/34)(P >0.05)。使用巴利昔单抗诱导的患者,CMV 感染发生时间为:(65.62±45.74)d,使用rATG 组为(33.06±20.11)d(t =2.9922,P <0.01)。
2.2 Tac(C0)在CMV 首次感染患者及非感染患者中的相关性分析:三组患者Tac(C0)分别为A 组为(8.95±3.17)ng/ml,B 组为(9.15±2.92)ng/ml,C 组为(8.18±1.86)ng/ml。方差分析检验结果示三组患者Tac 的C0 与是否引起CMV感染无相关性(F =0.2879,P >0.05)。
2.3 CMV-pp65 抗原血症结果与CMV-DNA 的一致性比较:受体的血样本检测,CMV-pp65 与CMV-DNA 同阴性有45 例,阴性符合率为54.9%,同阳性有27 例,阳性符合率为96.4%,总符合率为65.5%。
2.4 T 淋巴细胞亚群在各组患者中的区别(表1):CMV-pp65 抗原血症阳性的样本CD8+T 细胞(Ts/Tc)绝对值及NK 细胞绝对值均低于CMVpp65 阴性的样本,差异有统计学意义(P <0.05)。
表1 pp65 抗原检测阴性组及阳性组中淋巴细胞亚群的比较(109/L,±s)
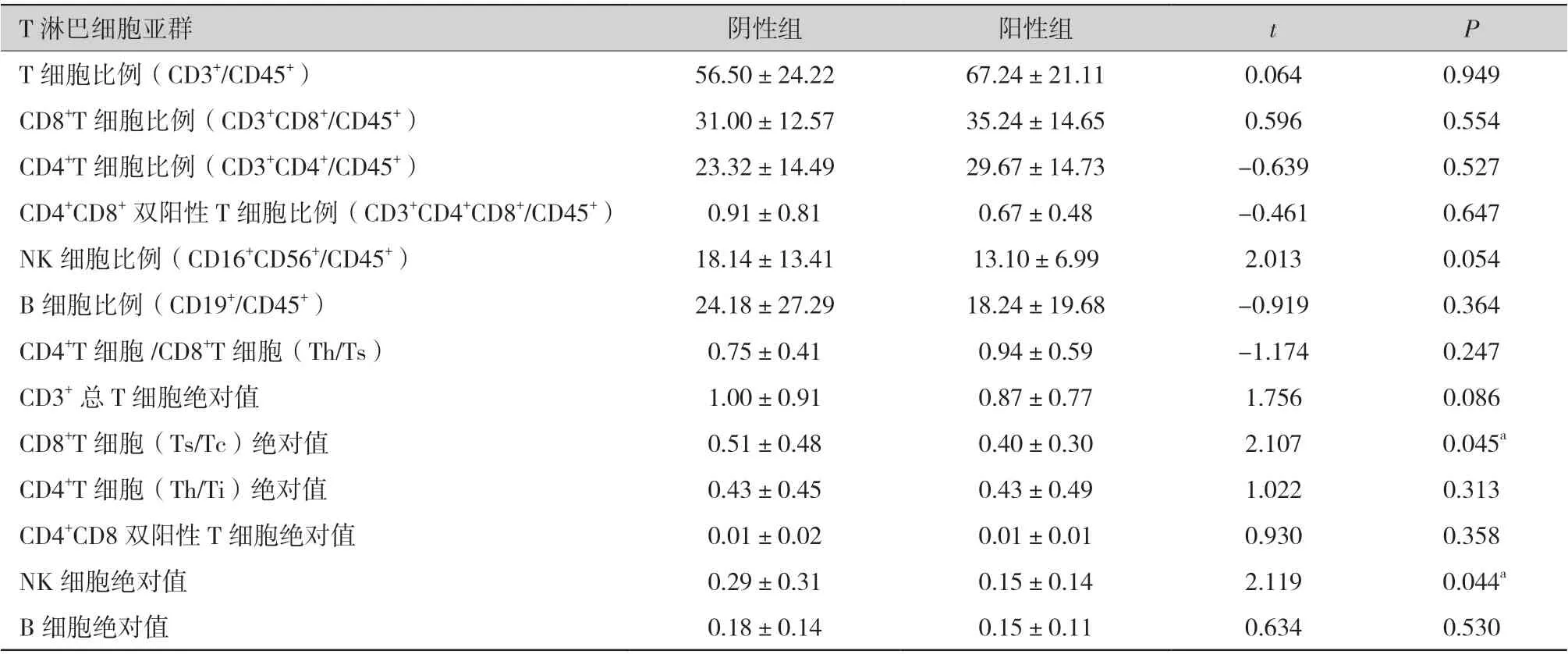
表1 pp65 抗原检测阴性组及阳性组中淋巴细胞亚群的比较(109/L,±s)
注:a 为pp65 抗原血症阳性结果与CD8+T 细胞(Ts/Tc)绝对值、NK 细胞绝对值差异有统计学意义(P <0.05),CMV-pp65 抗原血症阳性的样本CD8+T 细胞(Ts/Tc)绝对值及NK 细胞绝对值均低于pp-65 阴性的样本。
T 淋巴细胞亚群阴性组阳性组tP T 细胞比例(CD3+/CD45+)56.50±24.2267.24±21.110.0640.949 CD8+T 细胞比例(CD3+CD8+/CD45+)31.00±12.5735.24±14.650.5960.554 CD4+T 细胞比例(CD3+CD4+/CD45+)23.32±14.4929.67±14.73-0.6390.527 CD4+CD8+双阳性T 细胞比例(CD3+CD4+CD8+/CD45+)0.91±0.810.67±0.48-0.4610.647 NK 细胞比例(CD16+CD56+/CD45+)18.14±13.4113.10±6.992.0130.054 B 细胞比例(CD19+/CD45+)24.18±27.2918.24±19.68-0.9190.364 CD4+T 细胞/CD8+T 细胞(Th/Ts)0.75±0.410.94±0.59-1.1740.247 CD3+总T 细胞绝对值1.00±0.910.87±0.771.7560.086 CD8+T 细胞(Ts/Tc)绝对值0.51±0.480.40±0.302.107 0.045a CD4+T 细胞(Th/Ti)绝对值0.43±0.450.43±0.491.0220.313 CD4+CD8 双阳性T 细胞绝对值0.01±0.020.01±0.010.9300.358 NK 细胞绝对值0.29±0.310.15±0.142.119 0.044a B 细胞绝对值0.18±0.140.15±0.110.6340.530
2.5 预防或抢先治疗的预后、白细胞减少症发生率对比:A 组患者中,31 例患者(31/40)口服缬更昔洛韦达到CMV 完全转阴的目的,且在6 个月内未再复阳。剩余的9 例患者中,6 例患者予更昔洛韦250 mg 静脉滴注2 ~3 周后转阴,2 例患者在治疗后CMV 载量无明显变化,7 个月后自动转阴。1 例患者多次复阳,但移植肾存活良好,继续密切随诊。B 组患者中,32(32/34)例患者使用更昔洛韦5 ~8 mg/(kg·d)静脉滴注治疗2 ~3 周后转阴未再复发。1 例患者治疗后无好转,将Tac 转为环孢素A(ciclosporin A,CsA)维持治疗并观察,目前移植肾功能稳定。另1 例患者反复出现治疗后CMV 复阳,时间超过半年,后发现其感染李斯特菌,使用磺胺治疗后痊愈,且CMV 持续阴性。A、B 两组患者治疗期间白细胞减少症、移植肾功能等见表2。
2.6 三组受者人、肾存活率,移植肾功能及AR发生率:AR 的发生率A、B、C 三组分别为5%(2/40)、8.82%(3/34)、0%。A、C 组人、肾存活率均100%,B 组人存活率100%,肾存活率97.05%(33/34),三组患者各时间点统计血肌酐(serum creatinine,Scr)差异无统计学意义(P >0.05)。
3 讨 论
CMV 感染是肾移植术后最常见的并发症之一[5-7],免疫功能正常的宿主中感染通常是不致病的,但却是器官移植受者发病和死亡的主要原因之一。在相关的研究中,约40%~100%的可发生主动感染[8],本研究CMV 感染在DD 移植术后总发生率为82.22%(74/90),研究结果较吻合,降低CMV 感染率并及时有效地处置相关并发症是移植后关注的重点。目前已知的CMV 感染高危因素有:① 供者阳性/受者阴性(D+/R-)是术后患者CMV 感染高危因素之一[9]。② 移植受者长期内环境代谢紊乱,免疫状况不佳,并经历长期透析、心力衰竭等因素影响[10]。③ 供体经历ICU 治疗及维护后面临多重感染风险,导致受者CMV 易感等[11]。本研究结果:术后3 个月内是CMV 感染的高发期(表2),在该时间段内,使用巴利昔单抗诱导的受者CMV 感染发生时间为(65.62±45.74)d,使用rATG 组为(33.06±20.11)d(t =2.992,P <0.01),这对于评估术后预防或抢先治疗是一个重要的参考,但CMV 易感因素中并不包括口服Tac(表2)。
在CMV 感染诊断上,实验室主要依靠CMVDNA、CMV-IgG、CMV-IgM 等方法[12],这其中CMV DNA 是首选的诊断测试方法,而pp65 是由CMV UL 83 基因编码的、分子量为65 kd 的被膜蛋白,是CMV 活动性复制时产量最多的病毒蛋白。CMV-pp65 抗原血症检测的方法能够早期检测CMV,甚至在感染后3 h、DNA 合成开始之前就出现在细胞质中[13],对肾移植后CMV 活动性感染的诊断及指导临床治疗具有重要价值。本研究中,CMV-pp65 与CMV-DNA 同阴性有45 例,阴性符合率54.9%,同阳性有27 例,阳性符合率96.4%,总符合率65.5%,提示将CMV-pp65 抗原的检测与CMV DNA 检测评估相结合,能够更及时、准确诊断CMV 感染为临床治疗提供指导[14]。另外,CMV感染与急性排斥反应和慢性异体移植物损伤相关,但是CMV 感染与淋巴细胞亚群之间的具体关系仍未完全清楚[15]。有研究表明[16]:CMV 的抗原可以刺激CD8 T 淋巴细胞进行增值,当CD8 T 淋巴细胞增值后,CD4+T 细胞/CD8+T 细胞(Th/Ts)比值可能产生倒置或者直接表现为CD8 T 淋巴细胞计数绝对值增加,从而实现依据T 淋巴细胞亚群用于肾移植术后对排斥监测、CMV 感染、免疫状态评估等。本研究的结果显示pp-65 抗原血症结果与CD8+T 细胞(Ts/Tc)绝对值、NK 细胞绝对值差异有统计学意义(P <0.05,表1),CMV pp-65抗原血症阳性的样本CD8+T 细胞(Ts/Tc)绝对值及NK 细胞绝对值均低于pp65 阴性的样本,研究认为以CD8+T 细胞(Ts/Tc)绝对值及NK 细胞绝对值为指标,辅助判断CMV 在体内与免疫系统的作用表现,能帮助术后CMV 风险分层和管理,这与相关文献[17]的研究也较为吻合。针对本研究与其他研究[18]在CD8 T 淋巴细胞计数并不一致的结果,一方面考虑个体之间在淋巴细胞亚群有区别,另一方面也有研究[19-20]证实CD8 T 淋巴细胞计数变化为低于非感染组,且与预后有相关性。
治疗上,按诊疗规范建议[21]:缬更昔洛韦是公认的抗CMV 感染的一线用药,预防剂量为900 mg,每日1 次,治疗剂量为900 mg,每日2 次口服,但价格昂贵,我中心随访发现仅有少数患者有经济能力继续遵嘱进行治疗,参照国内其他中心经验[2],我中心将缬更昔洛韦减半量为450 mg/d口服,观察A 组31 例患者(31/40)达到CMV 完全转阴的目的,且在6 个月内未再复阳,剩余的9 例患者中,6 例患者予更昔洛韦治疗2 ~3 周后转阴,2 例患者在治疗后CMV 载量无明显变化,7 个月后自动转阴。1 例患者多次复阳,移植肾存活良好,继续密切随诊。按照指南该例患者考虑更昔洛韦耐药,应行CMV 基因检测,必要时调整药物为咪唑立宾等,鉴于移植肾功能稳定,暂未进行更换药物。B 组患者因病毒载量较高,极易向着CMV 病进展,遂将32 例患者使用更昔洛韦5 ~8 mg/(kg·d)静脉滴注治疗2 ~3 周后转阴未再复发。在生物利用度上,口服缬更昔洛韦900 mg/d和更昔洛韦5 mg/(kg·d)相仿,本研究予更昔洛韦8 ~10 mg/(kg·d)静脉滴注,效果良好,常见的不良反应骨髓抑制发生率组间对比无差异(表2,P >0.05)。有研究提示CMV 感染会引起AR 发生率升高[22],但统计各组AR 发生率无统计学区别(P =0.727),且半年内受者移植肾存活良好,Scr 统计也无区别(表2),本研究结果可证明按照病毒载量以及危险因素,分别予缬更昔洛韦普遍预防及静脉滴注更昔洛韦抢先治疗效果良好,不良反应少。
综上,肾移植术后CMV 感染率约为82.22%(74/90),发生因素复杂,但与Tac 无相关性,将CMV-pp65 抗原检测与CMV-DNA 检测评估相结合,能够更及时、准确诊断CMV 感染并为临床治疗提供指导,低剂量的缬更昔洛韦及标准剂量更昔洛韦用于DD 异体肾移植术后预防及抢先治疗治疗效果良好,不良反应少。本研究存在以下不足:临床观察病例数较少,观察时间相对较短,未来仍需不断追踪研究新入组患者资料。

