SNP-9对鱼藤酮所致帕金森病细胞模型的作用及机制研究
黄志欢,梁 潇,高向东,陈 松
(中国药科大学生命科学与技术学院江苏省生物药物成药性研究重点实验室,南京 211198)
帕金森病(Parkinson's disease,PD)是仅次于阿尔茨海默病的全球第二大神经退行性疾病。中脑黑质多巴胺能神经元的丢失和错误折叠的α-突触核蛋白(α-synuclein,α-syn)异常聚集形成的路易小体[1-2],是PD 的典型病理特征。PD 患者临床上表现为运动性障碍和非运动性障碍。运动性障碍主要包括运动迟缓、肌肉强直、静止性震颤[3],非运动性障碍包括焦虑、认知障碍、失眠等[4-5],这些症状严重影响PD 患者的生活质量。当前对于PD的发病机制尚未明确,可能涉及到神经炎症、氧化应激、线粒体功能障碍、接触毒性物质等[6],以及SNCA、PINK1、PRKN、LRRK2、GBA等基因突变[7]。随着全球人口老龄化的加剧,PD 将会给公共卫生、家庭和经济带来更加沉重的负担,开发有效的PD 治疗手段受到越来越多的关注。课题组前期研究发现丝素蛋白水解物(silk fibroin hydrolysate,SFH)具备神经元保护功能[8-9]。通过对SFH进一步研究,课题组获得了多肽SNP-9。本文旨在前期研究基础上,对SNP-9 抗PD 的作用及机制开展初步研究。
本研究使用鱼藤酮损伤SH-SY5Y 细胞作为PD 细胞模型,探讨鱼藤酮作用下SNP-9 对PD 细胞模型细胞活力和凋亡的影响,并进一步考察SNP-9对PD 细胞模型活性氧(reactive oxygen species,ROS)水平,以及酪氨酸羟化酶(tyrosine hydroxylase,TH)、α-syn 和凋亡相关蛋白Bax/Bcl-2 的影响,为SNP-9防治PD的研究提供实验基础。
1 材 料
1.1 试 剂
DMEM 高糖培养基、胎牛血清(美国Gibco 公司)、胰蛋白酶(美国Sigma 公司);SNP-9(序列:GSGAGAGSGAGAGSGAGSGSGA,纯度:95.2%,中国金斯瑞生物科技有限公司);鱼藤酮(美国MCE 公司);氨苄青霉素、链霉素、MTT(中国Biosharp 公司);ROS 检测试剂盒、BCA 蛋白浓度检测试剂盒、Hoechst/PI 细胞凋亡检测试剂盒、RIPA 裂解液、SDS-PAGE 蛋白上样缓冲液(5 ×)(中国碧云天生物技术有限公司);胎牛血清白蛋白(德国Bio-Froxx 公司);增强型ECL 发光液、PVDF 膜、蛋白酶抑制剂、磷酸酶抑制剂(美国Millipore 公司);蛋白样Marker(美国Thermo 公司);TH 抗体、Bax 抗体、Bcl-2抗体、β-actin抗体(中国Abclonal公司);α-syn抗体(美国BD Biosciences 公司);山羊抗兔IgG、山羊抗鼠IgG(美国Cell Signaling Technology 公司);其余试剂均为国产市售分析纯。
1.2 仪 器
细胞培养箱、高速冷冻离心机、全波长酶标仪(美国Thermo 公司);倒置荧光显微镜(日本Olympus 公司);电泳仪、转膜仪(美国Bio-Rad 公司);化学发光成像系统(中国Tanon 公司);流式细胞仪(美国BD Biosciences公司)。
1.3 细 胞
神经母细胞瘤细胞SH-SY5Y(ATCC)。
2 方 法
2.1 细胞培养及诱导分化
将SH-SY5Y 细胞复苏后,置于含有10%胎牛血清的DMEM 培养基中,于含5% CO2的细胞培养箱中37 ℃过夜培养。待细胞汇合度达到80%,进行细胞传代。待SH-SY5Y 细胞贴壁后,将细胞培养基更换为含1%胎牛血清和反式维甲酸(终浓度为10 μmol/L)的DMEM 培养基,培养3 d,将细胞培养基更换为含1%胎牛血清和十四烷酰佛波醇乙酸酯(终浓度为80 nmol/L)的DMEM 培养基,继续培养3 d,即完成诱导分化。
2.2 鱼藤酮致SH-SY5Y细胞损伤模型的建立
使用胰酶消化SH-SY5Y 细胞后,按照每毫升4 × 104个细胞的密度接种至96 孔板,每孔体积为100 μL。10 h 后设置不同浓度鱼藤酮(0.05、0.1、0.2、0.4、0.8 μmol/L)与SH-SY5Y细胞共孵育24 h,通过MTT 法检测细胞活力:每孔加入5 mg/mL MTT 10 μL,37 ℃孵育4 h,舍弃培养基,每孔加入二甲亚砜150 μL,置于摇板机上350 r/min 摇板10 min。使用全波长酶标仪,设置570 nm 为检测波长,630 nm 为参比波长,检测各孔吸收度,计算细胞活力。
2.3 SNP-9 对鱼藤酮致SH-SY5Y 细胞PD 模型细胞活力的影响
细胞培养及铺板同“2.2”项。以0.1 μmol/L作为鱼藤酮造模损伤浓度,分别设置加入鱼藤酮和不加鱼藤酮两种条件。以含1%胎牛血清的DMEM 培养基设置不同浓度的SNP-9(1、2、4、8 μmol/L),与细胞孵育24 h 后,通过MTT 法检测各组细胞活力。
2.4 Hoechst/PI 双染法检测鱼藤酮及SNP-9 对SH-SY5Y细胞凋亡的影响
从培养箱中取出状态良好的SH-SY5Y 细胞,胰酶消化后按照每毫升4×105个细胞的密度接种至6 孔板,置于5% CO2的细胞培养箱中37 ℃过夜培养。次日设置实验组别:空白对照组、SNP-9(4 μmol/L)组、鱼藤酮(0.1 μmol/L)组、鱼藤酮(0.1 μmol/L)+ SNP-9(4 μmol/L)组。造模及SNP-9干预24 h后,舍弃培养基,使用PBS润洗2次。在各孔中加入含有7 mmol/L Hoechst 的DMEM 培养基1 mL,置37 ℃细胞培养箱中孵育25 min。舍弃培养基,使用PBS 润洗细胞2 次,在各孔中加入含有2 mmol/L PI 的DMEM 培养基1 mL,置于室温中避光孵育15 min。孵育结束,使用PBS 润洗细胞3次,在各孔中加入无血清的DMEM 培养基1 mL,于倒置荧光显微镜下观察检测红色和蓝色荧光,考察细胞凋亡情况。
2.5 DCFH-DA 探针检测鱼藤酮及SNP-9 对SHSY5Y细胞ROS水平的影响
细胞培养、铺板、分组同“2.4”项。造模及SNP-9 干预24 h 后,舍弃培养基,加入胰酶消化细胞,收集细胞并将细胞转移至EP 管中,使用离心机设置1 000 r/min,离心5 min 收集细胞。离心完毕,舍弃上清液,加入含有10 μmol/L DCFH-DA 的DMEM 培养基1 mL,置于37 ℃细胞培养箱中避光孵育30 min,其间隔3 min 颠倒混匀1 次。孵育结束,使用离心机设置1 000 r/min,离心5 min,舍弃上清液,加入PBS 润洗3 次。使用筛网过滤后,通过流式细胞仪检测各组别胞内ROS水平。
2.6 Western blot 检测鱼藤酮及SNP-9 对SHSY5Y细胞TH、α-syn、Bax、Bcl-2水平的影响
细胞培养、铺板、分组同“2.4”项。造模及SNP-9干预24 h后,提取细胞总蛋白。舍弃细胞培养基,使用PBS 润洗细胞3 次后,在每个孔中加入RIPA裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂)80 μL,使用细胞刮刀刮下细胞,转移细胞至EP 管中,放置于冰上裂解30 min,每3 分钟涡旋1 次。使用离心机设置条件为4 ℃、12 000 r/min,离心20 min。离心结束后收集上清液并记录体积。通过BCA 法检测各组别蛋白浓度,并调整为相同浓度,加入1/4 体积的5 × 上样缓冲液,水浴加热10 min。配制SDS-PAGE 胶进行80 V 恒压电泳。电泳完毕将SDS-PAGE 胶取出置于PVDF 膜上,300 mA 恒流湿法转膜。取出PVDF 膜,置于5%BSA 中封闭2 h。封闭结束,使用TBST 洗膜5 次,孵育TH、α-syn、Bax、Bcl-2 一抗,于4 ℃放置过夜。次日取出PVDF 膜,使用TBST 洗膜5 次,加入对应的山羊抗兔二抗或山羊抗鼠二抗孵育2 h,孵育结束,使用TBST 洗膜5 次,加入ECL 发光液进行成像。
2.7 统计分析
所有实验数据使用GraphPad Prism 8.0 软件进行统计分析,实验结果表示为±s,采用Oneway ANOVA 进行组间分析。P< 0.05 代表具有显著性差异。
3 结 果
3.1 鱼藤酮损伤SH-SY5Y细胞模型的建立
不同浓度鱼藤酮与SH-SY5Y 细胞共孵育24 h后,MTT 法检测细胞活力。结果如图1 所示,鱼藤酮对SH-SY5Y 细胞活力的损伤具有浓度依赖性。对比空白对照组,0.1 μmol/L鱼藤酮处理组细胞活力降低约30%,选择该浓度作为鱼藤酮造模损伤浓度。

Figure 1 Effects of different concentrations of rotenone on SH-SY5Y cell viability (± s, n = 6)**P < 0.01, ***P < 0.001 vs control group
3.2 单独给药SNP-9 对SH-SY5Y 细胞活力的影响
通过含1%胎牛血清的DMEM 培养基设置不同浓度SNP-9与SH-SY5Y细胞共孵育24 h后,MTT法检测细胞活力。结果如图2所示,对比空白对照组,SNP-9 单独给药组细胞活力无显著变化,说明单独给药不同浓度SNP-9 对SH-SY5Y 细胞活力无显著影响。
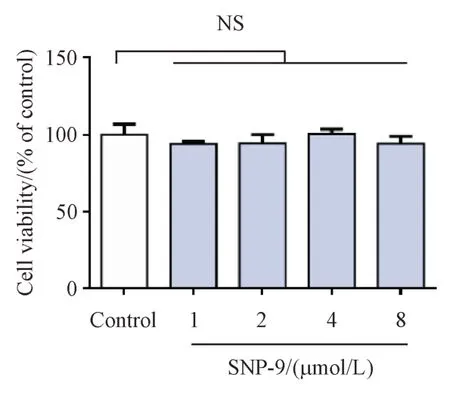
Figure 2 Effects of different concentrations of SNP-9 on SH-SY5Y cell viability (± s, n = 6)NS: No significance
3.3 SNP-9 对鱼藤酮损伤SH-SY5Y 细胞活力的影响
0.1 μmol/L 鱼藤酮及不同浓度SNP-9 与SHSY5Y 共孵育24 h 后,MTT 法检测细胞活力。结果如图3 所示,对比空白对照组,鱼藤酮模型组细胞活力显著降低。对比鱼藤酮模型组,2、4、8 μmol/L SNP-9 可显著缓解鱼藤酮诱导的SH-SY5Y 细胞活力下降。最后选择4 μmol/L 作为SNP-9 的给药干预浓度开展进一步研究。
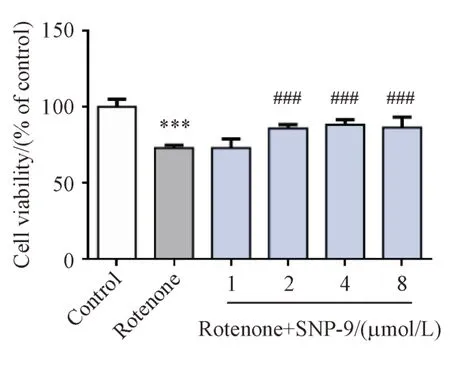
Figure 3 Effects of rotenone and SNP-9 on SH-SY5Y cell viability(± s, n = 6)***P < 0.001 vs control group; ###P < 0. 001 vs rotenone group
3.4 SNP-9 对鱼藤酮损伤SH-SY5Y 细胞凋亡的影响
实验分组为空白对照组、SNP-9(4 μmol/L)组、鱼藤酮(0.1 μmol/L)组、鱼藤酮(0.1 μmol/L)+SNP-9(4 μmol/L)组。鱼藤酮及SNP-9 与SH-SY5Y细胞孵育24 h 后,进行Hoechst/PI 双染。结果如图4 所示,对比空白对照组,鱼藤酮模型组细胞凋亡水平增加。对比鱼藤酮模型组,SNP-9给药能够减少鱼藤酮诱导的PI阳性细胞水平。实验结果证明SNP-9能够缓解鱼藤酮导致的异常细胞凋亡。
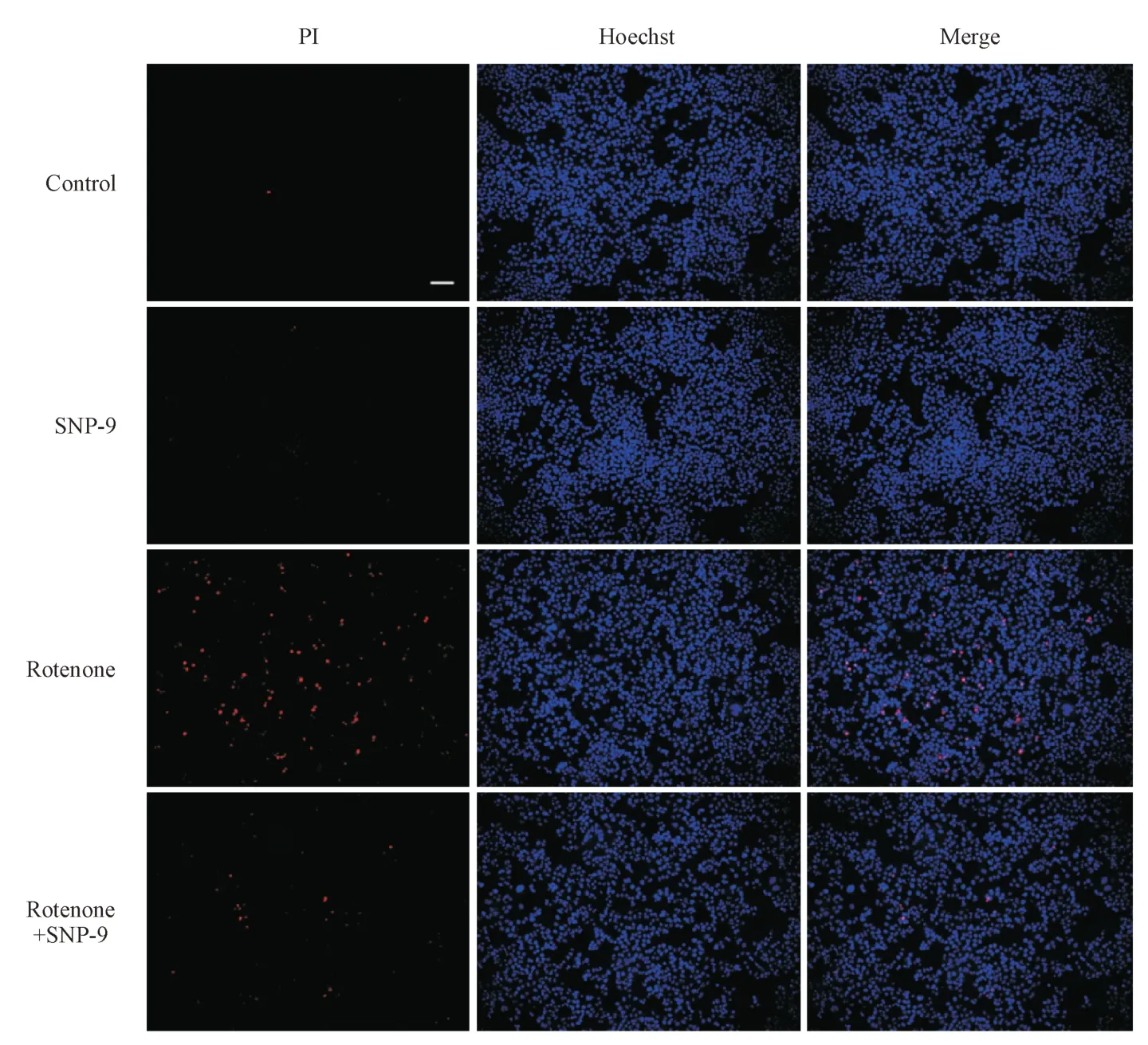
Figure 4 Effects of SNP-9 and rotenone on apoptosis in SH-SY5Y cells (Scale bar, 100 μm)
3.5 SNP-9 及鱼藤酮对SH-SY5Y 细胞胞内ROS水平的影响
实验分组同“3.4”项。鱼藤酮和SNP-9 给药干 预SH-SY5Y 细 胞24 h 后,通 过DCFH-DA 探 针结合流式细胞术检测细胞胞内ROS 水平。结果如图5 所示,对比空白对照组,鱼藤酮处理使SHSY5Y 细胞胞内ROS 水平显著升高。对比鱼藤酮模型组,SNP-9 给药干预后ROS 水平显著降低,说明SNP-9 可缓解鱼藤酮诱导的ROS 水平异常。实验结果证明SNP-9 具有缓解PD 细胞模型中氧化应激的作用。
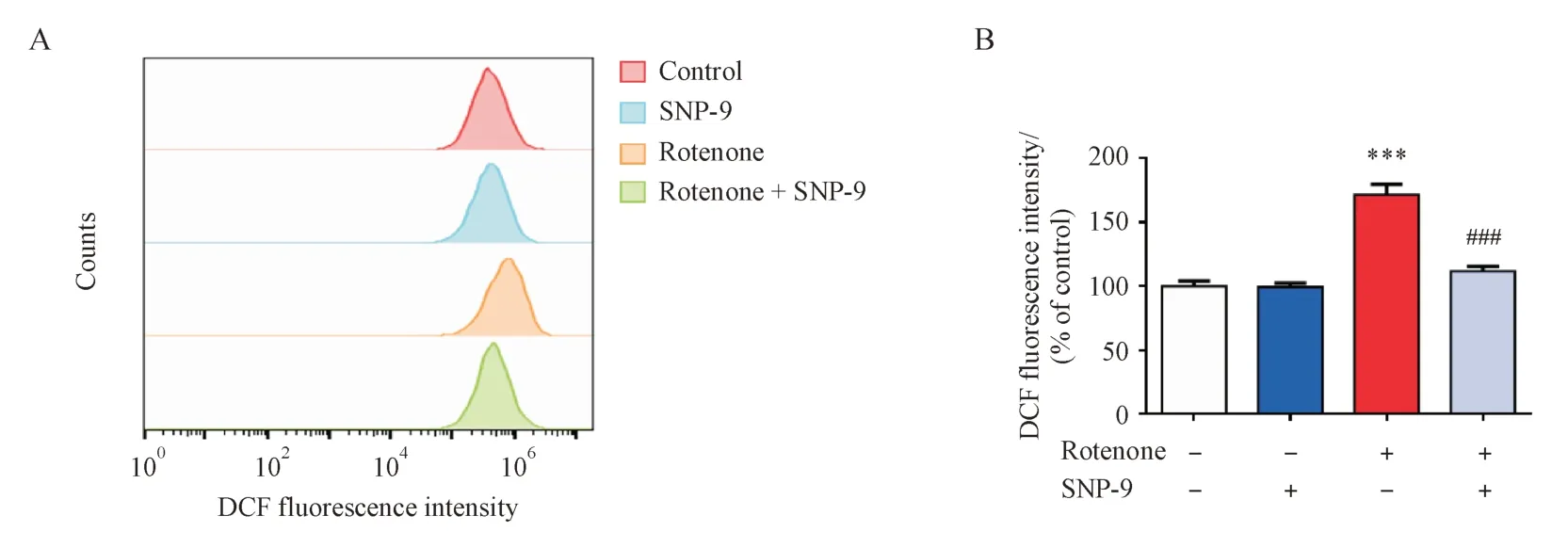
Figure 5 Effects of SNP-9 and rotenone on the ROS levels in SH-SY5Y cells (± s, n = 3)A: Detection of ROS levels in SH-SY5Y cells by flow cytometry; B: Quantitative analysis of ROS levels***P < 0.001 vs control group; ###P < 0. 001 vs rotenone group
3.6 SNP-9及鱼藤酮对SH-SY5Y 细胞TH 和α-syn水平的影响
实验分组同“3.4”项。鱼藤酮造模和SNP-9给药干预SH-SY5Y 细胞24 h 后,提取细胞总蛋白,Western blot 检测细胞TH、α-syn 水平。结果如图6显示,对比空白对照组,鱼藤酮模型组细胞TH 水平显著降低,α-syn 水平则显著升高。对比鱼藤酮模型组,SNP-9 给药干预后缓解了TH 水平的异常降低和α-syn 水平的异常升高。Western blot 结果证明SNP-9能够缓解鱼藤酮诱导的PD病理。
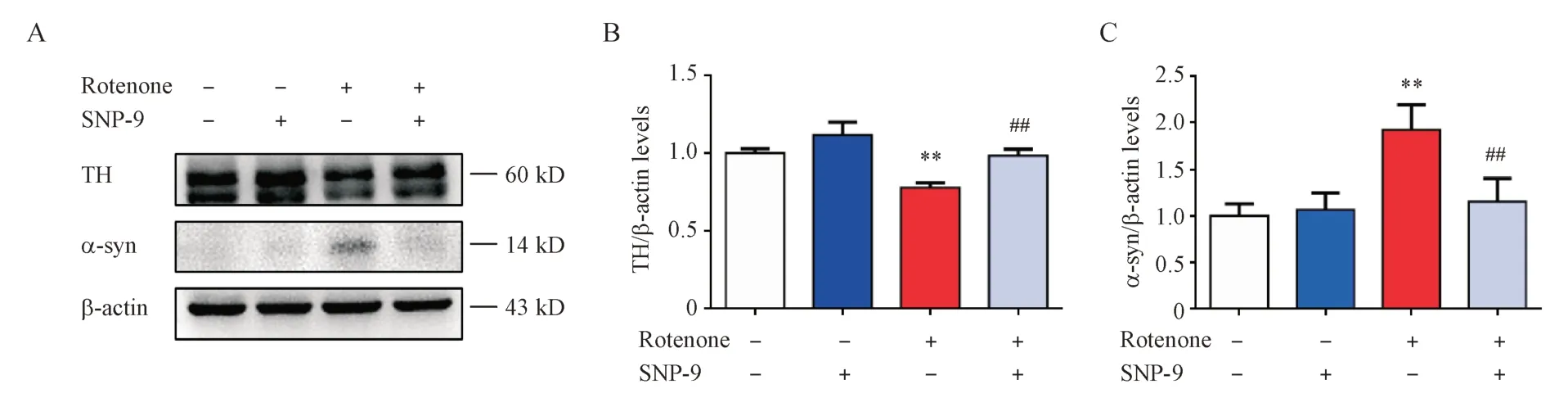
Figure 6 Effects of SNP-9 and rotenone on the levels of tyrosine hydroxylase (TH) and α-syn in SH-SY5Y cells (± s, n = 3)A: Levels of TH and α-syn detected by Western blot; B, C: Quantitative analysis of the levels of TH and α-syn**P < 0.01 vs control group; ##P < 0.01 vs rotenone group
3.7 SNP-9 及鱼藤酮对SH-SY5Y 细胞Bax、Bcl-2蛋白水平的影响
实验分组同“3.4”项。鱼藤酮造模和SNP-9给药干预SH-SY5Y 细胞24 h 后,提取细胞总蛋白,Western blot检测细胞凋亡相关蛋白Bax和Bcl-2的水平。结果如图7 所示,对比空白对照组,鱼藤酮模型组细胞Bax/Bcl-2显著增加。对比鱼藤酮模型组,SNP-9 给药干预显著缓解Bax/Bcl-2 的异常增加。实验结果表明SNP-9 可能通过调控凋亡相关通路中的Bax/Bcl-2,进而发挥神经保护作用。
4 讨 论
PD具有复杂的发病机制,目前对于PD的发病原因尚未完全明确。氧化应激是PD 发病过程中的关键病理事件[10-11]。氧化应激源于细胞内氧化与抗氧化作用的失调,进而造成ROS 的累积。过量的ROS 造成细胞膜脂质、蛋白质和核酸氧化损伤,从而破坏神经元的结构完整性,造成神经元信息传递受损[12],提示氧化应激可能与多巴胺能神经元的退化密切相关。线粒体作为细胞的能量工厂,对于能量生成、ROS 产生、细胞凋亡的调节至关重要[13]。鱼藤酮是一种线粒体电子传递链复合物I 的抑制剂,能够造成多巴胺神经元α-syn 聚集[14],并且导致ROS 的过度生成,引起多巴胺能神经元的氧化应激[15],是模拟PD 病理常用的神经毒性分子[16-17]。SH-SY5Y 细胞经过分化后能够提高多巴胺合成限速酶TH 的表达水平,并增加细胞对神经毒性分子的敏感性[18-19]。因此,本研究通过鱼藤酮损伤分化后的SH-SY5Y 细胞建立模拟PD 病理的细胞模型,考察SNP-9 对PD 细胞模型的作用和机制。
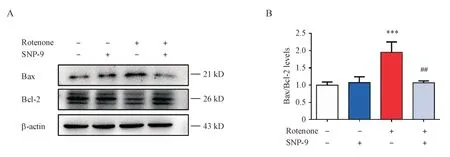
Figure 7 Effects of SNP-9 and rotenone on the levels of Bax and Bcl-2 in SH-SY5Y cells (± s, n = 3)A: Levels of Bax and Bcl-2 detected by Western blot; B: Quantitative analysis of the levels of Bax/Bcl-2***P < 0.001 vs control group; ##P < 0. 01 vs rotenone group
细胞凋亡可能参与了神经退行性疾病的发生发展,其中线粒体介导的细胞凋亡途径,抑凋亡蛋白(Bcl-2和Bcl-xL)和促凋亡蛋白(Bax和Bak)的平衡起着关键作用[20]。抑制线粒体介导的凋亡可能对神经退行性疾病具有保护作用[21]。在本研究中,SNP-9可能通过影响凋亡相关蛋白Bax/Bcl-2信号通路,减少鱼藤酮诱导的SH-SY5Y 细胞凋亡和ROS 水平,缓解TH 和α-syn 水平异常。本研究为SNP-9应用于治疗PD提供实验依据。

