乙酰基二肽-1鲸蜡酯的皮肤抗衰老作用及其机制
杨甲丽,贺升升,柯 慧,杨 珊,王喆堃,张兴江,王 攀,宗凯乐,黄 庆,吴建新
(中国药科大学中药学院,南京 211198)
衰老表现为细胞和组织的功能随着时间依赖性下降[1-2]。皮肤作为机体外在器官,其表象在一定程度上反映整个机体的状态,是判断衰老程度的直观参考指标[3]。皮肤衰老是多方面综合作用的结果,包括内源性因素和外源性因素[4]。外源性衰老主要受温度、湿度、压力、睡眠、吸烟和紫外线等的影响[5],其中,超过80%的面部老化由紫外线照射所致[6]。在紫外线的长期照射下,皮肤容易出现粗糙、皱纹、色素沉着、干燥等衰老表型[7-8]。
紫外线中长波紫外线(UVA)的穿透力较强可到达真皮层,引起真皮结缔组织的改变[9]。紫外线对皮肤的影响之一是活性氧(reactive oxygen species,ROS)的产生。ROS 能激活NF-κB 和MAPK 信号通路,促进AP-1 和MMPs 的表达,从而诱导ECM的降解,加速皮肤老化。同时,衰老发生时,ATM和ATR 可以阻断p62依赖的自噬降解,促进NF-κB的激活和SASP 的分泌[10-11]。研究表明,自噬是衰老过程的关键参与者,抑制自噬会导致过早衰老,增加自噬可延缓衰老并增加寿命[12]。雷帕霉素、白藜芦醇、亚精胺和二甲双胍等化合物可以通过激活自噬起到延缓衰老的作用。
乙酰基二肽-1 鲸蜡酯(acetyl dipeptide-1 cetyl ester,AD-1)是二肽Tyr-Arg 的衍生物,有减轻和收缩肌肉纤维的特性[13]。AD-1 具有α-MSH 类似活性,可以通过调节NF-κB 干预炎症反应的发生[14-15],目前被广泛用于敏感肌化妆品中,主要通过减少皮肤炎症和改善皮肤屏障发挥作用[16]。然而,AD-1在抗衰老领域缺乏系统科学的研究,也未见其对UVA 诱导的与自噬相关的皮肤光老化影响的报导。
因此,本研究着重探讨了AD-1 对UVA 照射的大鼠原代皮肤成纤维细胞(rat dermal fibroblasts,RDFs)的自噬指标、ROS 含量及胶原合成的影响。结果表明,AD-1可能通过激活细胞自噬、降低ROS含量和促进胶原合成来缓解UVA诱导的光老化。
1 材 料
1.1 试 剂
胎牛血清(北京全式金生物技术有限公司);DMEM 培养基、胰蛋白酶(浙江美森生物科技有限公司);二苯基四氮唑溴盐(methyl thiazolyl tetrazolium,MTT)、ROS 检测试剂盒、β-半乳糖苷酶活性检测试剂盒(北京索莱宝科技有限公司);RIPA 细胞裂解液、BCA 蛋白浓度检测试剂盒、一抗二抗稀释液、HRP 标记的山羊抗兔IgG(上海碧云天生物技术有限公司);RNA-easy Isolation Reagent、4 ×Hi ScriptⅡq RT Super MixⅡ、5 × Hi ScriptⅡq RT Super Mix Ⅱ、2 × Cham Q Universal SYBR qPCR Master Mix(南京诺唯赞生物技术有限公司);4 ×蛋白上样缓冲液、Biostep™ 预染蛋白Marker、蛋白酶和磷酸酶抑制剂、ECL 试剂盒(上海天能科技有限公司);β-actin 抗体、LC3B 抗体、p62 抗体(美国Santa Cruz 公司)、Col1 抗体、p21 抗体(英国Abcam公司)、p53 抗体(美国Cell Signaling Technology 公司)、p16 抗体(美国Thermo 公司);HRP 标记的山羊抗鼠IgG(安徽Biosharp 公司);细胞自噬染色检测试剂盒(上海源叶生物科技有限公司);AD-1(山东济肽生物科技有限公司);其余试剂均为市售分析纯。
1.2 仪 器
二氧化碳细胞培养箱、高速冷冻离心机(美国Thermo 公司);UVA 灯管(荷兰Philips 公司);酶标仪(美国Molecular Devices 公司);电泳仪、转膜仪、多功能凝胶成像系统(上海天能科技有限公司);实时荧光定量PCR 分析仪(杭州博日科技股份有限公司);倒置荧光显微镜(广州明美光电技术有限公司);流式细胞仪(美国Beckman公司)。
1.3 动 物
SPF 级1 ~ 3 d SD 乳鼠购自上海市计划生育科学研究所,合格证号:SCXK(沪)2018-0006。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 抗氧化活性测定
通过建立PTIO 反应体系评价AD-1 的体外抗氧化活性。使用PBS 溶液将AD-1 配制成不同质量浓度的待测溶液。随后各取不同浓度待测溶液100 μL 和500 μg/mL PTIO 溶液100 μL 于96 孔微孔板中混匀,37 ℃避光处静置2 h,使用酶标仪检测560 nm 处吸光度。每组实验重复3 次,以50 μg/mL 抗坏血酸(VC)为对照品,抗氧化活性测定结果以PTIO 自由基清除活性表示,计算公式如下:PTIO 自由基清除活性(%) = [1−(Asample−Ablank)/(Acontrol−Ablank)] × 100。
2.2 抗糖基化活性测定
通过建立牛血清白蛋白(BSA)-果糖模拟反应体系评价AD-1 对非酶糖基化终末产物(AGEs)的抑制作用。将不同浓度待测溶液70 μL 分别与果糖溶液70 μL 混合,37 ℃孵育2 h 后加入BSA 溶液70 μL混匀,置于37 ℃培养箱孵育6 d,反应结束后在激发波长370 nm 和发射波长440 nm 条件下测定待测样品的荧光强度。每组实验重复3次,以氨基胍盐酸盐(AG)为阳性对照,抗糖基化活性以糖基清除率表示,计算公式如下:糖基抑制率(%) =[1−(FA−F0)/FB] × 100,式中FA为待测样品组荧光强度、FB为空白组的荧光强度、F0为样品对照组的荧光强度。
2.3 UVA诱导RDFs光老化模型的建立
参考文献方法[17-19]并略加修改,建立了UVA诱导RDFs 光老化模型。首先采用实验室成熟方法从SD 乳鼠中分离得到RDFs,使用培养至1-3 代的RDFs 进行实验。随后将RDFs 以每孔8 × 103个密度接种于96 孔板中,待细胞铺满板底达80%融合,使用1.50 J/cm2UVA 剂量照射3 次,每次间隔24 h,每次照射完成后置于含有2%胎牛血清、1%青霉素-链霉素DMEM 培养体系中培养。3次UVA照射后即为建立的光老化模型。
2.4 AD-1对UVA诱导RDFs细胞光老化的影响
分别在UVA 照射和不照射RDFs的情况下,添加不同浓度的AD-1,孵育24 h 后,通过MTT 法测定细胞的增殖情况[20]。
2.5 ROS含量测定
细胞内活性氧含量采用ROS 检测试剂盒测定。实验前使用PBS 洗涤细胞1 次,按1∶1 000 稀释DCFH-DA至终浓度为10 μmol/L,每孔加入稀释好的DCFH-DA 1 mL,37 ℃孵育30 min 后,用无血清培养液洗涤3 次,收集细胞,D-PBS 重悬后采用流式细胞仪检测(λEx= 488 nm;λEm= 530 nm)细胞内的活性氧。
2.6 RT-qPCR检测细胞中目标基因mRNA水平
取70% ~ 80%汇合度的RDFs,以每毫升8 ×104个细胞密度均匀接种于6孔板中,每孔2 mL,分为空白组、模型组、模型+给药组。按“2.3”项进行细胞模型构建,给药后,使用RNA-easy Isolation Reagent提取细胞总RNA,并对RNA 进行定量。使用4 × Hi ScriptⅡq RT Super MixⅡ、5 × Hi ScriptⅡq RT Super MixⅡ将获得的RNA 逆转录成cDNA。使用2 × Cham Q Universal SYBR q PCR Master Mix在Gene-9660 系统上进行实时 PCR 测定。所使用的引物序列如下:

Table 1 Primers for RT-qPCR
2.7 Western blot法检测细胞中目标蛋白水平
在6 孔板中最后一次UVA 照射结束给药24 h后,PBS清洗2次,每孔加RIPA裂解液90 μL置于冰上裂解30 min,收集蛋白裂解液,4 ℃、12 000 r/min离心15 min 后收集上清液,采用BCA 法检测蛋白浓度。将同浓度的蛋白样品中加入4 × 蛋白上样缓冲液,95 ℃水浴10 min 制备蛋白上样液。在12% SDS-PAGE 胶中上样,80 V 预电泳至目标条带分开时,调至120 V 恒压电泳至溴酚兰刚跑出即可终止电泳。在200 mA 恒流下湿法转膜2 h,封闭,TBS 缓冲液洗膜。分别4 ℃过夜孵育β-actin、LC3B、p62、Col1、p21、p53、p16,次日用TBST 缓冲液洗2 次,随后按抗体来源分别孵育HRP 标记的山羊抗鼠IgG、HRP 标记的山羊抗兔Ig G 1 h,TBST清洗过后,加ECL发光液在天能显影仪上曝光。
2.8 SA-β-gal染色及MDC染色
SA-β-gal 染色按照说明书进行。在6 孔板中造模给药24 h 后,用PBS 洗2 遍,加入β-半乳糖苷酶固定液1 mL,室温固定15 min,PBS 洗3 遍,每次3 min,每孔加入染色工作液1 mL,37 ℃孵育过夜,用封口膜封住防止蒸发,倒置显微镜下观察。
MDC 是一种嗜酸性的荧光色素,通常被用于检测自噬囊泡形成的特异性标记染色剂。细胞接种在96 孔板中,造模给药24 h 后,各孔加入MDC Stain (10 × ) 10 μL 和染色缓冲液90 μL,37 ℃ 5%CO2条件下避光孵育60 min。各孔加入洗涤液100 μL清洗3次,在荧光显微镜下观察。
2.9 统计分析
使用统计软件GraphPadPrism 8.0 进行统计分析。实验结果以3 次独立重复的±s来表示,Student'st检验用于检验两组之间的差异。在进行正态分布检验后,采用One-way ANOVA,方差齐的LSD 检验和方差不齐的Dunnett's T3检验进行统计分析,以确定多组之间的显著差异。P< 0.05代表具有统计学意义。
3 结 果
3.1 AD-1的体外抗氧化效果
基于自由基衰老学说,自由基过多会破坏细胞膜及其他重要成分,使蛋白质和酶变性,当自由基引起的损伤积累超出机体的修复能力时,会导致细胞分化状态的改变、甚至丧失,从而导致和加速衰老[21]。PTIO 自由基清除实验是体外抗氧化功效评价的常用方法,其基本原理是通过测量吸光度的改变来测定物质的抗氧化性。为了评价AD-1的体外抗氧化活性,以VC 为阳性对照,构建了PTIO 反应体系,结果如图1-A 所示,与初始浓度相比,随着VC 浓度的增加,PTIO 自由基清除率显著增加(P< 0.01),且呈现剂量效应依赖关系。以50 μg/mL的VC为阳性对照,AD-1的抗氧化活性结果如图1-B 所示,与初始浓度相比,随着AD-1 浓度的增加,PTIO 自由基清除活性显著增加,在质量浓度为3 000 μg/mL 时,AD-1 的PTIO 自由基清除率为(28.90 ± 0.97)%。

Figure 1 Free radical scavenging effect of acetyl dipeptide-1 cetyl ester (AD-1) (± s, n = 3)A: 2-Phenyl-4, 4,5, 5-tetramethylimidazoline-l-oxyl 3-oxide (PTIO) free radical scavenging activity of VC; B: PTIO free radical scavenging activity of AD-1**P < 0.01 vs the lowest dose group
3.2 AD-1的体外抗糖基化产物生成活性
蛋 白 非 酶 糖 基 化(non-enzymatic glycation,NEG)反应是在还原糖的羰基和蛋白质上的游离氨基进行的非酶性缩合反应,所产生的糖基化终产物(AGEs)会使蛋白质产生褐色、荧光和交联[22]。基于NEG 的衰老学说,糖基化造成的蛋白质的交联损伤是衰老的主要原因[23]。氨基胍(aminoguanidine,AG)是一种亲核的小分子肼类化合物,可通过与葡萄糖的羰基发生亲核加成反应,从而阻止AGEs 的形成。为了评价AD-1 的体外抗糖基化活性,以AG 为阳性对照,构建了BSA-果糖模拟反应体系,结果如图2-A所示,随着AG浓度的增加,AGEs 形成抑制率显著增加,呈现剂量效应依赖关系。以250 μg/mL AG 为阳性对照,AD-1 的抗糖基化活性结果如图2-B 所示,与初始浓度相比,随着AD-1 浓度的增加,AGEs 形成抑制率显著增加,在质量浓度为3 000 μg/mL 时,抗糖基化活性达到(83.51 ± 2.72)%。

Figure 2 Inhibitory activity of AD-1 (± s, n = 3)A: Advanced glycation end products (AGEs) inhibitory activity of AG; B: AGEs inhibitory activity of AD-1**P < 0.01 vs the lowest dose group
3.3 AD-1 对UVA 诱导RDFs 光老化模型的细胞活力影响
研究表明,持续暴露于紫外线照射造成的皮肤渐进性损伤,是引起皮肤光老化的主要诱发因素[17]。为了评估AD-1 的抗皮肤光老化作用,本研究首先采用MTT 法考察了不同质量浓度的AD-1对RDFs 细胞活力的影响。结果如图3-A 所示,在0.75 ~ 3.00 μg/mL 质量浓度范围内,AD-1 显著提高RDFs 的细胞活力,当AD-1 质量浓度达到6.00 μg/mL 以上时,RDFs 的细胞活力显著下降(P<0.01)。在UVA诱导RDFs光老化模型上,如图3-B所示,光老化细胞对AD-1 的耐受性降低,在1 500 ng/mL 和3 000 ng/mL 质量浓度下细胞活力下降,375和750 ng/mL溶液可在一定程度缓解UVA照射诱导的细胞活力的下降,因此,本研究后续采用375 ng/mL和750 ng/mL AD-1进行相关实验。
3.4 AD-1 对UVA 诱导RDFs 光老化模型中ROS含量的影响
ROS 在自然老化和光老化中发挥着重要作用, 它通过对细胞成分的损伤作用来诱导皮肤衰老[24]。本研究使用DCFH-DA 探针标记RDFs,通过流式细胞仪检测了AD-1对UVA 诱导RDFs 光老化模型中ROS含量的影响。如图4所示,与未照射空白组相比,UVA 照射能够使RDFs中ROS的含量显著增加1.39 倍(P< 0.01)。与UVA 照射组相比,AD-1 干预能够显著降低UVA 照射后RDFs 中ROS 的含量(P< 0.01),并且具有一定的量效关系。
3.5 AD-1 对UVA 诱导RDFs 光老化模型的细胞因子和衰老相关蛋白表达的影响
β-半乳糖苷酶是细胞衰老的经典生物标志物,可与底物X-Gal结合生成深蓝色产物,常用于表征衰老细胞[25]。如图5-A,β-半乳糖苷酶染色结果表明,相比于空白组,UVA 照射后蓝色标记的衰老细胞数目增多,AD-1 的干预减少了UVA 照射后衰老细胞的数量。
采用RT-qPCR 法检测AD-1 干预UVA 诱导RDFs 光老化后对衰老相关蛋白p21、p53、MMPs 等的mRNA 表达的影响。结果如图5-B 显示,相比于空白组,UVA 照射后,细胞周期抑制因子p21、p53,促炎细胞因子IL-6 的mRNA 表达增加,细胞外基质金属蛋白酶MMPs表达增加,胶原蛋白合成基因Col1 和Col3 表达降低,AD-1 的干预能够显著抵抗UVA 照射对RDFs 细胞衰老相关蛋白mRNA 表达的影响(P< 0.01)。
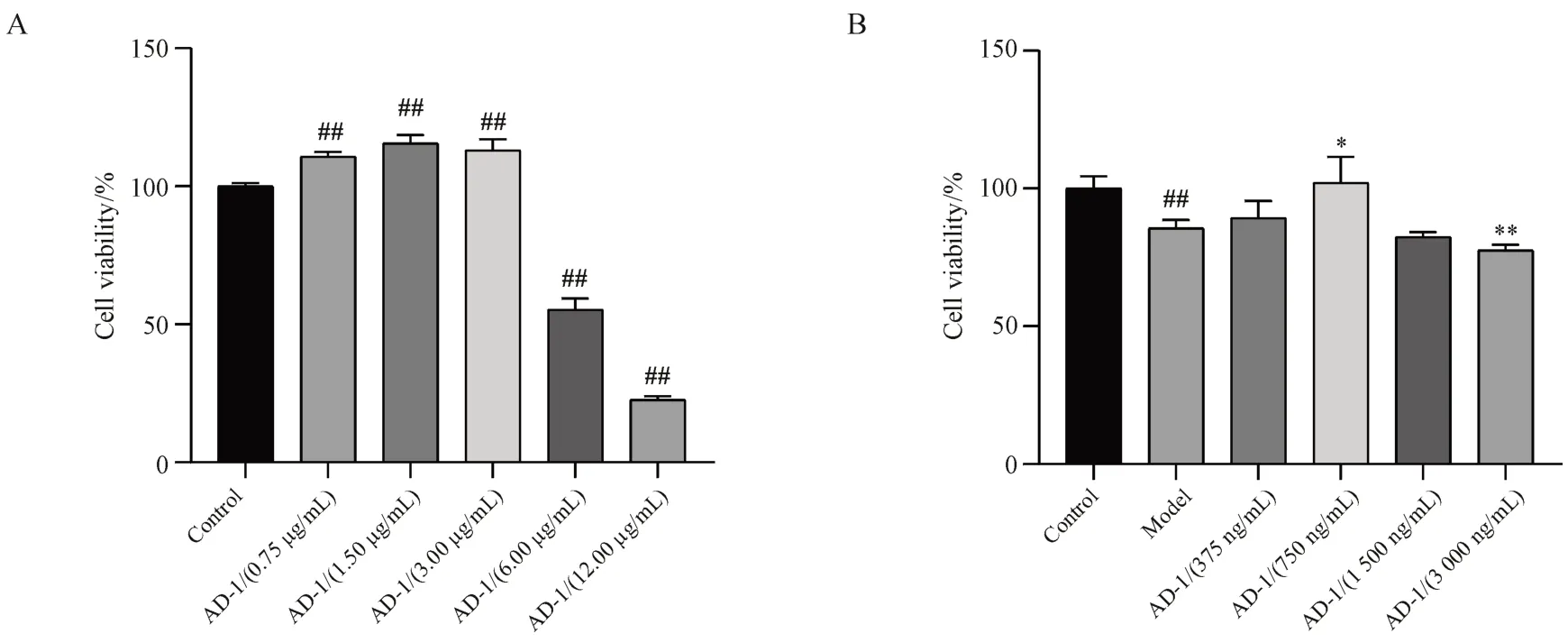
Figure 3 Cell viability of rat dermal fibroblasts (± s, n = 3)A: Cell viability of rat dermal fibroblasts (RDFs) treated with a series of concentrations of AD-1; B: Cell viability of RDFs treated with a series of concentrations of AD-1 on UV radiation##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group
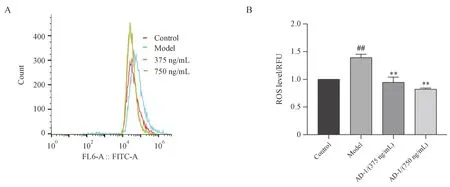
Figure 4 Effect of AD-1 on UVA-induced ROS formation (± s, n = 3)A: Analysis of ROS levels in RDFs by flow cytometry; B: Quantification of ROS levels##P < 0.01 vs control group; **P < 0.01 vs model group
进一步采用Western blot 在蛋白水平检测AD-1干预UVA诱导RDFs光老化后对衰老相关蛋白表达的影响。如图5-C ~ 5-G 所示,AD-1 能够显著抵抗由UVA 诱导引起的RDFs 中p53、p16INK4a、p21CIP1的蛋白水平的增加,Col1 蛋白水平的下降,这与mRNA水平的表达趋势保持一致。
3.6 AD-1 对UVA 诱导RDFs 光老化模型的自噬水平的影响
自噬作为细胞自身物质更新代谢的重要机制,在皮肤衰老进程中发挥着重要作用。自噬囊泡的积累是自噬发生时的标志物,可以通过MDC染色进行表征。本研究通过检测自噬相关基因和自噬底物p62 蛋白的含量考察AD-1 对UVA 诱导RDFs 光老化细胞中自噬水平的影响。如图6-A ~6-B MDC 染色结果所示,与空白组相比,蓝色标记的自噬囊泡的数量降低,AD-1 的干预能够显著抵抗UVA 诱导引起的自噬囊泡数目的减少。RT-qPCR 和Western Blot检测结果(图6-C ~ 6-F)表明,在UVA 诱导的RDFs光老化模型中自噬底物蛋白p62表达升高,自噬相关蛋白ATG5、ATG7、LC3B 的表达降低,提示UVA 诱导能够抑制RDFs 的自噬水平。然而AD-1 的干预能够抵抗UVA 诱导引起的自噬途径的抑制,促进RDFs中自噬的发生。

Figure 5 AD-1 suppress UVA-induced collagen-I degradation and photoaging (± s, n = 3)A:SA-β-Gal staining of RDFs; B: Expression of p21, p53, MMP3, MMP9, IL-6, Col1, Col3 mRNA was detected by RT-qPCR; C-G: Protein level of p16INK4a, p21CIP1, p53, Col1 was detected by Western blot#P < 0.05, ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group
4 讨 论
日复一日的低剂量刺激导致的炎症、细胞衰老、皮肤屏障功能障碍等会加速皮肤老化进程,同时AGEs 的形成和堆积,也是皮肤老化的重要标志。在活性成分的筛选中,常使用体外化学和细胞生物学相结合的方法进行快速、有效的评价。本研究采用PTIO 自由基清除实验结合BSA-果糖模拟反应体系初步证实了AD-1 具有良好的体外抗氧化和抗糖基化效果。
成纤维细胞作为真皮层的主要细胞类型,常用于皮肤衰老的研究。Nakyai等[17]研究发现,UVA反复照射成纤维细胞后Ⅰ型胶原、MMP-1 和纤维连接蛋白表达均发生变化,这些变化与光老化皮肤中的现象一致。另一方面,考虑到通常皮肤衰老也是由于日复一日的紫外照射等外因以及内因相结合所引起的,因此本研究采用了低剂量的UVA重复照射来造模,以此减少应激所引起的影响。
UVA 重复照射会增加ROS 水平,使ROS 与抗氧化防御水平之间的平衡失调,导致DNA 和蛋白质损伤,促进基质金属蛋白酶MMPs 表达,诱导胶原蛋白降解,最终导致胶原蛋白减少和结缔组织损伤[26-29]。在UVA 诱导的光老化模型中,AD-1 干预后ROS 水平显著降低,表明AD-1 具有一定的抗氧化作用。与年轻的细胞相比,衰老的细胞活力降低、形态扩大、扁平,β-半乳糖苷酶活性增加,细胞周期停滞[30]。通过测定这些衰老标志物,发现AD-1 能通过提高UVA 照射后RDFs 的细胞活力,降低β-半乳糖苷酶活性以及调节细胞周期调控相关蛋白p16、p21、p53水平发挥抗皮肤光老化作用。

Figure 6 UVA-inhibited autophagy could be reversed by AD-1 (± s, n = 3)A-B: Florescence microscopy analysis after MDC staining; C: Expression of p62, ATG5, ATG7 mRNA was detected by RT-qPCR; D-F: Protein level of p62, LC3B was detected by Western blot#P < 0.05, ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group
自噬是真核细胞在自噬相关基因的调控下利用溶酶体降解自身细胞质蛋白和受损细胞器的过程[31]。在自噬的发生过程中,LC3A 被ATGs 加工修饰成LC3B 定位于自噬体膜上,p62 作为自噬底物与泛素化蛋白质相结合,在LC3B 的帮助下被运往溶酶体内进行降解[32]。在成纤维细胞中,老化的皮肤成纤维细胞表现出的皮肤脆性与自噬水平受损有关[33],重复的紫外线照射会破坏自噬稳态干扰自噬进程[34]。本研究发现,重复UVA 诱导能够抑制RDFs 的自噬水平,导致自噬底物蛋白p62表达升高,自噬相关蛋白ATG5、ATG7、LC3B 的表达降低,这与目前的研究结果一致[19,35-36]。此外,有研究表明提高自噬水平能够抑制炎症反应和下调炎症因子的产生,从而减轻紫外线引起的损伤[34]。同时,已有研究证明AD-1 能够抑制炎症因子的产生[14-15,37]。因此根据本实验结果推测,AD-1抑制炎症因子产生极有可能是通过激活自噬所导致的。
本研究考察了AD-1 的体外抗氧化和抗糖基化作用,并通过构建UVA 诱导的RDFs 光老化模型,从细胞自噬的角度阐明了AD-1 能通过激活细胞自噬、增加自噬相关蛋白的水平,从而起到延缓皮肤光老化的作用。由此可见,AD-1 具有良好的抗衰老功效,作为抗衰老化妆品的活性成分具有良好的应用前景。
致谢:感谢山东济肽生物科技有限公司提供的乙酰基二肽-1鲸蜡酯。

