外泌体在肿瘤诊疗中的研究进展
佟雷, 林懿
(华侨大学 医学院, 福建 泉州 362021)
近年来,外泌体(exosome)作为肿瘤诊断的生物标志物已逐渐成为研究热点,它源于细胞内吞系统中的多囊泡内体,通过出芽、内陷等形成球形、扁形的双层磷脂膜结构小体,并通过胞吐的形式分泌到细胞外.作为一种细胞间通讯的载体,外泌体以结构稳定、携带信息量大、生物相容性好等特点在诊疗、预后、靶向药物传递等肿瘤精准诊疗环节中显示出极具潜力的临床应用前景.本文结合外泌体的结构特点,从肿瘤诊断及靶向治疗两方面出发,对外泌体的研究进展及临床应用前景进行综述.
1 外泌体概述
外泌体是细胞分泌的直径为40~100 mm级别的生物纳米级球形脂质双分子层囊泡,大小均匀.外泌体在蔗糖密度梯度溶液中以质量浓度为1.13~1.19 g·mL-1进行漂浮,大多数正常细胞和肿瘤细胞均以出芽方式进行分泌,特别是树突状细胞、淋巴细胞、上皮细胞等免疫相关细胞[1].外泌体的提取方法很多,除高速离心是金标准外,还包括超滤、免疫亲和捕获、基于电荷中和的聚合物沉淀、尺寸排阻色谱法和微流体技术等[2].
Johnstone[3]发现成熟红细胞中转铁蛋白受体的形成与胞内转铁蛋白受体丢失有关,为了与其他类型的细胞外囊泡区别,将其命名为外泌体.早期研究发现外泌体广泛存在于血液、唾液、尿液、脑脊液和母乳等多种体液中,是细胞排出代谢废物的一种简单方法.
随着不同类型的外泌体中分离出不同的核酸、蛋白质和脂质,人们已经认识到外泌体在肿瘤、自身免疫性疾病、心血管疾病、神经退行性疾病等人类多种疾病中发挥重要作用.根据外泌体数据库的更新,外泌体内容物包括9 769种蛋白质、4 946种mRNA、2 838种miRNA和1 116种脂质.在表观遗传调控和肿瘤生物学行为中,已有大量研究发现,多种肿瘤细胞外泌体携带的核酸、蛋白质与肿瘤细胞信号通路的调控与肿瘤微环境的改变有着密切的关系.
外泌体内容物与不同类型肿瘤生物学功能的关系,如表1所示.
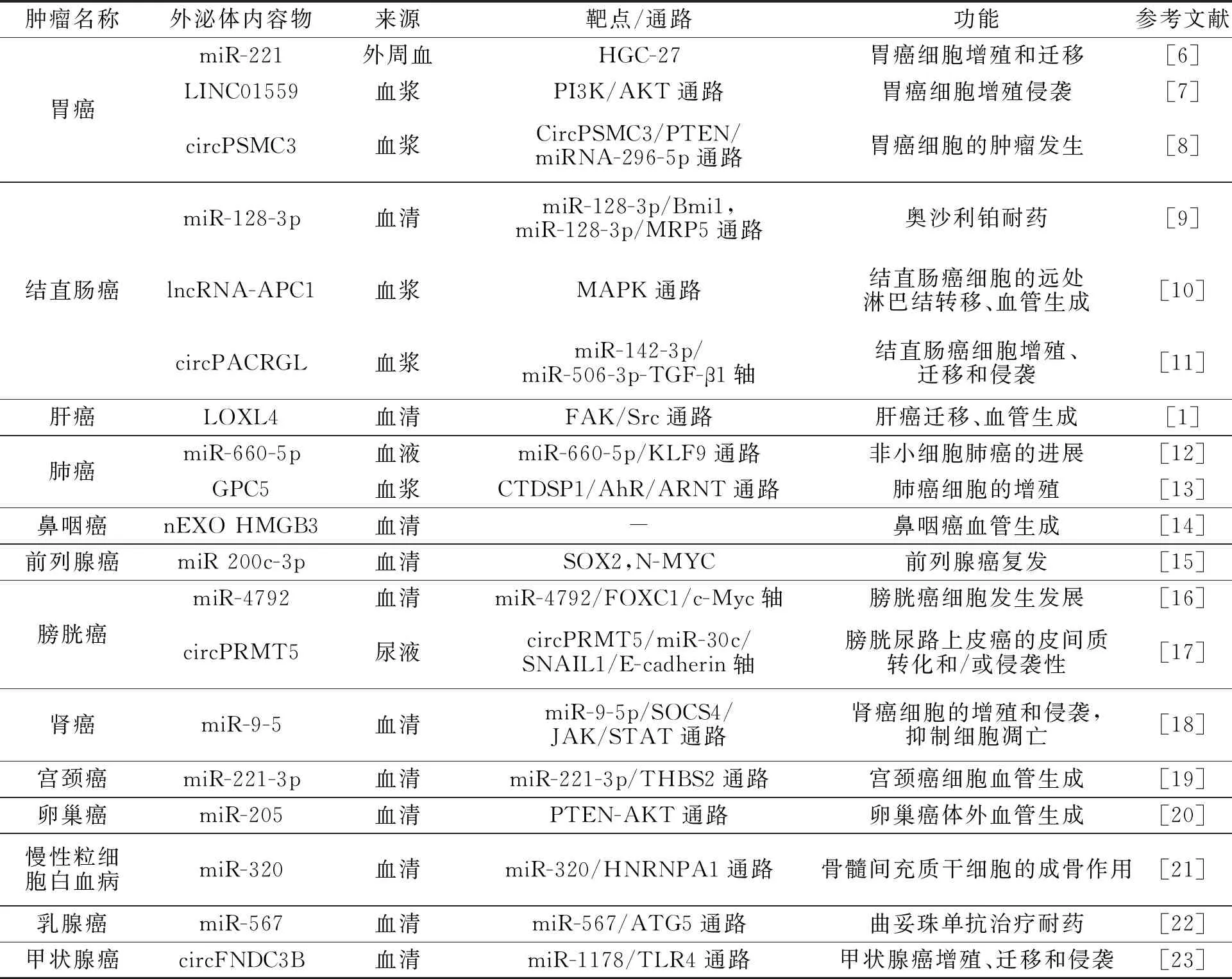
表1 外泌体内容物与不同类型肿瘤生物学功能的关系
外泌体内容物可以作为肿瘤的抑制或促进因子,调节细胞增殖和迁移,上皮-间质转化(epithelial-mesenchymal transition,EMT),以及血管生成和转移等,在肿瘤微环境的信息传递过程中发挥重要作用[4].与传统血清肿瘤抗原生物标志物相比,外泌体独特的表达模式及其内容物的相对稳定性使其成为肿瘤液体活检的新候选物.
外泌体还可在免疫治疗中作为免疫细胞激活物刺激抗癌免疫应答,发挥免疫调节功能,其独特结构也适用于靶向药物传递系统的构建,有助于实现抗肿瘤药物的靶向传递[5].综上,将外泌体作为一种新的临床检验方式及治疗手段应用于肿瘤的诊疗具有极大潜力.
2 外泌体在不同类型肿瘤诊断中的应用
2.1 胃癌(gastric cancer,GC)
GC作为消化系统最重要肿瘤之一,患者往往由于早期症状不典型而延误病情,错过最佳治疗机会.因此,GC的早期诊断对提高患者的长期生存率至关重要.研究发现,外泌体携带的内容物,尤其是非编码RNA(non-coding RNA,ncRNA),在GC诊疗方面都具有巨大潜力.Guo等[24]运用RNA的分离、合成方法及RT-PCR技术,检测循环外泌体中GC来源的外泌体lncRNA-GC1(早期、多阶段),发现lncRNA-GC1与传统临床血清标志物CEA,CA72-4,CA19-9相比,在鉴别GC患者、GC癌前病变患者、特别是对于标准生物标志物阴性的GC患者中表现出更强的特异性和敏感性.Tang等[25]在不同肿瘤淋巴结转移(tumor node metastasis,TNM)分期的GC患者的临床样本中检测circRNA表达谱,发现circ-KIAA1244在GC患者组织细胞、血浆中的表达水平均低于对照组,且GC组织来源的circ-KIAA1244在血浆中的表达水平降低与GC患者的TNM中淋巴结转移行为负相关,表明GC组织来源的circ-KIAA1244有望作为一种新型GC检测生物标志物.
此外,一些外泌体携带的蛋白已被证实具有GC诊断价值.GC患者血清中GKN1浓度明显低于健康人群和结直肠癌、肝细胞癌患者,提示其有可能成为GC特异性诊断标志物[26].外泌体在GC的进展中发挥重要作用,包括GC发生、转移、耐药等.紫杉醇耐药GC细胞MGC803R通过产生含有过表达miR-155-5p的外泌体,抑制GATA结合蛋白3和p53诱导核蛋白1的表达水平,从而促进紫杉醇敏感GC细胞的EMT,降低紫杉醇化疗敏感性[27].
2.2 结直肠癌(colorectal cancer,CRC)
CRC是另一种重要的消化系统恶性肿瘤,其发病率在我国逐年呈上升趋势,但临床诊断上缺少除肠镜外的有效早期诊断方法,外泌体的研究可能成为新的手段.Li等[28]发现CRC患者手术治疗前,肿瘤组织和血浆外泌体中GPC1+蛋白表达水平明显高于对照组,同时,检测到血浆中miR-96-5p和miR-149表达水平降低,手术治疗2个月后,3者指标均恢复正常.过表达miR-96-5p和miR-149可以明显降低外泌体GPC1+的表达水平,说明血浆GPC1+外泌体的增加和血浆miR-96-5p和miR-149表达水平的减少可能是CRC诊断的特异性标志物和CRC治疗的靶点.
此外,患者血清外泌体的检测还与CRC的增殖、迁移及预后有显著相关性,既包括miRNA[29],例如,miR-25-3p,miR-130b-3p,miR-425-5p表达水平的显著上调与CRC的进展及转移相关,也包括长链非编码RNA(long non-coding RNA,lncRNA),例如,lncRNA GAS5与CRC细胞增殖、迁移、侵袭及预后显著相关,CRC中lncRNA GAS5低表达导致miR-221的表达水平升高,从而抑制了RECK mRNA表达水平,最终促进CRC细胞的远处淋巴结转移和局部复发[30].
2.3 肺癌(lung cancer,LC)
LC是世界上最常见的癌症,也是引起癌症死亡的主要原因,主要包括小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)两种类型,它们分别占LC的15%和85%.临床上,LC患者组织活检是常用的诊断标准,但由于组织采集的数量和时间的限制,且肿瘤具有异质性,这种方法在时间性和准确性上还有缺陷,外泌体内多种miRNA,ncRNA,蛋白质的检测均可能成为新的诊断标志.据报道,与正常对照组相比,NSCLC患者外泌体miRNA表达谱显著改变,其中,血清外泌体miR-146a-5p,miR-486-5p表达水平上调可能是NSCLC早期诊断较好的生物标志物,而miR-320d,miR-320c和miR-320b过表达水平被认为是预测晚期NSCLC免疫治疗疗效的潜在生物标志物[31].同时,NSCLC细胞来源的外泌体lncRNA UFC1的高表达水平与肿瘤浸润有关,lncRNA UFC1通过与EZH2结合,并介导EZH2在PTEN启动子区域的富集,使H3K27的三甲基化及PTEN的表达水平受抑制,进而促进NSCLC细胞的增殖、迁移和侵袭,为NSCLC诊断提供了一个潜在的标志物[32].此外,间变型淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性NSCLC患者外泌体蛋白质组Tim-3和Galectin-9表达水平降低提示其可用于NSCLC早期检测[33].
除了可以作为诊断标志物以外,外泌体内还包括一些与肿瘤治疗相关的蛋白,包括表皮生长因子受体、生长因子受体结合蛋白等在NSCLC外泌体中高表达水平.奥西麦替尼是NSCLC的一线治疗药物,然而,大多数接受奥西麦替尼治疗的患者一年内易复发,EGFR基因突变可能是诱发耐药的重要因素.Wu等[34]通过构建小鼠模型,证实奥西麦替尼可通过上调Rab GTPase (RAB17)促进外泌体EGFR的释放,而含突变EGFR的外泌体通过癌细胞网格蛋白依赖的内吞作用内化,激活下游的PI3K/AKT和MAPK信号通路,诱导奥西麦替尼耐药.
2.4 前列腺癌(prostate cancer,PCa)
血液中的外泌体lncRNAs有望成为对PCa诊断有效且无创的肿瘤诊断新生物标志物.明确肿瘤来源的外泌体lncRNAs的功能是了解其对癌症鉴别诊断意义的先决条件.Wang等[35]通过建立双抗体免疫亲和系统研究lncRNA SAP30L-AS1,lncRNA SChLAP1在PCa中的表达模式和临床意义,发现SChLAP1在PCa中的表达水平显著高于健康和良性前列腺增生个体,而SAP30L-AS1在良性前列腺增生表达水平上调,与前列腺特异性抗原(prostate-specific antigen,PSA)值呈正相关.此外,PCa患者尿液中催化糖基化的酶表达异常可产生PCa特有的糖蛋白,测定PCa患者尿液中异常表达的糖蛋白量也有望作为另一种潜在的诊断方法.Fujita等[36]发现尿液中异常糖蛋白表达水平与PSA表达有关(PSA也是一种具有n-糖基化位点的糖蛋白),采用凝集素抗体酶联免疫吸附法测定69名男性(20名活检阴性的男性,49名PCa患者),与活检阴性的男性相比,PCa患者的PSA表达水平明显降低.
骨转移是PCa晚期常见征象,此时,患者易发生病理性骨折,且在X线片上表现为成骨细胞增多.Yu等[37]发现外泌体miR-92a-1-5p是调节骨稳态的关键介质,体外实验表明,PCa细胞来源的外泌体通过直接靶向COL1A1下调I型胶原的表达水平,从而促进破骨细胞向成骨细胞分化.此外,PCa来源外泌体也显著降低了I型胶原在体内的表达水平.主要表现为破骨细胞的骨溶解,从而促进骨肿瘤生长.外泌体miR-92a-1-5p诱导破骨细胞分化,为PCa骨转移提供了可能潜在的治疗靶点.
2.5 膀胱癌(bladder cancer,BCa)
临床上BCa的初步诊断包括膀胱镜检查、上尿道造影和尿液细胞学检查.尽管特异性高,但这些检测易导致尿路炎症,经常发生假阳性.另外,核基质蛋白22和膀胱肿瘤抗原作为现有诊断性生物标志物,由于缺乏诊断特异性和敏感性,不适用低级别BCa[38],因此,迫切需要寻找BCa新分子靶点.近年来,随着表观遗传和遗传标记等技术取得重大进展,外泌体的ncRNA的标记主导了这一领域的研究.据报道,BCa患者中血清外泌体lncRNA PCAT-1的AUC(药时曲线下面积)为0.753,尿液外泌体lncRNA PCAT-1的AUC分别为0.832和0.729,表明lncRNA PCAT-1表达水平与BCa有较强相关性.联合生物标志物组可能比单一生物标志物更准确地诊断BCa.例如,BCa患者血液外泌体lncRNA PCAT-1,UBC1和SNHG16联合的AUC为0.826,敏感性为80%,特异性为75%.尿液外泌体miR-139-5p,miR-136-3p和miR-19b1-5p的联合应用将AUC提高到0.903,敏感性提高到80%,特异性提高到88.2%[39-41].外泌体miR-4644是另一种促进细胞增殖的miRNA,Yan等[42]发现与非BCa患者相比,BCa患者血浆外泌体中miR-4644水平更高,其可直接靶向并下调UBIAD1的表达水平,进而刺激BCa细胞增殖.
2.6 其他系统肿瘤
卵巢癌(ovarian cancer,OC)患者的低生存率和低生活质量的部分原因是缺乏早期诊断工具,既往研究认为miR-200f可作为诊断标志物,因为上皮性OC患者血液中miR-200f水平显著升高[43].此外,最近的一项研究报道了上皮性OC患者血浆中外泌体miR-21,miR-100和miR-320的表达水平较高,而miR-16,miR-93和miR-126的表达水平较低,并揭示上皮性OC来源的外泌体miRNAs在刺激内皮细胞血管生成的作用[44].近年来,中枢神经系统的疾病越来越受到重视,miR-1246在胶质母细胞瘤(glioblastoma,GBM)患者的脑脊液中富集,肿瘤切除后表达水平降低,表明miR-1246可能是诊断GBM的一个新的生物标志物,靶向miR-1246的治疗可能有助于抗GBM免疫治疗[45].乳腺癌(breast cancer,BC)现已成为全球第一大癌症,早筛查、早诊断仍是降低BC发病率和死亡率的关键措施,Risha等[46]通过Western blotting和高分辨率流式细胞术对BC衍生外泌体GLUT-1,GPC-1和ADAM10三种外泌体膜/表面蛋白进行验证,结果表明,与正常组织相比,GLUT-1,GPC-1在BC组织膜表面表达水平较强,而ADAM10则在晚期BC患者或高级别BC组织中表达水平较高,可用于评估BC诊断和预后潜在的新型生物标志物.
3 外泌体在肿瘤治疗中的应用
3.1 肿瘤免疫治疗
外泌体可能成为最有效的肿瘤疫苗、靶向抗原/药物载体,在免疫治疗方面具有很大的潜力.例如,CD8+T细胞来源的外泌体被发现能够靶向和诱导肿瘤间质细胞凋亡,促进自然杀伤(natural killer,NK)细胞的激活和增殖,从而诱导肿瘤退化[47].NK细胞来源的外泌体(NKEVs)在体内外均发挥抗肿瘤活性.一方面,NKEVs可以通过与肿瘤或免疫细胞的相互作用促进癌症治疗,另一方面,NKEVs中的内容物可反映癌症患者NK细胞实际状态.Federici等[48]开发了一种基于NKEVs的免疫酶检测方法(NKExoELISA)检测血浆NKEVs,发现参与细胞毒性、淋巴细胞归巢、细胞粘附和免疫激活的NKEVs高表达肿瘤抑制因子101(tsg101),CD81,CD63和CD9,提示这些标记物有望成为检测NK细胞免疫功能的指标.另外,免疫调节研究发现,NKEVs可刺激外周血单核细胞增殖,诱导单核细胞上人类白细胞抗原DR亚型和共刺激分子的表达,同时,NKEVs还增加了CD56+NK细胞的表达比例,促进免疫应答.因此,NKEVs可能对癌症治疗发挥重要作用.
细胞毒性T细胞(cytotoxic T cell,CTL)与MHC I的亲和力对控制细胞内病原体和肿瘤发生发展具有重要意义.Wu等[49]发现高亲和力CTL分泌的外泌体IL-12可以在不需要抗原的刺激下促进低亲和力CTL的快速激活,从而提高机体的免疫防御功能.同时,IL-12外泌体也激活CD8+T细胞产生IFN-γ和颗粒酶B,并最终诱导宿主细胞凋亡.这些结果揭示了CTLs完全激活低亲和力CTL的潜在机制,可能对提高低亲和力CTL在癌症和慢性病毒感染免疫治疗中的功能具有重要意义.
CD4+辅助T细胞(CD4+Th)表面标志物主要为CD4,CD4与抗原提呈细胞表面的MHC Ⅱ结合时,可激活免疫应答.从CD4+Th分离的外泌体包含外泌体相关蛋白(LAMP-1,TCR和LFA-1)和CD4+T细胞标记物(CD4,TCR,LFA-1,CD25和FasL),在外泌体中过表达这些蛋白及标记物可能促进细胞毒反应和抗肿瘤免疫的发生[50].
有研究表明,外泌体DNA(ExoDNA)可能来源于在细胞质中积累的细胞核和线粒体受损DNA,ExoDNA可通过旁分泌作用激活胞质STING/cGAS通路并激活免疫细胞.既可以调节肿瘤免疫,又可以作为检查点免疫治疗的关键调节因子[51].NK细胞对转移性恶性肿瘤或血液系统恶性肿瘤可表现出快速的免疫反应.Zhu等[52]证实了NK细胞来源的外泌体(exosomes derived from NK cells,NK-exo)膜上FasL的表达,其对黑色素瘤细胞具有良好的杀伤作用.同时,通过BLI和CCK-8试验证实NK- Exo对小鼠黑色素瘤细胞具有良好的体外抗肿瘤作用,且对正常细胞无明显影响.
3.2 肿瘤靶向治疗
外泌体作为一种具有独特靶向功能的“纳米颗粒”生物囊泡,本身具有装载多种生物小分子和大分子的能力,并且可以在体内进行运输,可以成为良好的天然药物传递载体,已有研究将其进行多种修饰,用于肿瘤的靶向治疗中.有研究表明,可溶性FMS样酪氨酸激酶-1(soluble FMS-like tyrosine kinase-1,sFlt-1)在许多癌症中通过抑制血管生成发挥抗肿瘤活性.基于此,Hao等[53]设计了一种用于装载sFlt-1外泌体,为探索潜在的NSCLC治疗方法进行体内外测试,sFlt-1通过抑制NCI-H69肿瘤异种移植体的生长增加肿瘤凋亡,发挥显著抗肿瘤活性,并抑制肿瘤细胞增殖.此外,在胰腺导管腺癌免疫治疗的研究中,Zhou等[54]构建了一种基于外泌体的双传递生物系统,该系统由骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)来源的外泌体、电穿孔加载的半乳糖凝聚素-9 siRNA(Galectin-9 siRNA)组成,表面由奥沙利铂(OXA)前体药包裹,作为免疫原性细胞死亡(ICD)的触发因子.
OXA可逆转M2样肿瘤相关巨噬细胞的肿瘤免疫抑制作用,而BM-MSC外泌体通过靶向Galectin-9/dectin 1轴可增加药物在肿瘤部位的积累,发挥肿瘤杀伤作用.这种外泌体修饰的抗肿瘤药物通过抑制肿瘤周围巨噬细胞极化、细胞毒性T淋巴细胞募集、下调调节性T细胞表达水平等途径诱导抗肿瘤免疫的疗法被称为iEXO-OXA联合疗法,其在肿瘤治疗中已取得显著疗效.miR-21在多种肿瘤细胞中表达水平均出现显著异常,其在多种肿瘤的发生和发展中起着重要的作用.Wang等[55]将外泌体靶向治疗与化疗、基因、光热疗法结合起来,设计了一种装载有模型抗癌药物内化阿霉素(doxorubicin,DOX)和磁性纳米颗粒的外泌体,且外泌体内含有能够靶向肿瘤周围miR-21的分子信标,这些磁性纳米颗粒通过外部磁场引导至肿瘤富集miR-21的部位.当外泌体聚集在肿瘤部位后,应用近红外辐射诱导局部热疗,并诱导外泌体包裹的DOX的释放.释放的分子信标可以靶向miR-21进行成像和基因沉默,同时,释放的DOX可以杀死约91.04%癌细胞.诱导肿瘤细胞的铁死亡有助于增强抗肿瘤免疫效果,而黑素细胞瘤分泌的外泌体PD-L1具有免疫抑制作用.在这种情况下,Zhao等[5]设计了由外泌体抑制剂(GW4869)和铁死亡诱导剂(Fe3+)组装成的纳米单元,通过靶向下调外泌体PD-L1表达水平,诱导黑色素瘤细胞的铁死亡,解除黑素瘤细胞对机体的免疫抑制,从而提高全身抗肿瘤免疫应答.上述研究表明,以外泌体为载体构建的靶向药物模型,以及配合多模式治疗有望成为精准肿瘤纳米药物开发的新方向.
4 结论
外泌体与多种肿瘤的生物学行为有密切联系,核酸、蛋白质和脂质等可通过外泌体内容物形式传递至受体细胞并激活相应信号通路调控肿瘤细胞生物应答,这种外泌体介导的反应可以促进或抑制肿瘤的发生、发展,在各类型肿瘤的诊断和预后等方面都具有良好应用前景.因外泌体膜结构稳定性及体液中分布广泛性,以其为基础的液体活检有望成为未来肿瘤诊断的重要手段.在治疗方面,与外泌体内容物相关的信号通路可能作为一种更安全、更有效的肿瘤免疫治疗的手段.同时,外泌体可被设计成用于递送不同药物的载体,包括siRNA、反义寡核苷酸、化疗药物等,这种设计可以比其他合成载体更有效、更有针对性地作为抗肿瘤药物的靶向载体.
虽然外泌体具有很多特异性的优势,但仍需克服诸多难题.一方面,由于外泌体的分离提纯仍存在一些困难,故外泌体的诊断在肿瘤患者中的临床应用证据不足.首先,目前大多数外泌体是从血浆等体液或细胞培养的上清液中分离出来,外泌体的产量和纯度受到限制;其次,目前外泌体诊断研究的标本量较少,但外泌体应用于肿瘤早期诊断和治疗的研究需要大样本量的实验数据支持,而且如何大量生产具有治疗目的外泌体也是制约其临床应用的问题之一[56].此外,对外泌体分离提纯始终未建立一套统一的标准,超速离心法、免疫亲和捕获法、聚合物沉淀法等都有所涉及,但无论何种方法都存在蛋白质污染,使得研究人员数据互通和继续研究存在障碍[57].另一方面,基于外泌体的免疫治疗和靶向治疗目前仍处于早期临床试验阶段,对于这种新型药物载体的生产和应用,国际上尚无具体的管理指南[58].因此,在外泌体正式应用于临床之前,应解决基于外泌体的生物制药的质量分类和标准问题,并尽快制定具体临床应用指南,以确保外泌体治疗的安全性.总之,外泌体在肿瘤诊疗中的应用具有巨大的潜力和广阔的前景,但在基于外泌体的治疗被临床广泛应用之前,还需要大量的基础和应用研究.

