6 种新型CpG 分子增强新型冠状病毒重组亚单位疫苗的免疫效果比较
李思奇 高孟 安彤 张柯欣 马培凯 沈钱通 朱赟 庄昉成 陈刚
杭州医学院基础医学与法医学院 浙江省医学生物工程疫苗研发重点实验室,杭州 310053
佐剂是一种非特异性免疫增强剂,在疫苗中广泛使用[1]。 寻找安全有效的新型佐剂一直是免疫学领域的热点之一。 CpG 分子具有巨大的潜力[2],它是模式识别受体——Toll 样受体9(TLR9)的激动剂[3],其作用机制是激活TLR9 并引发下游炎症相关基因表达,从而达到激活和加强免疫应答的效果[4]。 CpG 根据其结构不同可以分为A、B、C 三种类型[5]。 2017 年在美国上市的新型乙型肝炎疫苗由于和CpG1018联用,对不同年龄组人群的保护效果均优于传统疫苗[6]。 但是由于专利保护的原因,目前全球仅有个别公司可以使用CpG1018。 本研究在设计出多个新型CpG 分子的基础上,评价其对重组亚单位疫苗的免疫增强作用,筛选出具有潜力的分子,为后续新型CpG 佐剂的开发提供依据。
材料与方法
一、仪器与试剂
SPECTRAMAX 190 酶标仪(Molecular Devices);MCO-20AIC 二氧化碳培养箱(三洋电机株式会社厂)。
新型冠状病毒(SARS-CoV-2)亚单位疫苗由浙江省医学生物工程疫苗研发重点实验室制备,主要成分为SARS-CoV-2 受体结合域(RBD)抗原蛋白和铝佐剂[7];CpG 寡核苷酸由擎科生物公司合成且经高效液相色谱(HPLC)纯化;血管紧张素转化酶2(ACE-2) 蛋白、SARS-CoV-2 RBD 蛋白以及辣根过氧化物酶(HRP)酶标的SARS-CoV-2 RBD 蛋白均购自金斯瑞公司;HRP 酶标羊抗鼠IgG1、 羊抗鼠IgG2a 抗体购自Abcam 公司; 小鼠IFN-γ 酶联免疫斑点试验试剂盒购自达科为公司;小鼠IL-2 酶联免疫斑点试验试剂盒购自Mabtech 公司,SARS-CoV-2 RBD 原型株和Delta 突变株肽刺激物由金斯瑞公司合成;磷酸盐缓冲液(PBS)粉剂购自索莱宝公司;TMB 显色液购自北京四正柏生物科技有限公司。
4 周龄SPF 级雌性BALB/c 小鼠购自北京维通利华实验动物技术有限公司上海分公司,饲养于浙江中医药大学实验动物中心[实验动物使用许可证号SYXK(浙)2018-0012;合格证编号:20170005044109],SPF 环境下保持温度20~25 ℃、 相对湿度为40%~70%。
二、实验方法
1. CpG 寡聚脱氧核苷酸(CpG-ODN)分子设计
目前的研究发现CpG1018 只含有刺激基序AACGTT,导致其效果有限[8]。 本实验将人鼠共源的CpG 基序TCGTT[9]加入到所有设计的CpG 序列之中, 在CpG1~CpG5 中只加入单一种类的刺激基序——TCGTT,并且都以TCGTT 作为开头而后以2个胸腺嘧啶作为连接,以相同的序列TCGTT 作为结尾,中间序列不含腺嘌呤核苷酸,通过不同的排列组合将2~3 个TCGTT 序列插入其中。 CpG6 在引入TCGTT 序列的同时还包含有GACGTT 和AACGTT基序,所设计的CpG 长度均为19~26 bp,并采用全硫代修饰。 由于CpG-ODN 分子仍处于研发阶段,此处略去CpG1~CpG6 的完整序列。
2.动物分组及免疫
将4 周龄SPF 级雌性BALB/c 小鼠分为9 组,每组5 只。 空白对照组小鼠只接种注射用水,疫苗对照组小鼠接种SARS-CoV-2 亚单位疫苗(含铝佐剂成品),实验组小鼠接种SARS-CoV-2 亚单位疫苗和7 种不同的CpG 佐剂, 根据加入的CpG 不同而分为CpG1~CpG6 组以及CpG1018 组。 免疫途径均为腹腔注射,体积为0.5 mL。SARS-CoV-2 疫苗抗原蛋白剂量为50 μg/剂, 根据前期的研究结果,CpG剂量采用20 μg/剂,铝佐剂用量为0.5 mg/剂。
免疫程序为初次免疫当天计为第0 天, 第14天加强免疫。 2 次免疫的疫苗均来自浙江省医学生物工程疫苗研发重点实验室。 初次免疫后7 d 小鼠眼眶采血收集血清,14 d 后免疫前采血同时进行加强免疫。 加强免疫后每周继续采集眼眶血,收集血清,加强免疫21 d 后脱颈处死小鼠,取眼球血收集血清,取脾脏收集淋巴细胞。
3.不同亚型血清结合抗体效价检测
取商品化SARS-CoV-2 RBD 蛋白 (浓度为1.22 mg/mL), 稀释1 500 倍后包被96 孔板, 用含1%牛血清白蛋白的PBS 溶液稀释小鼠血清, 每孔100 μL 梯度倍比稀释, 以1%牛血清白蛋白的PBS溶液作为本底,每个样本同时设置平行复孔。 37 ℃孵育1 h 后洗版,将HRP 酶标的抗小鼠IgG1、IgG2a抗体分别稀释5 000 倍, 加入96 孔板37 ℃孵育0.5 h,再次洗板,加入TMB 显色液,室温避光孵育后终止显色, 酶标仪读取450 nm 处的OD 值。 cutoff 值为本底孔OD 平均值的2.1 倍,且≥0.105。 选择结合抗体水平最高的CpG 组的血清做后续免疫学检测。
4.竞争抑制法检测结合抗体效价
将商品化的ACE-2 蛋白(浓度为0.65 mg/mL)稀释700 倍,包被在96 孔板上。参照试剂盒说明书用稀释液稀释小鼠血清, 并与1 000 倍稀释的酶标HRP的SARS-CoV-2 RBD 蛋白1∶1 充分混合均匀,37 ℃水浴锅孵育30 min, 取出后加入到包被ACE-2 蛋白的96 孔板中,37 ℃水浴锅孵育15 min, 洗版后加入TMB 显色液室温避光显色15 min 后终止并读数。 酶标仪读取450 nm 处的OD 值, 用各个稀释度下血清的抑制率表示其中和能力,计算公式为抑制率=(1-样本读数的平均值/阴参读数的平均值)×100%。
5.小鼠细胞免疫水平检测
取加强免疫后21 d 的小鼠脱颈处理,并在无菌环境下取出小鼠脾脏, 置于滤网中碾磨经过洗涤、裂解红细胞等处理后得到小鼠脾淋巴细胞悬液,混匀后细胞计数,参照试剂说明书将细胞浓度稀释到5×106个/mL,每孔100 μL 加入到预包被小鼠IFN-γ和IL-2 的板子上,然后加入SARS-CoV-2 RBD 肽库作为刺激物。 酶联免疫斑点试验检测参考文献[10]的方法并参照试剂说明书进行。
三、统计学方法
采用Graphpad Prism 8.3.0 统计软件处理分析,符合正态分布的计量资料采用±s 表示, 组间两两比较采用S-N-K 法进行统计学分析,P<0.05 表示差异存在统计学意义。
结 果
一、血清结合抗体水平
在初次免疫后14 d,CpG6 组小鼠血清IgG2a和IgG1 水平分别为3.63±0.27 和3.44±1.03,显著高于CpG1018 组的2.06±1.30 和2.06±0.39。 加强免疫后除空白对照组之外,所有组别的血清IgG2a 和IgG1水平均大幅提高,且接种了CpG 佐剂组均高于疫苗对照组。 加强免疫后14 d,CpG6 组IgG2a 水平为6.52±0.21,高于CpG1018 组的6.33±0.40。 根据结合抗体的结果,选择效果较好的CpG6 组,做后续的免疫学指标检测。 具体结果见图1。
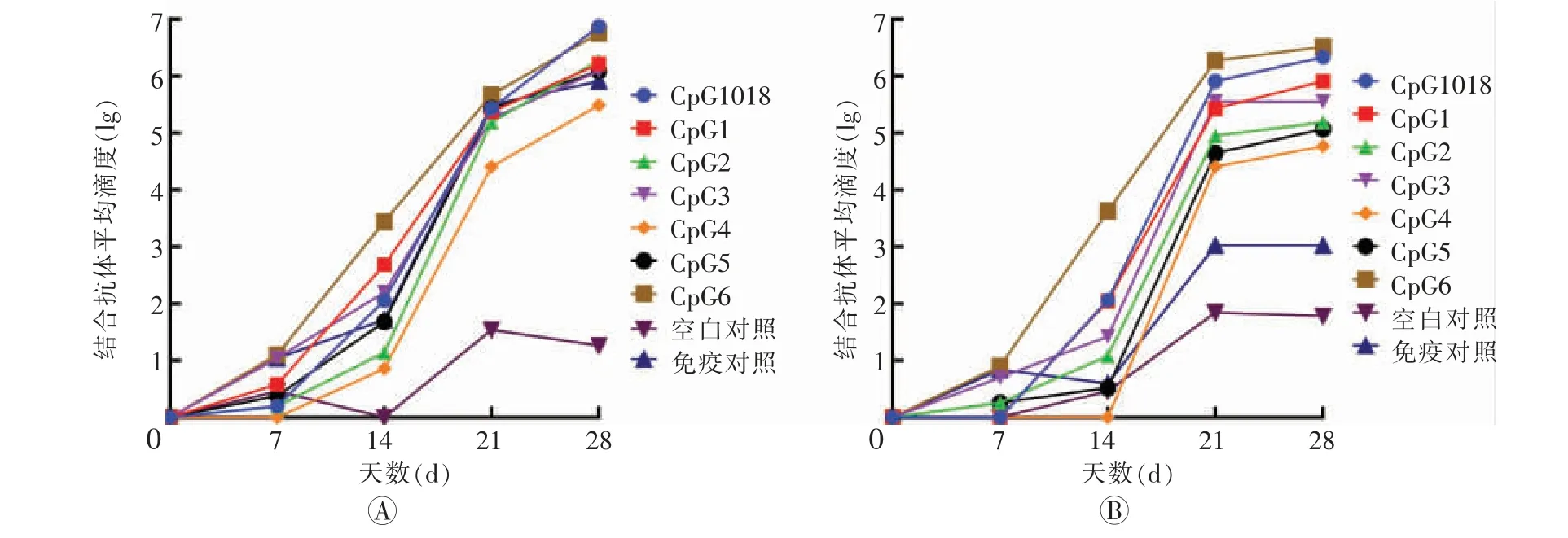
图1 不同佐剂联用的新型冠状病毒亚单位疫苗注射后小鼠血清IgG 结合抗体亚型水平
二、血清结合抗体抑制率
采用竞争性ELISA 法检测血清结合抗体水平,在初次免疫14 d、加强免疫21 d 后,各组间差异均有统计学意义(F=13.66、12.58、19.38 和19.38,均P<0.001)。 初次免疫后第14 天将CpG6 组小鼠血清稀释10 倍, 对SARS-CoV-2 原型株的抑制率为(64.67±20.41)%, 高 于CpG1018 组 的 (27.84±20.23)%,差异有统计学意义(t=2.70, P=0.031);并且高于疫苗对照组和空白对照组,差异均有统计学意义(t=5.42, P=0.001;t=5.07, P=0.001),结果如表1所示。对加强免疫后21 d 处死的小鼠眼球血血清稀释150 倍后发现CpG6 组和CpG1018 组的结合抗体抑制率分别为(88.21±1.47)%和(78.09±8.20)%,且CpG6 组抑制率明显高于疫苗对照组和空白对照组, 差异均有统计学意义 (t=2.78 和39.51, 均P<0.001)。将血清稀释1 000 倍后CpG6 组和CpG1018组对SARS-CoV-2 原型株的抑制率仍然维持在很高的水平,其中CpG6 组血清抑制率为(89.71±4.83)%,高于CpG1018 组的(70.84±17.20)%,差异有统计学意义(t=2.36, P=0.046),也高于疫苗对照组和空白对照组, 差异均有统计学意义(t=4.35, P=0.002;t=30.56, P<0.001)。 对SARS-CoV-2 Delta 突变株的抑制率上,CpG6 组为(79.04±6.32)%, 高于CpG1018组的(52.61±14.22)%,差异有统计学意义(t=3.80,P=0.005), 并且CpG6 组抑制率明显高于疫苗对照组和空白对照组,差异均有统计学意义(t=3.94, P=0.004;t=19.61, P<0.001)。
表1 免疫后各组小鼠在不同免疫天数的血清结合抗体抑制率(%, ±s)

表1 免疫后各组小鼠在不同免疫天数的血清结合抗体抑制率(%, ±s)
注:a:血清稀释10 倍;b:血清稀释150 倍;c: 稀释1 000 倍;与CpG6 组比较,d:P<0.05,e:P<0.01
组别 只数(只) 初次免疫14 d 加强免疫21 d原型株a 原型株b 原型株c Delta 株c CpG1018 5 27.84±20.23d 78.09±8.20 70.84±17.20d 52.61±14.22e CpG6 5 64.67±20.41 88.21±1.47 89.71±4.83 79.04±6.32疫苗对照 5 8.46±1.22e 46.49±33.53e 33.18±28.66e 31.30±26.34e空白对照 4 11.82±2.71e 21.80±3.43e 9.88±2.07e 14.67±1.59e F 值 13.66 12.58 19.38 19.38 P 值 <0.001 <0.001 <0.001 <0.001
三、细胞免疫水平检测结果
利用酶联免疫斑点试验检测小鼠特异性细胞水平,结果如表2 所示,CpG1018、CpG6、疫苗对照和空白组细胞数差异有统计学意义 (F=14.08、14.71、17.37 和13.85, 均P<0.001)。 CpG6 组针对SARS-CoV-2 原型株敏感[(795.06±332.09)个/5×105个细胞]和Delta 突变株敏感的特异性IFN-γ 分泌T细胞[(678.53±269.60)个/5×105个细胞] 均明显高于疫苗对照组(t=4.74,P=0.001;t=4.74,P=0.001)和空白 对 照 组 (t =3.95,P =0.008;t =3.93,P =0.008)。CpG1018 组针对SARS-CoV-2 原型株敏感和Delta突变株敏感的特异性IFN-γ 分泌细胞数分别为(947.62±300.92)个/5×105个细胞和(825.67±326.11)个/5×105个细胞,与CpG6 组相比,差异均无统计学意义(t=0.76,P=0.469;t=0.78,P=0.459)。 在特异性IL-2 分泌T 细胞数量上CpG6 组无论针对SARSCoV-2 原型株[(874.75±402.28)个/5×105个细胞],还是针对Delta 突变株[(743.68±332.07)个/5×105个细胞],均高于疫苗对照组(t=2.98,P=0.018;t=2.02,P=0.019) 和空白对照组 (t=4.30,P=0.004;t=4.30,P=0.004);而CpG1018 组与CpG6 组相比,差异没有统计学意义(t=0.70,P=0.503;t=0.90,P=0.395)。
表2 酶联免疫斑点试验检测小鼠特异性细胞水平(±s)

表2 酶联免疫斑点试验检测小鼠特异性细胞水平(±s)
注:a:与疫苗对照组比较,P<0.05;b:与空白对照组比较,P<0.05
组别 只数(只) 分泌IL-2 的特异性细胞(个/5×105 个细胞) 分泌IFN-γ 的特异性细胞(个/5×105 个细胞)原型株肽库刺激 Delta 株肽库刺激 原型株肽库刺激 Delta 株肽库刺激CpG1018 5 1 030.44±291.33ab 915.74±270.03ab 947.62±300.92ab 825.67±326.11ab CpG6 5 874.75±402.28ab 743.68±332.07ab 795.06±332.09ab 678.53±269.60ab疫苗对照 5 290.95±175.17 259.12±165.53 82.12±48.73 92.43±62.60空白对照 4 18.89±7.66 19.80±3.58 10.11±8.28 15.16±11.57 F 值 14.08 14.71 17.37 13.85 P 值 <0.001 <0.001 <0.001 <0.001
讨 论
一、新型CpG 佐剂分子的设计思路
佐剂在保证及提升疫苗免疫效果中扮演了重要角色。 CpG 佐剂具有作用机制明确、不良反应小、对细胞免疫提升大等优点,目前已在一些商业化重组蛋白疫苗中获得使用批准。
本研究在设计新型CpG1~CpG6 分子时, 参考CpG1018 加入了TCGTT 基序, 突出其免疫增强效果,并希望在后续灵长类动物体内和临床试验中能体现出相应的效果。 CpG 存在种属特异性,人和鼠的TLR9 受体在氨基酸水平上只有76%的同源性[11]。由于针对不同的物种产生的效果不一致,目前上市的 疫 苗 中,CpG1018 用 量 较 大 (达 到3 mg/剂)。TCGTT 基序可以同时增强小鼠和人免疫应答水平。相对于小鼠来说,TCGTT 基序对人的免疫提升作用更佳[9]。 CpG1018 序列中不含有TCGTT 基序,因此CpG1018 虽然可以较好地激活小鼠免疫应答,但在灵长类动物体内的效果可能弱于含该序列的CpG分子。
二、CpG6 佐剂分子的特点
本实验中,CpG6 和CpG1018 两组对小鼠免疫增强效果都较为明显,均高于疫苗对照组和空白对照组。本文在细胞免疫水平的评估中选择了IL-2 和IFN-γ 这两项指标。 IFN-γ 可以作用于多种APC,通过受体-配体相互作用, 启动信号级联反应, 触发STAT1 磷酸化, 并最终激活转录因子T-bet 使T 细胞向Th1 类细胞分化,是反映细胞免疫水平的重要因子[12-14]。 IL-2 是T 细胞生长因子,对于T 细胞的生长增殖以及发挥效应起重要作用,是重要的细胞免疫因子[15]。 在本研究中, CpG6 诱导的细胞免疫激活水平与CpG1018 组相比无显著性差异。 相比于CpG1018,自行设计的新型CpG,特别是CpG6 在初次免疫后的体液免疫和细胞免疫方面保护效果更显著,能更快地激活特异性淋巴细胞产生抗体和刺激细胞免疫等相关应答。同时,加强免疫后CpG6 组的IgG2a 抗体滴度高于CpG1018 组。 以上结果表明CpG6 和CpG1018 佐剂一样, 能引起相应的机体免疫应答。 不过在面对新发、突发传染病,需要尽快诱导特异性高水平免疫应答时,CpG6 在初次免疫时即可表现出的良好作用, 使其效果极有可能优于CpG1018。
总体来说, 本实验设计的新型佐剂分子CpG6在初次免疫后表现出超越CpG1018 的良好效果,在加强免疫后诱导的体液免疫强于CpG1018,细胞免疫效果也不弱于CpG1018。 有待对其免疫增强的机制做进一步研究, 并且探究CpG6 对于其他类型的疫苗(如治疗性疫苗)是否也具有显著的免疫效果提升作用。 本研究存在一定的局限性:(1)实验中所用到的疫苗为原核表达,其抗原分子与目前主流的真核疫苗有一定区别;(2) 研究所用到的CpG 分子的计量单位为质量而不是摩尔数,可能由于CpG 分子量的不同而加入不同摩尔数的CpG 分子;(3)实验中使用的重组亚单位疫苗剂量为50 μg/剂,高于已上市的重组亚单位疫苗,后续研究中,将对其剂量探究。 在保证免疫效果的情况下,降低CpG 自身及抗原蛋白的用量, 并针对铝佐剂做一定的优化,这对于降低疫苗不良反应、提升安全性具有重要的现实意义。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明李思奇:酝酿和设计实验、实施研究、采集数据、分析/解释数据、起草文章、统计分析;高孟:酝酿和设计实验、分析/解释数据、对文章的知识性内容作批评性审阅、获取研究经费、技术和材料支持、指导;安彤、张柯欣:实施研究、采集数据、分析/解释数据、统计分析;马培凯:采集数据、分析/解释数据、统计分析;沈钱通:实施研究、采集数据、分析/解释数据;朱赞:分析/解释数据、对文章的知识性内容作批评性审阅、技术和材料支持;庄昉成:对文章的知识性内容作批评性审阅、技术和材料支持、指导;陈刚:酝酿和设计实验、分析/解释数据、对文章的知识性内容作批评性审阅、统计分析、获取研究经费、技术和材料支持、指导

