马铃薯锌转运蛋白基因StZIP12调控锌吸收功能
索海翠 刘计涛 王 丽 李成晨 单建伟 李小波
广东省农业科学院作物研究所 / 广东省农作物遗传改良重点实验室, 广东广州 510640
人体缺锌已成为非常普遍的公共健康问题。提高粮食作物可食用部位的锌含量是缓解人体缺锌的一条经济而有效的途径[1]。马铃薯是全球仅次于水稻、玉米和小麦的第四大重要粮食作物, 世界上已经有2/3的人口把马铃薯作为主粮消费, 全球每年消费马铃薯约为3.0~3.3亿吨。中国是世界马铃薯生产和消费第一大国[2], 因此提高马铃薯块茎中锌含量, 对于缓解人体缺锌的现状具有积极意义。
锌以Zn2+或有机复合物的形式从植物根部运输到叶肉细胞, 参与各种生理生化过程; 也可以存储在液泡中,避免过量Zn2+的伤害; 或者通过韧皮部再分配[3]。这些过程都与植物锌转运蛋白家族的调控密不可分[4]。因此, 从分子水平研究这些转运蛋白家族在锌吸收和分配的动态平衡中的作用, 有助于增加植物可食用部位的锌含量。近年在拟南芥[5-12]、水稻[13-16]、苜蓿[4]和番茄[17]等植物中发现了多种锌转运蛋白家族, 并利用酵母互补技术或转基因手段在水稻[16]、大麦[18-19]、木薯[20]等作物中开展了其调控机制的研究。锌转运蛋白家族按其功能不同可分为吸收蛋白和排出蛋白两大类: 吸收蛋白主要有铁调控转运蛋白家族(Zinc-iron transporter protein, ZIP)[21]和自然抗性相关巨噬蛋白家族(Natural resistance associated macrophage protein, NRAMP)[22], 锌吸收蛋白主要位于细胞质膜上, 功能是将Zn2+等二价阳离子跨膜运转到细胞内, 参与植物细胞中多种生理生化反应; 锌排出蛋白包括CDF蛋白家族(Cation diffusion facilitator protein family,CDF)[23]和重金属ATP酶家族P1B-ATPase (Heavy metal ATPase, HMA)[24]等, 其主要位于细胞质膜和液泡膜上,功能是将Zn2+排出细胞质或运载到液泡进行区域化隔离,在植物耐受锌胁迫中起到防御作用[25-26]。锌转运蛋白家族基因成员可在植物不同组织, 包括根、茎、叶等部位表达,表明其不仅与根吸收有关, 同时与细胞内锌的再分配和平衡相关[6,27]。
ZIP转运蛋白家族广泛存在于动物、植物、细菌和原生生物中[21]。ZRT1和ZRT2是首次在酵母细胞中发现的ZIP家族成员[28]。随后Eide等[5]发现了IRT1转运载体的基因。ZIP转运蛋白的氨基酸序列一般为309~406个序列,具有8个跨膜结构域, 其N末端和C末端均位于细胞膜的外侧, 在第III~IV结构域之间一段氨基酸序列称为可变区, 可变区是富含His的区域, 在第IV~V之间是允许金属离子通过的位点, 在第II~III结构域之间是转运底物的最初结合位点。ZIP基因家族的功能分析表明, 该基因家族在从胞外向胞内转运并在胞内进行锌运输过程中起重要作用。另外, 其转运对象也包括其他二价阳离子, 如:Fe2+、Mn2+及Cd2+, 但成员间往往具有不同的转运对象及专一性[7]。
在马铃薯中, 前期通过ZIP家族基因生物信息学分析,鉴定出12个马铃薯ZIP基因, 大多数含有8个跨膜区域。在III和IV结构域之间, 有一个可变区,StZIP12在可变区中His的数量最多, 且低锌品种的马铃薯块茎中StZIP12表达量受到诱导, 推测StZIP12在马铃薯块茎锌富集中的作用可能存在潜在作用[29]。本研究在前期研究基础上, 克隆了马铃薯StZIP12基因, 并通过异源酵母互补试验和遗传转化手段证实了StZIP12在体外和体内能够增强马铃薯锌吸收, 在马铃薯锌富集过程中具有重要作用。
1 材料与方法
1.1 供试材料
马铃薯(Solanum tuberosumL.)品种‘粤引85-38’、‘鄂薯3号’, 哥伦比亚型拟南芥[Arabidopsis thaliana(ecotype Columbia)], super1300植物双元表达载体, pJG4-5(pB42AD)酵母表达载体, pCAMBIA2300N植物表达载体均由本实验室保存。酵母野生型菌株: (WT)DEY1457, 锌吸收障碍突变体酵母菌株(zrt1zrt2) ZHY3 (MATα ade6 can1 his3 leu2 trp1 ura3 zrt1::LEU2 zrt2:: HIS3)由David Eide, Ph.D. Professor and Chair, Department of Nutritional Sciences, University of Wisconsin-Madison赠与。
1.2 基因克隆及载体构建
根据文献[29]和马铃薯基因组网站(http://solanaceae.plantbiology.msu.edu/index.shtml)结合, 在参考序列5′UTR和3′UTR两端设计2条基因特异引物StZIP12-F1:5′-GAAAGAATTTCATTCCCTCGACCCC-3′和StZIP12-R1:5′-ATAATTGCTTGCTTGGCTGATTTT-3′, 进行PCR扩增。将StZIP12的开放阅读框(open reading frame, ORF)构建到super1300~GFP双元表达载体上, 最终形成super:GFP~StZIP12载体。StZIP12的编码区(ORF)构建到pCAMBIA2300~35S载体上, 形成35S:StZIP12。将StZIP12的ORF构建到酵母表达载体pJG4-5 (pB42AD)。
1.3 实时荧光定量PCR
定量PCR仪为CFX96 (美国Bio-Rad公司), 预混液使用SYBR Premix ExTaqII (Tli RNaseH Plus) (TaKaRa)。反应为25 μL, 其中1 μL cDNA作为模板。程序为两步法:95℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 共39个循环。EF1-α作为内参基因。数据分析采用2-ΔΔCt方法。
1.4 亚细胞定位
取短日照培养4~5周的拟南芥莲座叶片, 去掉叶脉取中间部位, 将叶片切成1 mm左右的细叶条, 然后置于预先备好的酶解液中, 使切好的叶条可以与酶液充分接触;用黑色塑料袋包裹烧杯, 置于水平摇床上, 以60转 min-1的转速消化3~4 h, 此时, 酶液由褐色变为绿色, 镜检酶解效果, 拟南芥叶肉原生质体直径约为30~50 μm; 用300目的网筛过滤包含有原生质体的酶液于圆底离心管中,36×g离心1~2 min; 去掉上清, 加预冷的W5溶液, 缓缓悬起原生质体, 36×g离心再沉淀1~2 min; 轻轻吸取上清, 加入适量预冷的W5溶液, 使原生质体浓度达到1×105~2×105mL-1, 冰上放置30 min; 60×g离心1 min, 以1×105~2×105mL-1浓度重悬于MMg溶液; 取20 μL质粒DNA于1.5 mL的离心管中, 加200 μL的原生质体(4×104个原生质体), 轻轻混匀; 加入220 μL的PEG/Ca2+溶液, 轻轻混匀, 23℃放置15~30 min; 加入800 μL的W5溶液, 充分轻轻混匀; 2×g离心1 min, 去掉PEG; 轻轻重悬原生质体于1 mL的W5溶液中; 放于23℃培养箱中黑暗培养, 12~16 h之后CCD观察。
1.5 酵母功能互补
将酵母突变体菌株ZHY3 (zrt1zrt2) (MATα ade6 can1 his3 leu2 trp1 ura3 zrt1::LEU2 zrt2::HIS3)接种到YPD培养基上28℃活化2 d; 挑取生长良好的单菌落用三角瓶加入25.0 mL YPD液体培养基扩大培养, 摇菌8~12 h (28℃,200转 min-1)至OD600=1.0; 660×g(25℃)离心5 min去上清, 用25.0 mL无菌水震荡悬浮清洗酵母菌, 再次离心5 min去上清; 加入25.0 mL无菌水震荡悬浮, 吸取1.0 mL菌液到无菌的1.5 mL离心管中; 2656×g离心5 min, 弃上清;用100 μL one-step buffer悬浮; 加入6 μL预先沸水浴20 min的鲑鱼精; 1 μg载体DNA (空载、融合或报告子)涡旋混合均匀; 45℃水浴30 min, 每隔10 min涡旋一次; 取约200 μL悬浮液涂布在SD-Trp选择培养基上, 28℃暗培养2~3 d; 待长出白色单菌落后, 挑取菌落进行PCR验证,获得阳性转化菌株; 将鉴定好的转化菌株加入10 mL液体SD-Trp培养基28℃, 200转min-1培养至OD600=1.0; 将各菌株的菌液按照细胞浓度分别做10-1、10-2、10-3、10-4浓度梯度稀释; 取各菌液2.5 μL, 按照顺序将菌液分别滴在含Zn2+、Zn2++2 mmol L-1EGTA、Zn2++5 mmol L-1EGTA、Zn2++7.5 mmol L-1EGTA的SD-Trp酵母异源功能互补验证的培养基上, 28℃培养2~3 d; 观察并记录个菌株的生长情况, 照相记录。
1.6 马铃薯遗传转化及转基因植株缺锌处理
采用的农杆菌菌株为GV3101, 受体材料为马铃薯鄂薯3号, 具体方法参考文献[30]。
转基因组培苗处理: 采用茎段培养的方式将转基因和对照植株分别转入无锌和正常锌培养的MS培养基中,放入人工气候箱(温度25 ℃/ 18 ℃,光照16 h/8 h), 培养20 d后, 每个处理各取5株进行数据统计和锌含量测定。
转基因植株沙培处理: 取生根21 d的马铃薯转基因植株和对照植株, 放入去离子水中盖上保鲜膜平衡2 d, 然后移栽到装有石英砂的花盆中, 放入人工气候箱中进行培养。每隔3 d分别施入Hoagland营养液和无锌Hoagland营养液, 直到收获。每个处理各取5株进行数据统计和锌含量测定。
1.7 锌含量测定
收获后, 块茎在65℃下干燥1周。25.0 mg样品分别用5.0 mL HNO3和1.0 mL HClO4在150℃下消化5 h。采用ZA3300型火焰原子吸收分光光度计(日本日立公司;波长为213.856)进行锌含量测定。
2 结果与分析
2.1 StZIP12基因的克隆及跨膜结构域分析
利用前人研究的StZIP12基因序列, 设计特异引物进行扩增和测序。结果表明,StZIP12基因全长1820 bp(图1-A), 包含245 bp的5′UTR, 351 bp的3′UTR, 编码区长度为1224 bp, 编码含有407个氨基酸的蛋白(图1-B)。进一步利用 CCTOP (http://cctop.enzim.ttk.mta.hu/?Ref=labworm)软件对StZIP12蛋白在细胞中的跨膜结构域进行分析, 预测到8个跨膜结构域, 在第3和第4个跨膜结构域之间有1个长环区(图1-C)。
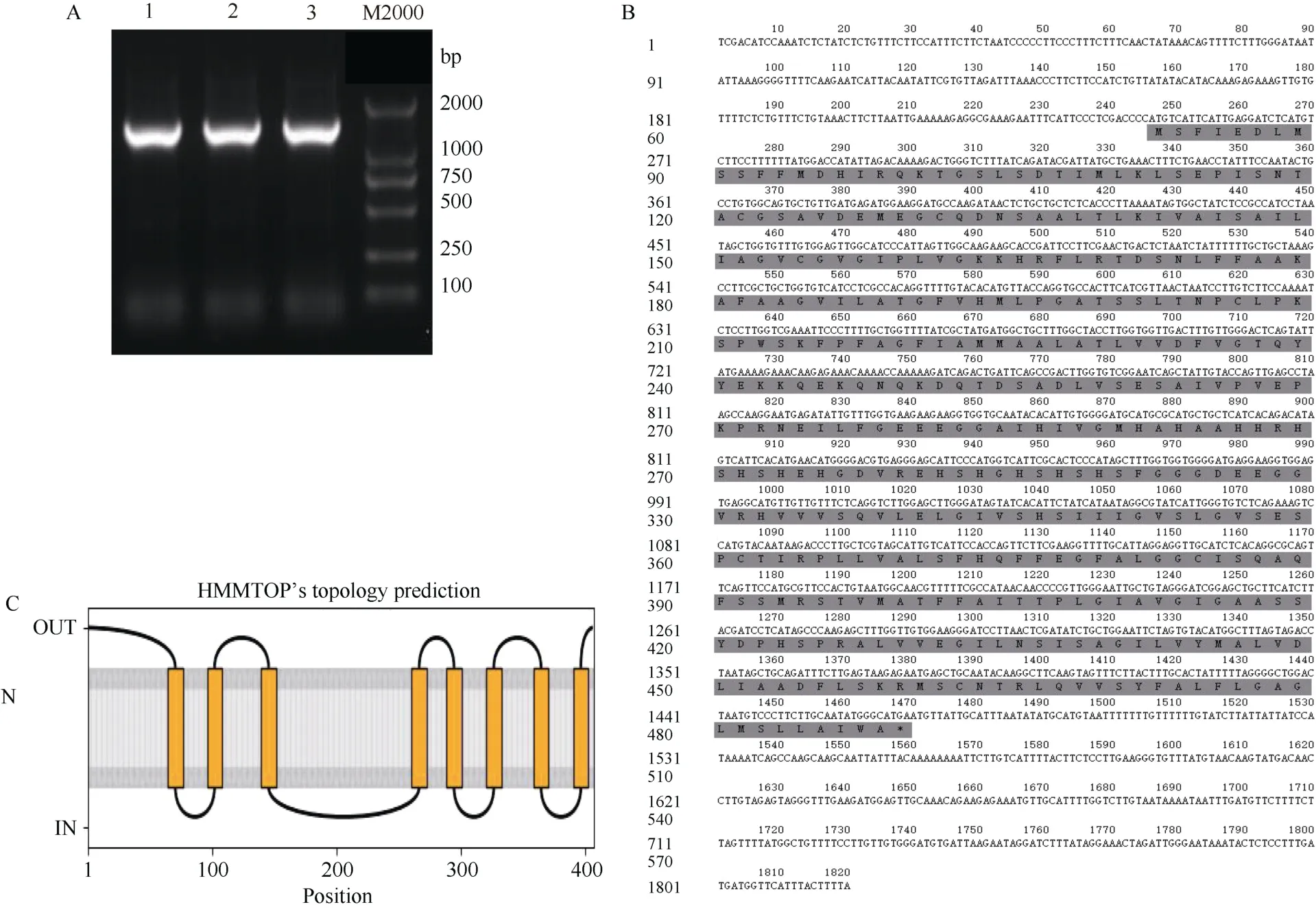
图1 StZIP12基因的克隆及跨膜结构域分析Fig. 1 Cloning and transmembrane domain analysis of StZIP12 geneA: StZIP12基因的分离; 1、2、3泳道均为马铃薯StZIP12基因, M为DL2000 DNA marker。B: StZIP12序列分析, 灰色字母代表氨基酸序列。C: StZIP12跨膜结构域分析, 黄色区域代表跨膜结构部分, 灰色区域代表细胞膜。A: the isolation of StZIP12 gene. Lane 1, 2, and 3 are all potato StZIP12 genes. M2000 is DL 2000 DNA marker. B: the sequence analysis of StZIP12, gray letters in the background represent amino acid sequences. C: StZIP12 transmembrane domain analysis. The yellow area represents the transmembrane structure and the gray area represents the cell membrane.
2.2 StZIP12蛋白亚细胞定位
为确定 StZIP12蛋白在细胞内的定位, 构建了StZIP12基因的瞬时表达载体进行亚细胞定位。结果表明,GFP空载的信号存在于整个细胞, 而GFP-StZIP12融合蛋白主要存在于细胞膜上(图2)。因此,StZIP12基因编码的是一个细胞膜定位的蛋白。
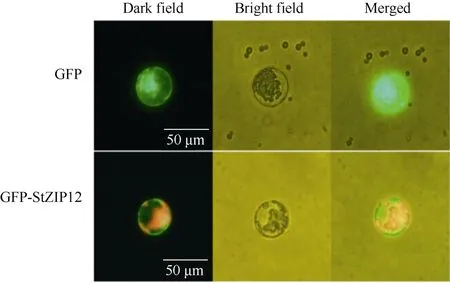
图2 StZIP12蛋白亚细胞定位在细胞膜上Fig. 2 StZIP12 protein is subcellular localized on the cell membrane标尺为50 μm。Bar: 50 μm.
2.3 StZIP12基因表达特性分析
分析StZIP12基因在新叶、老叶、根、茎、匍匐茎、小薯以及成熟薯中的表达量发现,StZIP12在马铃薯各组织中均有表达, 且在新叶中表达量显著高于其他组织, 其次为老叶和根, 在薯块中表达量最低(图3-A)。
分析不同浓度锌溶液喷施处理下StZIP12的表达模式发现, 随着喷施锌浓度的增大,StZIP12的表达量逐渐受到抑制(图3-B)。
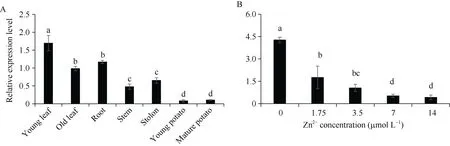
图3 StZIP12的表达分析Fig. 3 Relative expression pattern of StZIP12 genes误差线代表标准误, 多重比较采用Duncan分析法, 不同小写字母代表显著水平(P < 0.05)。Error bar represents standard error. Duncan’s analysis method is used for multiple comparisons. Different lowercase represents significant difference at P < 0.05.
2.4 StZIP12异源酵母功能互补分析
为明确StZIP12蛋白对于锌吸收的功能, 构建StZIP12酵母表达载体StZIP12-pJG4-5, 转化到锌吸收障碍突变体(zrt1zrt2)ZHY3中, 空载体作为对照。在培养基上进行不同锌浓度处理。结果显示, 转入空载体的锌吸收缺陷型酵母突变体zrt1 /zrt2随着菌液稀释倍数的增大和锌吸收障碍螯合剂EGTA浓度的增加, 生长受到抑制; 与对照相比, 转StZIP12的酵母突变体表现出较好的生长状态(图4)。表明马铃薯StZIP12在锌吸收缺陷型酵母突变体zrt1 /zrt2中能够恢复其对Zn的吸收, 证明StZIP12在Zn吸收过程中起着重要的作用。

(图4)
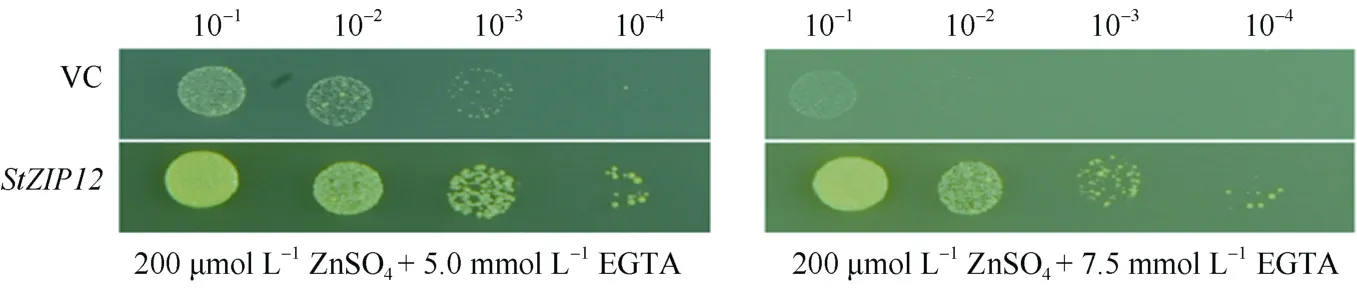
图4 StZIP12对酵母锌吸收障碍突变体功能互补Fig. 4 Functional complementation of StZIP12 to yeast zinc uptake deficient mutantVC: 空载体对照; 10-1~10-4代表菌液稀释浓度。VC: the empty vector controls; 10-1-10-4 represent the dilution concentration of bacterial solution, respectively.
2.5 过量表达StZIP12增加马铃薯锌含量
为进一步验证StZIP12的功能, 构建过量表达载体并利用农杆菌进行遗传转化, 共获得7株阳性植株(图5)。
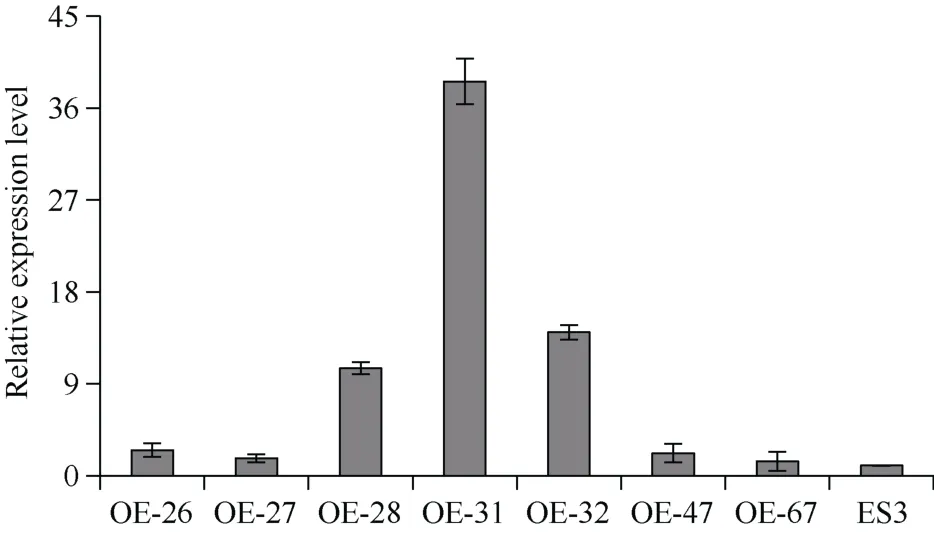
图5 转基因株系定量PCR检测Fig. 5 Detection of transgenic lines by qRT-PCRES3: 非转基因对照; OE-26、OE-27、OE-28、OE-31、OE-32、OE-47、OE-67为过表达株系。ES3: non transgenic control; OE-26, OE-27, OE-28, OE-31, OE-32,OE-47, and OE-67 are overexpressed StZIP12 lines.
对转基因株系及对照植株的组培苗进行缺锌处理发现, 在正常锌培养条件下, 转基因株系OE-26和OE-31与对照ES3在总根长、地上部株高上差异不显著。在缺锌培养条件下, 转基因株系OE-26和OE-31与对照ES3在地上部株高和总根长上差异显著, 且在地上部和根部鲜重上OE-26显著高于ES3。对地上部和根部锌含量进行测定发现, 在正常锌培养条件下, 转基因株系OE-26和OE-31与对照ES3锌含量差异不显著。缺锌处理显著降低了转基因株系和对照植株的地上部和根部锌含量。但在缺锌培养条件下, OE-26地上部和根部锌含量显著高于对照植株, OE-31地上部和根部锌含量也略高于对照植株, 但差异未达显著水平(图6-A)。
根体积能反映根粗。对总根体积进行分级发现, 在缺锌处理下, 对照植株V>0.400的体积比由63%降低到20%,0.000<V≤0.100的体积比由4%上升到16%; 而OE-26和OE-31两个株系的根体积比变化不大, V>0.400的体积比分别为77%和58%, 0.000<V≤0.10的体积比分别为2%和4%。说明在缺锌处理下, 2个转基因株系生长所受影响较小(图6-B, C)。
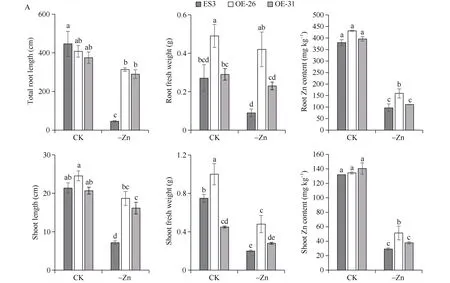
(图6)
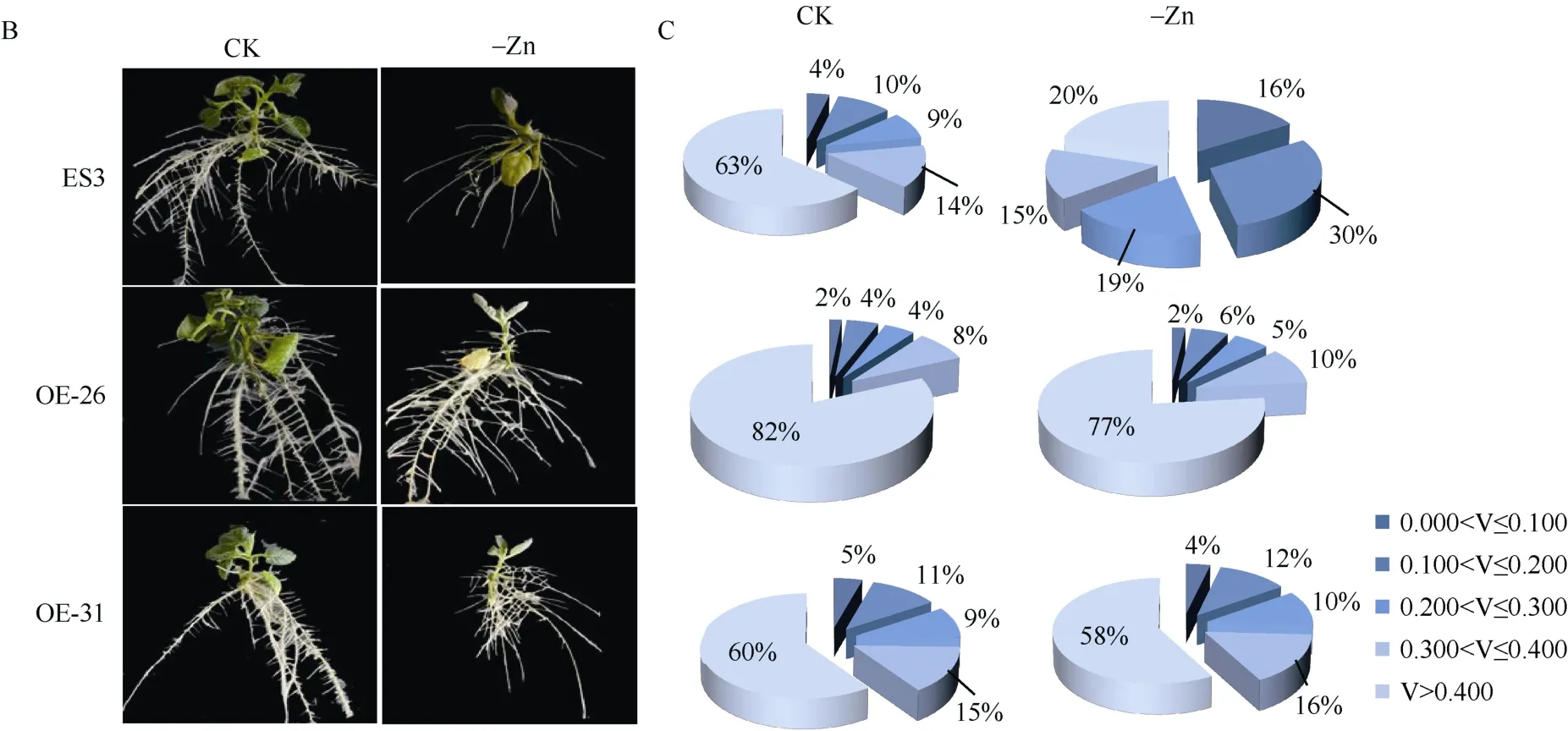
图6 缺锌处理下马铃薯转基因组培苗的表型及锌含量Fig. 6 Phenotype and zinc content of potato transgenic tissue culture seedlings under zinc deficiency treatmentsA: 植株表型及锌含量分析, 误差线代表标准误, 多重比较采用Duncan分析法, 不同小写字母代表显著水平(P < 0.05)。B: 植株表型图片; C: 根体积分级。CK: 正常锌; -Zn: 缺锌处理。A: plant phenotype analysis. Error bar represents standard error. Duncan’s analysis method is used for multiple comparisons. Different lowercase represents significant difference at P < 0.05. B: plant phenotype; C: the classification of root volume. CK: the normal zinc treatment;-Zn: zinc deficiency treatment.
为进一步探究StZIP12在马铃薯块茎锌吸收过程中的功能, 本研究采用了石英砂培养下的锌处理试验。结果表明, 在正常锌浓度条件下, 过表达株系植株高度低于对照植株, 其中OE-31与对照差异显著; 但在块茎锌含量上,转基因株系与对照植株差异不显著。在缺锌培养下, 2个过表达株系的块茎锌含量高于对照, 分别比对照提高22.00%和32.95%, 且差异达到显著水平(图7)。
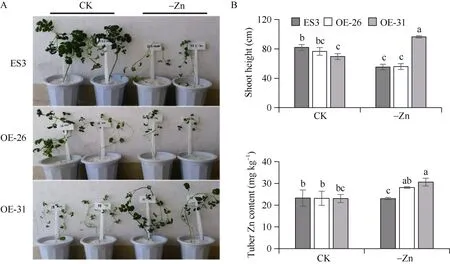
图7 正常和缺锌处理下下转基因马铃薯植株表型、株高和锌含量Fig. 7 Phenotype, plant height, and zinc content of transgenic lines under zinc deficiency treatmentCK: 正常锌; -Zn: 缺锌处理。误差线代表标准误, 多重比较采用Duncan分析法, 不同小写字母代表显著水平(P < 0.05)。CK: normal zinc treatment; -Zn: zinc deficiency treatment. Error bar represents standard error. Duncan’s analysis method is used for multiple comparisons. Different lowercase represents significant difference at P < 0.05.
3 讨论
植物吸收锌主要分为3个阶段, 即锌的吸收、转运和储存。这些过程与植物锌转运蛋白密不可分, 按锌转运蛋白家族功能的不同可分为吸收蛋白和排出蛋白, ZIP家族属于吸收蛋白家族, 该家族的基因表达变化会影响锌的吸收和分配。迄今为止, 从植物中发现鉴定的ZIP家族成员大约有100多个, 并对其功能进行了研究[31]。
据报道, 拟南芥中存在15个ZIP家族成员, At-ZIP1~AtZIP12和AtIRT1~AtIRT13[7]。IRT1和ZRT1是最早被分离出来的ZIP家族成员。IRT1是拟南芥在缺铁条件下在根部表达的一种蛋白, 主要参与了拟南芥在根系对铁离子吸收的生理生化过程[5]。ZRT1和ZRT2分别是酵母中Zn2+吸收和转运的高、低亲和转运蛋白, 参与了Zn2+的跨膜运输[28]。最近在拟南芥中新发现一个锌转运蛋白AtZNE1, 亚细胞定位于高尔基体上, 对于叶片中锌离子浓度的平衡起到重要作用[6]。水稻是研究ZIP基因较多的作物之一, 共预测出17个ZIP家族成员。异源酵母互补杂交试验已经验证了OsIRT1、OsIRT2、OsZIP1~OsZIP5、OsZIP7~OsZIP9等家族成员均具有转运锌和铁的功能[15,21,32], 且研究表明OsZIP5和OsZIP9在锌和钙的吸收上表现出协同作用[33]。此外, 还鉴定和研究了ZIP家族成员在其他物种中的功能, 如大麦[18]、玉米[34]。目前在马铃薯中, 共鉴定到了12个ZIP转运蛋白StZIP1~StZIP12, 且发现StZIP12在可变区中His的数量最多, 暗示它具有很强的金属离子结合能力。缺锌条件下, 在高、低锌品种(系)马铃薯块茎中发现了4个差异表达基因StZIP6、StZIP9、StZIP11和StZIP12, 这4个基因在高锌品种中表达量增加, 而在低锌品种中表达量减少, 其中,StZIP12的表达水平最高, 分别是StZIP6和StZIP9的5倍和12倍以上, 推测StZIP12在马铃薯块茎锌富集中的作用可能更为显著[29]。
本研究克隆了StZIP12基因, 表达模式分析显示其在马铃薯所有组织中均有表达, 尤其在新叶中表达量最高,且受低锌诱导。异源酵母互补试验证实了StZIP12基因能够互补锌吸收障碍突变体ZHY3(zrt1/zrt2)的功能, 说明了StZIP12基因在体外具有锌吸收的功能。与前人在拟南芥[5]、水稻[15,21,32]、柑橘[35]的研究结果一致。此外利用转基因手段, 过表达StZIP12基因于马铃薯品种鄂薯3号,提高了转基因组培苗的锌含量和转基因植株块茎的锌含量, 表明StZIP12在锌的吸收和富集过程中起着重要的功能。这与前人研究基本一致。如过量表达AtZIP1提高木薯根部锌含量9倍以上[20]。过量表达AtZIP1提高了大麦种子锌含量2倍以上[19]。在水稻中,OsZIP1的异位表达提高了烟草和小米中的锌含量[36],OsZIP4、OsZIP5、OsZIP8和OsZIP9的超表达都显著提高了根部锌的富集, 降低了植株地上部分的锌含量[14,16,37]。OsZIP4的过量表达于甘薯块根锌含量提高[39]。OsZIP7对锌在根系木质部卸载和节部的维管束间转移中起着不可或缺的作用, 优先向正在发育的组织和水稻籽粒输送锌[40]。过量表达OsZIP7于拟南芥, 转基因植株地上部锌含量提高了25%[41]。

