外源水杨酸提高云麻1号(Cannabis sativaL.)对铜胁迫的耐受性
项嘉铭 戴 茜 刘立军
华中农业大学植物科学技术学院, 湖北武汉 430070
大麻(Cannabis sativaL.)是大麻科(Cannabaceae)大麻属(Cannabis)的一年生草本植物, 工业大麻是指四氢大麻酚(Tetrahydrocannabinol, THC)的含量低于0.3%的大麻, 多用于纤维用途, 也称火麻或汉麻。中国是世界上最早开始栽培并使用工业大麻纤维的国家之一, 工业大麻的纤维产品及其副产品仍在国民生活中发挥着重要作用[1]。目前, 黑龙江、云南2省均可合法种植工业大麻, 吉林、山西、安徽等省份的工业大麻种植面积也很大。
铜(copper, Cu)是一种与人类生活息息相关的金属元素, 其延展性、导热性和导电性极佳, 在自然界中广泛存在。铜是植物生长的必需元素, 参与植物光合作用、线粒体建成及呼吸作用、碳氮代谢等重要生理过程, 还是乙烯受体的一部分, 有研究指出,植物体内超过一半的铜存在于叶绿体中, 参与光合作用[2]。植物体中, 铜与铁(iron, Fe)的代谢密切相关,都以多种氧化还原态存在, 可作为电子传递链的重要辅助因子, 但过量的铜也会对植物造成氧化性损伤[3]。中国是世界上最大的铜生产和消费国[4], 随着铜的过量开采和使用, 铜尾矿砂及采矿废水等对铜矿周围农田和土壤均造成极大的重金属污染, 对作物生长产生恶劣的影响[5]: 环境中过量的Cu2+会抑制植株生长[6]; 并通过破坏内囊体膜结构, 影响色素合成等途径阻碍植株的光合作用[7]。在铜胁迫下,植物在不利的外界条件下生长, 活性氧(reactive oxygen species, ROS)极易大量累积; 同时, 过量的铜可以通过铜类芬顿反应产生ROS, 并与细胞质膜和细胞器膜发生膜质过氧化反应(lipid peroxidation),造成丙二醛(malondialdehyde, MDA)的累积, 产生氧化损伤[8-9]。
黑龙江的铜资源储量占全国的6.81%, 山西和安徽分别占3.55%和2.17%, 而云南则占了全国的16.60%, 居全国第2位, 这些铜矿资源丰富的省份也恰好是我国工业大麻的主种植区, 因此, 从云南,甚至是全国范围来看, 工业大麻的种植受铜金属逆境胁迫的影响较大, 探究如何利用栽培措施增强工业大麻耐铜性具有重要意义。
水杨酸(Salicylic acid, SA)是一种在植物体内普遍存在的酚类化合物, 化学名称为“邻羟基苯甲酸”, 生物合成主要包括异分支酸合成酶(isochorismate synthase, ICS)途径和苯丙氨酸解氨酶(phenylalanineammonialyase, PAL)途径2种[10-11]。SA属于植物的次级代谢产物, 但其能调控和影响植物的众多生理过程[12], 施用SA可以促进小米的开花过程[13]; 在某些植物的花结构中, SA快速累积,并刺激产热[14]。SA不仅在植物抗病虫方面有重要作用, 也参与抵御植物非生物逆境胁迫(如盐渍、干旱、低温、重金属和紫外线等)[15], 提高作物对重金属胁迫耐性是第一个被证实的SA增强作物应对非生物胁迫耐受能力的案例[16]。研究表明, 外源SA可以降低铜胁迫下细胞液的电导率和透性, 保护细胞膜的完整性[17], 其机制可能是SA缓解铜胁迫下葡萄糖转入细胞壁的抑制效应, 减轻木质化, 促进植物生长[18], 同时, SA下调了质膜上转运蛋白的表达, 抑制Cu2+的进入[19]。此外, 外源SA可诱导铜胁迫下植物体内的游离氨基酸和原儿茶酸(protocatechuic acid, PCA)大量累积[20-21], 增强植物的螯合作用; 并增强抗氧化系统[22], 从多维度增强植株对铜胁迫的耐受性。利用SA缓解作物的重金属毒害作用已成为植物抗逆的热点之一, 在镉(cadmium, Cd)、锌(zinc, Zn)、镍(nickel, Ni)等重金属胁迫下进行了大量的研究[23-25]。本研究通过对Cu胁迫下云麻1号进行外源SA叶面喷施, 探究SA对工业大麻铜耐性和铜富集能力的影响, 并通过转录组测序分析外源SA作用的生理生化机制, 筛选、克隆工业大麻抗铜胁迫基因, 为工业大麻在铜污染土壤中种植和利用提供理论支撑。
1 材料与方法
1.1 试验材料
本试验根据前人的研究[26], 选择铜敏感型品种云麻1号(Yunma 1, Y1), 由云南大学提供。
1.2 试验方案
1.2.1 外源水杨酸缓解铜胁迫下苗期云麻1号生长抑制试验 选取均匀饱满的云麻1号种子, 在水中浸泡12 h后育苗, 当大麻苗长至1对真叶时, 将麻苗移入营养液中水培生长, 营养液根据刘飞虎等[27]的方法配置。麻苗在1/2 Hoagland营养液中锻炼至4对真叶时, 进行铜-SA双因素试验, 其中铜胁迫浓度为50 mg L-1, 即设置处理为C0S0(无铜处理, 无SA处理)、C0S1(无铜处理, 有SA处理)、C1S0(有铜处理, 无SA处理)和C1S1(有铜处理, 有SA处理),每个处理设置3次重复。SA处理浓度为300 μmol L-1,由预试验确定, 处理方法为在麻苗胁迫1周后喷施在叶片上, 以叶片滴水为标准, 每3 d喷施1次, 共3次, 对照用纯水进行喷施。在SA处理1周后取样,测定植株的MDA含量、SOD、POD、CAT活性等指标。
留取上述试验中4个处理叶片鲜样若干, -80℃冰箱中留存待提取RNA进行转录组测序分析。将各处理叶片RNA作等量混样, 作为1个生物学重复,每个处理设置3个重复。
1.2.2 外源水杨酸影响铜胁迫下工业大麻盆栽试验
利用铜尾矿砂和普通土壤进行盆栽对照试验,铜尾矿砂取自湖北省阳新县赤马山铜矿, 土壤基本信息见表1, 设置处理为C0S0(普通土, 无SA处理)、C0S1(普通土, 快速生长期SA喷施)、C1S0(铜尾矿砂,无SA处理)和C1S1(铜尾矿砂, 快速生长期SA喷施)。

表1 铜尾矿砂和普通土壤基本信息Table 1 Basic information of copper tailings and common soil
本试验选用种植盆种植, 在播种前施基肥, 每盆播15粒种子, 留苗5株, 每个处理15盆。在栽培期间的浇水、追肥、除草等皆按照工业大麻的栽培技术要点执行; SA处理方式为到达快速生长期时喷施4周, 每周1次, 每次以叶片滴水为标准, 其他处理由纯水进行喷施, 喷施浓度为300 μmol L-1。待工业大麻达到工艺成熟期, 收获麻纤维并测定地上部和地下部干重, 并按地上部、地下部与麻纤维分别烘干、粉碎过筛, 测定铜含量, 计算铜的富集系数和转运系数。
1.3 测定方法
1.3.1 抗氧化指标测定 本试验选用苏州格锐思生物科技有限公司提供的试剂盒, 利用硫代巴比妥酸(thiobarbituric acid, TBA)法测定丙二醛(MDA)含量[28]; 利用氮蓝四唑(nitro-blue tetrazolium, NBT)法测定超氧化物歧化酶(SOD)活性[29]: 利用过氧化氢显色法测定过氧化氢酶(CAT)活性[30]; 利用愈创木酚法测定过氧化物酶(POD)活性[31]。
1.3.2 铜含量及相关指标 铜含量利用硝酸消煮法测定: 植物样本于消解管中, 每管加入H2O2溶液和硝酸并在微波消解仪中消解干净, 将消解管内剩余溶液用ddH2O定容, 利用安捷伦(Aglient)公司的240FS AA火焰原子吸收光谱仪测定铜含量。
富集系数(Germination index, GI)=工业大麻全株铜含量/土壤铜含量
转运系数(vigor index, VI)=地上部铜含量/地下部铜含量
1.3.3 工业大麻RNA的提取及反转录 本试验利用TRIzol法提工业大麻的RNA: 叶片在TRIzol下磨匀, 加入氯仿剧烈震荡后静置, 离心后吸上层相于异丙醇中, 混匀后静置; 离心后倒去上清液,加入乙醇, 轻柔混匀后离心; 倒去上清液, 加DEPC水溶解RNA。
选用 Roche公司的 Transcriptor first strand cDNA synthesis kit反转录试剂盒完成工业大麻RNA的反转录。
1.3.4 荧光定量PCR 利用前期选定CsCIPK25、CsWRKY32两个基因进行实时荧光定量PCR验证抗逆基因表达分析, 内参基因选用CsUBQ, 通过NCBI网站的Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)网页在线设计qRT-PCR所需的特异性引物, 所用引物见表2。

表2 qRT-PCR所用引物Table 2 Primers for qRT-PCR
1.3.5 cDNA文库构建及测序 利用TRIzol法提取满足测序条件的RNA后, 委托上海派森诺生物科技有限公司对相关RNA样品进行文库构建, 并在Illumina NovaSeq平台上进行测序, 本试验选用的参考基因组来自本研究室提供的工业大麻全长基因组。转录组测序完成后, 先对原始下机数据(Raw data)进行过滤, 将过滤得到的高质量序列(Clean data)与工业大麻参考基因组比对, 进一步分析各基因表达水平的差异, 并作富集分析与聚类分析。
1.4 数据分析
采用Microsoft Excel、SPSS 16等软件进行数据整理和分析, 采用最小显著差法(Least significant difference, LSD)以及双侧t检验法比较处理间的差异性。利用GraphPad Prism软件制图。
2 结果与分析
2.1 外源水杨酸对铜胁迫下苗期云麻1号根系生长的影响
在云麻1号(Y1)苗期水培试验中, 对胁迫2周(SA喷施1周)的Y1根系进行扫描, 结果如图1-A,在没有铜胁迫毒害下, SA的施用对根的生长没有较大影响; 当环境中存在铜胁迫时, Y1根系生长受强烈抑制, 表现在主根萎缩, 侧根和根毛稀疏; 当在铜胁迫下施用SA, 极大地缓解了Cu2+对根生长的毒害作用, 根系生长向正常情况恢复, 主根伸长、侧根和根毛也恢复生长。
铜胁迫下, 苗期Y1的根长、根表面积、根体积及根尖数均受到显著抑制, 而外源SA的施用可以缓解这种抑制效应, 其中SA施用对铜胁迫下Y1根表面积生长有显著影响, C1S1根表面积比C1S0增大41.6%; 对根长、根体积及根尖数影响未达到显著,但仍提高87.8%、3.4%及26.8% (图1-B, C)。
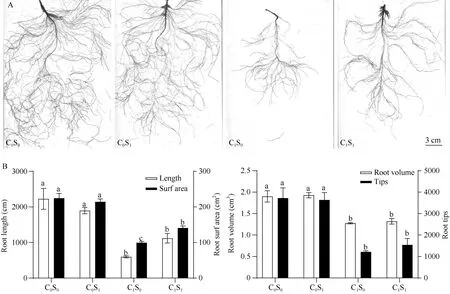
图1 铜胁迫及水杨酸喷施对苗期云麻1号根系生长的影响Fig. 1 Effects of copper stress and SA spraying on root growth of Yunma 1 at seedling stageC0: 无Cu处理; C1: Cu胁迫; S0: 无SA处理; S1: SA处理。不同小写字母表示处理间在0.05概率水平差异显著。C0: no Cu treatment; C1: copper stress; S0: no SA treatment; S1: SA treatment. Different lowercase letters indicate significant differences between the treatments atP< 0.05.
2.2 外源水杨酸对铜胁迫下全生育期云麻1号生长的影响
在快速生长期对Y1叶面喷施SA, 在工艺成熟期收获全株。由图2可知, 铜胁迫抑制了Y1的生长,植株外观矮小, 叶片稀疏, 根系生长受抑制; 在无铜胁迫下, SA处理组C0S1外观与对照C0S0并无明显差异, 但在铜胁迫下, SA处理组C1S1的生长情况优于C1S0, 表明外源SA可以促进工业大麻地上部生长, Cu2+的毒害效应得到缓解。

图2 水杨酸处理对铜胁迫下云麻1号生长的影响Fig. 2 Effects of SA treatment on the growth of Yunma 1 under copper stressC0: 普通土壤; C1: Cu污染土壤; S0: 无SA处理; S1: SA处理。不同小写字母表示处理间在0.05概率水平差异显著。C0: the ordinary soil; C1: copper tailings sand; S0: no SA treatment; S1: SA treatment. Different lowercase letters indicate significant differences between the treatments atP< 0.05.
由表3可知, 在相同的SA处理下, 种植于铜污染土壤的Y1所有指标均小于种植于普通土壤的,大部分差异显著, C0S0与C1S0的株高和地上部干重差异达到极显著, 表明铜胁迫对工业大麻的生长具有较强的抑制作用。
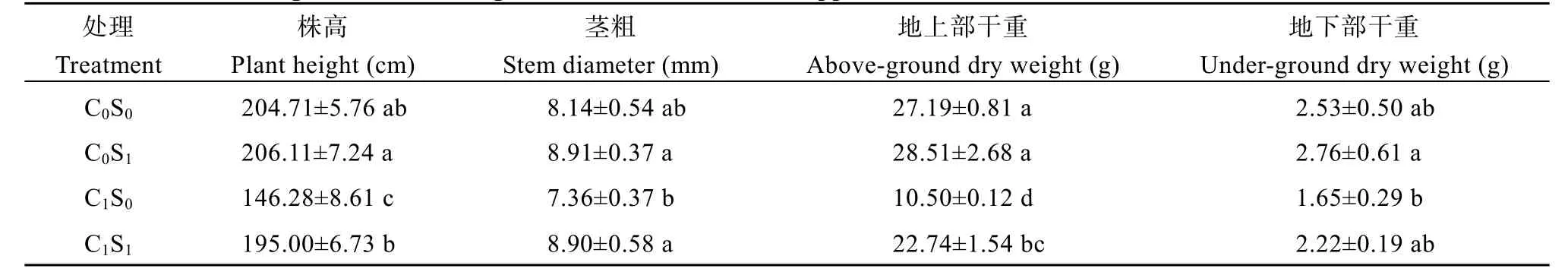
表3 外源水杨酸对铜胁迫下云麻1号生长的影响Table 3 Effects of exogenous SA on the growth of Yunma 1 under copper stress
对种植于普通土壤的处理进行分析, 喷施SA处理的Y1株高、茎粗、地上与地下部干重分别提高0.68%、9.46%、4.85%、9.09%, 但差异不显著。对种植于铜污染的处理进行分析, 外源SA处理缓解了因铜胁迫带来的生长抑制效应, Y1株高、茎粗、地上与地下部干重分别提高33.31%、20.92%、116.57%、34.55%, 显著提高工业大麻铜耐性。
2.3 外源水杨酸对铜胁迫下云麻1号活性氧清除系统的影响
在Y1苗期水培试验中, 对4个处理工业大麻的MDA含量进行测定, 结果如图3。铜胁迫下C1S0处理的MDA含量显著高于其他3个处理, 约为对照的2.26倍; C0S1与对照的MDA含量无显著差异, 表明外源施用SA不会对工业大麻造成损伤。而铜胁迫下利用外源SA处理能显著降低作物体内的MDA水平, C1S1的MDA含量与无胁迫组无显著差异, 处于同一水平。

图3 外源水杨酸对铜胁迫下苗期云麻1号活性氧清除系统的影响Fig. 3 Effects of exogenous SA on reactive oxygen species scavenging system of Yunma 1 at seedling stage under copper stress处理同图1。不同小写字母表示处理间在0.05概率水平差异显著。Treatments are the same as those given in Fig. 1. Different lowercase letters indicate significant differences between the treatments atP< 0.05.
对苗期Y1体内SOD、POD和CAT活性进行测定发现, 铜胁迫下苗期Y1的SOD活性显著高于无胁迫组, 且C0S0和C0S1无显著差异, 表明在铜胁迫下SOD活性提高以消除过量的ROS; 在SA处理下,Y1体内SOD活性进一步提高, 达到C1S0的1.13倍,差异显著。相比于其他3组处理, 胁迫组C1S0的POD和CAT活性都显著降低, 其中POD活性为对照的23.6%, CAT活性仅为对照的19.3%。C0S1与对照相比, 其POD和CAT活性没有显著差异, 表明在没有胁迫的情况下, 外源施用SA不会对作物的活性氧清除系统有太大影响。在铜胁迫下施用SA可以显著提高活性氧清除系统的清除能力, 是C1S0的4.82倍; 而CAT活性显著低于无胁迫组, 但仍高于C1S0,是其的2.02倍, 达到显著。
2.4 外源水杨酸对铜胁迫下云麻1号铜富集的影响
盆栽条件下, 收获工艺成熟期Y1全株, 并分别测定各部位含量, 结果如图4。C1S0处理地上部铜含量显著高于其他处理, 约为对照的1.85倍, 而其他处理之间无显著差异, 可见外源SA处理可以显著降低工业大麻地上部铜含量, C1S1仅为C1S0处理的55.1%。从地下部铜含量来看, 铜胁迫下生长的工业大麻根系累积了高浓度的Cu2+, C1S0处理的铜含量约为对照的14.8倍; 而外源SA处理可以进一步增强工业大麻根系在铜尾矿砂土中富集铜的能力,C1S1相比无SA处理组(C1S0)提高113.0%; 而在普通土壤种植的工业大麻SA处理后根系铜含量与对照无显著差异。
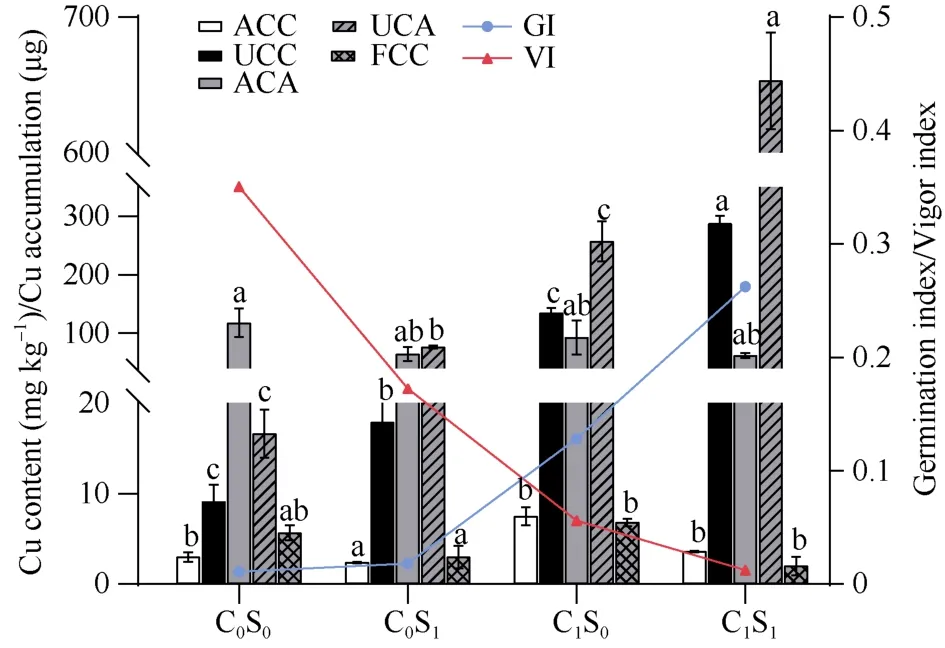
图4 外源水杨酸对铜胁迫下云麻1号铜富集的影响Fig. 4 Effects of exogenous SA on copper enrichment in Yunma 1 under copper stressACC: 地上部铜含量; UCC: 地下部铜含量; ACA: 地上部铜累积量; UCA: 地下部铜累积量; FCC: 纤维铜含量; GI: 富集系数;VI: 转运系数。处理同图2。不同小写字母表示处理间在0.05概率水平差异显著。ACC: the above-ground Cu content; UCC: under-ground Cu content;ACA: the above-ground Cu accumulation; UCA: under-ground Cu accumulation; FCC: fiber Cu content; GI: the germination index; VI:vigor index. Treatments are the same as those given in Fig. 2. Different lowercase letters indicate significant differences between the treatments atP< 0.05.
由于各处理地上部铜含量差异不大, 而普通土壤种植的Y1生物量高于铜尾矿砂土中种植的, 因此铜累积量无明显规律, 需结合生物量和铜含量共同分析, 其中C1S1处理地上部铜累积量最低, 是对照的59.4%, 表明快速生长期喷施SA可能通过减小地上部铜累积增强植株耐铜性。从地下部铜累积量来看, 铜胁迫下Y1根系铜累积量显著高于无胁迫处理, C1S1铜累积量约为C1S0处理的2.27倍, 差异达显著。该种植模式下收获的各处理麻纤维铜含量差异不大, 仅C1S0处理显著高于其他处理, 其余差异均未达到显著, 以C1S1最低, 是对照C0S0处理的35.3%, 证明快速生长期喷施SA抑制了Cu2+在工业大麻麻纤维中的富集。
分析外源SA施用对Y1铜富集系数和转运系数的影响: 对比C1S0, SA处理提高了工业大麻对环境中铜的富集能力, 提高富集系数到120.3%, 但未达到显著; 对转运系数来说, C1S1处理显著提高工业大麻根系对环境铜的吸收和富集能力, 而地上部积累量则差异不大, 因此转运系数显著低于C1S0。
2.5 水培条件下外源水杨酸对铜胁迫下云麻1号转录组的影响
2.5.1 外源水杨酸影响铜胁迫下云麻1号差异基因表达分析 利用DESeq对差异基因的表达水平进行分析, 结果如图5-B: 与对照处理C0S0相比, 仅用SA处理组C0S1有4115条基因显著上调, 2711条基因显著下调, 而铜胁迫组C1S0、C1S1显著上调的基因分别有6111条和5817条, 显著下条的基因有4971条和4370条。同为铜胁迫下的处理, C1S0和C1S1相比有2910条基因显著上调, 2640条基因显著下调。
总的来看, 对照组与C1S0和C1S1两组处理间的差异基因较多, 而这2组处理相比差异基因则少于其他处理的对比, 说明造成基因表达差异的首要诱因是外界过量的铜毒害造成的。
利用维恩图对不同处理间差异基因表达情况进行进一步分析(图5-A, C)发现, 仅因SA处理而特有的差异基因数为576; 在铜胁迫下特有的差异基因数为951; 在铜胁迫下, 由SA处理诱导的差异基因数为384; 在外源SA处理下, 由铜胁迫诱导产生的差异基因数为456; 所有处理间共有的差异基因数量为147。
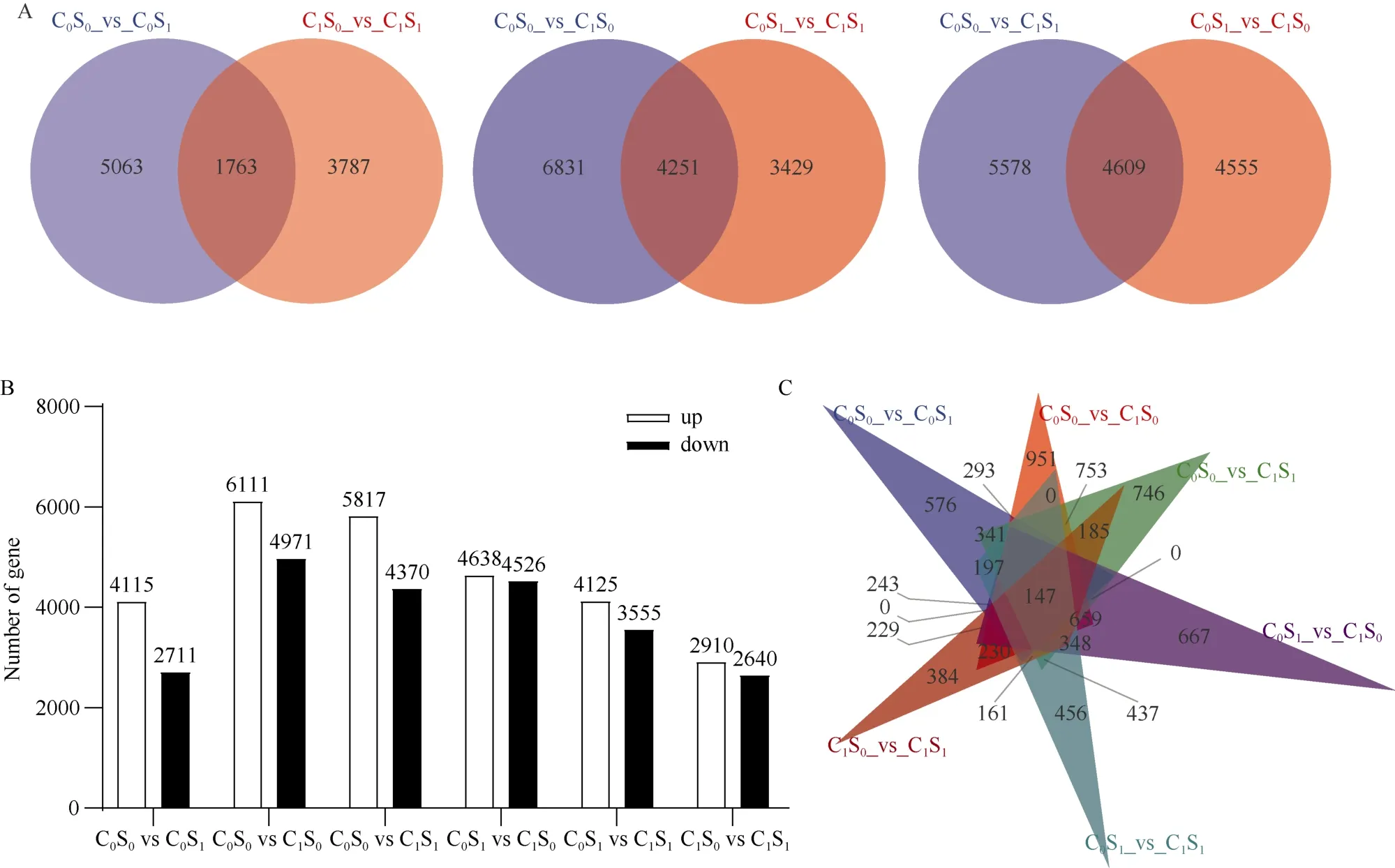
图5 铜胁迫及水杨酸喷施对苗期云麻1差异基因表达的影响Fig. 5 Effects of copper stress and SA spraying on the differentially expressed genes of Yunma 1 at seedling stageA: 转录组测序各处理间差异基因表达情况; B: 外源水杨酸对铜胁迫下工业大麻差异基因表达的影响; C: 转录组测序所有处理间差异基因表达情况。处理同图1。A: Differential gene expression among treatments in transcriptome; B: Effects of exogenous SA on differential gene expression of industrial hemp under copper stress; C: Differential gene expression among all treatments in the transcriptome. Treatments are the same as those given in Fig. 1.
2.5.2 差异表达基因GO功能富集分析 对照组与C1S0之间的差异表达基因共注释富集到4651个GO条目, 结果如图6-A。其中在上调的差异表达基因显著富集的15个GO条目中, 细胞组分有7个, 主要涉及核糖体; 分子功能有2个, 主要涉及结构分子活性和核糖体结构成分; 生物过程有6个, 主要涉及肽代谢、翻译及生物合成等过程。在下调的差异表达基因显著富集的15个GO条目中, 细胞组分有5个, 主要涉及光系统II析氧复合物; 分子功能有3个, 主要涉及焦磷酸酶活性、酰基辅酶A脱氢酶活性和磷酸酯水解酶活性; 生物过程有7个, 主要涉及支链氨基酸分解代谢、细胞调节以及去磷酸化。
对C0S0vs C1S0间的差异表达基因显著性最强的部分条目作topGO分析发现, 在铜胁迫作用下,差异表达基因主要富集在α-氨基酸分解代谢和4-磷酸赤藓糖/磷酸烯醇丙酮酸家族氨基酸代谢, 并共同指向L-苯丙氨酸代谢过程; 其次, 富集结果显示工业大麻的铜抗性与肉桂酸生物合成和核糖体相关;第三, 分子功能中差异表达基因显著富集在苯丙氨酸解氨酶活性与氨基酸跨膜转运蛋白活性条目上。
C1S0与C1S1之间的差异表达基因共注释富集到3731个GO条目, 结果如图6-B。其中在上调的差异表达基因显著富集的15个GO条目中, 分子功能有5个, 主要涉及葡萄糖基转移酶活性、木葡聚糖: 木葡糖基转移酶活性; 生物过程有10个, 主要涉及木葡聚糖代谢、光合作用、半纤维素代谢和细胞壁大分子代谢。在下调的差异表达基因显著富集的15个GO条目中, 细胞组分有7个, 主要涉及无膜细胞器;生物过程有6个, 主要涉及核糖体生物合成、核糖核蛋白复合物生物合成和有机氮化合物生物合成。
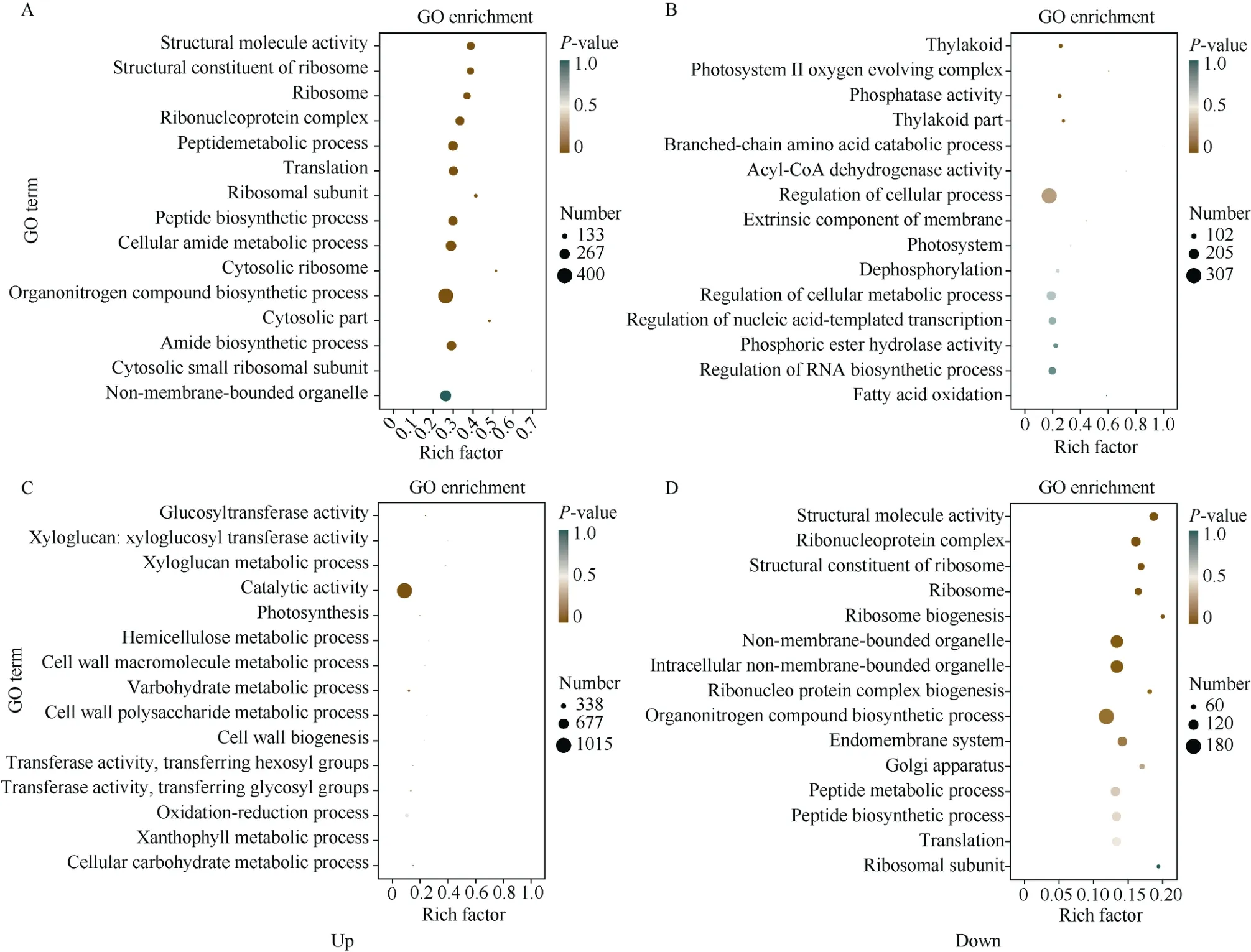
图6 差异表达基因GO富集分析Fig. 6 GO analysis of differentially expressed genesA: C0S0vs C1S0-GO; B: C1S0vs C1S1-GO。处理同图1。Treatments are the same as those given in Fig. 1.
对C1S0vs C1S1间的差异表达基因显著性最强的部分条目作topGO分析发现, 在铜胁迫作用下,外源SA处理下的工业大麻差异表达基因主要通过影响半纤维素和木葡聚糖代谢调控细胞壁的多糖代谢过程, 对细胞壁结构造成改变; 其次富集在叶黄素代谢和磷脂酰胆碱生物合成过程条目; 在MF中差异表达基因显著富集在果糖二磷酸醛缩酶活性、葡萄糖苷酶活性、木葡糖基转移酶活性和氧化还原酶活性条目上。
2.5.3 差异表达基因KEGG功能富集分析 对照组与C1S0之间的差异表达基因在KEGG数据库中共注释富集到126条代谢通路, 其中在上调的差异表达基因显著富集的15条代谢通路中(图7-A), 3条属于遗传信息处理, 主要涉及核糖体以及RNA降解;12条属于新陈代谢, 主要涉及苯丙氨酸代谢、氨基糖和核苷酸糖代谢以及异喹啉生物碱合成。在下调的差异表达基因显著富集的15条代谢通路中, 1条属于遗传信息处理, 涉及泛素介导的蛋白水解; 2条属于细胞过程, 主要涉及过氧化物酶体和细胞自噬;12条属于新陈代谢, 主要涉及缬氨酸、亮氨酸和异亮氨酸降解、脂肪酸降解以及乙醛酸和二羧酸代谢。

图7 差异表达基因KEGG富集分析Fig. 7 KEGG analysis of differentially expressed genesA: C0S0vs C1S0-KEGG; B: C1S0vs C1S1-KEGG。处理同图1。Treatments are the same as those given in Fig. 1.
C1S0与C1S1之间的差异表达基因在KEGG数据库中共注释富集到121条代谢通路, 结果如图7-B。其中在上调的差异表达基因显著富集的15条代谢通路中(图7-B), 1条属于组织系统, 涉及植物昼夜节律; 14条属于新陈代谢, 主要涉及苯乙醛酸和二羧酸代谢、光合生物中的碳固定以及类胡萝卜素生物合成。在下调的差异表达基因显著富集的15条代谢通路中, 4条属于遗传信息处理, 主要涉及核糖体及RNA降解; 新陈代谢中主要涉及半胱氨酸和蛋氨酸代谢、果糖和甘露糖代谢以及氨基糖和核苷酸糖代谢。
2.6 水培条件下外源水杨酸处理对铜胁迫下苗期云麻1号抗性基因表达的影响
CIPKs是指作物CBL互作丝氨酸/苏氨酸蛋白激酶, 与钙调磷酸酶B蛋白CBLs互作, 调节作物Ca2+的信号传导, 通过对离子通道、转运蛋白、植物激素和转录因子等的调控增强作物应对非生物胁迫的耐受性[32]。由图8可知,CsCIPK25在C0S1和C1S1中表达水平接近, 分别为对照的4.2倍和3.8倍, 在C1S0中表达水平仅为对照的2.2倍。表明外源SA和铜胁迫均能提高工业大麻CsCIPK25的表达水平,且SA对其表达水平的提高更大。
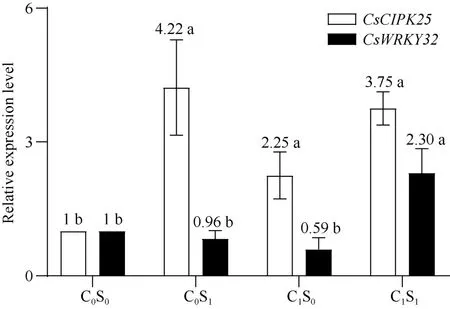
图8 水杨酸处理对铜胁迫下云麻1号基因表达影响Fig. 8 Effects of SA treatment on the differentially expressed genes of Yunma 1 under copper stress处理同图1。不同小写字母表示处理间在0.05概率水平差异显著。Treatments are the same as those given in Fig. 1. Different lowercase letters indicate significant differences between the treatments atP< 0.05.
WRKY转录因子家族是植物最重要的转录因子之一, 除对作物生长发育的调控外[33], WRKY转录因子还可以增强作物对多种生物或非生物胁迫的耐受性[34]。在无铜胁迫情况下, 施用SA对CsWRKY32基因表达水平无显著影响; 铜胁迫逆境下,CsWRKY32表达水平下调, 仅为对照的59.0%, 但仍未达到显著差异。铜胁迫下施用SA使工业大麻CsWRKY32基因表达水平显著提高, 是对照的2.3倍,C1S0处理的3.9倍, 表明CsWRKY32基因可能是铜胁迫下特异性响应SA表达的抗性基因。
3 讨论
3.1 云麻1号对铜毒害的生理响应
铜作为人类历史发展和科技进步中不可或缺的重金属材料, 其多年来的广泛使用也带来广域性的严重铜污染; 铜是植物生长所需的基础元素, 但过度的铜污染将严重阻碍高等植物对其他营养元素的吸收利用, 破坏植物体内正常的组织结构和功能,抑制植物生长[35], 铜也将经可食用作物被人体富集,带来健康风险[36]。
水培条件下, 铜胁迫导致工业大麻主根缩小、变细, 大部分根毛凋亡、零落, 整体根系呈浅灰色,根尖淡蓝色。盆栽试验表明根系是Cu2+吸收和储存的主要场所, 因此, 铜胁迫下工业大麻根系的损伤极有可能是储存在根系的过量Cu2+引发的毒害。此外, 有研究指出[37-38], 作物应对重金属胁迫的重要机制是加强根系对Cu2+的固定作用, 通过螯合作用等途径降低Cu2+的生物毒性, 并阻止Cu2+向地上部运输, 这也与本试验结论不谋而合。在此基础上我们进一步猜想, 吸收器官在积蓄大量Cu2+后, 作物可能通过控制其凋亡来有效降低总铜含量, 防止铜造成更深的伤害, 并减少对环境中Cu2+的吸收, 保护其余组织正常生长。盆栽试验中的根系生长也符合这一规律。
在铜胁迫下, 植株吸收的Cu2+除部分被螯合运输进液泡外, 其他将对细胞膜、细胞器及蛋白质、DNA等大分子造成损伤, 并产生ROS, 造成氧化损伤[39]。在水培试验中, 当ROS产生速率大于抗氧化系统的清除速率, ROS在植株体内积郁, 并造成进一步的损伤; 在长时间的氧化损伤后, 作物抗氧化系统受损, ROS清除能力变弱, 抗氧化酶活性显著降低。当植株处于重金属胁迫时, 体内ROS发生脂质过氧化作用, 产生MDA, 因此MDA的含量可作为作物受环境胁迫程度的标志[40]。在铜胁迫下, 苗期工业大麻POD和CAT活性显著低于对照, MDA大量累积, 这也是铜胁迫下工业大麻生长发育受抑制, 各项生理指标及生长情况显著低于对照的内在原因之一。
对差异表达基因进行GO功能注释表明, 铜胁迫显著抑制了焦磷酸酶和酰基辅酶A脱氢酶的活性,并抑制工业大麻的光合作用: 焦磷酸酶被证实与磷运输和代谢相关, 并通过调控磷对植物生长发育和抗逆产生影响[41], 在苎麻中发现, 一种液泡膜质子焦磷酸酶基因表达受镉胁迫诱导, 促进作物对Cd2+的区隔化作用, 增强镉耐性[42]; 酰基辅酶A脱氢酶与脂肪酸降解和线粒体的电子传递链相关[43]。工业大麻应对铜胁迫的重要机制之一即促进4-磷酸赤藓糖/磷酸烯醇丙酮酸家族氨基酸代谢, 而4-磷酸赤藓糖是苯丙氨酸合成的底物, 因此苯丙氨酸的合成和代谢受调控, 并提高苯丙氨酸解氨酶(PAL)的活性,PAL特异性催化苯丙氨酸生成反式肉桂酸, 由肉桂酸转化的肉桂醛是木质素的重要底物[44], 综上, 工业大麻可能通过改变木质素的含量和组分, 影响对Cu2+的固化和运输来抵御铜胁迫。此外, 研究表明作物体内PAL活性受外源SA调控[45], 青稞中发现PAL基因可与其他抗性基因协同增强作物镉耐性[46]。
3.2 外源水杨酸对云麻1号铜毒害的缓解效应
水杨酸(SA)是植物重要的激素和信号分子, 参与调控植物从生长发育到抗逆免疫的众多生理过程。在外源SA增强镉耐性的研究中指出, 外源SA对耐性影响具有剂量依赖性, 且不同处理方法所需剂量和效果各有差异, 其中以根系吸收效果较好,浸种及叶面喷施所需剂量更大[23]。本研究为贴近实际生产情况, 选用叶面喷施法。对铜胁迫下Y1作外源SA处理, 其生长抑制情况得到明显缓解。
许多研究指出, 外源SA增强作物重金属胁迫耐受性的重要机制是调节根系对环境中重金属离子的吸收和转运, 依据作物种类不同一般有2种调节机制。第一种机制是外源SA抑制作物对重金属离子的吸收和贮存, 如用外源SA喷施铜胁迫下菊芋幼苗, 根、茎、叶中的铜含量显著下降, 生长抑制得到缓解[47], 细胞壁是作物固定重金属离子的重要场所, 外源SA可以促进细胞壁的多糖合成, 调节果胶甲基化, 使细胞壁变厚, 阻止重金属进入植物细胞[48]。另一种调节机制正好相反, Zhang等[49]发现在对镉胁迫下的油菜施加外源SA后, 谷胱甘肽和其他植物螯合素的生物合成途径被激活, 对镉的螯合固定增强, 油菜镉耐性和镉累积量显著提高。盆栽试验中, 在快速生长期喷施SA, 增强工业大麻根系对Cu2+的吸收和固定, 这种固定作用可能通过激活螯合作用实现; 并促进植株生长。
外源SA应对重金属胁迫的另一有效机制是增强作物ROS清除系统能力, 减少氧化损伤[50]。在本试验中, 外源SA促使铜胁迫下苗期工业大麻POD活性恢复到正常水平, CAT和SOD活性也有显著提高; 当抗氧化酶活性升高后, ROS被清除, MDA水平显著降低, 作物受铜胁迫引起的氧化损伤得到缓解。
外源SA处理可以增强工业大麻对铜毒害的耐性, topGO分析表明, 外源SA显著影响半纤维素和木葡聚糖的代谢, 而这两者是组成细胞壁的重要多糖, 研究表明, 细胞壁中的多糖是应对重金属胁迫和固定重金属离子的重要组分, 半纤维素的上升极大促进作物对Cd2+的固定效应, 增强作物镉耐性[51],因此, 外源SA可能通过改变细胞壁多糖含量, 促进胞壁对Cu2+的吸收固定来增强铜耐性。此外外源SA显著影响果糖二磷酸醛缩酶和葡萄糖苷酶活性,其中果糖二磷酸醛缩酶与光合作用和非生物胁迫相关[52], 而葡萄糖苷酶参与细胞壁形成, 并可增强作物对逆境的耐性[53]。最后, 外源SA显著增强了氧化还原酶活性, 消除累积的ROS。除此之外, 有意思的是仅用外源SA处理同样显著增强PAL活性, 而PAL途径是植物内源SA合成的重要途径, 因此, 外源SA的施用可能促进工业大麻内源SA的合成, 类似现象也在El-tayeb等[20]的研究中被观测到。
对差异表达基因进行KEGG代谢通路分析发现,铜胁迫显著抑制过氧化物酶体条目, 而过氧化物酶体不仅可以消除植株体内ROS, 同时是ROS水平的感受器和ROS信号网络的调节物质[54], 故铜胁迫下工业大麻受到更大氧化损伤。铜胁迫下施用外源SA显著促进光合作用中的碳固定以及类胡萝卜素生物合成通路, 提高光合作用效率和物质累积速率, 增强铜耐性。
3.3 外源水杨酸对铜胁迫下抗性基因表达的影响
外源SA和铜胁迫对作物的影响是复杂而多层次的, 且都能通过调控相关基因的表达对作物生长产生影响。本试验筛选出CsCIPK25和CsWRKY32这2个响应外源SA增强工业大麻铜耐性的抗性基因。有报道称在拟南芥中过表达AtCIPK2或HsCIPK2可以增强种子及根系对重金属汞、铜、镉的耐受性[55]。本试验中, 所有处理下CsCIPK25表达水平均显著高于对照, 但外源SA处理下表达水平更高, 表明CsCIPK25可能受铜胁迫与SA双重诱导,且SA对其影响更强。在铜胁迫下,TaWRKY74表达显著提高, 并诱导TaGST1表达, 促进作物GSH累积, 缓解铜毒害[56]; 还有研究表明,MdWRKY11可以直接促进铜胁迫下铜转运蛋白的转录和表达, 增强铜耐性[57]。本试验中,CsWRKY32表达受抑制, 而施用外源SA后表达显著提高, 表明CsWRKY32受到铜胁迫下外源SA的特异性诱导而表达, 并可能通过调控对Cu2+的吸收、转运和固定来增强铜耐性。
综上所述,CsCIPK25和CsWRKY32表现出极大的铜胁迫抗性基因潜力, 在铜胁迫下施用外源SA,可以特异性诱导表达, 并通过调控作物离子转运、铜吸收固定、金属螯合物合成等多种途径增强铜胁迫下工业大麻的铜耐性。
3.4 外源水杨酸对云麻1号铜富集的影响
随着金属矿石的开采和冶炼, 重金属污染日趋严重; 工业大麻具有生物量大, 抗逆性强, 不进入食物链等优良特性, 具有极大的重金属污染土壤修复潜能[58]。有多项研究证实工业大麻可吸收土壤、污水或固体废弃物中的Cu2+, 并富集在根系中, 有的还会被转运至其他器官(茎、叶、种子等), Cu2+的转运与否可能与工业大麻品种高度相关[59]。在当前的研究中, 应努力提高工业大麻在铜胁迫下的耐受能力, 提高对Cu2+的富集并避免Cu2+向纤维、花叶、种子等器官转运, 增强工业大麻对铜污染土壤的修复力, 提高修复过程中的经济效益。许多研究者致力于利用外源物质增强重金属胁迫耐性和富集能力[60-61], 而外源SA可以调控作物根系对重金属离子的吸收和固定, 因此, 利用外源SA增强工业大麻在铜污染土壤的生物修复能力具有应用前景。
在本试验中, 铜尾矿砂种植的工业大麻地下部铜含量远高于普通土壤种植的, 最高可达对比组的1610.1%, 可见工业大麻具有较强的铜吸收能力; 此外, 外源SA可以抑制Cu2+从地下部向地上部转运。许艳萍等[62]发现, 工业大麻在苗期对铜的转运能力较强, 在工艺成熟期转运能力较弱, 我们认为C1S1处理中地上部铜含量低是外源SA刺激与工业大麻本身铜转运规律共同形成的。
作物铜累积量由铜含量与干物质量两部分决定,由于工业大麻对铜的转运能力较弱, 所以在不同土壤和处理下地上部铜含量差异较小。从地下部铜累积量来看, 由于快速生长期喷施SA带来更大的生物量, 因此C1S1处理下工业大麻铜累积量更大, 这也与Zhang等[49]在外源SA增强作物镉富集试验中的结论类似。
对铜污染下麻纤维的铜含量进行测定发现,C1S1处理下麻纤维铜含量最低, 这可能是快速生长期喷施SA带来的铜转运抑制造成的结果。综上所述, 外源SA处理确实能增强工业大麻在铜污染环境下的适应能力并促进根系对Cu2+的富集和固定,具有很好的环境修复前景。
4 结论
铜胁迫对工业大麻具有明显毒害作用, 通过抑制根系营养吸收功能造成全株生长缓慢; 破坏活性氧清除系统, 导致工业大麻ROS和MDA累积, 造成氧化损伤。外源SA降低了麻纤维铜含量, 并显著增强了工业大麻根系对环境中Cu2+的吸收和固定,地下部铜含量是对比组的1610.1%, 铜累积量是对比组的857.1%, 这可能是通过提高半纤维素和木葡聚糖的代谢及葡萄糖苷酶的活性来完成的。外源SA显著影响铜胁迫下工业大麻果糖二磷酸醛缩酶活性、光合作用中的碳固定以及类胡萝卜素生物合成通路, 促进作物光合作用和干物质累积, 增强耐铜性; 外源SA显著增强了铜胁迫下工业大麻氧化还原酶的活性, 表现为SOD、POD和CAT活性显著高于铜胁迫组, 降低了工业大麻体内ROS和MDA含量, 减少氧化损伤。在铜胁迫下施用外源SA, 可以特异性诱导CsCIPK25和CsWRKY32表达, 并通过调控作物离子转运、铜吸收固定、金属螯合物合成等多种途径增强铜胁迫下工业大麻的耐铜性。

