甘蓝型油菜SGR基因家族的全基因组鉴定与功能分析
唐玉凤 姚 敏 何 昕 官 梅 刘忠松 官春云 钱论文
湖南农业大学农学院 / 南方粮油作物协同创新中心, 湖南长沙 410128
油菜是我国主要种植的油料作物, 其种植面积和产量居世界前列。到2020年, 我国已实现面积、总产、单产、含油量和双低品质“五齐升”, 但10年来我国菜籽油和菜粕产量低于消费量, 导致我国每年进口大量油菜籽来满足国内需求。同时, 随着我国城市化进程的加剧, 导致可用耕地面积逐渐减少[1]。因此, 提高油菜产量和籽粒含油量是解决国内食用油内需矛盾有效途径之一。
叶绿素含量与光合能力有关, 是光合作用的重要组成部分之一, 影响作物产量的重要生理特征[2-3]。梁颖等[4]研究发现油菜叶绿素含量是影响经济产量和生物产量的主导因素。此外, 叶绿素含量不仅影响植物抗逆性、生长和环境的适应性, 同时也影响了含油量积累[5-6]。油菜种子和角果皮中叶绿素含量能直接影响光合磷酸化作用产生ATP和NADPH的量, 影响光合作用, 从而影响含油量的积累[7]。Hua等[8]研究表明在角果发育的过程中, 高叶绿素含量将会提高角果糖和淀粉含量等, 增加种子油脂积累。在油菜角果发育后期阶段高效的光合作用也有利于含油量的积累[9]。提高作物光合作用可以从增加源的数量和改善质的性能两方面开展,例如控制绿叶面积、培育优良的株型、延长植株高效光能期等, 即提高光合作用进而提高产量的主要途径[10]。
滞绿基因STAY-GREEN(SGR)是绿色器官衰老与成熟的关键调控因子, 而滞绿基因SGR1是叶绿素降解的一个关键调控基因[11]。Thomas等[12]将滞绿分为5类, 其中SGR1/NYE1导致的滞绿类型属于C型,因为光合作用和衰老过程不受其突变显著影响, 但后续的研究表明C型滞绿影响了植物的衰老, 如任均等[13]在滞绿的大豆种子中发现SGR导致的滞绿没有显著影响到叶片衰老进程中光合作用效率的下降,但是明显影响衰老叶片中蛋白的降解与转运。最近研究也表明, 在小白菜中发现的sgr突变体延缓了小白菜叶片的衰老, 能长时间保持细胞膜及叶绿体类囊体膜的结构完整性及膜系统透性, 提高细胞膜系统的稳定性, 使膜脂过氧化程度降低, 延长了小白菜的货架期[14]。
本研究对甘蓝型油菜SGR基因家族进行分析,揭示SGR基因家族成员之间高度同源, 且在进化过程中非常保守。利用关联分析检测到1个SNP定位在BnaSGR1a-A01的外显子2区域, 并与叶绿素含量显著关联。共表达网络分析结果表明BnaSGR1a-A01与BnaSGR2-A03直接相连, 与BnaSGR1-C01、BnaSGR1-A08、BnaSGR2-C03、BnaSGR1-C07、BnaSGRL-C06、BnaSGRL-A10等基因间接相连, 共同调节油菜叶绿素含量积累。BnaSGR1a-A01在拟南芥中超表达分析, 揭示了其调控叶绿素降解。
1 材料与方法
1.1 甘蓝型油菜SGR基因家族鉴定与分析
用 staygreen作为关键词在 Pfam 数据库(http://pfam.xfam.org/)查询, 下载staygreen蛋白隐马尔科夫模型, 使用hmmsearch指令进行全基因组序列数据比对, 利用BLASTP比对甘蓝型油菜、甘蓝、白菜基因组, 筛选出对应的SGR候选同源基因。取BLAST和hmmsearch的交集结果, 确定候选基因。在SMART (http://smart.embl-heidelberg.de/)和NCBI保守结构域数据库(CDD; https://www.ncbi.nlm.nih.gov/cdd)检查候选基因是否含有staygreen结构域。拟南芥、甘蓝型油菜、白菜和甘蓝的基因全长序列、CDS序列、氨基酸序列等信息分别在Esembl Plants (http://plants.ensembl.org/index.html)和BRAD(http://brassicadb.cn/)获取。在 GenomeNet (https://www.genome.jp/tools-bin/clustalw)使 用 neighbourjoining (NJ)系统发育方法构建系统发育树以及在Evolview (http://www.evolgenius.info/evolview/)进行美化。在MEME (http://MEME.nbcr.net/MEME/cgibin/MEME.cgi)对拟南芥和甘蓝型油菜SGR基因进行保守结构域分析。使用ProtParam工具(https://web.expasy.org/protparam/)和ProtComp 9.0 (http://linux1.softberry.com/)预测分子量(molecular weight, MW)、等电点(pI)和亚细胞定位。利用TBtools[15]展示基因结构、染色体定位结果及共线性分析。
1.2 试验材料和材料表型生理指标测定
203份中国半冬性甘蓝型油菜材料种植在德国吉森尤斯图斯-李比希大学光照培养室。采用CCM-200叶绿素含量指数测定仪检测叶片苗期和抽薹期的叶绿素含量。叶绿素含量指数测定仪测定在653 nm和931 nm处的吸光度。每个材料测定3个不同的植株。
1.3 叶绿素含量关联分析
Qian等[16]研究中采用Q+K (population structure and kinship)的混合线性模型(mixed linear model,MLM), 利用TASSEL5.0[17]对203份甘蓝型油菜的叶绿素含量进行了全基因组关联分析。基于最优模型的关联分析结果, 利用R软件包QQman (https://www.rdocumentation.org/packages/qqman/versions/0.1.2)绘制曼哈顿图和 Quantile-Quantile散点图(QQman plot)[18]。设定位点与性状显著关联的阈值为P< 4。将与显著SNP处于同一单体型块(r2> 0.55)的区间, 定义为候选关联区间。
50份中国半冬性油菜的全基因组重测序和SNP标记的获得已经被详细的描述[19-20]。利用R软件包GenABEL[21](https://www.rdocumentation.org/packages/GenABEL/versions/1.8-0)对A01和C01染色体上与叶绿素相关的单体型进行区域关联检测。R软件包QQman被用于绘制曼哈顿图和Quantile-Quantile散点图。FDR (false discovery rate)值的计算是利用R语言中的q-value软件包(http://www.Bioconductor.org/packages/release/bioc/qvalue.html), 最终确定在不同年份不同地点间的显著水平的p值(p< 1×10-3)。
1.4 转录组数据分析
通过含油量等品质性状选择了13份种子材料作为转录组分析的样品。取发育15 d角果摘下立即在液氮中冷冻并储存在-80℃直至RNA提取。采用植物总RNA提取试剂盒DP432 (天根生化科技有限公司, 北京)提取极端材料角果的总RNA, 然后将样品送北京百迈客生物科技有限公司构建文库, 并以HiSeq 2000基因分析系统(Illumina公司, 美国)进行RNA-Seq PE100测序分析。将测序的结果比对到甘蓝型油菜 Darmor-bzh reference genome (https://genomevolution.org/CoGe/)。
1.5 共表达网络分析
利用收集的13个半冬性油菜品种转录组数据(RNA-seq)进行转录组学分析, 利用基因表达模式对基因进行分类, 运用加权基因共表达网络分析[22](weighted correlation network analysis, WGCNA)构建共表达网络, 软阈值设置为0.9, Pearson相关系数(Pearson correlation coefficient, PCCs)大于或等于0.50的基因被用于CYTOSCAPE3.7.1进行共表达网络构建[23]。
1.6 超表达载体构建及拟南芥遗传转化
根据BnaSGR1a-A01基因序列设计引物19OV141-F与19OV141-1R, 扩增19OV141T1片段。设计引物 19OV141-1F 与 19OV141-R, 扩增19OV141T2片段。引物19OV141-F与19OV141R以19OV141T1和19OV141T2为模板, 重叠延伸PCR扩增19OV141片段, 引物序列见表1。PC1300S载体用SacI与BamHI双酶切处理并回收, 与PCR扩增产物19OV141进行重组, 重组产物转化大肠杆菌,涂抗性平板。挑选克隆子摇菌, 引物19OV141-F与pCB-seqE菌落PCR验证阳性克隆, 然后进行测序验证。之后使用蘸花法转化拟南芥, 哥伦比亚野生型拟南芥(Columbia-0)为受体, 转化植株收种后, 利用次氯酸钠消毒后接种于含50 mg L-1潮霉素的MS培养基中, 22℃ ± 2℃培养1周后, 挑选正常萌发的阳性植株种植于土壤中, 培养管理至收种。剪取T1代转化植株叶片, 利用T5 Direct PCR Kit (Plant)试剂盒及HPT II特异性引物检测。
1.7 叶绿素含量测定
从OE-BnaSGR1-13、OE-BnaSGR1-14和对照植株中选取3株称取0.01 g拟南芥新叶, 加入1 mL 95%乙醇暗处浸提6 h至叶组织完全变白, 取浸提液测定OD649与OD665(95%乙醇为对照), 叶绿素计算公式[24]为:
1.8 BnaSGR基因表达情况检测
参照植物总RNA提取试剂盒说明书提取植物总RNA, 用反转录试剂盒合成cDNA。在甘蓝型油菜数据库(http://www.genoscope.cns.fr/brassicanapus/)下载BnaSGR1a-A01(BnaA01g12570D)序列, 通过Primer Premier 5软件设计该基因的qRT-PCR特异性引物。引物序列见表1。参照荧光定量试剂盒说明书配置20 μL的反应体系: 2×T5 Fast qPCR Mix(SYBR) 10 μL, cDNA模板1 μL, 正、反向引物(0.2 μmol L-1)各0.8 μL, 去离子水7.4 μL。qRT-PCR反应程序: 95℃预变性1 min; 95℃变性10 s, 55℃退火30 s,72℃延伸15 s, 循环数40个。每个样品3次生物学重复。选用AtACT2(AT3G18780)作为内参基因,采用2-ΔΔCt的方法分析目标基因的表达, qRT-PCR的试验结果由PCR仪自带软件自动导出, 利用GraphPad Prism 9作图。

表1 本研究中所用的引物序列Table 1 Primers used in this study
2 结果与分析
2.1 甘蓝型油菜SGR基因家族成员鉴定及性质分析
利用4个AtSGR(At4G22920、AT4G11910、AT4G44000和AT4G11911)核苷酸和氨基酸序列分别在甘蓝型油菜、白菜和甘蓝的基因组数据库中进行同源序列搜索, 并结合NCBI数据库和SMART数据库中的保守结构域(conservative domain, CD)搜索分析, 最终获得12个甘蓝型油菜SGR基因(BnaSGR)、6个白菜SGR基因(BraSGR)、6个甘蓝SGR基因(BoSGR), 其中12个基因定位到甘蓝型油菜染色体上,BnaSGR同源基因之间长度差异较大,BnaSGR1-C01最长有5975 bp, 而BnaSGLP-Cnn最短仅有983 bp。在甘蓝中, 6个基因定位到染色体上,最长的是BoSGR1-C01, 有 1252 bp, 最短的是BoSGLP-C02, 有982 bp。在白菜中, 有6个基因定位到染色体上,BraSGR1a-A01最长, 有5705 bp, 最短的BraSGR1b-A01仅有804 bp。它们的蛋白质序列长度和基因相对分子质量差异也较大。这些成员理论等电点均大于7, 表明SGR为碱性蛋白。亚细胞定位预测表明22个SGR蛋白定位在叶绿体, 2个定位在质膜上(表2)。
2.2 拟南芥、白菜、甘蓝及甘蓝型油菜的SGR基因进化树和结构分析
拟南芥、甘蓝型油菜与白菜、甘蓝都属于十字花科芸薹属作物, 根据4个物种的SGR蛋白序列构建系统进化树(图1), 直观地反映出28个SGR家族成员的进化和分组归属, 根据进化树, 将SGR蛋白分为4个亚族(SGR1、SGR2、SGRL和SGLP)。在24个SGR基因中鉴定出2组Br-Bo-An-Cn同源基因对(表 2), 即BnaSGR1a-A01、BraSGR1a-A01、BnaSGR1-C01、BoSGR1-C01和BnaSGR1-A03、BraSGR1-A03、BnaSGR1-Cnn、BoSGR1-C03。
SGR基因家族成员外显子、内含子分布(图2)表明,SGRs的内含子、外显子分布有一定规律, 大部分基因有4个外显子, 而BnaSGR2-A03具有5个外显子,BnaSGR1a-A01具有 6个外显子,BnaSGR1b-A01只有3个外显子,BnaSGR1-C01具有12个外显子,BraSGR1a-A01具有11个外显子, 最少的是BraSGR1b-A01, 只有2个外显子。Motif分析发现位于同一亚族的成员其保守基序具有一定的相似性, 大部分基因具有Motif1、Motif2、Motif3、Motif4、Motif5和Motif6, 而AtSGRL、BnaSGRL-A10、BnaSGRL-C06、BraSGRL-Scaffold000123、BoSGRLC06只具有Motif1、Motif2、Motif5,BnaSGR1b-A01、BraSGR1b-A01只具有Motif1和Motif6。说明Motif的亚家族特异性分布可能导致甘蓝型油菜中BnaSGR基因的功能分化。

图2 拟南芥、白菜、甘蓝和甘蓝型油菜SGR基因的系统比较分析Fig. 2 Systematic comparative analysis ofSGRgenes ofArabidopsis thaliana,Brassica rapa,Brassica oleracea, andBrassica napuschromosomes
2.3 染色体定位及共线性分析

?
为了进一步揭示拟南芥、甘蓝型油菜、白菜和甘蓝SGR基因家族进化关系, 对其进行了染色体定位和共线性分析。染色体定位结果显示(图3), 12个BnaSGR基因全部定位到8条染色体上, 分布比较均匀, 每条染色体有1个或者2个BnaSGR基因, 没有串联重复事件。6个白菜BraSGR基因分布在A01、A03、A08和Scaffold000123上, 每条染色体有1个或2个BraSGR基因。6个BoSGR分布在C01、C02、C03、Scaffold000269和C07染色体上, 其中C03上有2个BoSGR基因, 而其他染色体上只有1个。大多数的An-Ar和Cn-Co同源基因对具有相似的染色体位置。

(图3)

图3 白菜、甘蓝、甘蓝型油菜染色体上SGR基因的分布Fig. 3 Distribution ofSGRgenes inBrassica rapa,Brassica oleracea, andBrassica napuschromosomes染色体编号标记在每个染色体的左侧。A和C分别是白菜和甘蓝的染色体; chrA和chrC分别是甘蓝型油菜的A亚组和C亚组染色体;Random意味着基因被随机分配到一个特定的染色体上, chrCnn表示属于C亚基因组但不确定染色体信息。The numbers of chromosomes are labeled on the left side of each chromosome. A and C are the chromosomes fromBrassica rapaandBrassica oleracea; chrA and chrC are the chromosomes of the A-subgenomes and C-subgenomes fromBrassica napus, respectively. Random means genes are distributed randomly to the specific chromosome, and chrCnn is unanchored scaffold that cannot be mapped to a specific chromosome from the C-subgenomes.
而共线性分析图(图4)显示, 拟南芥、甘蓝型油菜、甘蓝、白菜4个物种之间, An和Cn亚基因组与相应的二倍体Ar和Co基因组基本上是共线的。甘蓝型油菜中,BnaSGR1-A03和BnaSGR1-C07、BnaSGR1-A08和BnaSGR1-Cnn与BnaSGRL-A10和BnaSGRL-C06,这3对同源基因紧密相连, 这可能是由于在漫长的进化历史中片段重复和染色体重排造成的。
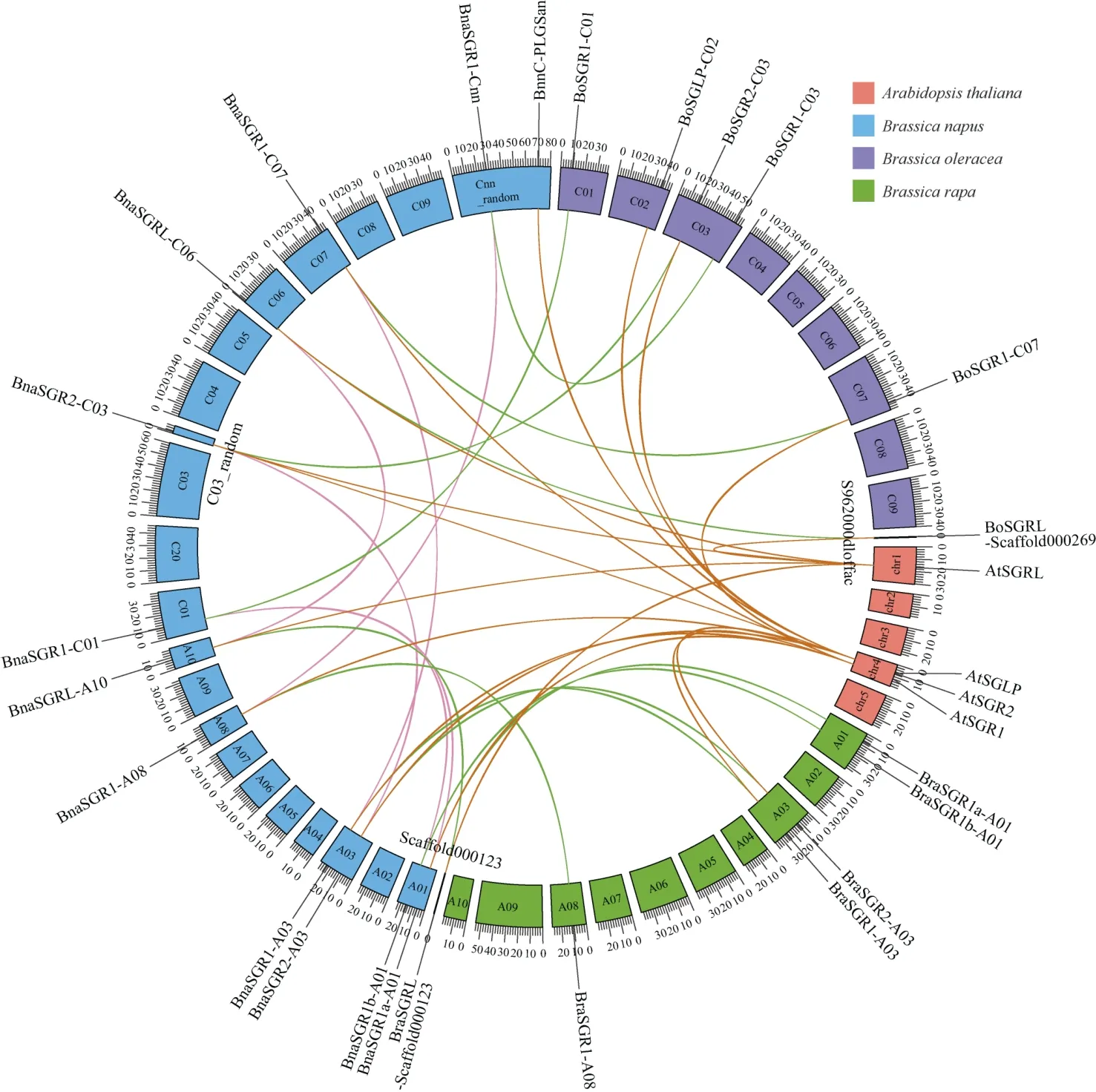
图4 甘蓝型油菜、甘蓝、白菜和拟南芥的SGR基因共线性分析Fig. 4 Syntenic analysis ofSGRgenes inBrassica napus,Brassica oleracea,Brassica rapa, andArabidopsis thaliana同一条粉色曲线上的2个基因是甘蓝型油菜内的线性关系, 同一条绿色曲线是甘蓝型油菜对白菜、甘蓝的线性关系, 同一条棕色曲线是拟南芥对甘蓝型油菜、白菜和甘蓝的线性关系。Syntenic analysis betweenBrassica napusshowed by pink lines. Syntenic analysis betweenBrassica napus,Brassica rapa, andBrassica oleraceaare indicated by green lines. Syntenic analysis amongArabidopsis thaliana,Brassica napus,Brassica rapa, andBrassica oleraceaare indicated by brown lines.
2.4 候选基因的关联分析
在光照培养室中, 203份油菜苗期和抽薹期叶绿素含量全基因组关联分析, 选取-log10(P)>4作为SNP标记与叶绿素含量显著关联的临界值, 在A01染色体上检测到一个 125 kb的单体型区域(6,193,165~6,317,757 bp) 与叶绿素含量相关, 这个区间包含1个与叶绿素含量相关的拟南芥同源基因BnaSGR1a-A01(BnaA01g12570D)。在C01染色体上检测到一个 847 kb的单体型区域(9,059,861~9,906,618 bp) 与叶绿素含量相关, 这个区间包含1个与叶绿素含量相关的拟南芥的同源基因BnaSGR1-C01(BnaC01g14360D) (图5)。在拟南芥中, 已有研究表明SGR1是叶绿素降解的正调节因子,SGR1受各种衰老信号诱导, 编码一个全新的叶绿体蛋白,在植物中高度保守[25]。

图5 203份油菜苗期和抽薹期叶绿素含量全基因组关联分析Fig. 5 Genome-wide association study of chlorophyll content at seedling and bolting stages in 203 rapeseed accessions单体型区域(6,193,165~6,317,757 bp)和单体型区域(9,059,861~9,906,618 bp)与叶绿素含量显著相关。这2个单体型区域包含2个拟南芥直系同源基因BnaSGR1a-A01(BnaA01g12570D)和BnaSGR1-C01(BnaC01g14360D), 这些基因涉及到叶绿素合成。热图显示了这些SNPs之间存在强的连锁不平衡。水平红色虚线表示临界值(-log10(P)=4.0)。ss_GH: 在光照培养室调查苗期叶绿素含量指数, bs_GH: 在光照培养室调查抽薹期叶绿素含量指数。Haplotype region (6,193,165-6,317,757 bp) and haplotype region (9,059,861-9,906,618 bp) were significant association with chlorophyll content. In these haplotype regions carrying two orthologues ofArabidopsisgeneBnaSGR1a-A01(BnaA01g12570D) andBnaSGR1-C01(BnaC01g14360D) are involved in chlorophyll biosynthesis process. The heat map spans the SNP markers in LD with the most strongly associated SNPs. The horizontal red dotted line represents the significant threshold (-log10(P)=4). ss_GH: chlorophyll content index in seedling stage (glasshouse experiments, 2012), bs_GH: chlorophyll content index in bolting stage (glasshouse experiments, 2012).
利用50重测序材料对这2个单体型区间进行进一步分析, 在A01染色体上的单体型区域, 检测到1个SNP (chrA01: 6306874)定位在BnaSGR1a-A01基因区域的外显子2区域, 并与叶绿素含量显著关联(图6-A, B)。通过比较BnaSGR1a-A01基因区域的2个等位基因G和T对应的叶绿素含量和基因表达水平分析, 表明等位基因G对应的材料显示了高的叶绿素含量和基因表达水平(图6-C, D)。
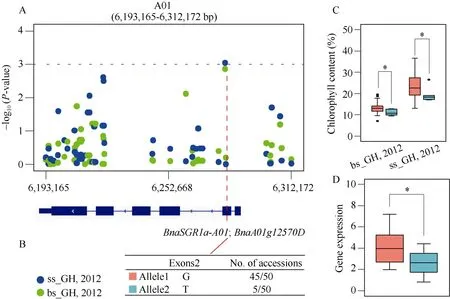
图6 50个重测序材料叶绿素含量候选基因关联分析Fig. 6 Association analysis of candidate genes for chlorophyll content within whole-genome resequencing of 50 accessionsA: 单体型(6,193,165~6,312,172 bp;r2=0.55)区域叶绿素含量的关联分析。蓝色虚线表示全基因组显著性的阈值P值为1.0×10-3。B:BnaSGR1a-A01基因区域变异位点分析。该SNP chrA01:6306874定位于BnaSGR1a-A01基因外显子2区域。C和D: 比较分析等位基因G和T对应材料的表达和叶绿素表型分析。等位基因在群体中的频率大于0.05将被用于此分析。箱型图显示了等位基因G对应的材料有较高的叶绿素含量和相对高的基因表达水平。A: the regional association analysis of chlorophyll content in haplotype region (6,193,165-6,312,172 bp;r2=0.55). The blue dotted line indicates a thresholdP-value of 1.0×10-3for genome-wide significance. B: SNP chrA01:6306874 locates in exon two region ofBnaSGR1a-A01gene showed associated with chlorophyll content. C and D: the comparative analysis of allele G and T related to gene expression and chlorophyll content. Allele frequency greater than 0.05 in the population will be used for this analysis. The box plot showed that the allele G corresponding to inbred lines had higher chlorophyll content and gene expression level.
构建含CaMV 35S启动子的植物表达载体(图7-A), 将G单倍型的基因转入拟南芥中获得BnaSGR1过表达株系。对野生型和超表达拟南芥一个月苗龄的第4~6片真叶进行对比, 发现超表达植株叶片颜色较野生型变浅(图7-B)。qRT-PCR结果表明(图7-C), 转基因拟南芥中,BnaSGR1a-A01的表达量显著高于野生型。比较分析野生型和超表达拟南芥材料中叶片叶绿素含量(图7-D~F)发现, 超表达株系叶片的叶绿素a、叶绿素b和总叶绿素含量显著低于野生型。表明BnaSGR1a-A01调控叶绿素降解。
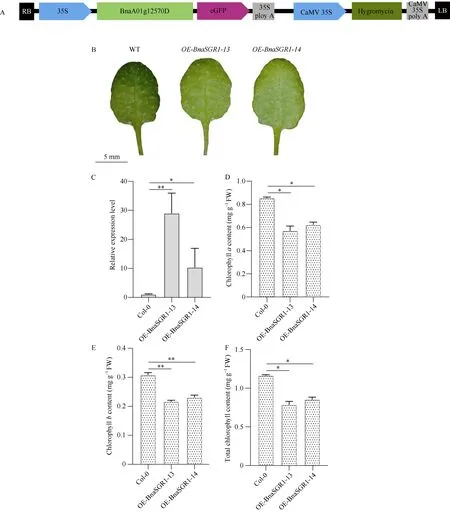
图7 BnaSGR1a-A01在拟南芥中超表达分析Fig. 7 Overexpression ofBnaSGR1a-A01inArabidopsisA: 超表达骨架载体示意图; B: 野生型拟南芥与超表达拟南芥1个月苗龄第4~6片真叶对比, 标尺为5 mm; C: 野生型拟南芥与超表达拟南芥的qRT-PCR检测; D~F: 野生型拟南芥与超表达拟南芥的叶绿素a、叶绿素b及总叶绿素测定。Col-0: 非转基因植株,OE-BnaSGR1-13和OE-BnaSGR1-14: 转基因植株。用Excel软件的数据统计分析对数据进行t检验(Student’st-test), *表示平均值间差异显著(P< 0.05), **表示平均值间差异极显著(P< 0.01), 误差线表示标准差(SD)。A: the schematic diagram of the overexpresed vector backbone; B: the comparison of one-month seedling age true leaves (No. 4-6) of Col-0 and OE lines, bar:5 mm; C: the qRT-PCR detection of Col-0 and OE lines; D-F: the determination of chlorophylla, chlorophyllband total chlorophyll in Col-0 and OE lines; Col-0: non-transgenic plant; OE-BnaSGR1-13,OE-BnaSGR1-14: transgenic plant. *:P< 0.05; **:P< 0.01.Error bars indicate the standard derivations.
2.5 BnaSGR1a-A01共表达网络分析
为了进一步验证BnaSGR1a-A01基因的功能,利用13个半冬油菜品种角果转录组数据构建了共表达网络(图8-A)。GO分析结果(图8-C) 表明BnaSGR1a-A01与叶绿素分解代谢过程、色素分解代谢过程、含卟啉化合物分解代谢过程和四吡咯分解代谢过程等显著相关。基于功能注释发现在局部共表达网络中(图8-B), 3种主要类型基因聚类与BnaSGR1a-A01基因相关, 包括叶绿素(32个)、光系统(36个)和转录因子(25个)等。其中BnaSGR1a-A01直接与BnaSGR2-A03和BnaSOX-C02等基因相连,间接与BnaSGR2-C03、BnaSGR1-A08、BnaSGRLC06、BnaSGR1-C01、BnaSGR1-C07、BnaSGRL-A10相连。

图8 BnaSGR1a-A01基因共表达网络分析Fig. 8 Co-expression network analysis ofBnaSGR1a-A01genesA: 甘蓝型油菜长角果中BnaSGR1a-A01的共表达网络。红色节点表示BnaSGR候选基因, 青绿色三角形节点代表着与BnaSGR基因直接相连接的基因。B: 在甘蓝型油菜长角果中的部分BnaSGR1a-A01共表达网络。基于功能注释,BnaSGR1a-A01共表达网络中的基因被分为以下3类: 叶绿素(浅蓝色节点)、光系统(青绿色节点)和转录因子(深橄榄绿节点)。C:BnaSGR1a-A01基因GO pathway分析网络。颜色的深浅表示BnaSGR1a-A01与这些代谢路径相关性的强弱。A: the co-expression network ofBnaSGR1a-A01in the silique ofBrassica napus. Red nodes representBnaSGRgenes, turquoise triangle node represent these genes directly correlation withBnaSGRgenes. B: the partly co-expression network ofBnaSGR1a-A01in the silique ofBrassica napus. Based on the functional annotation, the genes in theBnaSGR1a-A01co-expression network are classified into the following three groups: chlorophyll (light blue nodes), photosystem (turquoise nodes), and transcription factors (darkolivegreen nodes). C: GO pathway ofBnaSGR1a-A01co-expression networks. Deep yellow represents thatBnaSGR1a-A01is significant correlation with these metabolism process.
3 讨论
本研究基于模式作物拟南芥中AtSGR1基因序列及甘蓝型油菜、白菜和甘蓝的基因组序列, 在甘蓝型油菜、白菜和甘蓝全基因组范围内分别鉴定到了12个、6个和6个SGR基因家族成员, 它们都含有保守的SGR结构域。通过对鉴定到的甘蓝型油菜、白菜和甘蓝中的SGR基因家族成员进行理化性质的分析发现, 全部成员蛋白的等电点大于7, 家族成员以4个外显子为主。此前在甜瓜中报道的SGR基因家族成员等电点也大部分大于7, 外显子和内含子组成也与本研究较一致, 以4个外显子和3个外显子2种为主[26]。通过Motif预测分析发现拟南芥和甘蓝型油菜家族成员都含有Motif1, 说明Motif1是SGR基因家族的特征性Motif, staygreen domain位于Motif1。
模式植物拟南芥和甘蓝型油菜都是属于十字花科芸薹属, 亲缘关系较近, 鉴于拟南芥AtSGR1在叶绿素降解代谢调控过程中的重要性。本研究通过单体型区域关联分析检测到BnaSGR1a-A01与叶绿素含量显著关联, 并挖掘优异等位基因, 为油菜叶绿素含量遗传改良提供了有应用价值的新基因资源。此外, 在拟南芥中超表达BnaSGR1a-A01基因, 发现超表达植株叶绿素a、b和总叶绿素含量显著低于野生型, 表明BnaSGR1调控叶绿素降解。目前, 已在拟南芥、水稻、胡椒、番茄、豌豆、香蕉、小白菜等植物中, 发现SGR1同源基因突变延缓了叶绿素降解[6,14,27-30]。
此外, 本研究构建BnaSGR1a-A01的共表达网络发现BnaSGR1a-A01和BnaSGR2-A03直接相连, 并通过BnaSGR2-A03间接与BnaSGR2-C03、BnaSGR1-A08、BnaSGRL-C06、BnaSGR1-C01、BnaSGR1-C07、BnaSGRL-A10相连。Wu等[31]表明拟南芥中SGR2作为SGR1同源基因, 在叶绿素降解中起积极作用。SGRL在体内与SGR1和SGR2形成同/异源二聚体,并与LHCII和叶绿素分解代谢酶相互作用调节叶绿素降解[32]。BnaSGR1a-A01和BnaATSO-C02直接连接,BnaATSO-C02与拟南芥中参与编码亚硫酸盐氧化酶的ATSO基因同源, 研究表明[33], 亚硫酸盐氧化酶表达被抑制时, 会导致叶片黄化与叶绿素含量下降。这些研究结果表明BnaSGR基因形成了一个网络体系, 共同调节油菜叶绿素含量。
4 结论
本研究利用生物信息学方法在全基因组水平上对甘蓝型油菜SGR家族成员进行了分析, 表明甘蓝型油菜SGR基因家族成员之间具有线性关系, 高度同源, 且在进化过程中非常保守。此外, 区域关联分析检测到1个SNP定位在BnaSGR1a-A01的外显子2区域, 并与叶绿素含量显著关联。共表达网络分析结果验证了BnaSGR1a-A01与BnaSGR2-A03直接相连, 与BnaSGR1-C01、BnaSGR1-A08、BnaSGR2-C03、BnaSGR1-C07、BnaSGRL-C06、BnaSGRL-A10等基因间接相连形成了一个网络体系, 共同调节叶绿素含量。BnaSGR1a-A01转化拟南芥验证分析结果表明,BnaSGR1调控叶绿素降解。研究结果有利于我们挖掘有利的基因资源, 为高叶绿素含量的油菜改进提供理论指导。

