ω-3多不饱和脂肪酸联合托莫西汀治疗注意缺陷多动障碍患儿临床疗效观察
蔡冬冬 王 健 郑艺兵
1 福建省漳州市第二医院儿科 363200; 2 漳州市医院新生儿科
注意缺陷多动障碍(ADHD)常见于儿童时期,男性儿童群体患病高于女性儿童,患儿多表现出不符合其年龄阶段的注意力不集中、好动、情绪激动等症状,部分患儿的症状可能持续至其青春期或者成年[1]。目前,对于ADHD患儿的临床治疗多采用药物、行为和药物联合行为治疗等方法,药物治疗是最基本的治疗方式[2],但由于选用的治疗药物多为精神类药物,具有严重的成瘾性,长期使用容易出现严重不良反应。托莫西汀对于去甲肾上腺素的再摄取具有抑制作用,相比于其他中枢兴奋药物,长期服用不会产生成瘾性[3],然而托莫西汀仍具有一定的胃肠道刺激性。ω-3多不饱和脂肪酸(ω-3 PUFAs)目前临床多用于降血脂、抗凝血等,有研究指出[4],ω-3 PUFAs可以用于治疗ADHD。目前,应用ω-3多不饱和脂肪酸与托莫西汀联合用药对ADHD患儿进行治疗的相关研究较少。基于此,本文选取ADHD患儿86例,观察ω-3 PUFAs联合托莫西汀的治疗效果,为后续临床研究提供相关数据。
1 资料与方法
1.1 一般资料 选取2020年8月—2022年8月本院收治的ADHD患儿86例,随机将其分为联合组(n=43)和对照组(n=43)。联合组男36例,女7例,年龄7~16岁,平均年龄(10.67±2.19)岁,病程6~28个月,平均病程(17.46±5.62)个月,韦氏智力测验总智商(FIQ)评分80~95分,平均评分(87.26±3.79)分;对照组男34例,女9例,年龄6~15岁,平均年龄(10.72±2.25)岁,病程7~29个月,平均病程(17.37±5.81)个月,韦氏智力测验总智商(FIQ)评分80~95分,平均评分(87.31±3.75)分。两组患儿的性别、年龄等一般资料比较无明显差异(P>0.05)。纳入标准:(1)符合有关ADHD的诊断标准[5];(2)纳入的患儿均为初次诊断;(3)本次研究经患儿家长同意并签署知情同意书。排除标准:(1)存在精神药物治疗史的患儿;(2)合并凝血障碍、心血管疾病者;(3)对本次研究药物过敏,无法接受研究者。本研究经医院伦理委员会审核通过。
1.2 方法 两组ADHD患儿入院后完善基本资料,参考2011版美国儿科学会《儿童青少年注意力缺陷多动障碍诊断、评价和治疗临床实用指南》[6],对其进行听觉、视觉及感觉等统合训练。对照组ADHD患儿给予托莫西汀(天方药业有限公司,国药准字H20120097)治疗,用药方法:口服给药,初次给药总剂量为0.5mg/(kg·d),1周后,根据患儿的病情加减剂量,最高可增至1.2mg/(kg·d),1次/d,于早饭后服用。联合组ADHD患儿给予ω-3 PUFAs[深海鱼油软胶囊,威海百合生物技术股份有限公司,卫食健字(1999)第0306号]联合托莫西汀治疗,给药方法:托莫西汀给药方法与对照组一致,在此基础上患儿加用ω-3 PUFAs,口服给药,2粒/次,2次/d,于早晚饭后服用。两组患儿均持续治疗3个月。
1.3 评价指标 (1)临床疗效:治疗3个月后,采用中文版ADHD SNAP-Ⅳ评定量表—父母版(SNAP-Ⅳ)[7]和整合视听持续性操作测试(IVA-CPT)[8]评估两组患儿的临床疗效。SNAP-Ⅳ包括26项,从注意力不集中、自控能力差和对立违抗(ODD)三方面进行评估,由患儿父母填写,总分57分,得分越高表示患儿的症状越严重;IVA-CPT从视觉和听觉的注意力、反应控制两方面进行评估,得分越低患儿的症状越严重。(2)血清学指标:治疗前和治疗3个月后检测两组血清学指标,包括泌乳素(PRL)、中枢神经特异性蛋白(S100β)和25-羟维生素D[25(OH)D],采集患儿清晨空腹静脉血3ml,经离心操作后,分离血清,将其存放于含有促凝剂的真空采血管中,应用人垂体泌乳素检测试剂盒,采用酶联免疫法测定PRL水平;采用酶联免疫吸附法检测S100β水平;应用25-羟维生素D测定试剂盒,采用酶联免疫法测定25(OH)D水平。(3)不良反应:统计两组用药期间不良反应情况,包括厌食、嗜睡、头晕头痛、恶心呕吐、心动过速等症状。

2 结果
2.1 两组临床疗效比较 治疗前,两组患儿的SNAP-Ⅳ、IVA-CPT评分比较,差异无统计学意义(P>0.05);治疗3个月后,两组患儿的SNAP-Ⅳ评分低于治疗前,IVA-CPT评分高于治疗前(P<0.05),且联合组患儿的SNAP-Ⅳ评分低于对照组,IVA-CPT评分高于对照组(P<0.05)。见表1、2。

表1 两组SNAP-Ⅳ评分比较分)

表2 两组IVA-CPT评分比较分)
2.2 两组血清学指标比较 治疗前,两组患儿的PRL、S100β、25(OH)D水平比较,差异无统计学意义(P>0.05);治疗3个月后,两组患儿的PRL、S100β、25(OH)D水平高于治疗前(P<0.05),且联合组患儿的PRL、S100β和25(OH)D水平高于对照组(P<0.05)。见表3。
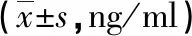
表3 两组血清学指标比较
2.3 两组不良反应发生率比较 用药期间,联合组患儿不良反应总发生率为4.65%,与对照组患儿的11.63%比较,差异无统计学意义(χ2=1.400,P=0.237>0.05)。所有不良反应经对症治疗后均得到缓解或消失。见表4。

表4 两组不良反应发生率比较[n(%)]
3 讨论
ADHD是一种多发于儿童时期的精神行为障碍,具有一定的持续性,可能从患儿的儿童时期一直持续至青少年甚至成年时期[9]。行为障碍是ADHD患儿面临的最主要问题,有研究表明[10-11],ω-3 PUFAs对患儿的认知功能具一定的改善作用;托莫西汀可以改善患儿注意力问题以及多动的症状。
本文结果显示,治疗3个月后,两组患儿的SNAP-Ⅳ评分低于治疗前,IVA-CPT评分高于治疗前(P<0.05),且联合组患儿的SNAP-Ⅳ评分低于对照组,IVA-CPT评分高于对照组(P<0.05)。表明ω-3 PUFAs联合托莫西汀治疗ADHD患儿临床效果良好,可以改善其临床症状。分析原因:ω-3 PUFAs是神经细胞膜磷脂的构成因子,可以增强神经细胞膜的流动性,改善ADHD患儿的神经系统功能[12];托莫西汀可以通过增加多巴胺(DA)的含量,增强去甲肾上腺素(NE)的反转效应[13],改善患儿的临床症状;ω-3 PUFAs与托莫西汀二者合用可以更好地改善患儿的行为和认知障碍。
研究发现[14-15],PRL、S100β和25(OH)D对于ADHD的病情进程均有一定的参与。本文结果显示,治疗3个月后,两组患儿的PRL、S100β和25(OH)D水平高于治疗前(P<0.05),且联合组患儿的PRL、S100β和25(OH)D水平高于对照组(P<0.05)。表明ω-3 PUFAs联合托莫西汀治疗ADHD患儿可以帮助调节其血清学指标。分析原因:PRL是一种由腺垂体分泌的蛋白质激素,具有促进乳腺发育、调节性腺等功能,PRL可受到DA激动剂的抑制;S100β具有促进脑部发育、维持机体钙稳定的作用;25(OH)D可以调控脑组织的钙信号、促进脑细胞分化等作用;使用ω-3 PUFAs联合托莫西汀治疗后,患儿血清中上述指标的水平上升,可以改善ADHD患儿的病情。
另外,本文结果还显示,用药期间两组患儿不良反应总发生率比较,差异无统计学意义(P>0.05)。表明ω-3 PUFAs联合托莫西汀治疗ADHD患儿的用药安全性较好。
综上所述,应用ω-3 PUFAs联合托莫西汀治疗ADHD患儿的临床疗效较好,可以帮助改善患儿的临床症状,调节PRL、S100β和25(OH)D 水平,并且具有一定的安全性。

