琼北红米色素的精制及抗氧化性研究
陈佳乐,任顺成
河南工业大学 河南省天然色素制备重点实验室,河南 郑州 450001
海南是我国水稻栽培起源地之一,具备生产优质稻米的自然条件,其独特的地理优势使得当地水稻越来越受到市场的青睐[1]。目前,在我国有色稻米种质资源中,红米稻种占据首位[2],琼北红米作为我国有色稻种资源中不可或缺的一种,分布于海南北部,种植历史悠久。
研究表明,有色稻米籽粒的果皮和种皮中聚集着丰富的色素[3],被认为是功能性食品中最有价值的抗氧化剂来源。研究认为,黑米中的主要着色剂是花色素苷,如花青素和飞燕草色素,而红米中的主要着色剂是原花青素和黄烷-3-醇低聚物[4-6]。由于有色稻米中富含丰富的天然活性物质,因此食用有色稻米对人体健康有多种益处[7],如抗氧化、抗癌、抗糖尿病等方面。
天然植物色素的提取通常使用有机溶剂萃取,目前,溶剂浸提法因方法简单、易操作被广泛应用,为了克服此方法产量以及效率低等问题,通常加以超声波、酶解以及超临界流体萃取法辅助提取,提高色素提取效率[8]。Yodkeeree等[9]研究发现,原花青素是红米乙醇提取物中的主要酚类物质,对胶原蛋白水解酶有强烈的抑制作用,能有效抑制皮肤老化,是一种天然的抗氧化剂。Yu等[10]通过提取荆州市和淮安市当地种植的有色稻米种皮活性物质并测定其含量发现,红米提取物中总酚、黄酮和原花青素含量显著高于普通稻米,同时有较高的清除DPPH和ABTS自由基的效果。
天然植物活性物质因其具有较高的保健功效以及食用安全性成为近年来的研究热点。因此,为提高琼北红米的应用价值和进一步探究红米色素的生物活性,本试验在红米色素提取单因素试验的基础上,采用Box-Behnken响应面法优化琼北红米色素提取工艺,利用大孔树脂将其精制并初步鉴定红米色素结构,分析其抗氧化活性。
1 材料与试剂
1.1 试验材料
琼北红米:海南璟益农业开发有限公司;乙醇、甲醇、香草醛,溴化钾等:分析纯,新丰化验器材有限公司;大孔树脂(HPD300、AB-8、NKA-9):新丰化验器材有限公司;儿茶素(>98%)、芦丁(>95%)、没食子酸(>95%):上海源叶生物科技有限公司;DPPH、ABTS:上海麦克林生化科技有限公司。
1.2 仪器与设备
FW135高速万能粉碎机:北京市光明医疗仪器有限公司;FA1004电子分析天平:上海上平仪器公司;FXB101-1电热鼓风干燥箱:上海树立仪器仪表有限公司;TDL-5A台式低速离心机:江苏省金坛市医疗仪器厂;UV-725紫外可见分光光度计:上海菁华科技仪器有限公司;RE-5旋转蒸发仪:上海亚荣生化仪器厂;PHS-3C雷磁酸度计:上海仪电科学仪器股份有限公司;HH-2数显恒温水浴锅:金坛市华峰仪器有限公司;Tensor Ⅱ傅里叶红外光谱仪:德国Bruker公司。
1.3 试验方法
1.3.1 样品的处理
琼北红米→粉碎→过60目筛→石油醚脱脂→干燥→粉末待用。
1.3.2 基本成分的测定
水分:参照GB 5009.3—2016;灰分:参照GB 5009.4—2016;蛋白质:参照GB 5009.5—2016;粗脂肪:参照GB 5009.6—2016;粗淀粉:参照GB/T 20378—2006;总酚:采用福林酚比色法;黄酮:采用亚硝酸钠-硝酸铝-氢氧化钠比色法。
1.3.3 红米色素紫外全波长扫描
参考Wang等[11]的方法提取红米色素,适当稀释提取液,在200~700 nm进行紫外全波长扫描。
1.3.4 红米色素标准曲线的绘制
配制2.0 mg·mL-1儿茶素甲醇溶液,分别吸取0.25、1、2、3、4、5 mL于10 mL容量瓶中定容,再各吸取1 mL与5 mL 2%香草醛甲醇溶液混合,振荡摇匀后加入1 mL浓盐酸,以1 mL甲醇为空白,30 ℃避光水浴5 min后于500 nm处测吸光度。以吸光度为纵坐标,儿茶素浓度为横坐标进行线性拟合,得到红米色素标准曲线的回归方程:Y=0.661X-0.005 2,R2=0.998 1。
1.3.5 红米色素提取工艺单因素试验
参考Wang等[11]的方法确定初始提取条件:50 ℃、1 h、1∶10 g·mL-1、80%乙醇。分别考察提取时间(30、60、90、120、150 min),水浴温度(30、40、50、60、70 ℃),料液比(1∶5、1∶10、1∶15、1∶20、1∶25 g·mL-1),乙醇体积分数(50%、60%、70%、80%、90%),将提取液定容补齐后,计算红米色素得率,试验重复测定3次。
1.3.6 响应面试验设计
在单因素试验的基础上,采用 Design-Expert 8.0 试验设计软件中的Box-Behnken模型,计算红米色素得率,优化提取工艺条件。

1.3.7 红米色素的精制及纯度的测定
参考Yang等[12]的方法对3种不同极性大孔树脂进行预处理,根据Shen等[13]的方法计算3种树脂对红米色素的吸附率和解析率,筛选出分离精制效果最优的树脂。参考Musdzalifah等[14]的方法进行精制:水洗体积2 BV,洗脱液70%乙醇,洗脱体积3 BV,除去色素中的蛋白、糖类、脂类等杂质。将精制后的样品溶液浓缩冻干成粉,-20 ℃备用。
将精制后的红米色素溶液浓缩冻干后参照马烨[15]的方法,计算红米色素精制物的纯度。
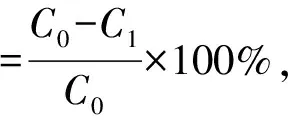
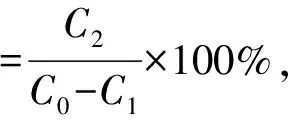

式中:C0为吸附前溶液中色素质量浓度,mg·mL-1;C1为吸附后溶液中色素质量浓度,mg·mL-1;C2为解吸液中色素质量浓度,mg·mL-1。
1.3.8 红米色素的鉴定
参考Esquivel-Alvarado等[16]的方法,将KBr与纯化后的红米色素粉末按照2%(质量比)混合,研磨成均匀的粉末后进行压制,使用KBr纯品压片扫描背景,然后在4 000~400 cm-1下对样品进行扫描。
参考纪秀凤[17]的方法,配制合适浓度的红米色素和儿茶素溶液,使用香草醛-盐酸法,按照1.3.4中方法,在400~600 nm进行全波长扫描。
1.3.9 红米色素抗氧化性研究
1.3.9.1 DPPH自由基清除作用
参照Peanparkdee等[18]的方法并做修改。将2 mL不同质量浓度(5、10、20、50、100、200 μg·mL-1)的红米色素溶液与3 mL 0.1 mmol/L的DPPH溶液混合,振荡均匀,室温避光反应30 min后,在517 nm处测定吸光度,用相同质量浓度的抗坏血酸(Vc)为参照。将DPPH溶液替换为等量乙醇溶液作为样品对照组,将样品溶液替换为等量蒸馏水作为空白组。计算DPPH自由基清除率。
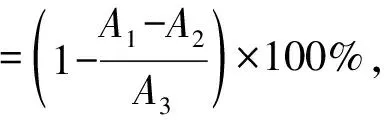
式中:A1、A2、A3分别为样品组、样品对照组、空白组在517 nm处的吸光度。
1.3.9.2 ABTS自由基清除作用
参照张燕等[19]的方法并做修改。将25 mL 7 mmol/L ABTS溶液与等体积的2.45 mmol/L过硫酸钾溶液混合,室温避光放置14~16 h,在使用之前,用磷酸盐缓冲溶液(0.2 mol/L、pH 6.86)将其稀释,当稀释液在734 nm处的吸光度为0.7~1.2即可使用。将1 mL不同质量浓度(5、10、20、50、100、200 μg·mL-1)的样品溶液与4 mL现配的ABTS工作液混合,振荡均匀,常温避光反应6 min,在734 nm处测定吸光度,用相同质量浓度的抗坏血酸(Vc)为参照;将ABTS溶液替换为等量蒸馏水作为样品对照组,将样品溶液替换为等量蒸馏水作为空白组。计算ABTS自由基清除率。
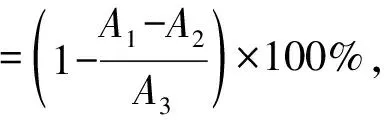
式中:A1、A2、A3分别为样品组、样品对照组、空白组在517 nm处的吸光度。
1.4 数据统计与分析
采用Design-Expert 8.0软件进行方差分析,使用Origin 2018软件进行绘图,使用OMNIC 8软件进行标峰处理。
2 结果与讨论
2.1 红米成分分析
由表1可知:琼北红米含有丰富的粗淀粉,含量达到了62.92%;琼北红米的蛋白质以及粗脂肪含量分别为11.28%和2.67%;还含有多酚、黄酮类生物活性物质。因此,琼北红米是一种有较高食用价值和保健功效的谷物。

表1 琼北红米的成分Table 1 Composition of red rice
2.2 红米色素紫外可见扫描
以往的研究发现原花青素沉积在红色稻米的种皮上,红米籽粒以原花青素的存在为特征[3,20]。对琼北红米色素粗提物进行紫外全波长扫描得图1。由图1可知,红米色素在280 nm处有最大吸收峰,在530 nm处并未出现吸收峰,这与市售井冈山红米的紫外光谱图一致[21],表明琼北红米是以原花青素为主要呈色物质的有色稻米。
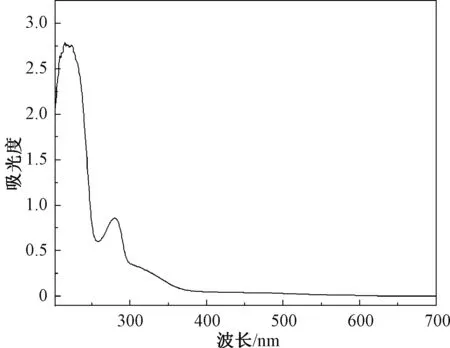
图1 红米色素全波长扫描Fig.1 Full wavelength scanning of red rice pigment
2.3 红米色素提取工艺单因素试验
2.3.1 提取时间
提取时间对红米色素得率的影响如图2(a)所示,红米色素得率随时间的延长呈先增加后降低的趋势,在90 min时,红米色素得率达到最大,随着提取时间的延长,红米色素得率略有下降。这可能是因为长时间受热条件下红米色素不稳定,被分解或氧化[22]。因此,选择提取时间为90 min。
2.3.2 提取温度
提取温度对红米色素得率的影响如图2(b)所示,红米色素得率随时间的延长呈先增加后降低的趋势,提取温度为50 ℃时,红米色素的得率达到最大,当温度高于50 ℃时,红米色素得率显著下降。这可能是因为在较低温度下,升高温度加速了溶剂的渗透,而过高的温度破坏了红米色素的结构[23]。因此,选择提取温度为50 ℃。
2.3.3 提取料液比
提取料液比对红米色素得率的影响如图2(c)所示,随着料液比的增大,红米色素的得率也不断增大,当料液比小于1∶20 g·mL-1,红米色素的得率增加缓慢。这可能是因为减小料液比能够使红米色素与溶剂充分接触,当达到一定比例后,红米色素已基本溶出[22]。考虑经济效益,因此,选择提取料液比为1∶20 g·mL-1。
2.3.4 乙醇体积分数
乙醇体积分数对红米色素得率的影响如图2(d)所示,随着乙醇体积分数的增大,红米色素得率先增大后降低,在70%时红米色素得率最大,随乙醇体积分数的继续增大,红米色素得率呈下降趋势。这可能是因为70%乙醇的极性与红米色素相似,利于红米色素的溶出[22]。因此,选择乙醇体积分数为70%。
2.4 响应面试验方案设计和结果分析
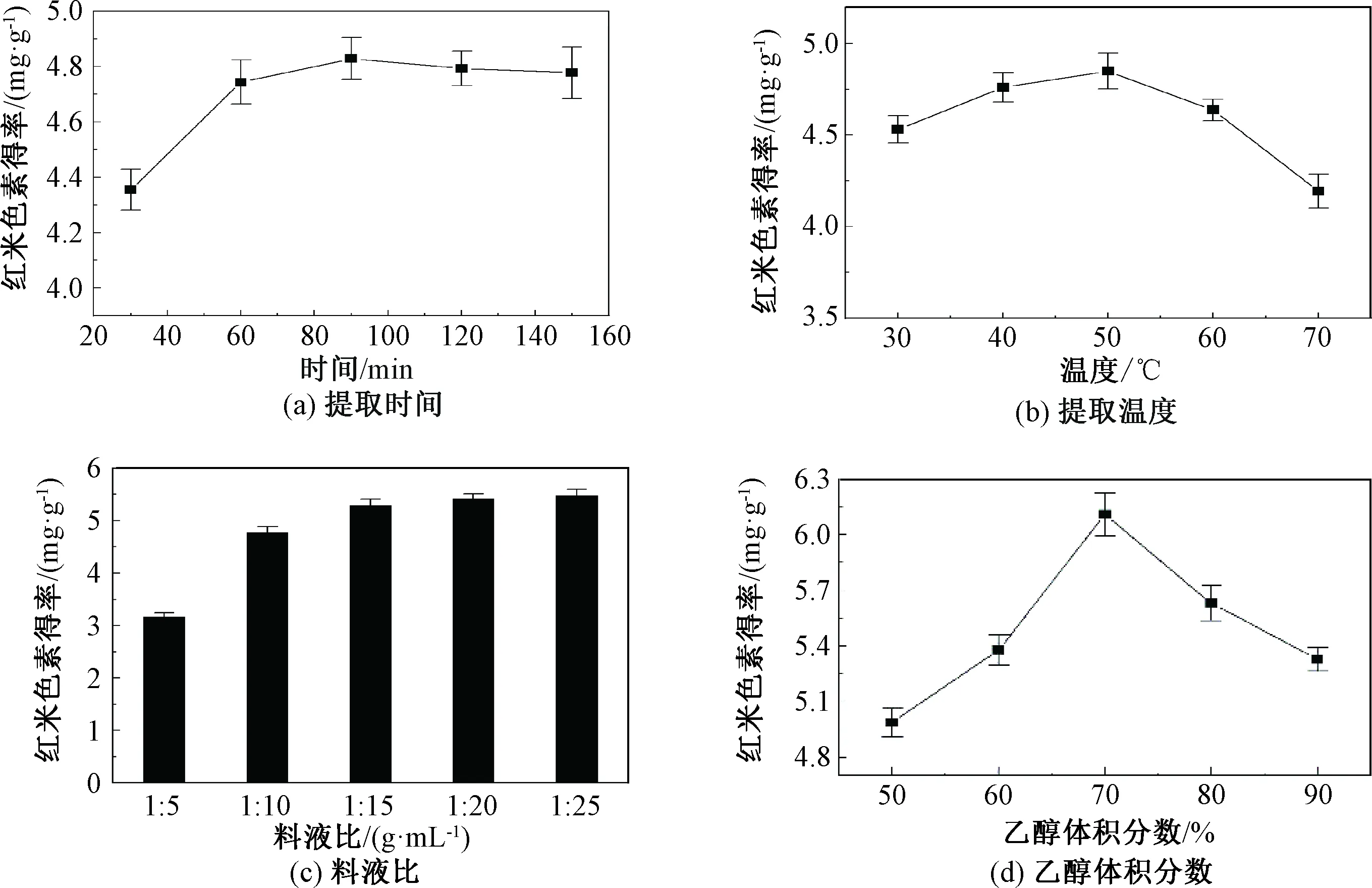
图2 提取时间、提取温度、料液比、乙醇体积分数对红米色素得率的影响Fig.2 Effects of extraction time, extraction temperature, ratio of material to liquid, and ethanol concentration on the yield of red rice pigment
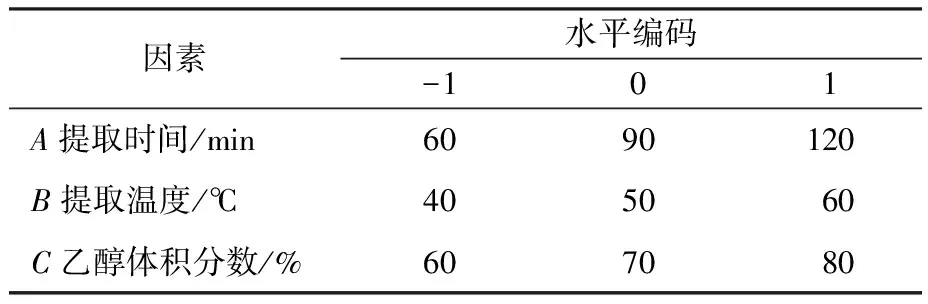
表2 Box-Behnken 试验因素与水平Table 2 Factors and levels of the Box-Behnken design
根据单因素试验结果,考虑到料液比对红米色素得率影响相对较小,且未出现下降拐点,只选取提取时间(A)、提取温度(B)、乙醇体积分数(C)为考察因素,进行响应面试验,试验因素及水平编码见表2。
利用Design-Expert 8.0软件统计表3中的数据并进行方差分析,结果如表4所示,得到各因素回归拟合方程:
Y=6.11+0.080A-0.085B+0.12C-0.17AB-0.047AC+0.11BC-0.31A2-0.57B2-0.20C2(Y为红米色素得率)。
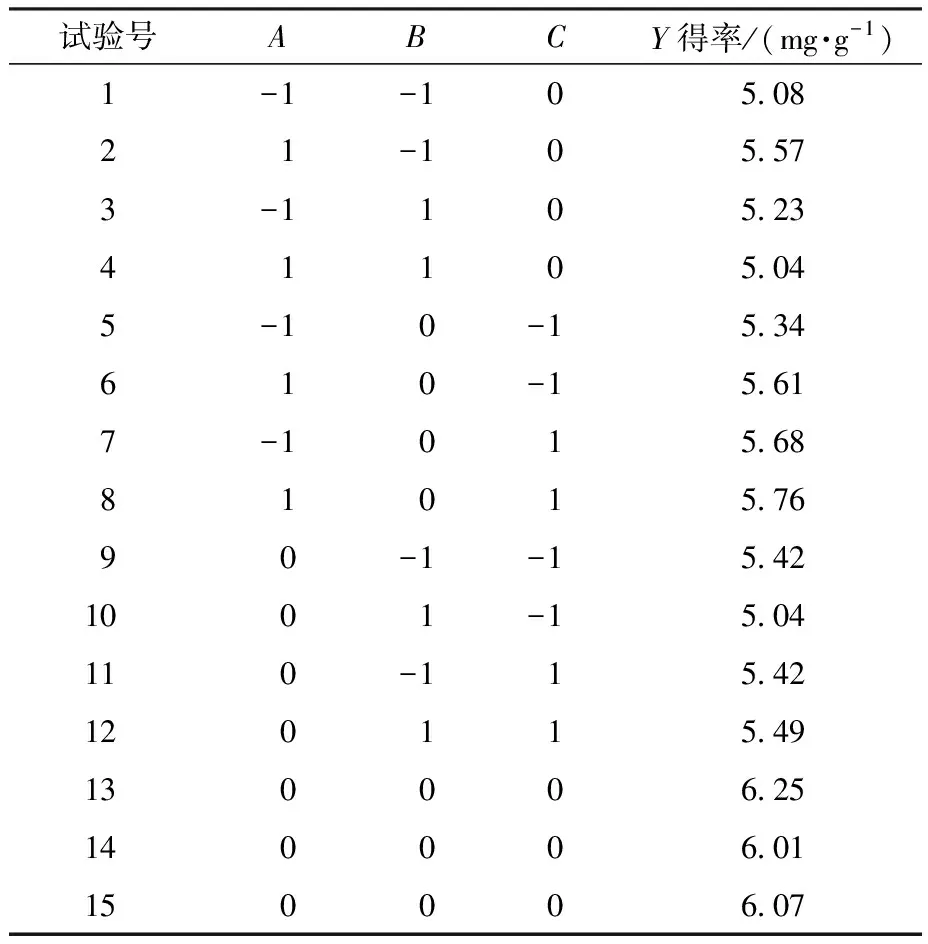
表3 响应面法试验设计与结果Table 3 Experimental design and results of response surface method
调整实际工艺参数:提取时间95 min,提取温度50 ℃,乙醇体积分数75%,料液比1∶20 g·mL-1。验证试验结果为红米色素得率(6.22±0.13) mg·g-1,与模型值相比较误差为1.47%,证明了此提取工艺的可靠性和有效性。马烨[15]通过浸提法提取哈尔滨中和镇红米色素,得到的红米色素得率为(4.37±0.02)mg·g-1,低于本试验的结果。

表4 方差分析Table 4 Analysis of variance
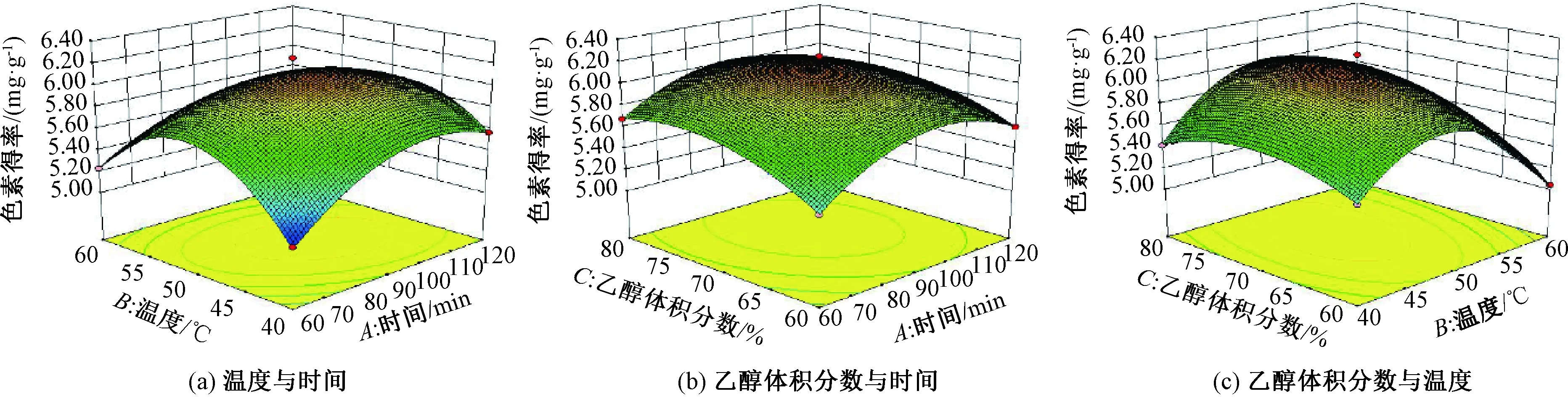
图3 各因素交互作用响应面图Fig.3 Response surface diagram of the interaction of various factors
2.5 红米色素的精制
由表5可知,3种型号的树脂中,AB-8对红米色素的吸附率与解吸率均为最大,表明其对红米色素有较好的精制效果,故选择AB-8用于精制红米色素的大孔树脂。按照1.3.7中的工艺进行红米色素的精制,脱去多糖、蛋白等杂质。通过测定可知,经过大孔树脂精制后红米色素的纯度为74.53%±2.79%,表明精制效果较好。
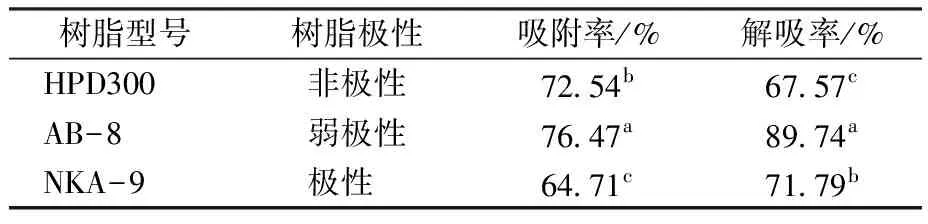
表5 3种大孔树脂静态吸附与解吸效果Table 5 Static adsorption and desorption effects of three macroporous resins
2.6 红米色素的鉴定

2.7 红米色素抗氧化性研究
从图5可以看出,当红米色素和 Vc质量浓度为0~200 μg·mL-1时,其对DPPH和ABTS自由基的清除能力均随质量浓度的增加而提高。当质量浓度大于50 μg·mL-1时,红米色素和Vc对DPPH自由基的清除率趋于平稳,且均达到90%以上,二者的IC50分别为6.48、4.44 μg·mL-1。当质量浓度大于50 μg·mL-1时,红米色素和Vc对ABTS自由基的清除率趋于平稳,且均达到95%以上,二者的IC50分别为7.38、7.50

图4 红米色素傅里叶红外和紫外鉴定图谱Fig.4 Fourier transform infrared and ultraviolet identification spectra of red rice pigment
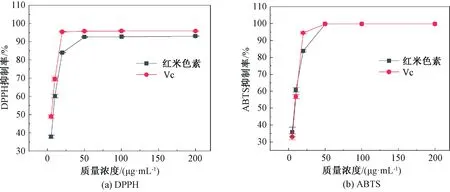
图5 红米色素、Vc对DPPH自由基清除作用和ABTS自由基清除作用Fig.5 Scavenging effects of red rice pigment and Vc on DPPH radical and ABTS radical
μg·mL-1。琼北红米色素具有较强的抗氧化能力,这与色素中含有丰富的原花青素、酚酸以及黄酮等酚类物质密切相关[9-10],这些化合物具有单个或多个酚羟基结构,能够释放出H+,同时与自由基竞争性结合,具有较强的抗氧化能力。因此,抗氧化研究初步表明琼北红米色素可以作为一种清除人体内自由基的天然抗氧化剂。
3 结论
由紫外全波长扫描可知,红米色素在280 nm处有最大吸收峰,与原花青素紫外最大吸收峰相似。通过红米色素提取工艺单因素和响应面试验确定最佳提取工艺为提取时间95 min,提取温度50 ℃,乙醇体积分数75%,料液比1∶20 g·mL-1,此提取条件下红米色素得率为(6.22±0.13) mg·g-1。将红米色素经AB-8型大孔树脂精制后,通过红外和紫外光谱鉴定可知红米色素中的原花青素是以(表)儿茶素为结构单元构成的原花青定聚合物,同时红米色素对DPPH以及ABTS自由基均有较强的清除能力,其IC50分别为6.48、7.38 μg·mL-1,表明琼北红米相较于常规稻米具有更好的保健功效,具有成为新型功能性食品的潜力。

