影像组学在喉癌诊疗中的应用综述
何知杨,谷金铭,李泉江,钟 艺,陈新伟,彭 娟
(重庆医科大学附属第一医院放射科,重庆 400016)
0 引言
喉癌是头颈部最常见的恶性肿瘤之一,96%~98%为鳞状细胞癌[1],常发生于中老年男性。目前喉镜及CT 是喉癌诊断及评估中常用的检查方法,其中喉镜无法评价软骨、黏膜下浸润以及声门下区病变[2];CT 在评估肿瘤浸润、软骨侵犯、颈部淋巴结转移及远处转移等方面具有优势,能够为临床诊疗及预后提供重要信息[3],但其诊断结果受个人经验及主观性等因素影响,在客观性、量化性方面存在不足。且无论喉镜还是常规CT 检查均无法显示肿瘤内微观环境,据此对喉癌的术前TNM 分期、放化疗疗效反应做出不准确的判断,会影响患者的预后。术前准确判断肿瘤分期、评估患者的预后情况以及预测疗效,是喉癌治疗决策过程中的关键和难点,但现有的影像及临床检查方法难以解决这些关键问题。目前临床上亟须寻求先进的技术,以获得更为客观精准的参数来提高对喉癌整体的判断。
2012 年,荷兰学者Lambin 等[4]首次正式提出影像组学的概念,即高通量地从医学影像中提取并分析大量高级、定量的影像学特征,把医学图像转化为可量化的数据,并结合临床和病理分析数据构建模型,用于指导临床诊疗决策。影像组学可深入挖掘影像背后隐藏的定量特征数据,揭示其生物学本质,更全面地定量评估肿瘤异质性,从而弥补临床上TNM分期及预后疗效评估时对肿瘤内部信息掌控的不足,对提高临床分期准确性、预后及疗效预测有效性,进而改善患者的预后、疗效具有重要意义[5]。目前,有关影像组学的研究主要集中在胸部、腹部肿瘤等疾病,在头颈肿瘤方面的研究主要为头颈部鳞状细胞癌、鼻咽癌、口咽癌以及淋巴结等相对常见病变的研究[6],而且多集中于肿瘤早期诊断、预后及疗效预测、人类乳头状瘤病毒感染检测等方面,在喉癌方面的研究则相对较少。以下围绕影像组学在喉癌中的应用进行综述。
1 影像组学在喉癌中的应用
1.1 判断喉癌术前分期
喉癌的术前TNM 临床分期[7]被认为是重要的风险分层因子,不同分期的喉癌患者治疗方案存在明显差异[8]。接受手术及放化疗的根治性综合治疗喉癌患者的5 a 生存率未见提高,术后生存质量未见改善,这是因为术前缺乏准确的风险分层,以及由此导致欠妥的治疗决策所致。因此,亟须寻求更佳的方案,以提高喉癌术前分期判断的准确度。
影像组学的出现,为以上问题的解决提供了可能。基于影像组学的肿瘤术前分期研究已在肺癌、腹部肿瘤中取得了较好成果[9-11],在头颈部肿瘤分期的应用较少,对喉癌分期的研究更少且不完善。Ren 等[12]对127 例包括喉癌在内的头颈鳞癌患者的T2WI、增强T1WI图像进行术前分期的影像组学研究,共提取970 个组学特征,发现其中3 个特征在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期之间具有显著差异,区分喉癌的准确率可达85.7%。这是首个基于MRI 影像组学判别早期和晚期头颈鳞癌的研究,但并未单独对喉癌分期进行判别。施淑君等[13]探讨了喉癌增强CT 纹理参数与T 分期的关系,从对40 例患者的分析中发现峰度和逆差距、熵对喉癌术前T 分期(T1-2 和T3-4)具有统计学意义。但该研究只探讨了影像组学特征与T 分期的关系,未讨论与总分期之间的关系。而且该研究仅用简单的纹理分析方法进行实验,所能得到的特征量较少。Wang 等[14]从211 例接受全喉切除术的晚期喉癌患者术前CT 增强图像中提取了1 390 个影像组学特征,以病理证实的T 分期为标准,发现人工判读联合影像组学特征的诺模图(如图1 所示)能提高术前T 分期的准确性,AUC 值为0.892。但该研究仅针对局部晚期喉癌(T3 和T4 期),且与以往绝大多数肿瘤分期预测研究一样忽略了淋巴结转移及远处转移相关的信息。Guo 等[15]纳入了265 例经病理证实的喉及下咽鳞状细胞癌患者,包括86 例甲状软骨侵犯(如图2 所示)及179 例无侵犯患者,结果表明基于静脉期影像组学特征建立的2 种组学模型均较人工判读是否有甲状软骨侵犯的准确率更高,AUC 值分别为0.905、0.876 和0.721。甲状软骨的侵犯提示喉癌分期达到了中晚期,但该研究并未关注喉癌伴其他组纵侵犯的情况,因此对喉癌分期预测的价值有限。

图1 诺模图预测局部晚期喉癌患者术前T 分期分析流程图[14]
由以上研究可知,现有的影像组学应用于喉癌术前的分期研究多针对晚期喉癌,且并未过多关注临床信息,未来不能仅进行纹理分析的研究,在综合多类特征的同时,还需纳入转移淋巴结相关的信息。此外,还要联合更多的临床资料,只有尽可能多地融合分期相关的临床与影像特征,才能使建立的模型更准确地判断肿瘤分期,也更能适用于临床。
1.2 预测喉癌的预后及疗效
近年来,随着放化疗技术的发展,喉全切除术越来越慎重,以放化疗为主的综合治疗逐步成为局部中晚期喉癌治疗的新模式[16-17]。研究显示,放化疗对于早期喉癌患者治疗效果好,但对于晚期喉癌疗效有限[18-19]。临床工作中,常常碰到具有相同临床分期但不同预后的喉癌患者,这提示喉癌患者接受同步放化疗后治疗反应不同,导致预后及生存期方面差异显著。肿瘤及个体对放化疗的治疗反应存在明显异质性,只有针对放化疗敏感的患者实施根治性放化疗或新辅助放化疗才能使其获益。
目前缺乏理想的临床特征或生物标志物来进行喉癌预后评估及疗效预测。现阶段,对喉癌患者预后的评估主要根据肿瘤总生存期、无进展生存期、无远处转移生存期以及无复发生存期[20]。临床对喉癌疗效的判断主要基于CT 或MRI 影像检查,依据实体瘤疗效评价标准1.1 版本对治疗后肿瘤缓解情况进行评估(完全缓解、部分缓解、病变稳定、病变进展)。但无论是影像评估还是术后病理都只能在治疗完成之后进行预后评估及疗效判断,具有滞后性,无法提前预测喉癌患者的预后及对放化疗的反应。因此,有必要寻找一种可靠、准确的方法评估喉癌患者的预后并预测患者对放化疗的反应,针对不同预后及不同放化疗敏感程度的患者给予个体化治疗,以改善喉癌患者的治愈率和提高其生存率。
1.2.1 喉癌预后预测
已有较多的证据表明影像组学特征正在逐渐发展成为一类重要的肿瘤预后生物标志物[20]。Agarwal 等[21]探讨了CT 纹理特征是否能预测晚期喉癌患者的远期局部控制效果和无喉切除术生存率。该研究选取统一接受放化疗的60 例晚期喉癌患者,根据治疗前影像进行随访研究,证明中等纹理熵是晚期喉癌患者局部控制效果和无喉切除术生存率的独立预测因子(如图3 所示)。该研究的不足在于仅使用纹理分析方法,未建立影像组学研究模型,且样本量较少,而且提取的特征为肿瘤的最大横截面,而非整个肿瘤。Chen 等[22]从136 例喉癌患者的术前增强CT 图像中提取纹理参数,建立了包含放射组学特征和临床病理因素的诺模图,并分析了该诺模图与总生存期的关系,结果发现影像组学模型比肿瘤TNM 分期在预测总生存期上具有更佳的预测效能,一致性指数分别为0.817、0.682。但该研究为单中心回顾性研究,且样本量较少,具有一定的选择偏差。Ou 等[23]纳入了包括18 例喉癌在内的120例头颈鳞癌患者治疗前的CT 图像数据,提取出544 个放射组学特征,发现其中24 个影像组学特征可作为肿瘤总生存期和无进展生存期的重要预测指标。该研究进一步结合分子表型p16 建立影像组学联合模型,其预测总生存期和无进展生存期的AUC 值达到0.78。但该研究包含的喉癌患者数量有限,且p16 与口咽癌的相关性更高,与喉癌的相关性有限。Meneghetti 等[24]探讨了基于CT 的影像组学特征预测局部晚期头颈鳞癌患者的局部肿瘤控制效果,共纳入包括8 例喉癌在内的318 例头颈鳞癌患者的治疗前CT 图像,建立临床特征与影像学特征的联合模型,在外部验证集中,该模型对局部晚期头颈鳞癌的局部控制效果具有较好的预测性能,一致性指数为0.66。该研究为一项多中心回顾性研究,但与Ou 等[23]的研究相似,在所纳入的头颈鳞癌中,喉癌所占比例较少,研究结果对喉癌的针对性有限。
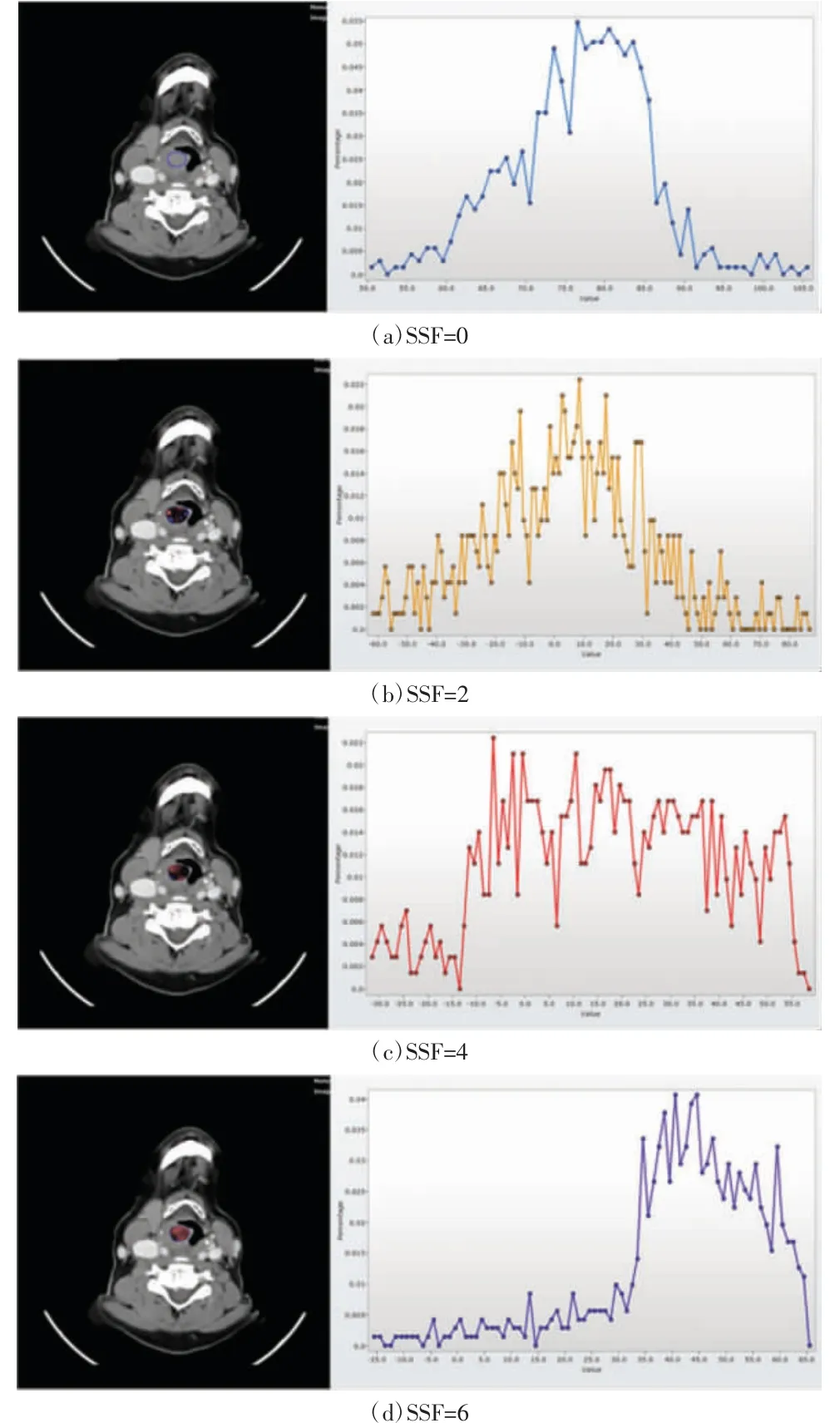
图3 增强CT 图像上喉癌患者的融合解剖图和对应不同SSF 值处的像素分布图[21]
以上研究表明影像组学能有效填补传统模型在肿瘤异质性信息方面的空缺,提供更具参考价值的预后信息。但较少的研究病例以及单一的纹理分析方法预示未来在喉癌预后预测的影像组学研究方面仍有较长的路要走,纳入更多的研究病例,联合丰富的临床资料,采取多中心、前瞻性的研究方法,才能使影像组学为喉癌预后预测提供更准确的临床帮助。
1.2.2 喉癌疗效预测
现有的影像组学研究已较成熟运用于肿瘤如鼻咽癌和直肠癌的疗效预测[25-26],但对喉癌疗效的预测研究仍然有限。Masson 等[27]探讨了影像组学预测喉癌对放化疗治疗抵抗的能力,通过提取104 例治疗前喉癌患者的CT 图像影像组学特征,发现区域百分比参数能很好地预测治疗抵抗,训练集中AUC 值为0.62(灵敏度为70%,特异度为64%),测试集也获得了比较满意的预测效能(灵敏度为80%,特异度为67%)。尽管该研究的样本量小,结果准确性难以保证,但是也展现出了影像组学预测喉癌治疗疗效的潜能,亟待研究者进行深入研究。
1.3 喉癌颈部淋巴结转移预测
喉部的解剖结构复杂,血管及淋巴管网丰富,极易出现喉癌的颈部淋巴结转移。颈部淋巴结转移是影响喉癌预后的独立危险因素[28]。对于就诊时发现有颈部淋巴结转移的喉癌患者治疗方式明确(淋巴结清扫),而对术前辅助检查未发现颈部淋巴结转移的患者,是否存在隐匿性颈部淋巴结转移的风险及是否需要常规行淋巴结清扫术仍存在争议[29-30]。通常非侵入性评估有无颈部淋巴结转移主要通过颈部触诊以及常规CT、MRI 及超声等影像学手段,对淋巴结的评估主要依靠淋巴结短径、形态、钙化、囊变等征象,主观性较强,判断不准确。
影像组学能准确反映原发灶肿块内部异质性,通过原发灶的影像组学特征预测淋巴结转移为我们提供了新思路,目前已在预测甲状腺癌、宫颈癌及直肠癌等淋巴结转移方面取得了较好的研究成果[31-32],而通过喉癌原发灶预测颈部淋巴结转移的影像组学研究目前较少。贾传亮等[33]探讨了利用影像组学列线图预测喉癌颈部淋巴结转移的效能,从117 例行开放性手术并行淋巴结清扫的喉癌患者的T2和T1增强图像中提取原发癌灶影像组学特征,纳入淋巴结MRI 影像特征及喉癌原发癌灶影像组学标签构建列线图模型,在训练集和测试集中,ROC 和校准曲线均展现出良好的预测效能,决策曲线分析(decision curve analysis,DCA)显示列线图预测颈部淋巴结转移具有一定的价值。郭峰等[34]从304 例有完整的淋巴结病理结果的喉癌患者原发灶术前CT 静脉期图像中提取影像组学特征,建立形态学模型、影像组学模型及联合模型预测有无颈部淋巴结转移,在训练集和验证集中,影像组学模型和联合模型AUC 值均高于形态学模型,提示基于喉癌原发灶的CT 影像组学可以较好地预测喉癌颈部淋巴结转移,其诊断效能高于传统CT 的人工判读。
以上的研究均采用二分类判断,未纳入颈部淋巴结分区及喉癌分型,后续有待进一步多分类研究。有学者利用喉癌病灶中分子标记物如增殖细胞核抗原(PCNA)、Ki-67 等作为预测颈部淋巴结转移的手段[35],为后续考虑融合临床分子生物学信息提高模型的预测效能提供了新思路。
2 不足与展望
虽然现有研究显示影像组学对喉癌术前分期、预后及疗效预测、颈部淋巴结转移的评估具有重要的价值,但仍然存在较多不足之处:(1)在研究方法上多采用单中心、回顾性的研究方法,后续可考虑多中心、前瞻性研究以提高模型泛化能力。(2)现有的研究在影像组学特征提取和模型建立中常选择单一或较少的特征提取算法和机器学习方法,未来可采用多样化的算法和方法,以取得最佳效果。另外,深度学习方法可以实现计算机自动提取特征,目前在医学影像领域发展迅猛,但在喉癌研究中仍应用较少,未来在喉癌的研究中也可以利用深度学习来进行特征提取。(3)在影像组学的图像分割上,肿瘤的感兴趣区划分由研究者手动绘制,主观性较强,而喉部解剖结构复杂,肿瘤组织往往分界不清,致使肿瘤划分可重复性较差。(4)MRI 的软组织分辨力更佳,能提供多种有助于喉癌诊疗的序列参数以获取更多组学特征,但图像采集时间长,伪影更大,基于MRI的喉癌影像组学尚需投入更多研究。(5)现有的研究大多仅针对单一的影像学表现,而未结合临床数据,未来的喉癌影像组学若与肿瘤基因表型、蛋白、代谢等临床参数相结合,则能增强与临床之间的因果联系,为医生制订更加合理的治疗方案提供决策辅助,实现疾病的个体化精准诊疗。
综上所述,未来的喉癌影像组学研究若能纳入更多的临床信息、采用更丰富的研究方法、提高提取影像组学特征的可重复性,充分利用组学优势,将大大提高临床诊疗能力,这是喉癌影像组学研究的目标,也是未来研究的重要发展方向。
3 结语
影像组学作为一种客观、定量、无创的方法,能较好地反映肿瘤异质性,更大程度地发挥医学图像的内在价值,其在喉癌患者的术前精准分期、预后及疗效判断、预测颈部淋巴结转移等方面均展现出较高的临床应用价值和广阔的研究前景。随着大数据、人工智能、深度学习等技术的发展,影像组学将逐步成为临床工作中诊疗决策的有益补充,对改善患者的预后具有重要的作用。

