PLCε1蛋白及Arg548Leu位点与广西壮族儿童原发性肾病综合征关系的分析
杨三菊,刘运广
(右江民族医学院附属医院儿科,广西 百色 533000)
原发性肾病综合征(primary nephrotic syndrome,PNS)是儿童时期最常见的慢性肾脏疾病,在亚洲地区年发病率高达每10万人6.4~7.14例之间[1-2]。PNS患儿中约85%~90%对类固醇治疗反应敏感,即为激素敏感型肾病综合征(steroid sentitive nephrotic syndrome,SSNS),在长期使用激素后常出现生长不良、肥胖和骨质疏松等,严重影响患儿生活质量[3]。其余10%~15%患儿则对类固醇治疗表现耐药反应,即为激素耐药型肾病综合征(steroid resistant nephrotic syndrome,SRNS),这部分患儿病情常迁延不愈,在10年内有近50%的患者最终进展为终末期肾病(end-stage renal disease,ESRD)[3-4]。因此,PNS一直是临床工作和研究的热点问题。随着遗传学和基因测序技术的不断发展,60多个与PNS疾病相关的单基因被报道,磷脂酶CE1(phospholipase CE1,PLCE1)基因是其中之一[4-5]。PLCE1基因编码信号系统,其编码的蛋白是各种G蛋白偶联受体的信号蛋白,参与肾小球足细胞信号转导,对维持肾小球正常发育起重要作用。有文献报道[6],PLCE1基因移码或无义突变使肾小球在S阶段发育停滞,导致早发型肾病综合征。另外研究者发现PLCE1突变也是孤立性弥漫性系膜硬化(isolated diffuse mesenteric sclerosis,IDMS)主要原因,有超过28%~33%的家庭受到影响[7]。而关于PLCε1蛋白及其单个基因位点多态性与PNS关系的分析少见报道。因此,本次研究运用FastTarget联合二代测序技术检测PLCE1基因Arg548Leu位点多态性,同时采用酶联免疫吸附法检测血清中磷脂酶Cε1(PhospholipaseCε1,PLCε1)蛋白的水平,分析Arg548Leu位点及PLCε1蛋白水平与PNS的关系,从分子水平为PNS的预后及防治提供理论和实验依据。
1 资料和方法
1.1临床资料 收集2020年10月至2022年5月在右江民族医学院附属医院就诊的广西壮族儿童255例,其中PNS患儿155例,男90例,女65例,平均年龄为(8.05±0.05)岁。均符合PNS诊断标准,根据对激素治疗反应情况,分为SSNS和SRNS[8],SSNS 95例,男72例,女23例,平均年龄为(8.05±0.07)岁,SRNS 60例,男45例,女15例,平均年龄为(8.05±0.09)岁。该院同期健康体检的壮族儿童100例,男66例,女34例,平均年龄为(8.06±0.07)岁。性别、年龄因素在各比较组间的差异无统计学意义(P>0.05)。纳入标准:①PNS的诊断标准及类固醇激素治疗反应分型参照中华医学会儿科学分会肾脏病组学制定的儿童激素敏感、复发/依赖肾病综合征诊治循证指南[8];②各组研究对象均为家族中无肾脏疾病且相互之间没有血缘关系的壮族人群。排除标准:①排除合并感染的PNS患儿;②排除Alport综合征患者;③排除继发性肾病:过敏性紫癜肾炎、系统性红斑狼疮肾炎、乙肝病毒感染肾炎、先天性巨细胞感染肾炎、糖尿病肾病等。本研究对象的监护人已知情,并已签署知情同意书。本研究已取得研究单位伦理委员会批准。
1.2方法
1.2.1采集血液标本 所有研究者空腹时取2 mL静脉血放入EDTA管,去除红细胞后置于-80 ℃冰箱保存。
1.2.2提取DNA 该实验严格按照德国Qiagen公司DNeasyBlood&TissueKit试剂盒实验步骤提取DNA。并测量DNA纯度(OD260/280比值)
1.2.3引物设计 以人类标准基因组为模板,委托上海昊天生物科技有限公司设计合成Arg548Leu位点的引物,序列见表1。

表1 PLCE1基因Arg548Leu位点引物序列
1.2.4QPCR反应 QPCR反应体系(20 μL):包括SYBR premix 10 μL,PrimerF 0.4 μL,PrimerR 0.4 μL,DyeII(50x)0.4 μL,DNA 2 μL,DEPC水6.8 μL。QPCR扩增程序:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火30 s,95 ℃延伸1 min,循环40次,最后95 ℃延伸30 s。
1.2.5FastTarget目标区域测序 通过扩增产物建立FastTarget测序文库,并经Agilent2100Bioanalyzer验证。最后通过IlluminaHiseq/Miseq平台对PLCE1基因27号外显子进行高通量测序。
1.2.6ELISA测定PLCε1血清蛋白水平 本实验使用PLCε1酶联免疫分析试剂盒检测,操作步骤严格按试剂说明书进行,并进行数据分析。
1.3统计学方法 数据采用SPSS 22.0软件进行统计分析,对健康对照样本采用Hardy-Weinberg平衡分析,评估健康对照组样本是否具有群体代表性。对PNS、健康对照组、SSNS及SRNS组的基因型和等位基因频率采用计数法。计量资料符合正态性、方差齐性条件采用t检验,不符合t检验要求的计量资料则采用秩和检验。计数资料则用χ2检验或Fisher确切概率法。按α=0.05检验水准,P<0.05为差异有统计学意义。
2 结果
2.1Hardy-Weinberg平衡分析 对健康对照组中PLCE1基因Arg548Leu位点进行Hardy-Weinberg平衡分析,Arg548Leu位点的基因型频数符合Hardy-Weinberg平衡(P>0.05),对照组样本具有群体代表性。见表2。
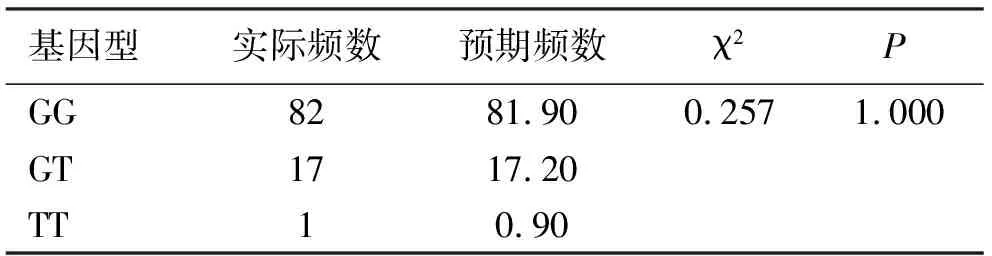
表2 健康对照组中Arg548Leu位点基因型频数Hardy-Weinberg平衡分析
2.2PLCE1基因Arg548Leu位点分析 PLCE1基因Arg548Leu位点基因型(GG、GT、TT)及等位基因(G、T)在PNS组和健康对照组间差异无统计学意义(P>0.05),见表3。该位点基因型(GG、CT)及等位基因(G、T)在SRNS及SSNS两组间分布差异也无统计学意义(P>0.05),见表4。

表3 PNS组与健康对照组Arg548Leu基因型及等位基因型比较
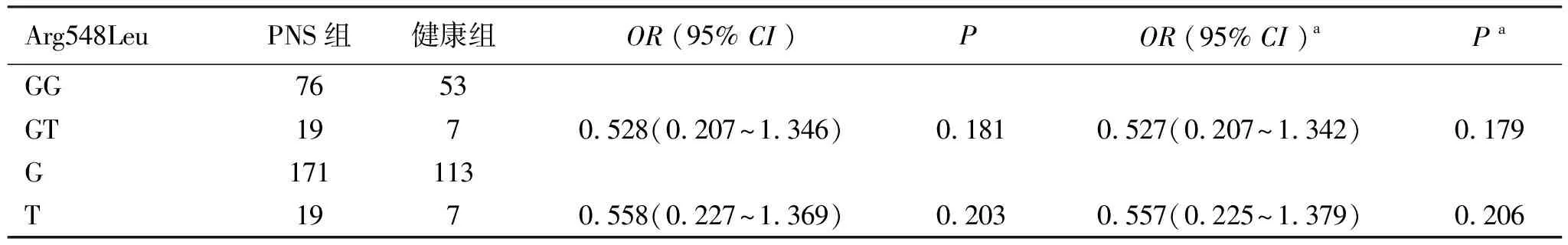
表4 SSNS与SRNS Arg548Leu基因型及等位基因型比较
2.3PLCε1血清蛋白水平比较 PNS组血清PLCε1蛋白水平低于健康对照组,差异有统计学意义(P<0.001);SRNS组血清PLCε1蛋白水平低于SSNS组,差异具有统计学意义(P=0.037),见表5。

表5 各组间PLCε1血清蛋白浓度水平差异比较
3 讨论
PNS是肾小球滤过屏障被破坏导致大量血浆蛋白从尿液中丢失的一组临床综合征,常呈慢性病程,部分耐药者,预后不良,易进展为ESRD,威胁患者生命健康。随着基因检测技术在临床中的广泛应用,基因多态性位点分析在指导PNS患者个体化治疗、延缓和延迟ESRD进展及遗传咨询方面日益重要[9]。本团队通过研究广西壮族壮族儿童PNS与PLCε1蛋白及Arg548Leu位点多态性的关系,为PNS疾病精准治疗、早期诊断以及预后评估提供一定数据。
PLCE1基因是定位于人染色体10q23.33上,长为334.3 kb的单拷贝基因,含有34个外显子。其编码的PLCε1蛋白在酵母双杂交实验中的秀丽隐杆虫中第一次被发现,随后KELLEY G G等[10]证实该蛋白属于磷脂酶家族C(PLC)的新成员,并首次为其命名。PLCε1作为PLC家族的一种同工酶,除包含XY、PH、C2及EF 4个家族成员所共有的保守结构域,还具有独特的RasGEF_CDC25和RA两个结构域。RasGEF_CDC25结构域位于PLCε1氨基酸末端,是GTP交换因子区域,可增加GDP和Rapl的释放,该结构还具有鸟嘌呤核苷酸交换活性(GEF),从而激活Ras/MAPK信号通路和细胞外信号调节酶(ERK)途径[11];RA结构域是2个C端Ras绑定区,与Ras结合,参与PLCε1的激活。依据PLCE1与肾病综合征相关研究报道[12],认为PLCE1是肾病综合征的重要候选基因。Hildebrandt团队在1 783个家庭组成的国际队列中,发现PLCE1突变是导致家族性SRNS的第4大最常见原因[13-14]。BOYER O等[15]对来自68个家族的139位SRNS患者进行突变分析,发现PLCE1突变个体出现早发性肾病综合征,发病年龄在3个月到6岁不等,且在7岁前进展为ESKD,其主要病理类型是弥漫性肾小球硬化(DMS),但在局灶性节段性肾小球硬化(FSGS)中的比例也不可忽视。HASHMI J A等[16]也通过一个沙特近亲家庭证实了PLCE1突变在家族性SRNS中呈常染色体隐性遗传模式,在该家族SRNS病例中发现了PLCE1新的纯合子插入突变(C.6272_6273insT),突变后蛋白质从2090Met_2091GlnPheSer位置移码,导致了PLCE1缺乏完整的RA结构域,这可能是导致肾病综合征的原因。另外张研等[17]也在广西壮族PNS患儿检测出了5种PLCE1的突变(c.578T>C、c.670C>T、c.923G>T、c.4916C>T、c.5927_5929del),c.578T>C、c.670C>T、c.923G>T三位点引起改变的氨基酸靠近RasGEF_CDC25结构域,c.4916C>T引起改变的氨基酸位于XY结构域中,c.5927_5929del引起改变的氨基酸位于位于C2和RA结构域之间,5个突变位点导致PNS可能与PLCE1复杂结构域相关。因此,本研究选取了位于RasGEF_CDC25结构域中的Arg548Leu多态性位点,并分析该多态性位点与广西壮族儿童PNS发生及治疗的相关性。
THI KIM LIEN N等[18]分别在2名先天性肾病综合征(CNS)患儿中检测到PLCE1基因p.Arg548Leu(c.1643G>T)位点杂合突变及纯合突变,纯合突变患儿出现更严重的临床表型。另外MACHUCA E等[19]也在CNS患儿中检测到了常见的多态性(p.Arg548Leu)。PLCE1基因Arg548Leu多态性位点位于RasGEF_CDC25结构域,可能通过以下途径导致影响PNS的发生及发展:①RasGEF_CDC25结构域可增加GDP核Rapl的释放率,Rapl有GEF活性,有助于GDP和GTP相互转换,从而活化Ras和Rho等一类小G蛋白;②RasGEF_CDC25结构域通过鸟苷酸交换因子改变Ras家族分子结构从而激活Ras/MAPK信号通路。Arg548Leu多态性位点中精氨酸(Arg)带正电荷,亮氨酸(Leu)不带电荷[20]。特定区域氨基酸电荷的改变可引起特定区域PLCε1蛋白三维构象的改变,因此Arg548Leu可能通过引起RasGEF_CDC25区域三维构象的改变,从而影响足细胞内外信号的转导。在本研究中,PLCE1基因Arg548Leu位点多态性可能与广西壮族PNS及其治疗无关,与上述文献报道不符,这可能与不同的种族、地域及样本量有关;另外样本虽均来自广西壮族,但随着时代的变迁,广西壮族生活习性及饮食习惯不断改变,也可能影响基因位点多态性与疾病的关系。
目前关于PLCε1蛋白与PNS及其治疗的关系少见报道,本研究发现PNS组PLCε1蛋白水平显著低于健康对照,同时在SRNS组的蛋白水平也是显著低于SSNS组。所以,PLCε1蛋白可能是广西壮族PNS的一种保护性蛋白,并可能对PNS的治疗有影响,这与张研等[16]的研究结果相一致。但血清中PLCε1蛋白水平容易受到药物、感染等多种因素影响,导致最终结果可能出现误差。本研究的不足之处是未能进一步将感染等因素纳入考虑,下分感染组及非感染组等亚层开展研究,因此必要时将PNS组与健康组和SSNS组和SRNS组中分别将感染等因素纳入下分亚层,从而排除感染等因素对研究的影响。
综上所述,本研究发现PLCε1蛋白可能是广西壮族PNS的一种保护性蛋白,并可能对PNS的激素治疗有影响,这在临床上可有利于广西壮族儿童PNS治疗及预后判断。本研究未发现Arg548Leu多态性位点与广西壮族PNS及其治疗有关,但关于PLCE1基因位点多态性与广西壮族儿童PNS相关性需更深入研究,可以继续扩大样本量,多地区、多民族比较,多个多态性位点联合分析等研究,为揭示PNS的发病机制提供更多的理论依据。

