淋巴结阳性胰腺癌患者术后生存预测模型的构建
李沈,王小明,王晓红
(皖南医学院第一附属医院,安徽 芜湖 241001)
胰腺癌是全球范围内癌症死亡的主要原因,胰腺癌发病率最高的地区包括北美、欧洲和澳大利亚,胰腺癌存在一些可控的危险因素,包括吸烟、饮酒、糖尿病及肥胖[1],除此之外,影响胰腺癌患者预后的因素还包括年龄、肿瘤分化程度等因素。手术仍然是治疗胰腺癌有效的方法之一,特别近些年来,外科手术飞速发展,通过引入动脉先行入路及钩突先行入路等方式,能提高胰腺肿瘤切除的完整性并降低复发的风险[2],虽然经过科学的手术治疗,但是胰腺癌的生存率仍然不容乐观,其中,胰腺导管腺癌是一种高度侵袭性肿瘤,5年生存率低于5%[3],因此,积极研究胰腺癌预后的影响因素,对于提高术后生存率有很大意义。美国国家综合癌症网络(NCCN)指出,淋巴结活检阳性的胰腺癌患者复发风险更高,阳性淋巴结的数量也是术后生存期的独立影响因素[4],虽然淋巴结状态是胰腺癌术后生存期的影响因素,但淋巴结检查不充分可能导致将N1分期误认为是N0分期,将淋巴结阳性的患者视为与其他胰腺癌患者不同的人群进行研究是非常重要的。本次研究收集了SEER数据库2010年至2015年淋巴结阳性胰腺癌患者的相关信息,进行统计学分析后构建术后预后风险模型,为临床上更好地治疗胰腺癌患者提供指导。
1 资料与方法
1.1研究对象与资料收集 选取SEER数据库2010年至2015年确诊为胰腺癌的患者资料,包括年龄、种族、性别、肿瘤位置、组织学类型、分化程度、手术方式、放疗、化疗、婚姻状况、肿瘤分期、T分期、M分期。纳入标准:①行根治性手术治疗;②组织病理学确诊为胰腺癌;③淋巴结活检均为阳性;④临床病理资料完整。排除标准:①变量中包含缺失值的患者;②生存时间等随访资料缺失;③淋巴结未活检或活检结果为阴性。最终的得到符合条件的患者共5 816例,后续使用R4.0.0软件进行数据处理与模型构建。
1.2统计学方法 使用R4.0.0软件中的caret包将5 816例患者按照7∶3随机分成建模组和验证组,使用SPSS 22.0软件中的χ2检验或者秩和检验进行组间资料的比较,对于建模组数据,使用单因素COX回归分析及多因素COX回归分析得到预后影响因素,使用Kaplan-Meier法对多因素COX回归分析有意义的因素进行生存分析,生存率差异的比较采用log-rank检验,根据多因素COX回归分析有意义的因素,使用R4.0.0软件中的rms包构建列线图模型,计算该模型的一致性指数(C-index),绘制ROC曲线、校准曲线来对模型进行验证。
2 结果
2.1建模组和验证组间临床病理学资料的比较 此次纳入研究的5 816例患者,建模组包含4 072例,验证组包含1 744例,组间资料比较发现,年龄、种族、性别、肿瘤位置、组织学类型、分化程度、手术方式、放疗、化疗、婚姻状况、肿瘤分期、T分期、M分期变量均无统计学差异(P>0.05),见表1。
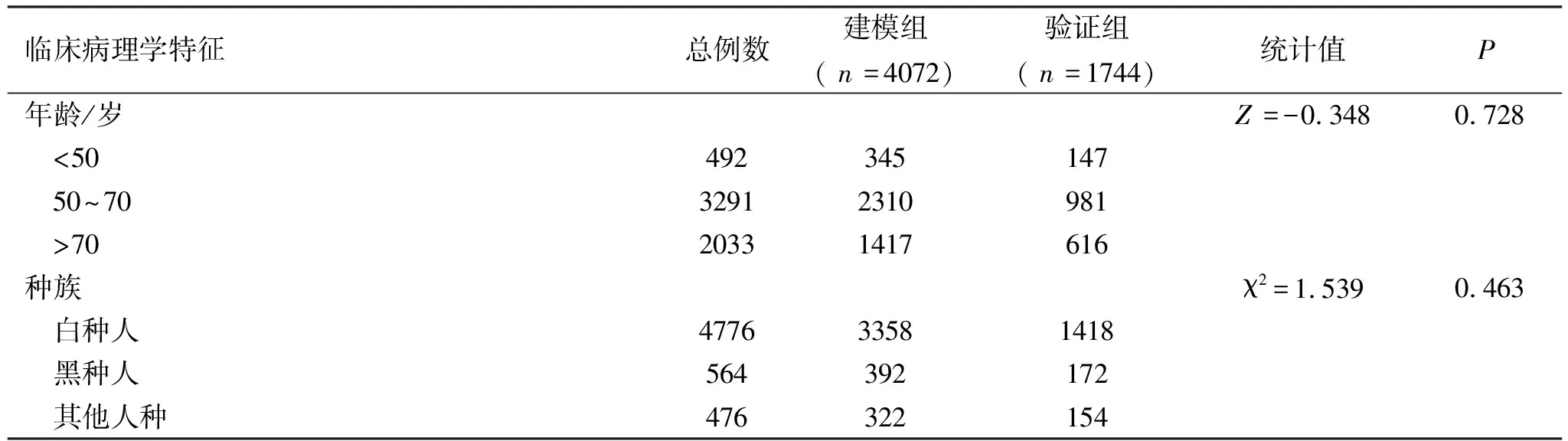
表1 建模组和验证组间临床病理资料的比较结果
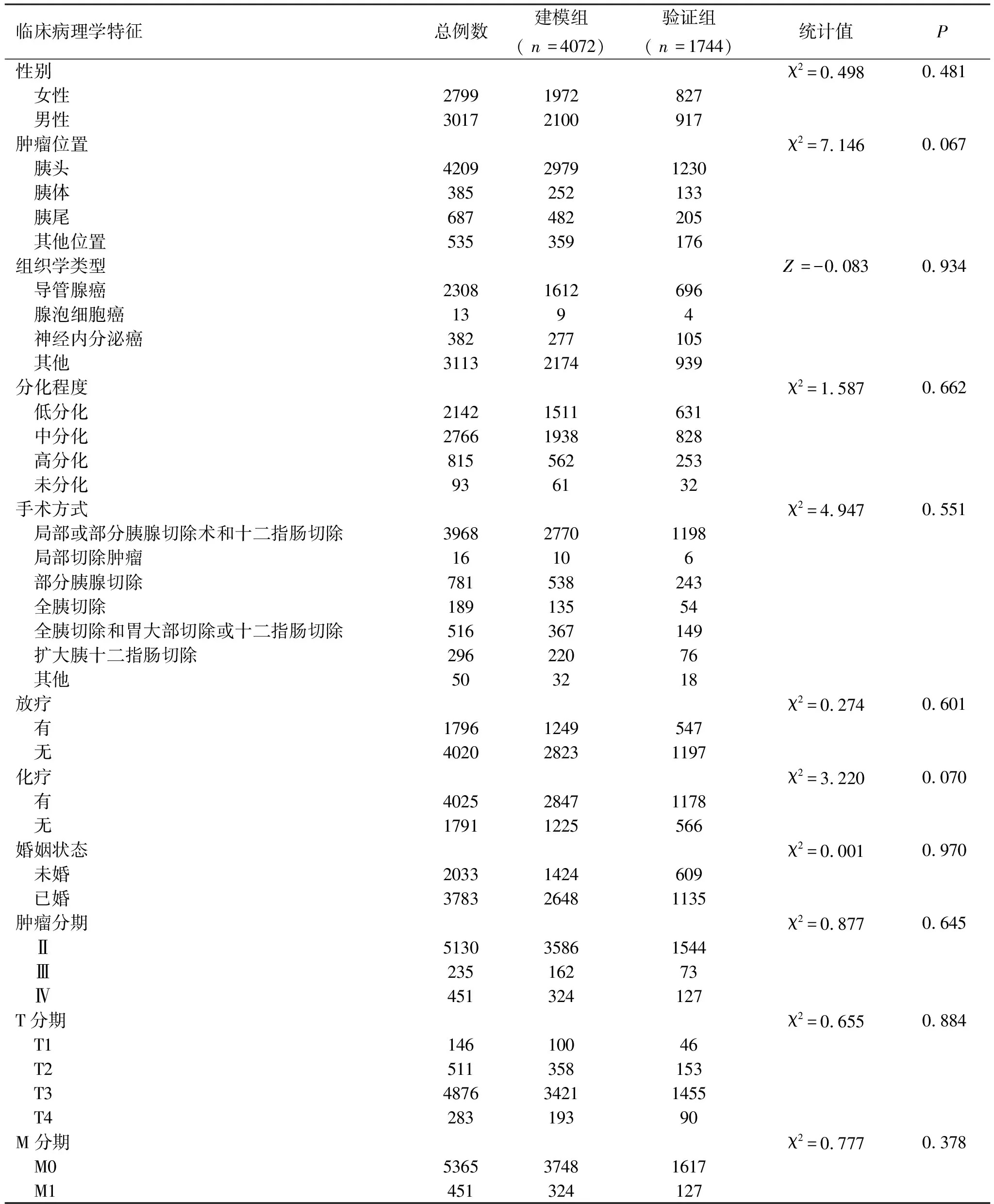
表1(续) 建模组和验证组间临床病理资料的比较结果
2.2单因素COX比例风险回归分析结果 建模组患者共4 072例,其中男2 100例,女1 972例,死亡3 365例,存活707例,中位生存时间为19个月,单因素COX比例风险回归分析结果表明,年龄、肿瘤位置、组织学类型、分化程度、手术方式、放疗、婚姻状况、肿瘤分期、T分期是胰腺癌患者术后的预后影响因素(P<0.05),见表2。

表2 单因素COX比例风险回归分析结果
2.3多因素COX比例风险回归分析结果 将单因素COX回归分析中有意义的因素纳入多因素COX回归分析,多因素COX回归分析结果显示,年龄、肿瘤位置、组织学类型、分化程度、放疗、婚姻状况、肿瘤分期、T分期是胰腺癌患者预后的影响因素(P<0.05),见表3。
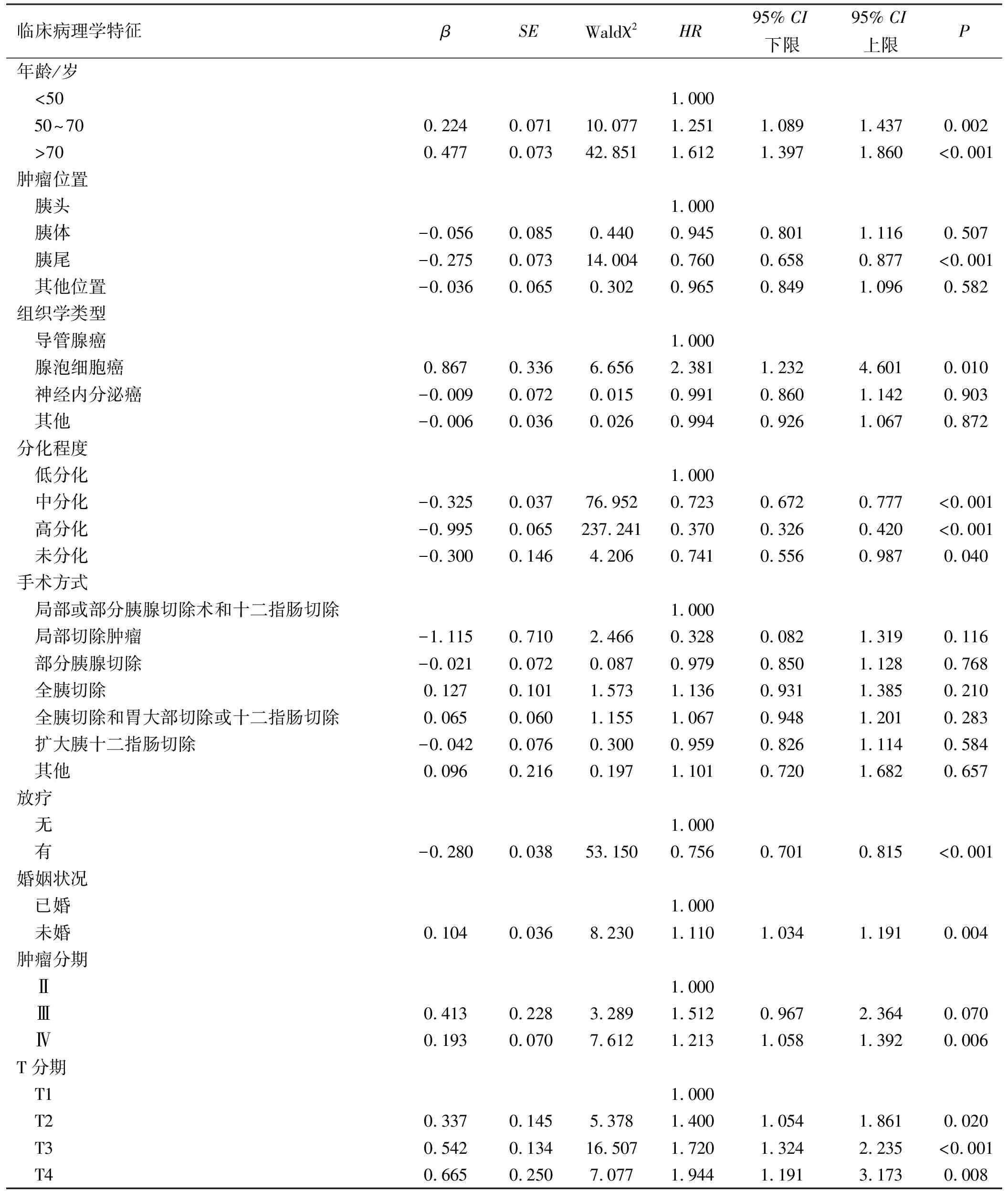
表3 多因素COX比例风险回归分析结果
2.4生存分析 将多因素COX比例风险回归分析有意义的因素进行生存分析,生存分析表明,年龄、肿瘤位置、组织学类型、分化程度、放疗、婚姻状况、肿瘤分期、T分期是术后患者生存的影响因素(P<0.05),见图1A~图1H。并根据预后风险值将建模组患者分为高风险和低风险两组,进行生存分析后显示高风险组患者术后生存时间低于低风险组,见图1I。
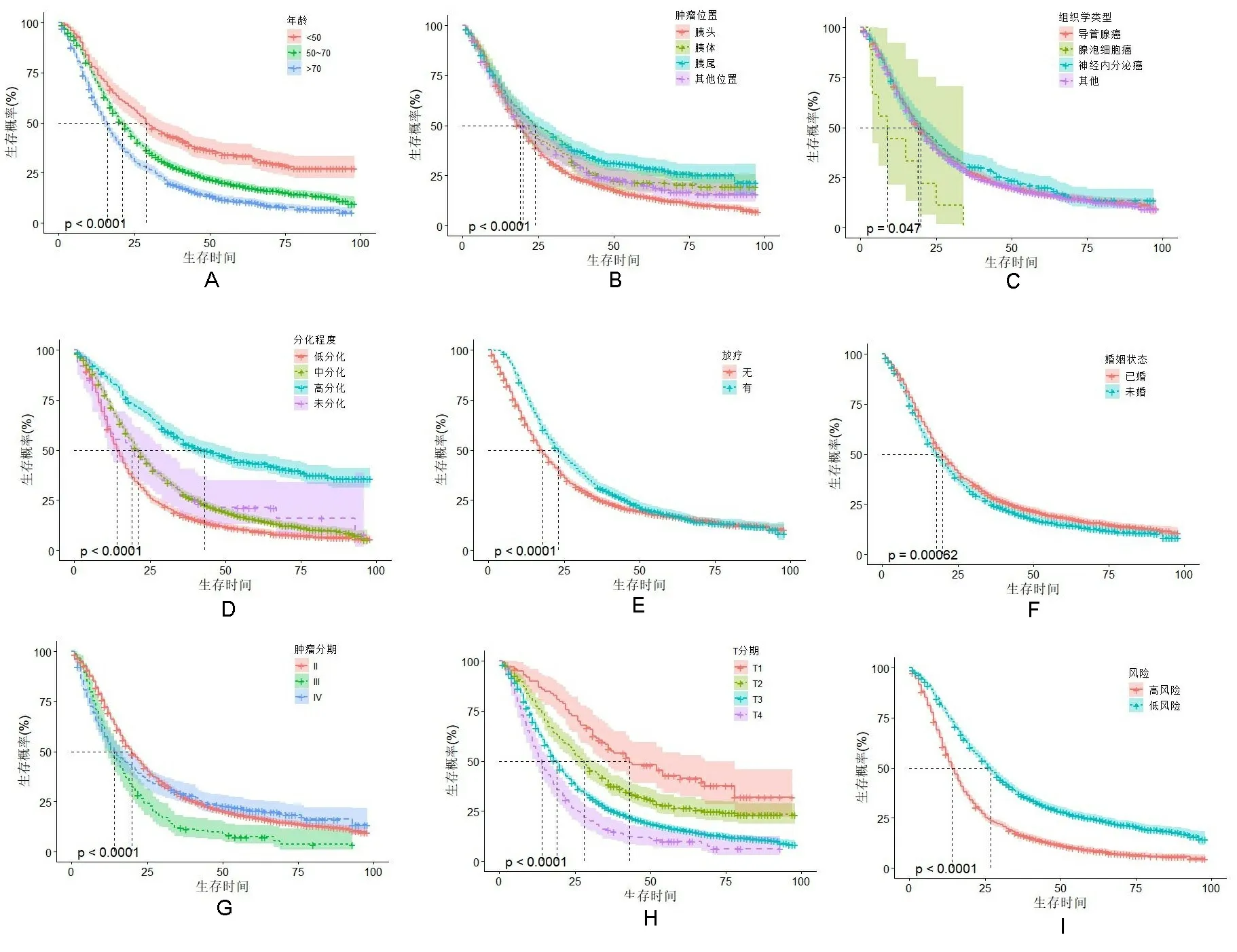
注:不同年龄(A)、肿瘤位置(B)、组织学类型(C)、分化程度(D)、放疗(E)、婚姻状态(F)、肿瘤分期(G)、T分期(H)情况的胰腺癌患者的生存曲线;I.高风险组和低风险组的生存曲线。
2.5胰腺癌患者术后预测模型的构建 根据多因素COX比例风险回归分析的结果,将年龄、肿瘤位置、组织学类型、分化程度、放疗、婚姻状况、肿瘤分期、T分期纳入淋巴结活检阳性胰腺癌患者术后预测模型的构建中,并绘制列线图,列线图可以整合多个预后因素来准确预测个体的生存率,在该列线图中,肿瘤分化程度线段最长,婚姻状态线段最短,根据每个影响因素对应的分值,可以得到总分,并直接预测患者1年、3年及5年的生存概率,见图2。

图2 胰腺癌患者术后1、3、5年生存率的预测模型
2.6预测模型效能验证 分别绘制建模组和验证组1年、3年及5年的ROC曲线,见图3,建模组患者术后1年、3年及5年ROC曲线下面积(AUC)分别为0.67、0.68、0.71,验证组患者1年、3年及5年ROC曲线下面积(AUC)分别为0.69、0.69、0.67,建模组和验证组C-index分别为0.627、0.639,建模组校准曲线均与标准直线贴合良好,见图4A、图4B、图4C,验证组校准曲线均与标准直线贴合良好,见图4D、图4E、图4F,以上均提示该模型的预测效能较好。

注:A.建模组的1年、3年及5年的ROC曲线;B.验证组的1年、3年及5年的ROC曲线。

注:A、B、C分别为建模组患者1年、3年及5年校准曲线;D、E、F分别为验证组1年、3年及5年校准曲线。
3 讨论
胰腺癌是世界范围内最致病的癌症之一,每年导致超过33万人死亡,在男性和女性死亡原因中排第七,其中,发达国家胰腺癌的发病率和死亡率最高[5],寻找与胰腺癌相互关联的临床病理学特征并针对患者采取个性化的治疗显得尤其重要。正如前言中提到,淋巴结阳性的人群与非阳性的人群预后存在明显差异,在淋巴结检查不充分的情况下,部分阳性的淋巴结可能会被漏检,并影响肿瘤的N分期,因此,迫切需要将淋巴结阳性的人群进行单独研究,探讨这部分人群的预后危险因素,国外研究发现[6],有区域淋巴结转移的患者的中位生存期低于无淋巴结转移患者的中位生存期,分别为17.1个月和25.5个月,说明淋巴结状态本身也是预后的危险因素。本次研究发现,患病年龄<50岁或处于50~70岁年龄段的患者生存率及中位生存时间大于年龄>70岁的胰腺癌患者,与文献报道一致[7],胰腺癌死亡的风险随着年龄的增长而增加,这与人体机能及免疫力的下降有一定关系,我国已经步入老龄化社会,对高龄人群进行胰腺癌的早期筛查及一级预防尤为重要。肿瘤的位置可以分为胰头、胰体、胰尾及其他位置,多因素分析及生存分析均表明胰尾及胰体部肿瘤的预后好于胰头部,一项174例患者的研究曾得出结果,胰尾或胰体肿瘤的肿瘤中位生存期为24.05个月,而胰头肿瘤的中位生存期为19.45个月[8],差异有统计学意义,这与不同肿瘤部位存在肿瘤免疫及微环境的差异可能有关,此研究也证明B细胞和CD4+T细胞在胰头癌中浸润更显著,这值得进一步的研究。
肿瘤的组织学类型是预后生存率的又一个重要因素,神经内分泌癌和导管腺癌的生存率明显高于腺泡细胞癌,腺泡细胞癌是一种比较罕见的胰腺肿瘤,预后很差[9],约五分之一的腺泡细胞癌表现出BRCA1/2突变,因此,对腺泡细胞癌进行针对性的基因检测,有助于尽早发现并提前预防关联亲属胰腺癌的发生,神经内分泌癌通常被认为是一种惰性肿瘤,对化疗药物有一定的敏感性。肿瘤分化程度与术后生存期有显著的相关性[10],肿瘤的治疗一定程度上也基于肿瘤的分化程度,生长抑素类似物、细胞毒药物及靶向治疗药物是常用的治疗药物[11],肿瘤分化程度越低代表肿瘤的异质性越大,低分化肿瘤的中位生存期明显低于高分化肿瘤。近年以来,不断发展的放射治疗技术允许使用更高的消融剂量来提高患者的生存率[12],与本次研究的结果一致,化疗也是属于胰腺癌的有效治疗方法,在文献中有详细的临床使用指导[13],但在本次研究中,单因素分析显示化疗对预后无明显差异,可能与此次研究的人群有一定关系,此次纳入研究的人群全部为淋巴结活检阳性的,该部分人群对化疗的敏感度预计较差,导致化疗的研究结果产生一定的偏倚,后续将扩大样本量或避免某些混杂因素的影响进行进一步的分析。肿瘤的TNM分期对预后有着深刻的影响[14],T1及Ⅱ分期的肿瘤生存率最高,T4分期肿瘤的生存率最低。
关于婚姻状态对预后的影响,是一项比较有趣的研究,国外相关研究已经说明,已婚胰腺癌患者与未婚胰腺癌患者相比具有生存优势,但也有研究得出相反结果[15],认为婚姻状态与预后无关联,这在后续值得进一步的大样本分析,本次研究认为已婚胰腺癌患者的生存期高于未婚胰腺癌患者,可能与已婚患者的生活质量较好或心理社会因素有一定关系。
本次研究创新地研究淋巴结活检阳性的人群预后生存的影响因素,并构建可直观预测生存率的列线图模型,经过评估,模型的准确性良好,可信度较高,为临床医师判断患者预后提供了指导作用,后续可以用国内数据做再次的验证,但本研究也存在一定的不足,该数据库缺乏实验室指标及基因表达相关的数据,如CA199、CEA等肿瘤标志物,后续值得更深入的探索。

