新型氟化MOFs材料对水中全氟辛烷磺酸的吸附性能研究
邓 翔,陈 文,朱霞萍,魏嘉勋
(1.成都理工大学 材料与化学化工学院,四川 成都 610059; 2.四川省矿产资源化学高校重点实验室,四川 成都 610059)

符号说明
0 引 言
全氟辛烷磺酸(PFOS)(化学表达式为C8F17SO3X,X可为H、酰胺、金属离子及其他衍生物)因具备良好的化学稳定性、热稳定性、高表面活性和疏水疏油性等特性,被广泛应用于各种应用领域,例如消防泡沫、镀铬、光刻、纸张和织物保护等[1].但是,由于PFOS具有很高的化学稳定性,因此它具有极强的持久性、生物累积性、强毒性.PFOS在水生环境中广泛分布,被认为是一类具有内分泌干扰特性的新型持久性有机污染物[2].因此,对于PFOS的监测和去除降解是环境领域研究的重点.调查结果显示,绝大多数传统技术都无法对PFOS进行高效的处理[3],因此,开发有效的全氟辛烷磺酸去除技术非常重要.
目前已报道的PFOS处理技术有超声降解法[4]、紫外光降解法[5]、氧化还原降解法[6]、膜分离法[7]和吸附法[8].在这些方法中,吸附法具有简单、低成本和高效的优点,被认为是去除全氟辛烷磺酸的有效方法之一.MOFs材料因其多变、多种类金属中心和无限延伸的框架结构及有机配体,其优势远大于制备复杂、成本高昂的磁性纳米材料和分子印迹材料,且较以静电吸附为作用的LDHs材料,对PFOS具有更多样的相互作用[9].亲氟作用是指含氟基团识别其他含氟分子的独特能力,是一种类似“相似相溶”的相互作用,它源于分子的全氟烷基片段之间的非共价相互作用和强选择性.因此PFOS一类的PFCs会优先通过亲氟作用吸附在吸附材料的C-F键部分,且氟的引入量越多,材料越疏水[10].因此,本研究基于亲氟作用的吸附机理,制备具有多重吸附性能的氟化MOFs材料应用于环境水样中PFOS的吸附去除,进行PFOS吸附特性及吸附机理的研究,为环境水样中PFOS的吸附去除提供理论基础和技术支撑.
1 实验部分
1.1 主要试剂与仪器
FeSO4·7H2O、C6H12N4、NaOH、NaCl、H3BO3(分析纯,成都金山化学试剂有限公司);无水乙醇、冰醋酸、四氟对苯二甲酸(分析纯,上海阿拉丁试剂有限公司);N、N二甲基甲酰胺、盐酸、尼罗蓝A(分析纯,上海麦克林生化科技有限公司);磷酸(分析纯,上海皓鸿生物医药科技有限公司);全氟辛烷磺酸(PFOS)(分析纯,德国Dr.Ehrenstorfer公司).
ZD-85型数显恒温水浴振荡器(郑州豫华仪器制造有限公司);KH19A型离心机(福州新益仪器有限公司);DHG-9101·1SA型电热恒温鼓风干燥箱(上海三发科学仪器有限公司);DZF-6050型真空干燥箱(上海齐欣科学仪器有限公司);UV-5500型紫外-可见分光光度计(上海元析仪器有限公司);PXJ-1C+型离子活度计(成都世纪方舟科技有限公司);KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司).
1.2 F-Fe-MOF的制备
称取FeSO4·7H2O、四氟对苯二甲酸(H2tfbdc)和六次亚甲基四胺(HMT),摩尔比为2∶2∶1.分别在DMF溶剂中超声溶解FeSO4·7H2O、H2tfbdc和HMT一定时间.再将充分溶解的金属离子、有机碱溶液及配体混合超声.将混合溶液转移至反应釜中密封后置于烘箱中,于 150 ℃ 反应 24 h.将冷却后产物过滤、离心,分别用DMF、无水乙醇洗涤、去离子水反复清洗数次,直到滴加NaOH不产生沉淀.将洗涤后的产物置于真空干燥箱中,于 150 ℃ 活化 24 h.将活化完成的产物碾磨过筛,即得到F-Fe-MOF[9].
1.3 F-Fe-MOF的表征
X射线衍射(XRD):使用TD-5000型X射线衍射仪表征样品的晶体特性,以Cu Ka X-rays为靶,扫描区间为1.5°~80°,扫描速度为4°/min.
场发射扫描电镜(SEM):将干燥的样品用导电胶固定在样品台上,使用Pharos G2型扫描电镜观察其表面形貌.
傅里叶红外变换光谱(FT-IR): 将样品与溴化钾(KBr)均匀混合,置于压片机制成片,采用Cary630型傅里叶变换红外光谱仪进行检测,测量范围为500~4 000 cm-1.
物理吸附表征:使用麦克2460型BET分析仪,测试样品比表面积及孔径分布.将样品在 140 ℃ 下脱气 8 h,测试时以N2为吸附分子,氮吸附时相对压力的范围取 0.009 5~0.995.
1.4 吸附实验
称取一定量的F-Fe-MOF,并为每种材料设置空白组;配置PFOS-K水溶液浓度为 10 mg/L;用NaOH和HCl调节pH,加入一定量的NaCl溶液使其浓度为 0.01 mol/L,调节温度和时间进行振荡吸附.吸附后通过离心分离,将分离后的上清液pH调至与去离子水的一致,并用过滤头过滤,采用紫外-可见分光光度法测定PFOS平衡浓度,并计算F-Fe-MOF对PFOS吸附平衡时的吸附率θ和吸附容量qe,计算公式分别为式(1)和式(2).
解吸:取吸附完成后的材料,用去离子水重复离心洗涤5次,分别加入甲醇、乙腈、丙酮、甲醇碱(氨水的质量分数为0.1%)、氟化钠(0.1 mol/L)25 mL,在 25 ℃ 下于恒温振荡器中以 250 r/min 转速振荡解吸 2 h 后,悬浮液以 10 000 r/min 转速离心 5 min,并调节溶液pH与去离子水一致,用过滤头过滤,用紫外-可见分光光度法分析滤液中残留PFOS浓度,计算解吸率.
2 结果与讨论
2.1 F-Fe-MOF摩尔比制备条件的选择
通过对不同摩尔比nFe∶ntfbdc∶nHMT制备的F-Fe-MOF吸附性能研究发现,2∶3∶1、1∶3∶1、1∶2∶1、1∶1∶1 的产量很低,仅为 12 mg(12%)左右,是因为配体占比增加会使MOF材料的比表面积减小,产率降低[11],不适于吸附材料的应用.而nFe∶ntfbdc∶nHMT分别为3∶1∶1、2∶3∶1、2∶1∶1、3∶3∶1、2∶2∶1比例下制备的F-Fe-MOF,其产率较高,在 75 mg (75%)左右,对PFOS的吸附量如图1所示,根据吸附量的大小,确定制备F-Fe-MOF的金属离子、配体、有机碱的最佳摩尔配比为2∶2∶1.图中可见,有机碱越多,越有利于配体的去质子化,从而能够与中心金属离子更好地结合形成更多的活性位点.但如果引入过多的有机碱,会和配体存在与金属中心竞争配位的作用[9].因此以摩尔比nFe∶ntfbdc∶nHMT为2∶2∶1条件下制备的F-Fe-MOF作为吸附剂进行表征与后续吸附性能研究.
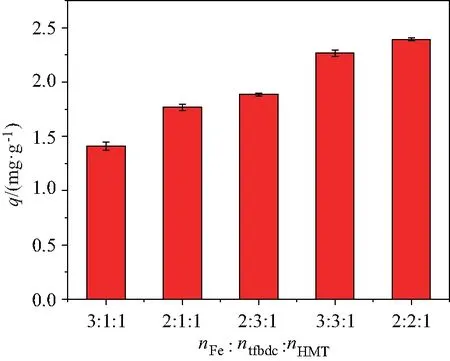
图1 不同的nFe∶ntfbdc∶nHMT比值 对PFOS吸附量的影响Fig.1 Effect of different nFe∶ntfbdc∶nHMT ratio on PFOS adsorption rate
2.2 F-Fe-MOF的表征
2.2.1 SEM &EDX表征
如图2的SEM图所示,F-Fe-MOF表面分散着许多片状纺锤体,分布不均,粒径大约为 250 nm.结合图3的EDX图可知,F-Fe-MOF主要由Fe、F、O等元素组成,各元素的质量分数为:F:48.44%;Fe:37.73%;O:13.83%.这说明材料中含大量氟元素.
2.2.2 FT-IR和XRD表征
由图4的FT-IR图可知,在 1 400 cm-1处有C-F键的存在,故能说明所制备的产品为F功能化MOF材料,如前言中提到,该材料具有含氟基团,因而与其他含氟分子(如PFOS)可以形成F-F键,从而具有较强的相互作用,也称亲氟作用.因此,当MOF材料经过氟功能化以后,氟化官能团与PFOS存在相互作用,使得该材料对PFOS的吸附性能获得很大的提高.其中 1 100 cm-1为C-O,1 650 cm-1为苯环上的C=C和C-H振动,3 600 cm-1处的-OH峰消失,故可说明四氟对苯二甲酸中的-OH全部与金属相结合.

图2 F-Fe-MOF的SEM图Fig.2 The SEM photo of the F-Fe-MOF
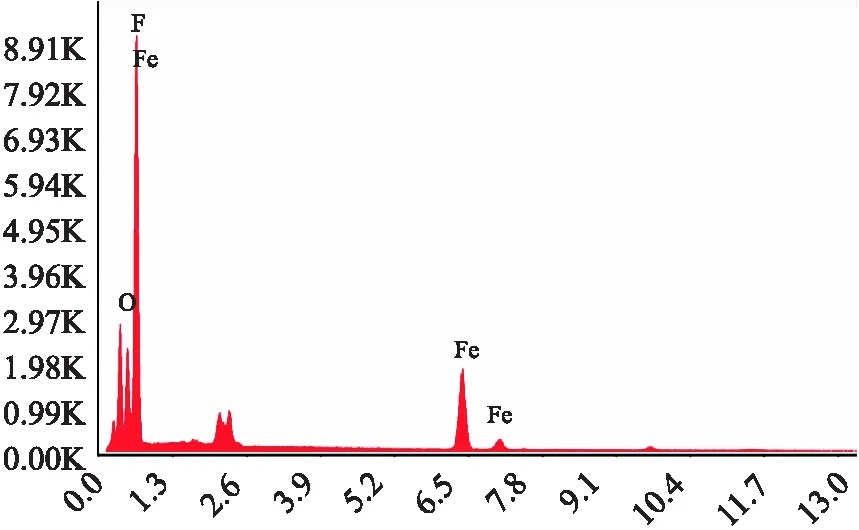
图3 F-Fe-MOF的EDX图Fig.3 The EDX photo of the F-Fe-MOF
图5为XRD的表征图谱,可以看出:F-Fe-MOF在2θ=32.7°、35.5°、43.2°、53.4°、54.9°、62.5°处的特征峰对应Fe2O3的220、311、400、422、511和440晶面,表明F-Fe-MOF为立方尖晶石结构[12].考虑到材料制备的时间成本,因其吸附性能与结晶度关系不大,本材料未等待晶型的充分生长,这是该材料的XRD图谱中衍射峰强度较低、表现出较明显的非晶态漫反射峰特征的缘故.
2.2.3 F-Fe-MOF的物理吸附表征
采用氮气吸附/脱附技术对F-Fe-MOF进行比表面积、孔体积、孔分布分析.其物理吸附曲线及脱附孔径分布如图6所示.由图6(A)可知,F-Fe-MOF对N2的吸附等温线满足Ⅳ型,回滞环满足H4型,表明F-Fe-MOF为微孔和介孔混合材料.图6(B)中介于 3.8 nm 处的高峰为假峰,是由于材料内部孔径的分散性、孔道的连接性在相对压力=0.4 MPa 时产生的突降.因此F-Fe-MOF材料中 4 nm 左右的介孔分布最广,这说明材料具有大量的孔穴,而PFOS的粒径约 1.7 nm,有利于PFOS在孔道内的充分扩散,并与内部活性位点相互作用,进一步说明了F-Fe-MOF能够吸附被介孔材料选择性透过的PFOS[13].
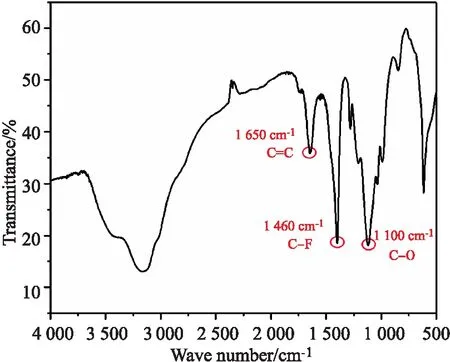
图4 F-Fe-MOF的FT-IR图Fig.4 FT-IR spectra of F-Fe-MOF

图5 F-Fe-MOF的XRD图Fig.5 XRD pattern of F-Fe-MOF
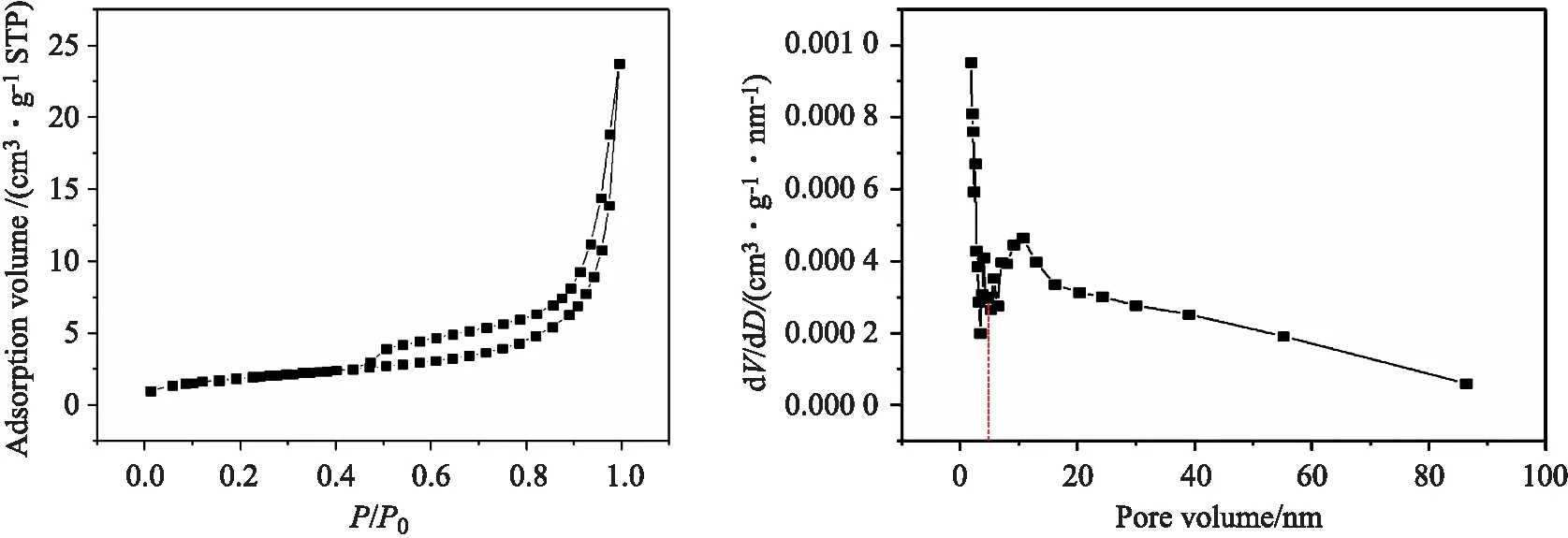
(A) (B)图6 F-Fe-MOF的氮气吸附等温图(A)、BJH脱附孔径分布图(B)Fig.6 Nitrogen adsorption isothermic photos (A) and distribution of BJH (B) of F-Fe-MOF
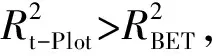
2.3 F-Fe-MOF对PFOS的吸附性能和饱和吸附量
2.3.1 吸附条件对F-Fe-MOF吸附PFOS的影响
按照实验方法研究考察了pH(2、4、6、8、10、12)、固∶液(S∶V)比(24 mg∶8 mL;16 mg∶8 mL;8 mg∶8 mL;8 mg ∶16 mL;8 mg∶24 mL)、吸附时间(5、15、30、45、60、90、120、150、180 min)、温度(25、30、40、50、60 ℃)、离子强度(0、0.01、0.02、0.03、0.04、0.05、0.06 mol/L)对F-Fe-MOF吸附PFOS的影响,结果如图7所示.
由图7(A)可知,当溶液pH=2时,F-Fe-MOF对PFOS的吸附容量最高.随着pH值的上升,吸附容量逐渐下降.这表明F-Fe-MOF对PFOS存在一定的静电作用.较低的pH增强了静电作用和表面配合物的形成,对PFOS有机阴离子的吸附量增加.当溶液酸性越强,F-Fe-MOF表面质子化越强,附着的H+越多,形成的活性吸附位点越多,越能和带负电的PFOS发生静电反应;而随着酸度降低,F-Fe-MOF逐渐去质子化,减少了材料所带的正电荷,从而造成吸附率降低.因此选择酸性较强的pH=2为最佳的溶液酸度条件进行后续的研究.
图7(B)~7(E) 显示:当S∶V=8 mg∶16 mL时,F-Fe-MOF对PFOS的吸附容量最高;吸附时间在 60 min 内基本达到平衡;而温度对F-Fe-MOF吸附PFOS存在一定影响,升温会造成吸附率下降,吸附温度T=25 ℃ 可以获得最佳的吸附量;而以NaCl为吸附体系提供离子强度,随着NaCl含量的升高,Cl-对PFOS的阴离子交换性产生一定程度的抑制,是因为Cl-占据了一部分PFOS在吸附剂上的吸附位点,阻碍了对PFOS的吸附,由于水体中存在大量的阴、阳离子,因此离子强度在吸附应用中无法回避.
最终确定了最佳吸附条件:pH=2;固∶液(S∶V)=8 mg∶16 mL;吸附时间为 60 min;吸附温度为 25 ℃;离子强度CNaCl=0.01 mol/L.

(A) (B) (C)

(D) (E)图7 pH(A)、固液比(B)、时间(C)、温度(D)和离子强度(E)对F-Fe-MOF吸附PFOS的影响Fig.7 Effect of pH (A),Solid-liquid ratio (B),time (C),temperature (D) and Ionic strength (E) on F-Fe-MOF adsorption of PFOS
2.3.2 F-Fe-MOF对PFOS的饱和吸附容量
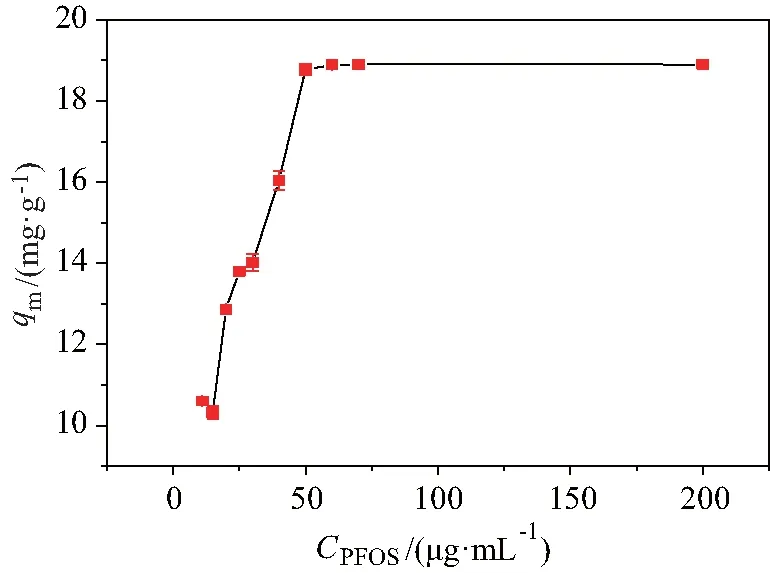
图8 F-Fe-MOF对PFOS的饱和吸附容量Fig.8 Saturated adsorption capacity of PFOS by F-Fe-MOF
在最佳吸附条件下,分别取初始浓度为10、15、20、25、30、40、50、60、70、200 mg/L 的PFOS-K水溶液;用HCl和NaOH调节pH为2,进行吸附研究.由图8可知,F-Fe-MOF材料对PFOS的饱和吸附容量为 18.89 mg/g.通过与目前部分PFOS吸附材料的对比发现,F-Fe-MOF材料较其他材料对PFOS的吸附性能更佳,见表1所示.
2.4 吸附动力学行为
用准一、准二级动力学模型及颗粒内扩散模型来描述F-Fe-MOF对PFOS的吸附动力学行为.
1) 准一级动力学模型:
ln(qe-qt)=lnqe-K1t
(3)
式中:Ci为i阶段的常数,表征外扩散过程中的边界层效应.
3种动力学模型对实验数据进行拟合,拟合参数见表2. 3种动力学模型相关的拟合相关系数R2中,准二级动力学的拟合相关系数为最高,R2=0.988 4,表明F-Fe-MOF对于PFOS是以亲氟、氢键作用的化学吸附为主,同时还存在着静电作用等物理吸附.

表1 不同吸附材料对PFOS吸附能力的对比Tab.1 Comparison of the adsorption capacity of PFOS by different adsorption materials

表2 F-Fe-MOF吸附PFOS的准一级和准二级动力学模型拟合参数
内扩散模型拟合中,第二段斜率K2=0.012 18 远小于第一段斜率K1=0.309 1,分别对应吸附过程中的化学反应阶段和扩散阶段.其中Ci为阶段i的常数,表征外扩散过程中的边界层效应.内扩散模型拟合曲线为直线,且均不过原点,整体拟合趋势不为直线,说明F-Fe-MOF吸附PFOS为外扩散和内扩散共同作用,其中化学反应过程中的C2大于扩散阶段的C1,这说明化学反应阶段的边界层效应大于扩散阶段的边界层效应.因此F-Fe-MOF对于PFOS的吸附过程首先在表面进行外扩散(这一过程包括静电、氢键作用),然后进一步通过介孔进入孔径,主要与孔径内的F产生亲氟作用完成吸附.
2.5 吸附等温线
用Langmuir、Freundlich等温线方程来描述F-Fe-MOF对PFOS的吸附行为.表达式如下:

图9 F-Fe-MOF在PFOS上的吸附等温线Fig.9 The Adorption Isotherms of F-Fe-MOF on PFOS
在 25 ℃ 下按照实验方法进行,利用式(2)计算平衡吸附量,F-Fe-MOF对PFOS的吸附等温曲线如图9所示,拟合参数见表3.
由图9和表3可知,Freundlich模型能较好地对F-Fe-MOF吸附PFOS的数据进行拟合,R2=0.919 6.F-Fe-MOF对PFOS的吸附位点不均匀,吸附是多分子层的,且各化学作用点不均匀.Freundlich公式中的n>1,表明此吸附过程是有利的,但随着温度的升高,n和KF、R2逐渐下降,因此升温对吸附过程有一定的影响.

表3 25 ℃ 下F-Fe-MOF对PFOS的Freundlich和Langmuir吸附等温线拟合参数
2.6 吸附热力学行为
温度对吸附过程的影响可以从吸附过程的热力学参数,比如吸附的焓变(ΔH)、标准自由能(ΔG)及吸附的熵变(ΔS)反映出来.可以用下述方程计算上述数值:
Van’t Hoff方程:
ΔG=-RTlnKd
(9)
由 Van’t Hoff方程(10)作lnKd对1/T的线性回归,由直线的斜率和截距可求得反应的焓变(ΔH)、吉布斯自由能(ΔG)和熵变(ΔS).其结果如表4所示.
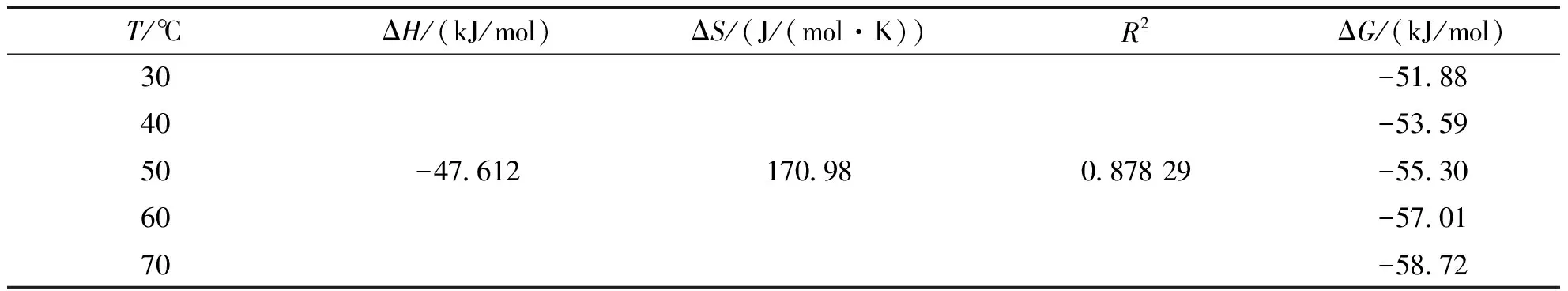
表4 F-Fe-MOF吸附PFOS的热力学拟合参数
由表4可知,根据Van’t Hoff拟合方程计算出在30、40、50、60、70 ℃ 条件下,ΔH<0,ΔS>0,ΔG<0且随着温度的升高ΔG变大.这说明F-Fe-MOF对PFOS的吸附是一个自发的放热过程,升温不利于反应的进行.
2.7 解吸实验
采用甲醇、乙腈、丙酮、甲醇碱(氨水的质量分数为0.1%)、氟化钠溶液(0.1 mol/L)对吸附过后的F-Fe-MOF进行解吸实验.5种解吸剂中仅甲醇碱对PFOS有一定的脱附作用,但脱附率仅为13%,表明F-Fe-MOF与PFOS的相互作用很强,不易被解吸.这对吸附剂的进一步重复利用造成了困难.然而,鉴于该材料对PFOS具有较好的吸附性能及难以解吸的特点,具有作为修复PFOS污染土壤的复合钝化剂的潜质.
2.8 实际水体应用性能分析
将所制备的F-Fe-MOF对实际地表水体中PFOS的去除性能进行研究.采集成都某大学湖水、附近渠水和实验室自来水,将水样过滤后,首先分析其中PFOS的含量,再加入适量PFOS,使其浓度为 10 mg/L,再调整pH=6、2,以制成模拟地表水和模拟酸性废水,按照实验方法进行吸附去除应用.吸附后对不同水样中PFOS的吸附率见表5.
由表5可知,F-Fe-MOF对以3种实际水样为本底配制的模拟地表水和酸性废水的吸附性均较好.其中,对模拟地表水中PFOS的吸附率在76%~80%之间,对模拟酸性污染水体中的PFOS吸附率在86%~92%之间.而模拟水体PFOS的浓度(10 mg/L)是通常污染水体最高浓度 730 ng/L 的1.37×104倍[20],因此,按照其吸附去除率,即便对地表水的吸附率仅为76%,也远远满足污染物的去除要求.
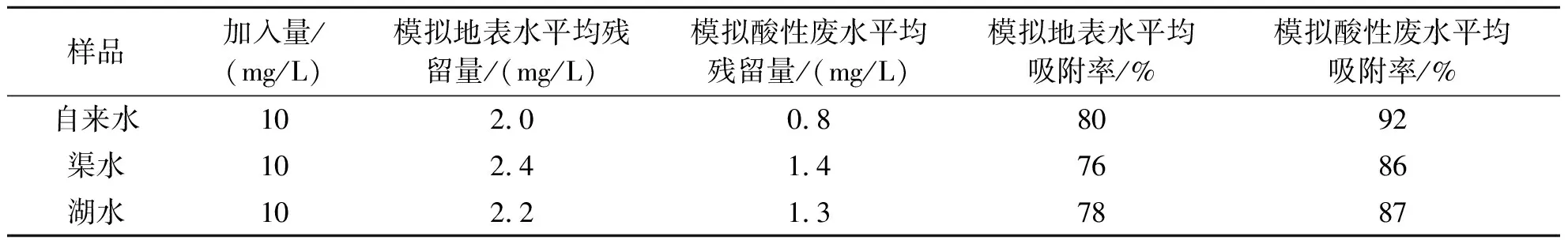
表5 吸附剂对模拟地表水和酸性污染水中PFOS的吸附率(n=3)
3 结 论
1) 对制备的F-Fe-MOF进行XRD、SEM、EDX、FT-IR、物理吸附表征分析可知,F-Fe-MOF为P21单斜晶空间型,呈片状纺锤体,且有C-F键的存在,具有亲氟作用.材料含有微孔、介孔、大孔结构,且 4 nm 左右的介孔分布最广.
2) 吸附研究结果表明,在吸附条件为:S∶V=8 mg∶16 mL;pH= 2;t=1 h;T=25 ℃;CNaCl=0.01 mol/L 时具有饱和吸附容量 18.89 mg/g.吸附过程能被Freundlich模型所拟合,说明F-Fe-MOF对PFOS的吸附为多分子层吸附,且吸附位点不均匀.热力学研究结果说明,此吸附过程是自发的放热过程,升温不利于反应进行.
3) F-Fe-MOF对PFOS的吸附满足准二级动力学方程,进一步证明此过程是以化学吸附为主的吸附过程,存在亲氟、氢键作用化学反应;也存在一定的物理吸附,如静电作用.且内扩散模型说明吸附过程为外扩散和内扩散共同作用.
4) 解吸实验证明,F-Fe-MOF对PFOS的吸附很稳定,较难解吸,具有作为吸附固定PFOS的环保材料的潜质.在实际应用研究中,F-Fe-MOF对3种模拟水体中PFOS的吸附率为76%~92%,说明了该吸附剂对PFOS具有优良的吸附去除性能.
总之,本研究对制备吸附PFOS的新型F-Fe-MOF材料提供了研究思路和技术方法,对于进一步完善和开发新的氟化MOF吸附剂提供了一种可参考的模式,对于研究发展去除环境中持久性有机污染物具有一定的促进作用.

