基于偏最小二乘法分析枇杷叶提取物中α-葡萄糖苷酶抑制剂
孔红铭 赵楠星 夏旭东 袁 芳 曹少谦 戚向阳 陈秋平
(浙江万里学院生物与环境学院,浙江 宁波 315100)
糖尿病(diabetes mellitus,DM)是一类与胰岛素分泌缺陷相关,以高血糖为特征的代谢性疾病[1]。常见症状有多食、多饮、多尿以及消瘦等[2],久病可致眼、肾、心脏等器官出现慢性损害[3]。目前口服降糖药和注射胰岛素通常可以控制糖尿病。天然α-葡萄糖苷酶抑制剂因副作用小,能够有效控制糖尿病患者餐后血糖上升等优势而成为辅助治疗Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)的首选药物。市面上常见的α-葡萄糖苷酶抑制剂大多为人工合成且副作用较多,例如阿卡波糖会引起腹胀、腹泻、腹痛等不良反应[4]。
独特的传统医学理论让中医药在糖尿病及其并发症的治疗方面有着良好的效果和广阔的前景。陈海君等[5]运用亲和超滤技术从毛菊苣种子提取物中筛选并鉴定出4 种α-葡萄糖苷酶抑制剂;Chen 等[6]通过沉淀交联法将猪胰脂肪酶固定在金属有机骨架上,筛选出夏枯草中的脂肪酶抑制剂,获得13 种可抑制脂肪酶的小分子化合物。枇杷叶(Eriobotrya japonica)为蔷薇科植物枇杷的干燥叶[7],作为传统中药,其性微寒、味微苦,有清肺止咳、降逆止呕之功效[8],主要化学成分为三萜酸类、黄酮类、多酚类等物质[9]。近年来,枇杷叶在抗炎、抗氧化[10]、降血糖[11]等方面的作用逐渐受到关注,枇杷叶所含化合物十分复杂,目前尚缺乏对枇杷叶抗糖尿病的药效成分及作用机制的整体认识。
本试验采用偏最小二乘回归分析法,对枇杷叶提取物抑制α-葡萄糖苷酶活性组分的超高效液相色谱-质谱联用(ultra-high performance liquid chromatographymass spectrometry,UPLC-MS)特征图谱与体外酶抑制药效进行相关性分析,以筛选出枇杷叶提取物中抑制α-葡萄糖苷酶的主要活性成分,初步揭示其物质基础。旨在从天然产物中寻找药效温和、毒副作用小的α-葡萄糖苷酶抑制剂,以解决糖尿病人的实际需求。
1 材料与方法
1.1 材料与试剂
α-葡萄糖苷酶(50~120 kDa),西格玛奥德里奇(上海)贸易有限公司;阿卡波糖、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG),上海阿拉丁生化科技股份有限公司;无水乙醇(分析纯)、科罗索酸、奎宁酸,国药集团化学试剂有限公司;枇杷叶(产地品种见表1);甲酸、乙腈(色谱纯),德国Merk公司;试验用水为重蒸水。
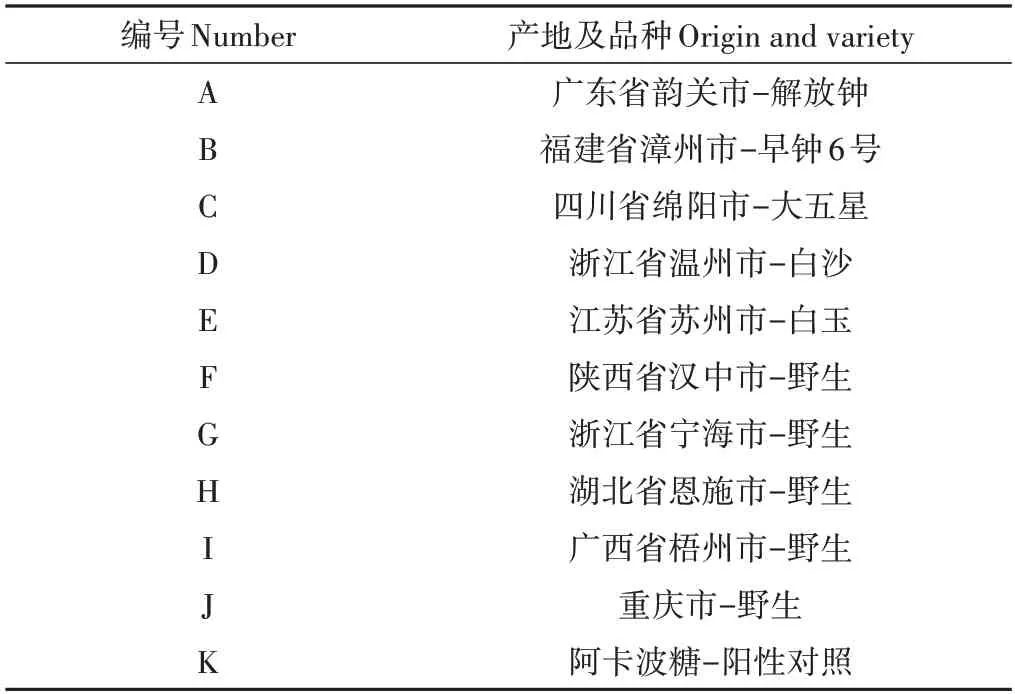
表1 枇杷叶样品信息Table 1 Loquat leaf sample information
1.2 仪器与设备
DXF-04D 手提式磨粉机,广东大祥仪器有限公司;RE2000 旋转蒸发器,上海亚荣仪器有限公司;Centrifuge 5804R 高速冷冻离心机,德国Eppendorf 公司;U570超低温冰箱,英国NBS公司;FD-1F-80T真空冷冻干燥机,上海舜制仪器有限公司;TU-1810可控温紫外分光光度计,北京普析通用仪器有限公司;Waters Synapt G2 MS 超高效液相色谱-质谱联用仪,美国Waters公司。
1.3 试验方法
1.3.2 提取物对α-葡萄糖苷酶的活性抑制作用 空白酶活的测定:用0.1 mmol·L-1磷酸缓冲盐溶液(phosphate buffer saline ,PBS,pH 值6.8)将α-葡萄糖苷酶配制成1.5 U·mL-1的溶液,用于酶活性分析[12-13]。比色皿中加入1.8 mL PBS 缓冲液,于37 ℃预热5 min,待其温度稳定后,加入100 µL PNPG(5 mmol·L-1)溶液,然后加入20 µL 1.5 U·mL-1酶液,迅速摇匀,于405 nm 处检测其2 min 内吸光度值的变化,平行测定3次,计算酶活性(enzymatic activity,EA)[14-15]。
样品和阳性对照阿卡波糖的半抑制浓度(semiinhibition concentration,IC50)测定:缓冲液预热后,加入100 µL PNPG,再加入不同体积梯度的抑制剂,其余步骤同上,抑制率计算公式如下:
将抑制剂浓度及其对应的抑制率输入CalcuSyn Demo软件,计算半抑制浓度,并通过SPSS 25软件进行抑制率曲线绘制。
1.3.3 LE 对α-葡萄糖苷酶活性抑制作用的动力学分析 以IC50值最低的LE 为样品组,控制反应时间、温度、pH 值等不变,在添加相同浓度不同体积(0、30、60、75 µL)抑制剂的条件下,改变底物PNPG 的添加量(90、32、20、13、10 µL),测定α-葡萄糖苷酶酶促反应速率(V),以底物浓度倒数(1/[S])为横坐标,反应速率倒数(1/V)为纵坐标,采用Lineweaver-Burk 双倒数作图分析[16],再以抑制剂浓度为横坐标,双倒数图中不同直线的斜率(Vmax/Km)为纵坐标,得到与x轴相交的直线,并求出Ki,确定抑制类型[17-18]。Vmax和米氏常数Km计算公式如下:
式中,Vmax为最大反应速率(µmol·L-1·s);[S]为底物浓度(µmol·L-1);Km为米氏常数(µmol·L-1)。
1.3.4 UPLC-MS 特征图谱建立 色谱条件:运用Synapt G2 MS 超高效液相色谱-质谱联用仪,色谱柱为ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 µm)。流动相A 为2 mmol·L-1乙酸铵+0.2%甲酸溶液,流动相B 为乙腈。洗脱梯度:0~1 min,20% B;1~9 min,20%~45% B;9~21 min,45%~98% B。进样量2 µL,流速0.2 mL·min-1,检测波长254 nm,柱温35 ℃。
质谱条件:采用电喷雾电离源(electrospray ionization,ESI),负离子模式采集,自动增益控制(automatic gain control,AGC)目标值5 e5;喷雾电压为3 500 V,离子传输管温度为350 ℃,鞘气压40 arb,辅助气压10 arb。
1.3.5 谱效关系分析 以特征图谱中代表化合物的各色谱峰的峰面积为自变量(X),LE 对α-葡萄糖苷酶的抑制率为因变量(Y)[19-20],导入SIMCA 14.0软件,采用偏最小二乘回归分析(partial least square,PLS)进行回归分析。
第四,分销渠道延伸性较弱,忽视促销策略。直接渠道模式,是南通鹏越纺织有限公司的主要分销模式,但这在一定程度上制约了企业的发展,且对竞争对手的了解相对落后。且在促销实践中,推销人员不足,推销力度广度都不够,新客户群体的获得都会受到不同程度的影响。
1.3.6 分子对接 从中药系统药理学数据库(traditional Chinese medicine systems pharmacology,TCMSP,https://tcmspw.com/tcmsp.php)下载配体化合物结构,采用Chem3D 软件将其进行能量最小化处理[21]。在蛋白质数据库(protein data bank,PDB,https://www.rcsb.org/)检索α-葡萄糖苷酶(PDB ID:3A4A),保存为pdb格式,通过Pymol 2.5.0对蛋白结构删除水分子、去除修饰配体[22],再使用AutoDock Tools 1.5.6将活性成分和α-葡萄糖苷酶转换为pdbqt格式,并通过AutoDock Vina 1.1.2 进行分子对接。通过LigPlus 2.5.5分析配体与蛋白的氢键、疏水作用力等。
1.4 数据处理
使用SPSS 25.0 软件进行数据统计,绘制抑制率曲线;通过CalcuSyn Demo 软件计算提取物对α-葡萄糖苷酶的IC50值。
2 结果与分析
2.1 枇杷叶提取物的抑制作用
由图1可知,不同品种产地的LE对α-葡萄糖苷酶均有抑制作用,并表现出一定的浓度依赖性[23],IC50为1.31~2.65 µg·mL-1,远低于阳性对照阿卡波糖(样品K,IC50值为81.98 µg·mL-1),其中抑制效果最佳品种为陕西汉中野生(IC50值为1.31 µg·mL-1)。
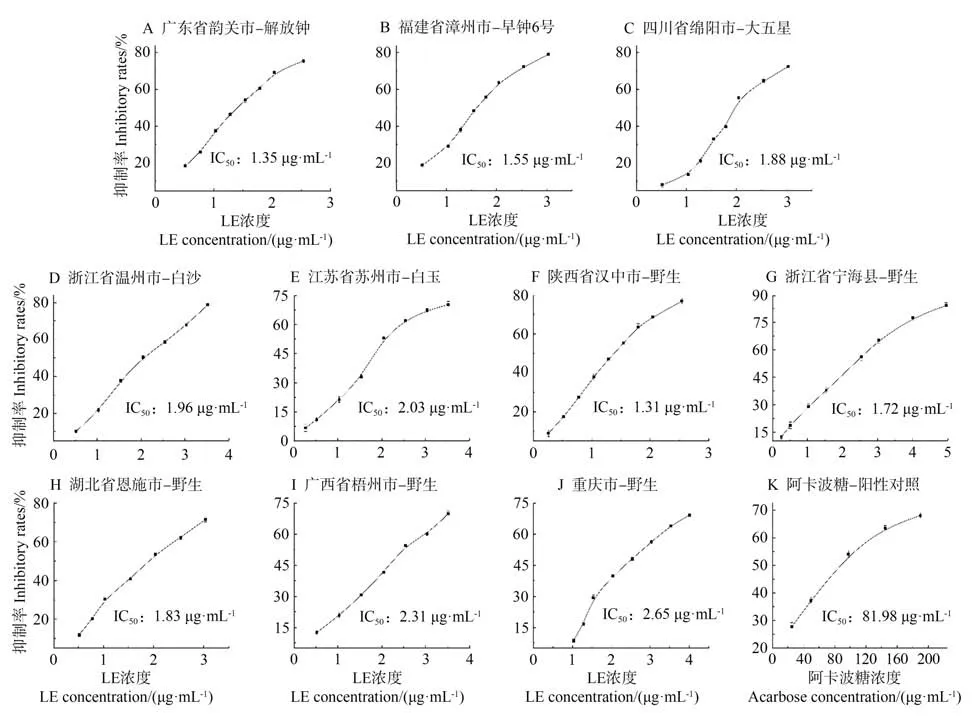
图1 种植品种的枇杷叶提取物对α-葡萄糖苷酶的抑制率曲线Fig.1 Inhibition rate curve of α-glucosidase by different varieties of LE
2.2 LE对α-葡萄糖苷酶的的抑制类型
陕西汉中野生品种对α-葡萄糖苷酶的动力学结果如图2所示,Lineweaver-Burk 双倒数作图法显示直线相交于第Ⅰ象限,非常接近Y 轴,表明提取物对α-葡萄糖苷酶表现为竞争型抑制[24],即提取物中的活性成分与酶促反应底物竞争α-葡萄糖苷酶的活性位点。通过二次作图计算得到其抑制常数Ki为0.491 mmol·L-1。
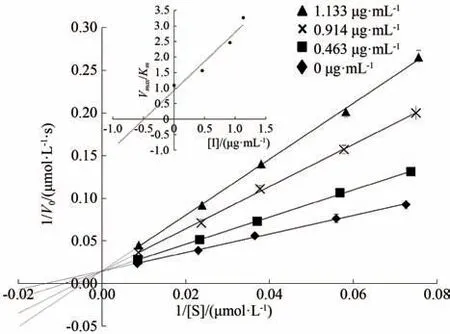
图2 LE对α-葡萄糖苷酶的抑制作用的Lineweaver-Burk曲线Fig 2 Lineweaver-Burk curves for the inhibition of α-glucosidase by LE
2.3 UPLC-MS特征图谱
10 批LE 的 UPLC-MS 特征图谱如图3所示,通过Integrate chromatogram 软件自动积分,分别导出特征图谱中的各峰面积,根据各样品特征图谱的各峰保留时间,共匹配出16 个共有峰,如表2所示,其中X1、X5 和X6 峰面积相对较大,意味着所对应化合物在LE 中占比相对较大,而X2、X4、X11、X13 等峰面积虽相对较小,但不同品种产地LE 的峰面积大小并非直接与α-葡萄糖苷酶抑制率呈正相关,因此,需要通过偏最小二乘法进一步分析。
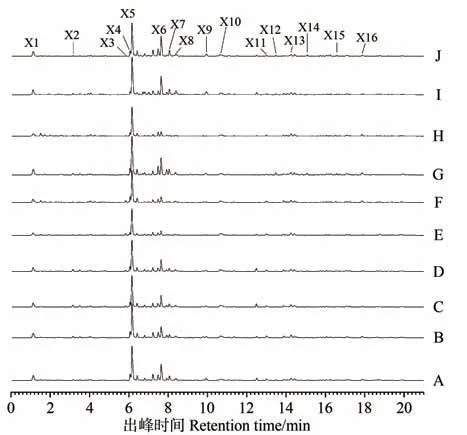
图3 10批LE的UPLC-MS特征图谱Fig.3 UPLC-MS characterization of 10 batches of LE
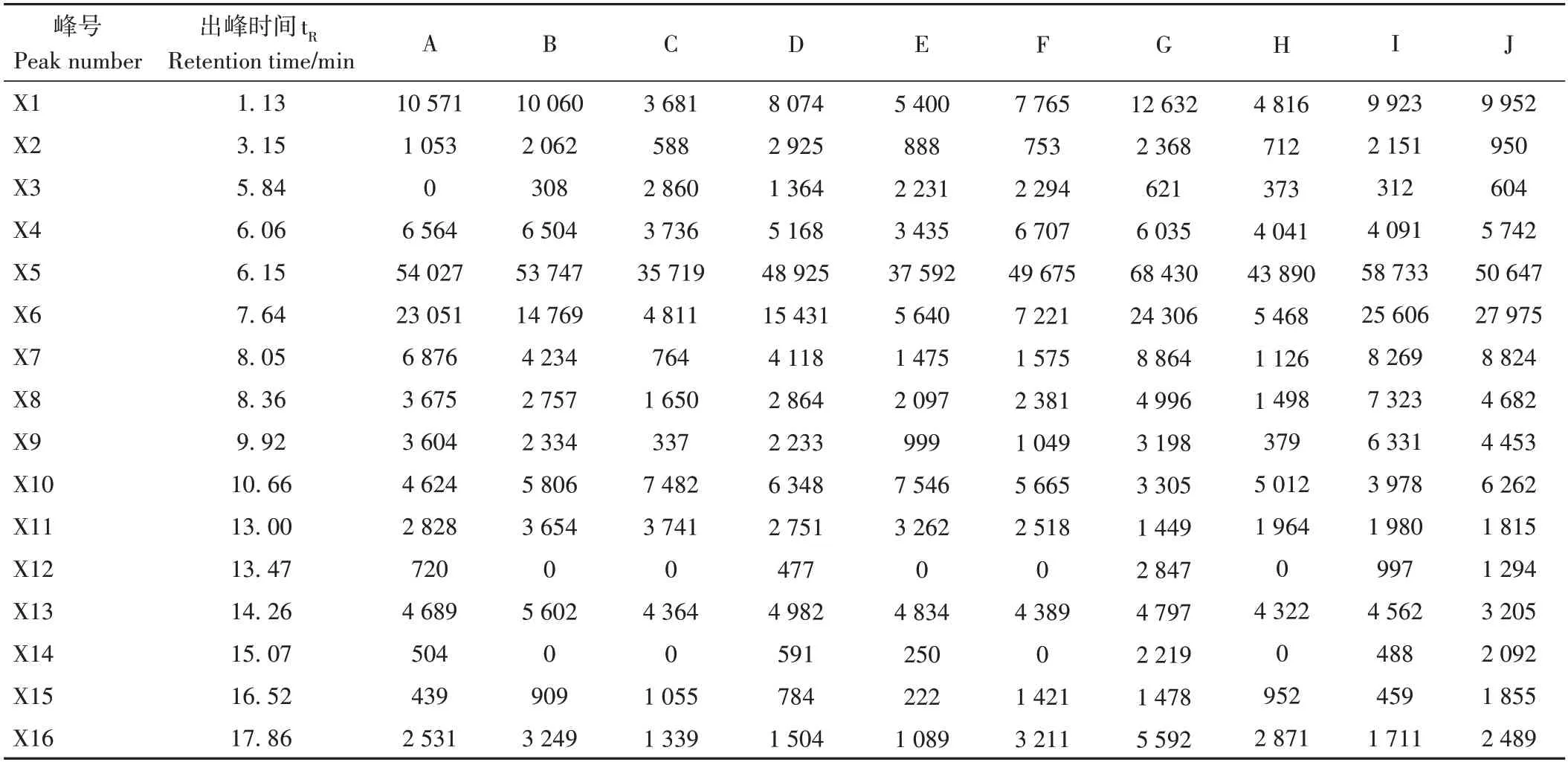
表2 不同品种LE活性组分共有峰峰面积Table 2 The common peak areas of active components from different varieties of LE/(mAU·min)
2.4 谱效关系分析
2.4.1 偏最小二乘回归方程 以图3 中16 个共有色谱峰的峰面积为自变量(X),LE 对α-葡萄糖苷酶的抑制率为因变量(Y),采用PLS模型进行偏最小二乘回归分析,数据选择标准差标准化处理,消除变量量纲差异,得到如下回归方程:Y=0.096X1-0.021X2-0.011X3+0.321X4+0.125X5-0.122X6-0.118X7-0.168X8-0.175X9-0.172X10+0.117X11-0.050X12+0.286X13-0.183X14-0.061X15+0.246X16,PLS模型抑制系数见图4。
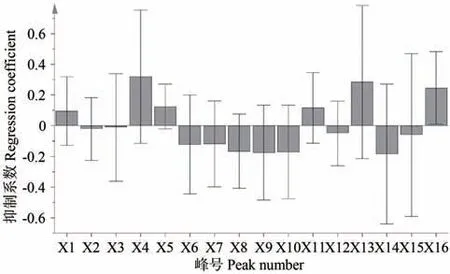
图4 LE抑制α-葡萄糖苷酶谱效关系偏最小二乘回归系数Fig.4 Partial least square regression coefficient of the spectral-effect relationship of LE inhibiting α-glucosidase
2.4.2 变量重要性分析 PLS 回归模型采用回归系数和变量重要性综合评价各特征共有峰对α-葡萄糖苷酶抑制活性的贡献大小,在回归方程中,系数为正值的自变量与抑制率呈正相关,反之则呈负相关。各特征峰的回归系数表明,X1、X4、X5、X11、X13、X16 与酶抑制活性呈正相关,变量重要性投影值(variable importance in project,VIP)显示X4、X13、X16的值较大,变量重要性均大于1.0。在PLS 分析中,VIP 反应自变量X对因变量Y的解释能力大小,VIP值越大,自变量X的解释能力越强[25]。因此,综合评价各特征峰的贡献小大排序为 X4>X13>X16>X11>X5>X1,表明峰 4、13、16、11、5、1 在UPLC-MS 特征图谱上代表的化合物为LE 抑制α-葡萄糖苷酶的主要活性物质。
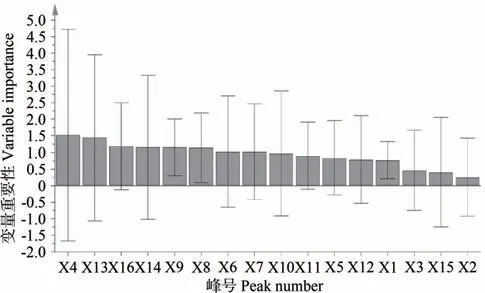
图5 各共有峰对LE抑制酶活性的变量重要性分析Fig.5 Variable importance analysis of common peaks on inhibitory enzyme activity of LE
通过UPLC-MS 获得峰 4、13、16、11、5、1的二级质谱碎片信息并汇总至表3,结合TCMSP、PubChem 数据库和相关文献数据[26-27],对上述6 个化合物进行鉴定分析,其中,峰1、峰13 用标准品进行二级质谱碎片信息比对,确定成分分别为奎宁酸和科罗索酸。
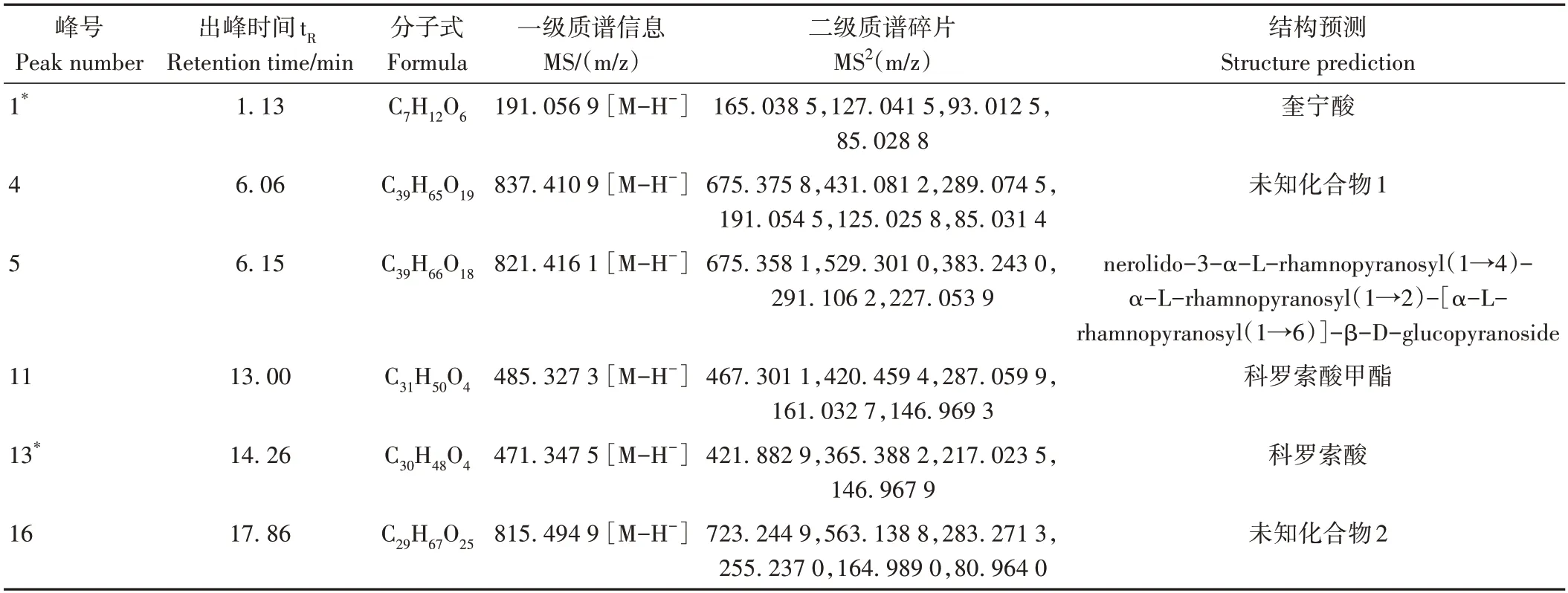
表3 化合物成分鉴定结果Table 3 Identification results of compound components
2.5 分子对接验证
由表4可知,活性成分在氢键和疏水作用力的共同作用下与α-葡萄糖苷酶相互作用,其中科罗索酸、科罗索酸甲酯与α-葡萄糖苷酶结合能小于-8.0 kcal·mol-1,NRRRG、奎宁酸的结合能小于-6.0 kcal·mol-1,奎宁酸的结合能相对最高,说明科罗索酸、科罗索酸甲酯对α-葡萄糖苷酶的抑制效果优于NRRRG和奎宁酸。

表4 枇杷叶关键成分与α-葡萄糖苷酶对接结果Table 4 Docking results of key components of loquat leaf with α-glucosidase
运用LigPlus2.5.5 进行配体与蛋白之间相互作用力分析,结果如图6所示。以科罗索酸为例,能够顺利与α-葡萄糖苷酶蛋白活性口袋结合,通过与活性口袋的 Asp307、Gly309、Thr310、Thr310、Ser304 氨基酸形成分子间氢键来维持配体与蛋白活性口袋的稳定,4 种活性成分中科罗索酸的氢键数量最多,与表4 结果一致。
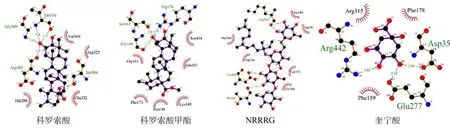
图6 活性成分与α-葡萄糖苷酶的分子对接结果Fig.6 Molecular docking results of active components with α-glucosidase
3 讨论
本研究发现,不同品种产地的LE 对α-葡萄糖苷酶的抑制作用存在较大差异,IC50最大值与最小值相差一倍,究其原因,可能是提取物成分复杂,多种化合物共同竞争α-葡萄糖苷酶的活性中心,由此产生协同作用,使抑制效果增强[28],本研究结果为谱效关系研究提供了良好的数据基础。枇杷树适宜在气候湿润的地区生长,在生长过程中对温度要求较高,年平均温度应在12~15 ℃范围内,冬季气温不低于-5 ℃[29]。通过分析10 批枇杷叶的品种产地发现,人工种植的解放钟(广东省韵关市)和早钟6 号(福建省漳州市)对α-葡萄糖苷酶的IC50值较低,酶抑制效果较好,这两个品种均生长于年平均降水量1 600 mm 以上的东南沿海地区[30],同属亚热带季风气候,夏季受海陆气温差异影响,来自太平洋的气流携带大量水汽不断吹向大陆[31];而大五星(四川省绵阳市)、白沙(浙江省温州市)和白玉(江苏省苏州市)枇杷叶的产地年平均降水量为800 mm,虽处于气候湿润区,但无法保证充沛的水量用于开花结果[32],因此,这三地所产枇杷果实相对前两地体积稍小,叶中活性成分的积累也相对较少。
LE可以有效抑制α-葡萄糖苷酶活性,但主要活性成分未知。采用传统的分离方法鉴定活性单体不仅效率低,且容易丢失活性目标。偏最小二乘回归法是集多功能为一体的多元数据分析方法,是构建中药谱效关系的一个重要工具[33]。肖作兵等[34]通过气相色谱-质谱联用仪(gas chromatograph-mass spectrometer,GCMS)结合偏最小二乘法,以甜橙油为研究对象,成功鉴定出15种风味化合物;孙飞等[35]通过偏最小二乘法分析山楂和焦山楂化学成分与消食健脾功效的相关性,共计识别出11 种功效成分。通过前期的酶抑制试验发现,枇杷叶提取物的IC50值低于阿卡波糖,但尚未明确具体是哪些化合物发挥主要的酶抑制作用,因此,本研究采用偏最小二乘法分析枇杷叶提取物与α-葡萄糖苷酶抑制率之间的谱效关系,对活性成分进行快速定位。通过PLS 分析发现,枇杷叶中各共有成分对α-葡萄糖苷酶抑制率均有影响,在16 个共有活性成分中,6 个活性成分对抑制率影响较大,说明LE 的酶抑制能力是多种活性成分共同作用的结果,符合天然活性成分“多通路、多靶点”的特点。同时,6 个活性成分回归系数较大,说明其对抑制率贡献较高[36]。卞振华等[25]、黄广伟等[37]认为,VIP值是反映自变量对因变量解释能力的重要指标,其值越大说明该自变量对因变量的解释能力越强。因此,本研究认为峰1、4、5、11、13、16 在UPLC-MS 特征图谱上代表的化合物为LE 抑制α-葡萄糖苷酶的主要活性物质。
通过分析化合物二级质谱碎片信息,结合文献数据库进行比对,鉴定得到4 个化合物。由于α-葡萄糖苷酶是临床上用于降血糖的关键靶点[38],因此将筛选得到的活性成分与α-葡萄糖苷酶进行计算机辅助分子对接模拟,通过分子对接模拟,发现科罗索酸的结合能最低,同时氢键数量最多,主要集中在6号碳原子与14号碳原子上的羟基,推测科罗索酸在与α-葡萄糖苷酶结合时,通过疏水作用力与氢键共同起作用,其中氢键在结合过程中起主导地位,与α-葡萄糖苷酶的Asp307、Gly309、Thr310、Thr310、Ser304 号氨基酸残基存在氢键相互作用。此外,4 个活性成分与α-葡萄糖苷酶的结合能均小于-6.0 kcal·mol-1,是十分良好的天然α-葡萄糖苷酶抑制剂[39]。通过与对照品比对,最终确定峰1、峰13分别为奎宁酸和科罗索酸,然而尚有部分化合物未能成功鉴定。由于NRRRG 和科罗索酸甲酯目前在国内无法购买,未能鉴定峰4、峰16具体为何种化合物,将在后续深入研究中,通过色谱分离等相关技术获得较高浓度的富集物,进一步鉴定化合物成分。
4 结论
本试验通过UPLC-MS 特征图谱结合偏最小二乘回归法分析α-葡萄糖苷酶的活性抑制组分与UPLCMS特征图谱共有峰并进行关联研究,揭示了枇杷叶提取物抑制α-葡萄糖苷酶活性物质的基础,确定峰1、峰13为奎宁酸、科罗索酸,分子对接结果表明,α-葡萄糖苷酶与科罗索酸、科罗索酸甲酯、nerolido-3-α-Lrhamnopyranosyl(1→4)-α-L-rhamnopyranosyl(1→2)-[α-L-rhamnopyranosyl(1→6)]-β-D-glucopyranoside、奎宁酸的结合活性较强。本试验结果为阐明枇杷叶提取物降糖机理提供了一定的理论依据。

