Collagen1和Collagen3在牦牛肺纤维化组织中的表达研究
陈 平 何振富 王 斐 谢建鹏 何翃闳
(1甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;2青藏高原动物遗传资源保护与利用重点实验室,四川 成都 610041;3西南民族大学畜牧兽医学院,四川 成都 610041)
牦牛生活在海拔3 000 m以上的高原地区,是高寒牧区特有的牛种资源[1]。牦牛对高寒低氧环境具有较强的适应性,为牧区人民提供了基本的生产生活资料,对牧区经济的发展具有不可替代的作用[2-3]。高原地区空气中的含氧量仅为海平面一半左右,牦牛可在低氧、低气压环境下生存,这与牦牛特殊的遗传适应性结构有很大关系,如肺血管收缩缓慢、肺动脉压低等[4]。肺是动物体呼吸系统重要的组成部分,也是机体供氧的重要器官,而胶原纤维、弹性纤维和平滑肌是肺结构的主要组成部分。胶原蛋白(collagen)是脊椎动物体内最丰富的分泌蛋白,约占总蛋白的1/3,在动物生命过程中不断更新[5],也是细胞外基质(extracellular matrix,ECM)的主要化合物,具有支撑器官和保护机体的作用[6-7],可提供支架并引导细胞迁移、增殖和分化[8]。Ⅰ型胶原蛋白(Collagen1)和Ⅲ型胶原蛋白(Collagen3)是肺内主要的间质型胶原蛋白,Collagen1蛋白直径较粗,伸张能力强,主要起支持作用;Collagen3直径较细,柔韧性强[9]。Kim 等[10]研究发现,以胶原蛋白为主的ECM 在肺纤维化进程中起着重要作用,发生炎症时成纤维细胞被过度激活,导致纤维化增殖并促使Collagen1 的合成[11-12]。Collagen1 和Collagen3 水平发生变化,将导致胶原合成代谢紊乱[13],而ECM 过度沉积或降解都会导致肺纤维化,因此Collagen1 和Collagen3 可以作为反映纤维化的指标[14-15]。肺纤维化组织病理学检查可见肺间质增生和ECM 过度沉积。但在肺纤维化组织中,Collagen1 与Collagen3 的相对表达量尚未研究,尤其是高寒地区特有动物。因此,本试验探究Collagen1与Collagen3在牦牛肺纤维化不同阶段的相对表达量,旨在为牦牛纤维化肺炎提供一定的理论基础。本试验还通过苏木精-伊红(hematoxylin-eosin,HE)染色和Masson 染色及透射电镜观察正常组和试验组组织结构变化;利用实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)和蛋白免疫印迹(western-blotting,WB)比较Collagen1 和Collagen3 在牦牛肺正常组和试验组的表达差异;并运用免疫组织化学和免疫荧光染色研究Collagen1 和Collagen3 在正常组和试验组肺组织中的分布特征,以期阐明Collagen1和Collagen3在牦牛肺发生纤维化进程中发挥的作用,为研究牦牛纤维化肺炎提供一定的理论基础。
1 材料与方法
1.1 试验材料
2021年11月于甘肃省临夏回族自治州,挑选健康和有严重呼吸道疾病的牦牛各6 头,颈动脉放血致死后迅速解剖,取其肺组织,用生理盐水冲洗干净。将样品分为3 份,第一部分做好标记迅速放入液氮,存于-80 ℃冰箱,用于RNA和蛋白的提取;第二部分浸泡于4%多聚甲醛磷酸盐缓冲固定液中固定,用于HE染色和Masson 染色、免疫组织化学以及免疫荧光染色;最后一部分固定于戊二醛中,用于制作透射电镜切片。
1.2 仪器与试剂
812 环氧树脂包埋套装、醋酸双氧铀、柠檬酸铅染液,北京中镜科仪技术有限公司;四氧化锇,德国徕卡公司;TransZol、Evo M-MLV 反转录试剂盒、Go Taq®Green Master Mix 2×,美国Promega 公司;SYBR®Premix Ex Taq™ Eraser™,大连TaKaRa 公司;Collagen1 抗体、Collagen3 抗体、Anti-GAPDH Mouse mAb、Goat antirabbit IgG-HRP antibody,苏州江苏亲科生物研究中心有限公司;显影定影试剂,武汉赛维尔生物科技有限公司;放射免疫沉淀法裂解液(radio immunoprecipitation assay,RIPA)、免疫组化试剂盒,北京索莱宝生物有限公司;ABI ViiA7 实时荧光定量PCR 仪,美国Life Technologies 公司;DP71 显微照相装置,日本Olympus公司;DP71 扫描成像仪,日本EPSON 公司;EM UC7 超薄切片机,德国徕卡;JEM-1400PLUS 透射电镜,日本电子(JEOL)。
1.3 试验方法
1.3.1 HE 和Masson 染色观察 肺组织在4%多聚甲醛磷酸盐缓冲固定液中固定48 h 以上,脱水,石蜡包埋,制作4 µm 石蜡切片。HE 染色观察正常肺和发生纤维化肺组织的结构变化;Masson 染色(铁-苏木精染色5 min,Masson 染液染5 min,阿利新兰染色2 min)观察胶原纤维变化。
1.3.2 透射电镜观察 分别取正常和发生纤维化的肺组织,修剪为1 cm³大小的肺块。经3%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水,脱水剂浓度梯度为30%→50%→70%→80%→90%→95%→100%(100% 浓度中换3 次脱水剂),将脱完水的组织再经过脱水剂与环氧树脂渗透液(脱水剂与环氧树脂渗透液的比例分别为3∶1、1∶1、1∶3),每步30~60 min。将渗透好的样品块放到适当模具中,灌上包埋液包埋经过加温聚合形成固体基质,即包埋块,随后采用超薄切片机制备约50 nm 的超薄切片,进行醋酸铀和枸橼酸铅染色,利用JEM-1400PLUS透射电镜观察。
1.3.3 引物的设计与RNA 的提取和反转录 从GenBank 检索牛(Bos taurus)Collagen1、Collagen3基因和β-actin基因的序列,用Primer Premier 6.0 软件设计特异性引物,由上海生工生物工程有限公司合成,以β-actin作为内参基因,引物序列见表1。将-80 ℃冰箱储存的牦牛肺组织样品按照TransZol 说明书提取总RNA,再按照反转录试剂盒将RNA 反转录为cDNA,存于-20 ℃条件下备用。
1.3.4Collagen1和Collagen3基因的扩增 以牦牛对照组和试验组肺的cDNA为模板,对Collagen1、Collagen3和β-actin基因进行普通PCR 扩增。PCR 总反应体系为20 µL:cDNA 1 µL,上下游引物各0.5 µL,无菌去离子水8 µL,Taq PCR Master Mix 10 µL。反应条件:95 ℃预变性4 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸15 s;72 ℃终延伸5 min,40 个循环。将扩增后的PCR产物用2%的琼脂凝胶进行核酸电泳。
1.3.5 qRT-PCR 检测Collagen1和Collagen3基因在牦牛对照组和试验组肺组织中的表达 使用实时荧光定量PCR 仪以β-actin为内参基因检测Collagen1和Collagen3基因在牦牛对照组和试验组肺组织中的表达水平。反应体系为20 µL:cDNA 1 µL,上下游引物各0.8 µL,无菌去离子水7.4 µL,SYBR®Premix Ex Taq™ Eraser™ 10 µL。反应条件:95 ℃预变性30 s;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸5 min,40个循环。每个样品重复4 次。分析其熔解曲线,用SPSS 21.0 软件对qRT-PCR 数据进行统计学分析,采用2-ΔΔCt法计算目的基因相对表达量。
1.3.6 制备牦牛肺组织蛋白样品 将存于-80 ℃冰箱的肺组织样品迅速转移到用锡箔纸包被的研钵中,加入液氮用研杵充分研磨至粉末状,各称取0.1 g 至1.5 mL 离心管中,并加入RIPA 裂解液,冰浴摇床裂解1.5 h,吸取上清液,一部分存于-80 ℃备用,另一部分提取好的蛋白加入4×蛋白上样缓冲液进行蛋白变性,用于WB检测,保存于-20 ℃备用。
1.3.7 WB 检测Collagen1 和Collagen3 蛋白的相对表达量 将变性好的组织样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,电泳结束后切胶,采用湿转法将蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用脱脂牛奶封闭,然后于4 ℃条件下孵育一抗过夜,室温孵育二抗2 h,PVDF膜上滴加化学发光液,采用扫描成像仪扫描条带。用Image J 6.0测量灰度值,根据灰度值分析蛋白的表达量。
1.3.8 免疫组织化学对Collagen1和Collagen3蛋白定位 4%多聚甲醛磷酸盐缓冲固定液充分浸泡固定组织,石蜡包埋后切片(4 µm),乙醇脱水,0.01 mol·L-1柠檬酸盐缓冲液进行抗原修复。按照免疫组化试剂盒进行染色,滴加3% H2O2溶液,阻断内源性过氧化物酶活性;滴加试剂盒A 液,湿盒内室温孵育15 min,进行一抗反应,4 ℃过夜;滴加试剂盒B 液,湿盒内37 ℃温箱孵育15 min;再滴加试剂盒C液,湿盒内37 ℃温箱孵育15 min;滴加3,3-二氨基苯联胺(diaminobenzidine,DAB)显色液显色,苏木精复染,脱水,透明,封片,显微摄影观察。
1.3.9 免疫荧光染色 石蜡切片脱蜡至水,置于乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA)抗原修复液(pH 值8.0)中,并于微波炉内进行抗原修复。磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后滴加牛血清白蛋白(bovine albumin,BSA)封闭液封闭30 min,之后滴加一抗置于湿盒内4 ℃孵育过夜,阴性对照用PBS 代替一抗;PBS 清洗后,置于避光室温条件下孵育荧光二抗50 min;滴加4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染液,避光室温孵育10 min;加入自发荧光淬灭剂作用5 min,之后流水冲洗10 min;切片风干后用抗荧光淬灭封片剂封片,荧光显微镜拍照观察。
1.4 数据分析
试验数据采用SPSS 21.0 软件进行单因素方差分析,每组重复3次,结果以“平均值±标准误”表示。
2 结果与分析
2.1 HE和Masson染色结果
由HE 染色结果可见,对照组(图1-a)肺组织结构完整,肺泡壁完整,结构清晰,肺泡隔无增厚,支气管管腔和肺泡腔内无炎性渗出物,肺泡无炎性改变;试验组(图1-b)肺组织可见几处片状坏死,胞核碎裂溶解,并可见重度出血,大范围肺水肿,肺泡腔内充满嗜酸性蛋白样物质,大范围肺泡壁中度至重度增厚,伴有炎性细胞浸润,部分肺泡萎缩,部分肺泡代偿性增大,肺泡大小不一。Masson 染色时胶原纤维呈蓝色,肌纤维呈红色,相比对照组(图1-c),试验组(图1-d)肺组织胶原纤维与肌纤维大量增生。
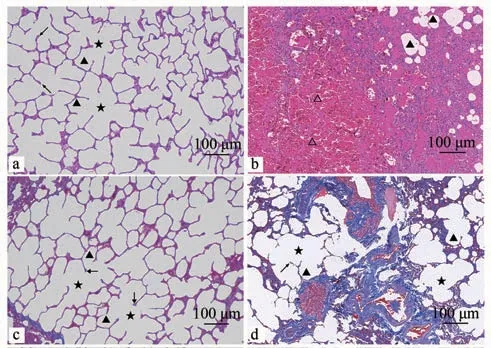
图1 肺组织HE和Masson染色结果Fig.1 HE and Masson staining results of lung tissue
2.2 透射电镜观察
透射电镜观察结果如图2显示。对照组(图2-a、b)肺组织形态结构较正常,血管开放性良好,I 型肺泡上皮细胞结构完整清晰,仅见Ⅱ型肺泡上皮细胞内部分粗面内质网扩张。试验组(图2-c、d)肺组织形态结构有明显异常,电镜下可见部分肺泡上皮细胞已裂解,细胞碎片散入肺泡腔内;少数血管内还可见中性粒细胞(炎症反应);Ⅰ型肺泡上皮细胞内线粒体已发生轻度肿胀,还可见少量空泡;Ⅱ型肺泡上皮细胞内多数粗面内质网已扩张呈至囊状。
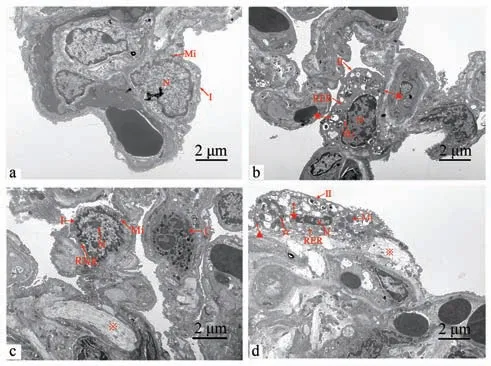
图2 肺组织透射电镜观察图Fig.2 Electron microscopic observation of lungs tissue
2.3 Collagen1和Collagen3基因的扩增
由图3 可知,Collagen1、Collagen3和β-actin分别在131、258 和174 bp 处有单一明亮条带,验证了反转录后的引物和cDNA良好,可以用于后续试验。
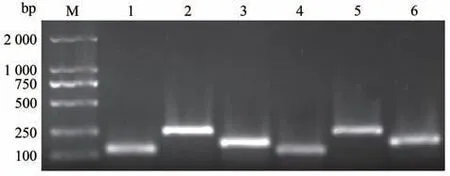
图3 Collagen1、Collagen3和β-actin基因PCR产物的电泳分析结果Fig.3 PCR products of electrophoretic analysis result of Collagen1,Collagen3 and β-actin gene
2.4 qRT-PCR检测结果
由图4 可知,Collagen1基因在牦牛肺试验组中的表达量显著高于对照组(P<0.05),Collagen3基因在牦牛肺对照组中的表达量极显著高于试验组(P<0.01);对照组Collagen3相对表达量极显著高于Collagen1(P<0.01),试验组Collagen3相对表达量显著高于Collagen1(P<0.05)。
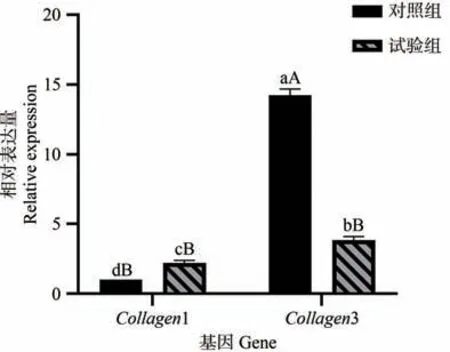
图4 qRT-PCR检测结果Fig.4 qRT-PCR results
2.5 Western-blotting检测结果
WB 结果如图5所示。Collagen1 和Collagen3 蛋白在肺对照组和试验组中均有表达且差异显著,其中Collagen1 蛋白在肺试验组中的表达量显著高于对照组(P<0.05),而Collagen3 蛋白则在肺对照组中的表达量显著高于试验组(P<0.05);且试验组、对照组中Collagen3 蛋白的表达量均显著高于Collagen1 蛋白(P<0.05)。
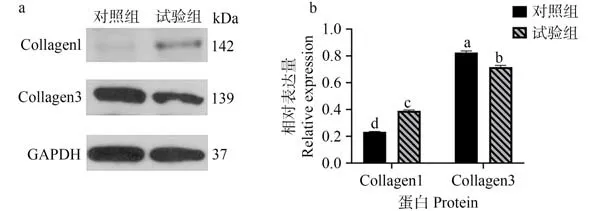
图5 Collagen1和Collagen3蛋白的检测结果及相对表达量Fig.5 The detection results and relative expression of Collagen1 and Collagen3 proteins
2.6 免疫组化检测Collagen1 和Collagen3 蛋白的分布
由图6 可知,Collagen1 和Collagen3 蛋白在对照组和试验组中均有分布,棕褐色表示Collagen1 和Collagen3 蛋白的阳性表达产物。Collagen1 蛋白同Collagen3 蛋白主要分布于细支气管黏膜上皮的克拉拉细胞、纤毛细胞和外膜平滑肌细胞、肺泡隔以及伴随动脉和平滑肌细胞中。
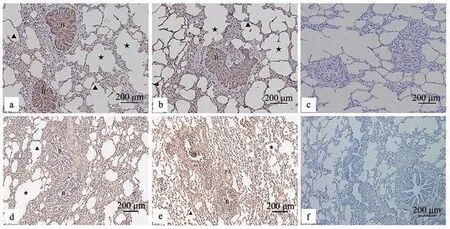
图6 Collagen1和Collagen3蛋白在牦牛肺组织中的分布Fig.6 Distribution of Collagen1 and Collagen3 protein in lung tissue of yak
2.7 免疫荧光染色检测结果
免疫荧光染色结果显示,在牦牛肺对照组(图7-a、b),Collagen1 蛋白主要分布于细支气管和终末细支气管的克拉拉细胞、纤毛细胞、外膜平滑肌和伴随动脉内皮细胞、平滑肌以及少量肺泡隔中;Collagen3蛋白在肺泡隔中只有极少量分布,其余分布位置同Collagen1。在试验组(图7-c、d)中,Collagen1 和Collagen3 蛋白大量增生,在肺泡隔中有大量分布,其余分布位置同对照组,但表达均强于对照组。
3 讨论
3.1 肺纤维化病理学检查与发生机制
急性肺损伤早期,肺成纤维细胞过度活化,出现纤维化增殖,产生胶原蛋白,从而启动肺纤维化过程[16-17]。本研究病理组织学检查显示,病变肺组织结构异常紊乱,肺泡间隔增宽,大范围肺泡壁中度至重度增厚,伴有炎性细胞浸润,肺泡大小不一,大量胶原及基质增生,呈典型纤维化。肺纤维化主要是肺间质、肺泡、肺小血管或末梢气道发生不同程度的炎症,导致肺泡结构破坏,形成肺泡腔内完全型纤维化,在炎症损伤和修复过程中形成肺纤维化[18-19],肺纤维化机制涉及大量的细胞因子和生长因子,胶原蛋白降解需要基质金属蛋白酶来完成,其活性受金属蛋白酶组织抑制物抑制。转化生长因子-β1(transforming growth factor-β1,TGF-β1)能够诱导肺成纤维细胞生成活性氧(reactive oxygen species,ROS),并促进ERK1/2通路的激活,导致Collagen1、Collagen3mRNA 相对水平和合成增加[20-21]。血管紧张素Ⅱ(AngⅡ)可能通过上调Hippo信号通路中Yap1 的表达和TGF-β1/Smad 信号通路中Smad2/3 的表达,促进Collagen1 合成,诱导大鼠肺纤维化[15]。本研究牦牛病变组织结构异常,推测该牦牛发生了急性肺损伤,产生了大量生长因子,从而促进了ERK1/2通路的激活,导致胶原蛋白合成增加。
3.2 中草药改善肺纤维化部分机制
前人研究发现,部分中草药可显著抑制肺纤维化进程,滇龙胆草通过抑制MAPK 信号通路可改善小鼠肺纤维化的影响,Collagen1 蛋白水平显著下调[22];由缺氧导致肺间质肌成纤维细胞化进程相关的Collagen1、Collagen3 指标明显上调,黄芩苷干预后Collagen1、Collagen3 指标明显下调,可有效抑制肺纤维化[23]。姜黄素通过调节博莱霉素诱导大鼠肺组织胶原蛋白周转、组装和沉积来防止纤维化沉积[24]。本试验中,在病变肺组织中,Collagen3 的表达量高于Collagen1,推测可能处于肺纤维化早期,因此,可通过检测Collagen1 和Collagen3 的含量来反映牦牛肺纤维化的病程或病变活动情况。后续在研究富含多酚类物质的中草药改善肺纤维化时,可通过中草药经信号通路调节Collagen1、Collagen3水平作为判断依据。
3.3 Collagen1和Collagen3在纤维化肺中的表达
Collagen1 和Collagen3 在不同动物肺脏表达形式不同。马跃文等[25]研究发现,鼠的肺支气管周围以及肺泡间隔中可见Collagen1 和Collagen3,且Collagen1的含量比Collagen3 高。本研究免疫组化结果发现,Collagen1 和Collagen3 也在牦牛肺细支气管和肺泡间隔中有分布,与前人发现的分布部位一致,但qRTPCR 和WB 结果表明,牦牛正常肺组织中Collagen1 的含量比Collagen3 低,与前人结果相反,推测是由于牦牛具有肺低氧适应性结构,高海拔地区牦牛肺泡隔的厚度大于低海拔地区,而肺泡隔中含有大量的Collagen3[26],因此推测本研究正常肺Collagen1 的表达量低于Collagen3,可能是高海拔地区牦牛肺泡隔Collagen3 高表达所致。Taniwaki 等[27]发现,一些组织器官如肺、肾、肝等在开始发生纤维化时,其上皮合成Collagen4 的能力转变为合成Collagen1 和Collagen3。当组织器官纤维化转变为慢性后,则以Collagen1 沉积为主,Collagen1 和Collagen3 比例失调,胶原代谢紊乱,导致胶原在肺间质中沉积,肺组织基质结构紊乱,从而发生纤维化[28]。张燕萍等[29]研究阐述了Collagen1 和Collagen3 的升高或降低影响肺纤维化程度,Collagen1的过度沉积在肺间质纤维化进程中发挥了至关重要的作用,Collagen3 主要分布在肺间质,在肺纤维化组织中变化最明显。Abraham 等[30]研究发现,肺纤维化时成纤维细胞释放以Collagen1 和Collagen3 为主的胶原蛋白。本试验免疫组化和免疫荧光结果发现,Collagen1 和Collagen3 在试验组大量增生,除在肺泡隔中有大量分布外,在对照组和试验组中的分布位置基本一致,均分布在细支气管黏膜上皮组织和平滑肌组织,伴随动脉内皮和平滑肌等肺间质中,且在试验组中呈强阳性分布。由此推测本研究中试验组牦牛患有巴氏杆菌病或纤维素性肺炎所致的急性肺损伤,导致其肺组织结构紊乱,胶原蛋白大量分布。
4 结论
Collagen1 和Collagen3 在牦牛对照组和试验组肺组织中均有表达且存在表达差异,Collagen1 在牦牛试验组中的表达量显著高于对照组,Collagen3 在牦牛对照组中的表达量显著高于试验组。Collagen1 和Collagen3 主要分布在对照组和试验组肺组织的细支气管黏膜上皮组织、平滑肌组织以及肺泡隔,伴随动脉内皮和平滑肌等肺间质中。综上,Collagen1 和Collagen3 在牦牛发生肺纤维化的过程中发挥着重要作用。

