双酚S通过诱导神经胶质瘤细胞干性维持增强替莫唑胺抵抗的机制探讨
张良龙,赵 舰,兰伟途
0 引言
神经胶质瘤作为颅内常见的恶性肿瘤,严重影响着患者的身心健康[1]。目前,神经胶质瘤的治疗相对局限,仍然以外科手术、化学治疗及放射治疗为主[2]。由于神经胶质瘤位于颅内,其药物治疗需要通过血脑屏障才能发挥作用。替莫唑胺(Temozolomide,TMZ)作为第2代烷化剂,极易通过血脑屏障,具有确切的疗效,是目前神经胶质瘤的重要一线化疗药物[3-4]。然而,药物治疗后出现的药物抵抗可能导致治疗失败。
双酚S(Bisphenol s,BPS)是目前世界上广泛使用的工业产品(包括洗涤剂、酚醛树脂、电镀溶剂和热敏纸等)[5]。有报道,男性摄入的BPS约为9.55 ng/(kg·d),女性为9.56 ng/(kg·d)[6]。流行病学研究显示,在人类的尿液和血液中可以广泛检测到BPS[7]。越来越多的证据表明,BPS在恶性肿瘤进展中发挥促癌作用[8-9]。肿瘤干细胞是肿瘤细胞中具有自我更新和无限增殖的细胞群体,其对药物治疗不敏感,具有药物抵抗能力[10]。目前,BPS与神经胶质瘤细胞干性以及化疗抵抗的关系尚不明确,本研究主要探究BPS在神经胶质瘤细胞干性维持中的作用及其与TMZ抵抗的关系。
1 材料
1.1 细胞 人神经胶质瘤U251细胞购自中国科学院上海细胞库。
1.2 试剂 BPS(货号43034)和TMZ(货号34219)购自美国Sigma公司;StemXVivo无血清肿瘤球培养基购自美国RD公司;超低吸附6孔板购自美国康宁公司;胎牛血清和MEM培养基购自美国Gibco公司;放射免疫沉淀法(RIPA)裂解液、噻唑蓝(MTT)、青-链霉素和蛋白定量试剂盒购自北京索莱宝公司;磷酸盐缓冲液(PBS)购自上海爱必信公司;CD133抗体、CD44抗体及β-actin抗体购自武汉云克隆公司;抗小鼠IgG-HRP二抗(货号BS12478)购自南京巴傲得公司;聚偏二氟乙烯膜 (PVDF) 购自美国Millipore公司。
1.3 实验仪器 SpectraMax 190酶标仪(美国美谷分子公司产品);电泳相关仪器(美国Bio-rad公司产品);E-Gel Imager凝胶成像系统(美国赛默飞公司产品);MF53-N倒置荧光显微镜(广州明美光电公司产品)。
2 方法
2.1 细胞培养 人神经胶质瘤U251细胞以MEM培养基、胎牛血清及青-链霉素按0.89∶0.1∶0.01配制的全培养基培养。
2.2 细胞成球实验检测细胞成球能力 在预热的StemXVivo无血清肿瘤球体培养基中加入2 U/ml肝素和0.5 μg/ml氢化可的松。将U251细胞接种于超低吸附6孔板中,加入配制好的培养基进行3D培养。以0.1、1、10 μM BPS处理细胞,同时设置对照(Control)组。细胞置于培养箱内培养7 d。拍摄细胞球照片,计数细胞球数量及测量对应细胞球直径。
2.3 平板克隆检测细胞克隆形成能力 收集U251细胞并重悬,按每孔300个接种于六孔板中。以0.1、1、10 μM BPS处理细胞,同时设置对照(Control)组。细胞置于培养箱内培养14 d。弃去旧培养基,分别以4%多聚甲醛和0.1%结晶紫对细胞进行固定和染色,拍摄对应孔板照片。
2.4 蛋白印记检测细胞CD44和CD133蛋白表达 收集细胞并以RIPA裂解液提取总蛋白,12 000转/min离心20 min,上层清液即为总蛋白。收集上层清液并以蛋白定量试剂盒检测总蛋白浓度。总蛋白制备成电泳样品后,以SDS-PAGE凝胶电泳进行分离并转印至PVDF膜。以5%脱脂牛奶封闭PVDF膜,随后PVDF膜在4 ℃孵育CD44(1∶2 000)、CD133(1∶2 000)及β-actin(1∶2 000)过夜。洗去一抗,孵育抗小鼠IgG-HRP二抗1 h。洗去二抗后,用凝胶成像仪对PVDF膜进行成像。
2.5 免疫荧光实验检测P-gp蛋白表达 将培养的细胞球用移液枪轻轻转移至6 cm培养皿中。置于培养箱10 min后,以4%多聚甲醛固定,以山羊血清封闭30 min,轻轻吸去封闭液。滴加CD44抗体(1∶100)和CD133抗体(1∶100)4 ℃孵育过夜。次日洗去一抗,滴加对应荧光二抗(1∶100)孵育1 h,。轻轻洗去二抗,加入DAPI孵育5 min,然后加入抗荧光猝灭封片液于荧光显微镜下显色拍照。
2.6 MTT法检测细胞增殖能力 收集U251细胞并重悬,按每孔5 000个接种于96孔板中。以0.1、1、10 μM BPS处理细胞,并同时向细胞中加入75、150、300、600、1 200、2 400 μM TMZ,每组4个复孔。24 h后每孔加入10 μl MTT(5 mg/ml)孵育4 h。弃去培养基,每孔加入150 μl二甲基亚砜,于酶标仪490 nm处测量吸光度值。

3 结果
3.1 BPS增强神经胶质瘤细胞成球能力 3D培养发现,与Control组相比,BPS(0.1、1、10 μM)处理后,U251细胞干细胞球直径明显增加(P<0.05),同时干细胞球数量也显著增加,且存在剂量依赖性(P<0.05),见图1A-1C。
3.2 BPS增强神经胶质瘤细胞克隆形成能力 平板克隆实验发现,Control组、BPS(0.1 μM)组、BPS(1 μM)组、BPS(10 μM)组克隆形成率分别为100%、(108.6%±8.7%)、(127.6%±10.5%)、(155.1%±16.2%)。相较于Control组,BPS各剂量组克隆形成率明显增加(P<0.01),且呈剂量依赖性,见图2。
3.3 BPS增强神经胶质瘤细胞球干细胞标志物表达 蛋白印迹结果显示,与Control组相比,BPS(10 μM)组细胞CD44和CD133蛋白表达明显上调(P<0.01),见图3。免疫荧光实验显示,Control组和BPS(10 μM)组CD44蛋白荧光强度为1 324.6±126.4和5 317.8±555.1,CD133蛋白荧光强度为1 152.6±103.7和6 572.7±737.9。与Control组相比,BPS(10 μM)组细胞CD44和CD133蛋白荧光强度均明显升高(P<0.01),见图4。
3.4 BPS增强神经胶质瘤细胞抵抗TMZ MTT结果显示,与Control组相比,BPS(10 μM)处理能够显著抵抗TMZ诱导的细胞活力降低(P<0.05),见图5。
4 讨论
目前,BPS已被证实在多种恶性肿瘤中发挥促癌作用。研究显示,BPS通过雌激素相关受体α诱发嗜铬细胞瘤PC12细胞的迁移和侵袭[8]。还有研究报道,长期暴露于BPS会降低尿路上皮细胞的能量代谢和特性,而对膀胱癌细胞发挥相反作用[9]。同时BPS能诱导侵袭性膀胱癌细胞迁移能力增强[9]。在关于乳腺癌的研究中,BPS也被证实可促进细胞迁移活动,而该作用与GPER/Hippo-YAP信号通路有关[11]。本研究发现,BPS可促进神经胶质瘤U251细胞成球能力增强,同时BPS还可增强U251细胞克隆形成能力。肿瘤细胞成球能力增强是其干性升高的重要特征,并且肿瘤细胞干性增强往往伴随克隆形成能力提高[12-13],提示BPS可诱导U251细胞干性增强。

图1 BPS处理对神经胶质瘤U251细胞成球能力的影响

图2 BPS处理对神经胶质瘤U251细胞克隆形成能力的影响
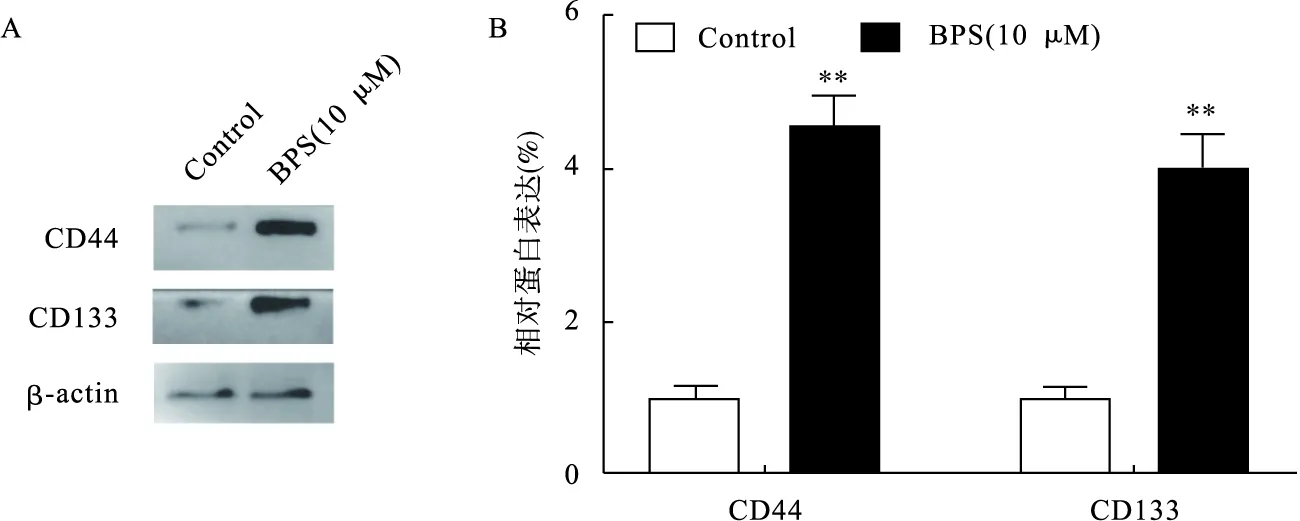
图3 BPS对U251干细胞球CD44和CD133蛋白表达的影响
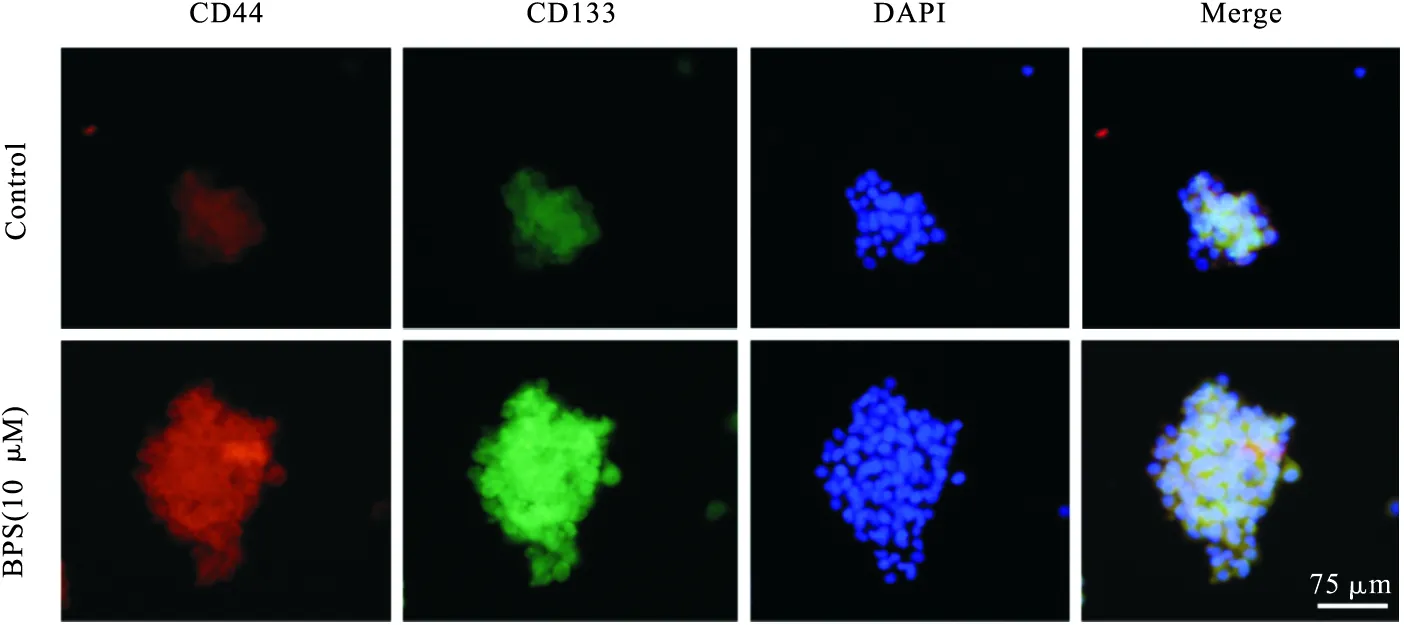
图4 免疫荧光验证BPS对U251干细胞球CD44和CD133蛋白表达的影响(100×)

图5 BPS对神经胶质瘤细胞抵抗TMZ的影响
CD44作为跨膜糖蛋白能够介导细胞间及细胞与细胞外基质相互作用[14]。在胶质瘤细胞中,CD44表达上调已被证实与细胞干性增强密切相关[14]。CD133是在造血干细胞表面发现的糖蛋白,是胶质瘤干细胞的功能性标志物[15]。为了进一步验证BPS对胶质瘤U251细胞干性的影响,我们对CD44和CD133蛋白表达进行了考察。结果显示,BPS处理上调了CD44和CD133蛋白的表达,提示BPS能够促进胶质瘤细胞干性增强。
药物抵抗是恶性肿瘤治疗失败的原因之一。越来越多的证据显示,包括神经胶质瘤在内的恶性肿瘤药物抵抗与细胞的干性有关。研究显示,长链非编码RNA PVT1通过miR-365/ELF4/SOX2轴促进胶质瘤的干性,并诱导TMZ抵抗[16]。还有研究显示,RIP2通过NF-κB通路增强神经胶质瘤细胞干性诱导TMZ耐药[17]。在本研究中,BPS处理后U251细胞出现明显的TMZ抵抗现象。提示,BPS可能通过诱导U251细胞干性增强从而抵抗TMZ。
本研究揭示了BPS诱导神经胶质瘤TMZ抵抗的潜在机制,为神经胶质瘤临床治疗以及日常防护提供了基础理论支持。但BPS诱导神经胶质瘤干性增强的机制尚不明确,有待于进一步研究。

