卡瑞利珠单抗联合化疗治疗老年非小细胞肺癌的疗效及其对肿瘤标志物的影响
韦海燕,温林春
PC方案是临床治疗非小细胞肺癌(NSCLC)的首选化疗方案[1],其中培美曲塞可通过叶酸的正常代谢过程抑制肿瘤细胞复制,而金属铂类络合物顺铂可通过与肿瘤细胞DNA链交叉连接,以此达到抗肿瘤的效果,上述方案虽然可使患者获得最长1年的中位生存期,但因老年患者机体生理功能下降,对肿瘤细胞的抵抗性差,故其1年生存率较低[2-3]。近年来,免疫治疗在肿瘤治疗中已成为临床研究热点[4],卡瑞利珠单抗是采用重组技术在仓鼠卵巢细胞系中表达的一种人源化单克隆抗体,其通过与程序性死亡受体1(PD-1)受体结合,阻断PD-1/程序性死亡受体配体(PD-L)1的结合,激活T细胞,产生持续抗肿瘤效应,抑制肿瘤生长,推测将其用于治疗NSCLC可能会更有效。现观察卡瑞利珠单抗联合化疗治疗老年NSCLC患者的疗效及其对肿瘤标志物的影响,报道如下。
1 资料与方法
1.1 临床资料 回顾性选取2019年9月—2021年8月徐州医科大学附属宿迁医院收治的51例老年NSCLC患者作为研究对象,根据治疗方法分为化疗组(n=25)和联合组(n=26)。化疗组中男17例,女8例;年龄60~75(63.36±6.05)岁;病理分型:腺癌12例,鳞癌7例,腺鳞癌4例,其他2例。联合组中男16例,女10例;年龄60~75(63.27±6.18)岁;病理分型:腺癌15例,鳞癌6例,腺鳞癌3例,其他2例。2组患者临床资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准。
1.2 病例选择标准 纳入标准:(1)符合NSCLC的诊断标准[5];(2)预计生存时间>3个月;(3)KPS评分>70分;(4)TNM分期为Ⅲb~Ⅳa期。排除标准:(1)对本研究所用药物过敏者;(2)合并严重精神异常或意识障碍者;(3)合并其他系统严重病变者;(4)对化疗药物不耐受者。
1.3 治疗方法 化疗组予以PC方案化疗:于化疗第1天予以注射用培美曲塞二钠(江苏豪森药业集团有限公司生产)500 mg/m2静脉滴注;顺铂注射液(江苏豪森药业集团有限公司生产)80 mg/m2静脉滴注。联合组在化疗组基础上予以注射用卡瑞利珠单抗(苏州盛迪亚生物医药有限公司生产)200 mg/次,静脉滴注。2组均以21 d为1个化疗周期,持续治疗3个周期。
1.4 观察指标与方法 (1)血管内皮因子水平:治疗前及治疗3个周期后,于晨起抽取患者空腹静脉血3 ml,经处理后采用酶联免疫吸附法(ELISA)测定碱性成纤维细胞生长因子(bFGF)、血管生成素2(Ang-2)、血管内皮生长因子(VEGF)及基质金属蛋白酶-9(MMP-9)水平。(2)肿瘤标志物:治疗前及治疗3个周期后,于晨起抽取患者空腹静脉血3 ml,采用ELISA测定血清糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、细胞角蛋白19片段抗原21-1(CY211)、癌胚抗原(CEA)水平。(3)不良反应发生率:化疗期间统计患者白细胞减少、恶心呕吐、蛋白尿、甲状腺功能减退(以下简称为甲减)、贫血乏力以及反应性毛细血管增生症发生率。
1.5 近期疗效判定标准[6]治疗3个周期后,患者临床症状、靶病灶完全消失且持续时间>4周为完全缓解(CR);患者靶病灶最大直径之和较治疗前缩小≥30%,且持续时间>4周为部分缓解(PR);患者靶病灶最大直径之和较治疗前缩小<30%为疾病稳定(SD);患者靶病灶最大径之和较治疗前增大>20%,且有新发病灶为疾病进展(PD)。疾病控制率=(CR+PR+SD)/总例数×100%。

2 结 果
2.1 近期疗效比较 治疗3个周期后,联合组疾病控制率为76.92%,高于化疗组的48.00%(χ2=4.561,P=0.033),见表1。
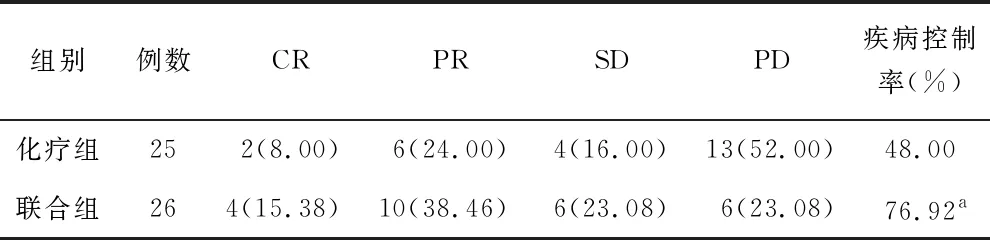
表1 化疗组与联合组近期疗效比较 [例(%)]
2.2 血管内皮因子水平比较 治疗前,2组bFGF、Ang-2、VEGF、MMP-9水平比较,差异无统计学意义(P>0.05);治疗3个周期后,2组bFGF、Ang-2、VEGF、MMP-9水平均低于治疗前,且联合组低于化疗组(P<0.05或P<0.01),见表2。

表2 化疗组与联合组治疗前后血管内皮因子水平比较
2.3 肿瘤标志物比较 治疗前,2组CA125、CA19-9、CY211、CEA水平比较,差异无统计学意义(P>0.05);治疗3个周期后,2组CA125、CA19-9、CY211、CEA水平均低于治疗前,且联合组低于化疗组(P<0.05或P<0.01),见表3。

表3 化疗组与联合组治疗前后肿瘤标志物水平比较
2.4 不良反应发生率比较 2组化疗期间白细胞减少、恶心呕吐、蛋白尿、甲减、贫血乏力的发生率比较,差异无统计学意义(P>0.05);联合组反应性毛细血管增生症及免疫相关性疾病的发生率高于化疗组(P<0.01),见表4。
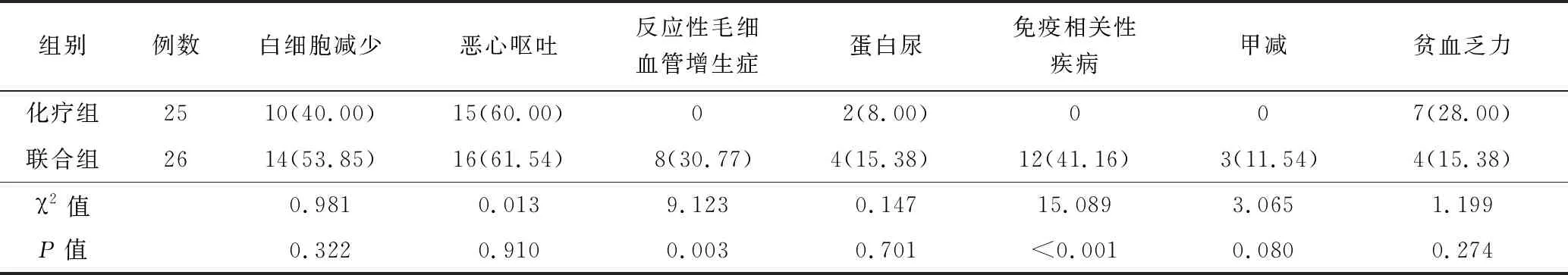
表4 化疗组与联合组不良反应发生率比较 [例(%)]
3 讨 论
NSCLC是临床常见的一类肺部恶性肿瘤,由于该疾病早期症状无特异性,因此临床发现时多数患者疾病已处于晚期,此时已错过最佳手术治疗时机,致使化疗成为临床治疗该疾病的常规治疗方式,其中PC方案为首选化疗方案[7-8]。但随着研究的深入,发现以铂类药物为主的化疗方案虽可抑制肿瘤细胞生成,但是难以延长患者的5年生存率[9]。近年有研究发现,肿瘤免疫逃逸在恶性肿瘤的发生发展过程中具有重要作用[10],卡瑞利珠单抗可通过结合免疫细胞,解除T细胞的免疫抑制作用,重建机体免疫系统,将其用于恶性肿瘤患者的治疗可能会弥补常规化疗方案的不足。
CA125、CEA、CY211以及CA19-9是临床诊断NSCLC的常用肿瘤标志物,当上述指标呈过度表达时,则表明机体出现癌性病变[11]。本研究结果显示,联合组疾病控制率(76.92%)高于化疗组(48.00%),治疗后CA125、CA19-9、CY211、CEA水平均低于化疗组,表明卡瑞利珠单抗联合化疗治疗老年NSCLC患者可通过降低肿瘤标志物水平而提高临床疗效,分析原因可能为:PC方案中的培美曲赛可通过破坏细胞内叶酸的正常代谢,抑制肿瘤细胞的复制,进而减缓肿瘤病灶的生长;顺铂可通过与机体内相应碱基结合而破坏肿瘤细胞DNA的复制,进而抑制肿瘤细胞的增殖以及分化,以达到降低肿瘤标志物水平、杀灭肿瘤细胞的目的[12];此外,卡瑞利珠单抗可通过与细胞表面的PD-1靶向结合,阻断肿瘤和巨噬细胞表面的PD-L1和PD-L2的相互作用,帮助机体重建免疫功能[13],提高杀灭肿瘤细胞的能力,从而发挥其抗肿瘤作用。另外,2组化疗期间白细胞减少、恶心呕吐、蛋白尿、甲减、贫血乏力的发生率比较无统计学差异,但联合组反应性毛细血管增生症及免疫相关性疾病的发生率高于化疗组,表明卡瑞利珠单抗联合化疗治疗可增加患者罹患免疫相关不良反应以及反应性毛细血管增生症的发生风险。免疫相关不良反应以及反应性毛细血管增生症是卡瑞利珠单抗特有的不良反应,但其具有可逆性,当停止用药后上述不良反应均可消退,或使用类固醇药物也可促使其消退,且上述不良反应属于1~2级,患者在化疗期间均可耐受[14]。
新生血管可为恶性肿瘤细胞的生长及增殖提供丰富的营养物质及氧气,而血管内皮细胞的分化及增殖是促进肿瘤细胞生成的重要因素。MMP-9、Ang-2、bFGF以及VEGF均可参与新生血管的生成[15]。本研究结果显示,联合组治疗后bFGF、Ang-2、VEGF、MMP-9水平均低于化疗组,表明卡瑞利珠单抗联合化疗可有效地抑制新生肿瘤血管的形成,分析原因可能为该药物可促进肿瘤血管正常化,减少其对肿瘤细胞增殖以及生长所提供的营养物质,进而降低氧细胞比例[16],抑制病灶周围毛细血管的生长,从而降低上述指标水平。
综上所述,与单一化疗相比,卡瑞利珠单抗联合化疗治疗老年NSCLC患者虽会增加免疫相关不良反应以及反应性毛细血管增生症的发生率,但后者可更好地改善患者血管内皮功能,降低肿瘤标志物水平,提高临床疗效。
利益冲突:所有作者声明无利益冲突。

