二甲戊灵对高粱种植土壤酶活性和微生物的影响
宋崴 ,王芳 ,闫舟 ,赵建国 ,丁保朋 ,淮泽勋 ,王翔 *
(1.山西省生物研究院有限公司,山西 太原 030006;2.煤基生态碳汇技术教育部工程研究中心,山西 大同 037009;3.石墨烯林业应用国家林草局重点实验室, 山西 大同 037009)
施用除草剂是高效去除田间杂草的的有效手段[1],能够减少杂草与作物争光争肥,降低田间害虫越冬基数,保证作物的稳产、丰收。二甲戊灵(pen⁃dimethalin)作为一种高效、低毒的二硝基苯胺类除草剂,可以通过抑制杂草分生组织细胞的分裂与伸长,实现对大部分一年生禾本科杂草及少部分阔叶杂草的化学防治作用,适用于棉花、大豆、胡萝卜等多种作物的栽培[2-3],是我国常用的除草剂,但长期施用会导致土壤出现生态系统破坏、生物减少以及肥力下降等情况[4]。
土壤酶作为生物催化剂,能够参与土壤中的有机物分解、养分循环、能量转移等各种生化过程,对土壤生态系统的物质和能量循环具有重大意义。其活性能够反映土壤中进行的各种生物化学过程强度和力度,可作为检测农药对土壤环境条件影响的指标[5]。土壤微生物作为土壤中生物群落最重要的组成部分,在土壤物质转化过程中发挥着关键作用[6],不仅参与了土壤肥力形成与植物营养元素迁移、转化,还可以分解、降解、净化有机物,吸收重金属,土壤微生物的种类和数量将最终影响土壤肥力和植物的生长[7-8]。如今,国内外有关二甲戊灵除草剂的研究多集中在田间应用、土壤中的残留以及农作物安全性等方面[9-12],对土壤酶活性与微生物多样性影响的研究报道较少[13-16]。
为了研究施用二甲戊灵对高粱种植土壤酶活性与微生物的影响,本研究以室内盆栽和大田栽培2种方式种植高粱后的土壤为对象,通过测定施用二甲戊灵后土壤的酶活性与微生物多样性的变化情况,以期揭示土壤对二甲戊灵的响应规律,为科学合理使用二甲戊灵提供数据基础与理论依据。
1 材料与方法
1.1 供试土壤处理
大田土壤于2021年6月选择山西省朔州市平鲁区木瓜界煤矿区复垦地未施用过除草剂的大田(111°52′ E,39°21′ N);当地大田常规管理,栽种作物为高粱,土壤质地为壤土;样方面积3 m2,随机区组排列,每2个样方之间设2 m隔离带。盆栽土壤采自实验室人工栽培高粱后的花盆(未施用除草剂);栽培过程常规管理,土壤质地为壤土。分别同时采集0~20 cm深度的大田土壤与盆栽土壤,过2 mm筛后装入盆中,每盆装土3 kg。试验用药为33%二甲戊灵乳油(采购于天津京津农药厂),依次稀释成有效成分 200(T2)、400(T3)、600(T4)、800(T5) g·hm-2的药液,并设置蒸馏水(T1)作为对照组(0 g·hm-2)。大田土壤与盆栽土壤分别每天喷施蒸馏水T1与经稀释的不同浓度二甲戊灵乳油药液T2~T5一次,每个处理设置3次重复,并每天加入无菌水使土壤含水量保持25%。施药30 d后,进行土壤检测试验。
1.2 土壤酶活性检测方法
土壤蔗糖酶采用3,5-二硝基水杨酸比色法,脲酶采用苯酚钠比色法,过氧化氢酶采用高锰酸钾滴定法,多酚氧化酶采用焦性没食子酸比色法[17]。
1.3 土壤微生物数量分离与计数
土壤微生物主要类群数量的测定采用稀释涂布平板法[18]。细菌由牛肉膏蛋白胨培养基培养[19],真菌由马丁氏培养基培养[20]。
1.4 土壤微生物群落多样性检测
使用E.Z.N.A.Soil DNA Ki(tOmega,美国)DNA提取试剂盒对土壤中的微生物总DNA进行提取,分别使用细菌通用引物(338F:5’-CCTAC⁃GGGAGGCAGCAG-3’;518R:5’-ATTACCGC⁃GGCTGCTGG-3’)、真 菌 通 用 引 物(NS1:5’-GTAGTCATATGCTTGTCTC-3’;NS4:5’-CTTCCGTCAATTCCTTTAAG-3’)对细菌16S rDNA的V3区与真菌18S rDNA的保守区进行 PCR 扩增,扩增体系为:10× PCR buffer 5 μL;dNTP(2.5 mmol·L-1)3.2 μL;rTaq(5 U·μL-1)0.4 μL;Forward Primer(1×10-2mol·L-1)1 μL;Reverse Primer(1×10-2mo·lL-1)1 μL;模 板DNA50 ng;ddH2O补至50 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性 3 min,55 ℃复性 30 s,72 ℃延伸1.5 min,30个循环;最终 72 ℃延伸 5 min。采用DNA Gel Extraction Kit(Omega,美国)对 PCR 产物进行纯化回收,PCR产物用1%琼脂糖凝胶电泳检测后,参考Cheng等[21]的条件进行DGGE电泳分析。具体方法为采用变形梯度为20%~40%、浓度为6%的聚丙烯酰胺凝胶(化学变性剂为100%尿素 7 mol·L-1和 40%(v/v)的丙烯酰胺)在 1×TAE缓冲液中150 V、60 ℃下电泳8 h。变形梯度凝胶电泳(DGGE)完毕后,采用银染法染色。用灭菌手术刀切下待回收DGGE条带,采用OMEGA公司Poly-Gel DNA Extraction Kit回收目的条带。分别选择细菌与真菌DGGE图谱中迁移率不同、明亮且容易分离的条带进行胶回收并送测序,将测序结果在NCBI进行Blast比对。
1.5 数据统计与分析
DGGE图谱采用Quantity one 4.6.2对每个样品的电泳条带数目、密度进行数字化分析[21-22],分别计算样品中细菌与真菌的Shannon香农指数(H)。使用ClustalX将胶回收的测序结果进行序列比对。使用MEGA 5.0采用邻位相连法(neighbor-join⁃ing)构建系统进化树,Bootstrap设为1000进行自检[23-24]。数据采用SPSS 19.0统计软件进行方差分析和多重比较,本研究所列结果为3次重复测定值的平均值。
2 结果与分析
2.1 二甲戊灵对土壤酶活性的影响
测定施用二甲戊灵后的种植地土壤酶活性,结果如图1~图4所示。在大田栽培和室内盆栽条件下,二甲戊灵对蔗糖酶活性的影响均表现出相似的变化趋势,随着施用浓度增加,蔗糖酶活性先升高后降低,在二甲戊灵施加浓度为200~800 g·hm-2范围内,二甲戊灵均能激活土壤蔗糖酶活性(图1)。在二甲戊灵施用浓度为400 g·hm-2时,土壤蔗糖酶活性均分别达到峰值 0.245、0.317 g·g-1·h-1,并且室内盆栽条件下二甲戊灵激活土壤蔗糖酶能力要强于大田栽培。
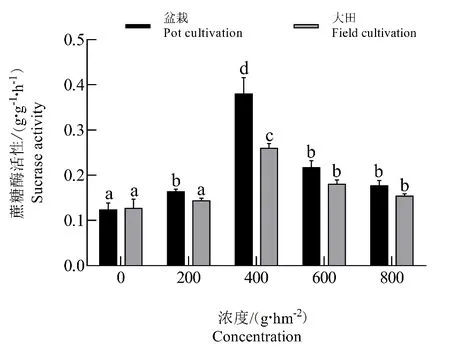
图1 二甲戊灵对蔗糖酶活性的影响Fig.1 Effects of pendimethalin on sucrase activity
由图2可以看出,在大田栽培和室内盆栽条件下,二甲戊灵对脲酶活性的影响表现为随着施用浓度的增加,土壤酶活性均呈“升高-降低-稳定-升高”的趋势,并且在0~800 g·hm-2范围内,当施加浓度为200和800 g·hm-2时,土壤脲酶活性显著激活。

图2 二甲戊灵对土壤脲酶活性的影响Fig.2 Effects of pendimethalin on urease activity
由图3可以看出,随着施用浓度的增加,室内盆栽条件和大田栽培条件下,在0~800 g·hm-2范围内,二甲戊灵对土壤过氧化氢酶活性均表现为未激活,甚至在二甲戊灵施加浓度为600 g·hm-2时,对土壤过氧化氢酶的活性表现出抑制作用。
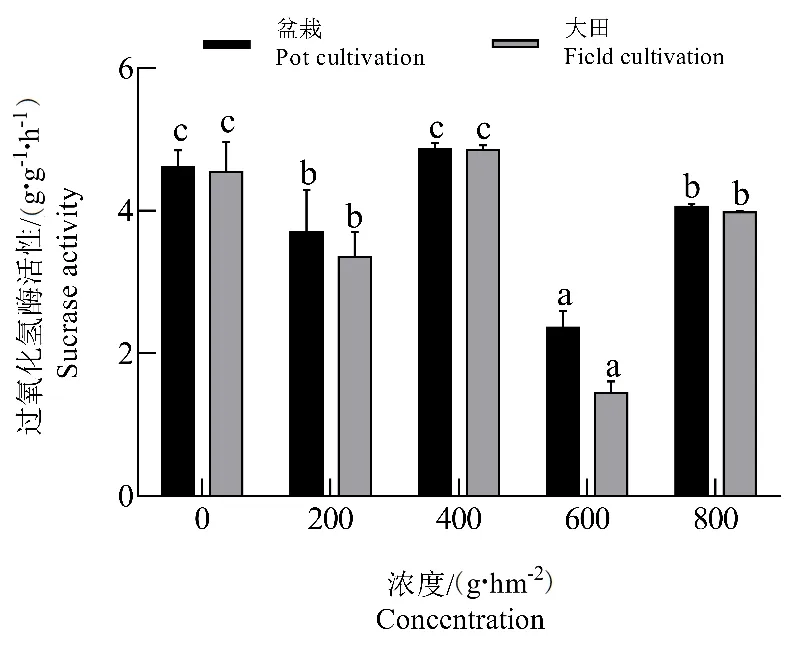
图3 二甲戊灵对过氧化氢酶活性的影响Fig.3 Effects of pendimethalin on catalase activity
由图4可以看出,在室内盆栽和大田栽培条件下,随着施用浓度的增加,多酚氧化酶活性先升高后降低。二甲戊灵施加浓度为200~800 g·hm-2范围内,二甲戊灵均能激活土壤多酚氧化酶活性。

图4 二甲戊灵对多酚氧化酶活性的影响Fig.4 Effects of pendimethalin on polyphenol oxidase
2.2 二甲戊灵对细菌和真菌数量的影响
不同浓度二甲戊灵对土壤细菌数量的影响如图5所示,0~400 g·hm-2浓度处理下,二甲戊灵对盆栽环境和大田环境下的细菌均有一定的激活作用(P<0.05),600~800 g·hm-2的处理下细菌数量开始出现下降的变化趋势,与0~400 g·hm-2时比较有所降低,但依旧高于对照组(P<0.05)。

图5 二甲戊灵对土壤细菌数量的影响Fig.5 Effect of pendimethalin on the amount of bacteria
不同浓度二甲戊灵对土壤真菌数量的影响见图6,盆栽环境下真菌数量有不同程度的下降,均低于对照组(P<0.05),并且200 g·hm-2浓度处理下真菌数量显著低于其它浓度的处理,同时其他浓度处理间差异不显著(P>0.05)。在大田环境下,不同浓度二甲戊灵对土壤真菌数量影响与盆栽环境呈现相反变化趋势,与对照组相比,不同浓度的二甲戊灵对真菌有不同程度的激活作用,并且在400和600 g·hm-2处理下,真菌数量达到了峰值(16.07×105cfu·g-1),具有明显的激活效应(图6)。随着二甲戊灵处理浓度增加,其对土壤真菌的激活效应达到稳定状态。
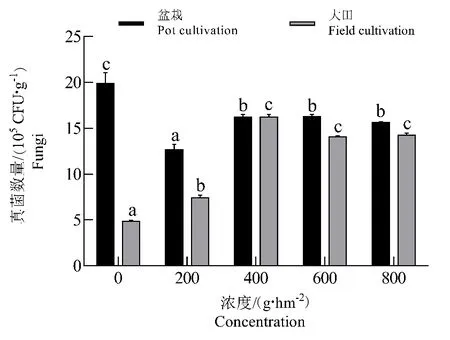
图6 二甲戊灵对土壤真菌数量的影响Fig.6 Effect of pendimethalin on the amount of fungi
2.3 二甲戊灵对土壤微生物群落多样性的影响
由图7A、表1及图8A可见在室内盆栽条件下,5种浓度二甲戊灵处理下的细菌群落多样性存在显著差异(P<0.05),400 g·hm-2和 600 g·hm-2处理下的土壤细菌群落相似性最高,为51.8%。随着二甲戊灵的浓度逐渐升高,其对细菌群落多样性的增加和香农指数的提升都起到了一定的激活作用。由图7B、表1可见,在大田环境下,400、600 g·hm-2二甲戊灵处理的土壤细菌群落多样性相似度达到最高,为68.7%,比盆栽环境下2种浓度二甲戊灵处理的土壤细菌群落多样性相似度更高,但香农指数均呈现先降低后升高的变化趋势(图8B)。
由图7C、图8C与表1可见,盆栽环境下5种浓度二甲戊灵处理的真菌群落多样性有很大差异,400 g·hm-2和对照的真菌群落相似性最高,达到69.4%。随着二甲戊灵的浓度逐渐升高,盆栽土壤真菌群落多样性增加、香农指数也逐渐增加,呈现出一定的激活作用。由图7D可见,大田环境和盆栽环境下,不同浓度二甲戊灵处理的土壤真菌群落多样性有所不同,在大田环境下未用二甲戊灵处理的对照组和200 g·hm-2处理的细菌群落多样性相似度最高,为62.5%(表1),但香农指数表现出了与盆栽条件一致的“升高—降低—升高”的变化趋势(图8D)。

图8 不同浓度二甲戊灵处理的土壤微生物群落的香农指数Fig.8 Shannon index of soil microbial communities treated with dif⁃ferent concentrations of pendimethalin
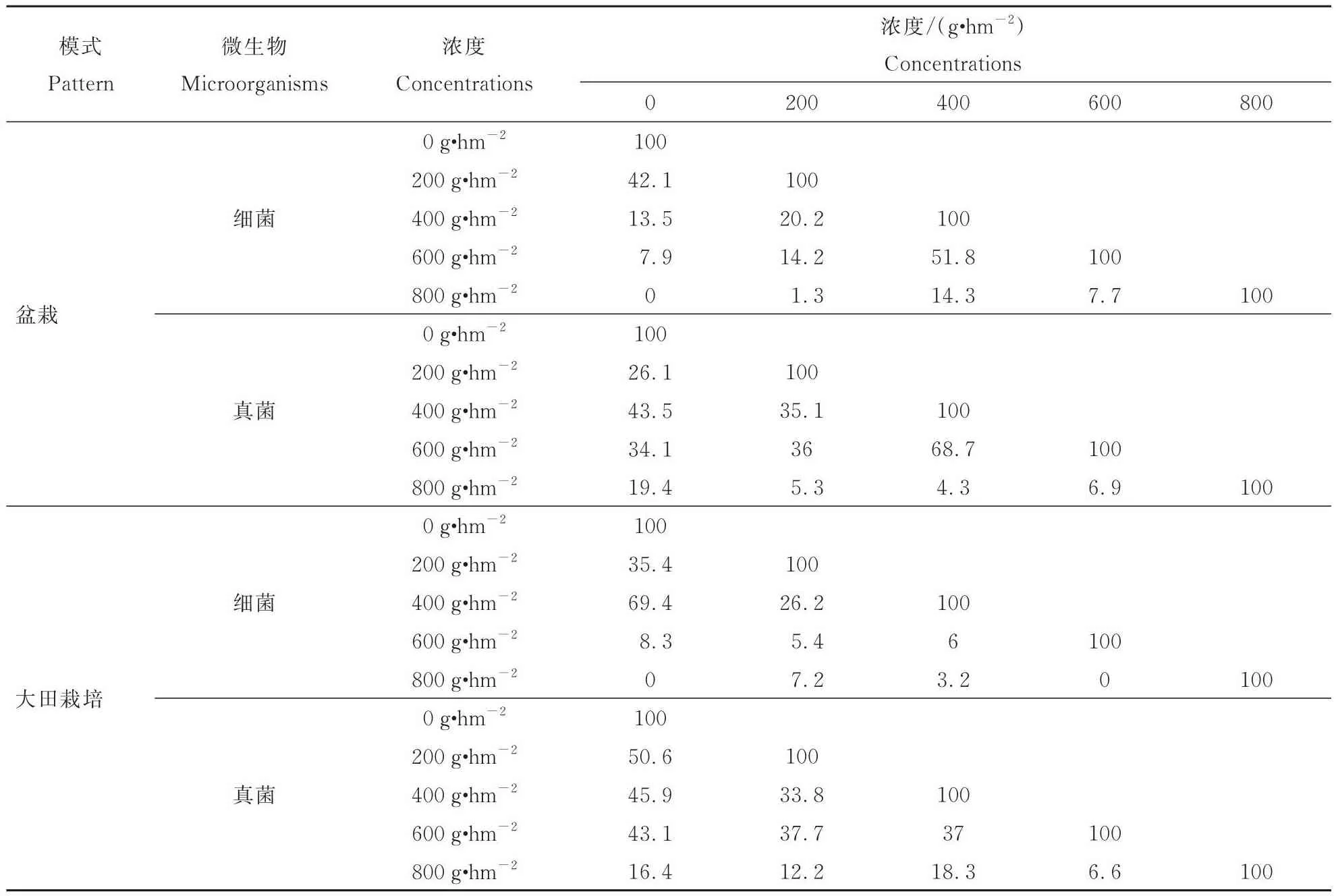
表1 不同浓度二甲戊灵处理的土壤微生物群落相似性Tab.1 Similarity of soil microbial communities treated with different concentrations of pendimethalin 单位:%

图7 土壤微生物PCR-DGGE指纹图谱Fig.7 PCR-DGGE fingerprints of soil microorganism
为进一步了解图谱中一些优势条带所代表微生物在种水平的系统发育地位,分别选择细菌与真菌DGGE图谱中迁移率不同、明亮且容易分离的条带:XJ-1~XJ-10、ZM-1~ZM-7进行胶回收并送测序,将测序结果在NCBI进行Blast比对。在条带中一共发现了Pantoea、Shewanella、Coxiella、Myxo⁃coccus、Bdellovibrio、Hyphomonas、Ohtaekwangia、Flavisolibacter、Flavobacterium、Acidobacterium10个属的细菌。此外,还发现了7种真菌,其中4种均为Stigmalychus属,另外3种分别为Pseudombroph⁃ila guldeniae、Pythium insidiosum、Pythium aphanidermatum,分析细菌与真菌中同源性较高的已知菌种的序列与本研究所得序列构系统发育树,发现在细菌的系统发育树中(图9A),XJ-9的代表菌株虽比对到与Shewanella irciniae菌株高度同源,但从进化关系上与Acidobacterium属的菌株关系较近,其他的代表菌在进化关系上与比对到的其高度同源的菌株的亲缘关系一致。在真菌系统发育树中(图9B),分属4个属的7种真菌的代表菌在进化关系上与比对到的其高度同源的菌株的亲缘关系一致。

图9 土壤样品中微生物的系统进化树Fig.9 Phylogenetic trees of microorganisms in soil samples
3 讨论
土壤酶是土壤中具有生物活性的蛋白质,在有机残体分解和一些无机化合物转化的初始阶段起着不可忽视的作用,对土壤肥力的演化具有重要的作用。二甲戊灵施用后土壤酶活性剧烈变化,影响了土壤养分循环与代谢,二甲戊灵对土壤酶影响作用程度间接反映了其对生态环境危害程度[25]。蔗糖酶与土壤的熟化程度密切相关,本研究中盆栽环境与大田环境下,二甲戊灵浓度在400~800 g·hm-2时促进了蔗糖酶活性的提升,浓度在400 g·hm-2时,对蔗糖酶活性的促进作用最大,随着二甲戊灵作用浓度的提高对蔗糖酶活性的促进作用逐渐减少,但高于未施用二甲戊灵的土壤,这是因为高浓度的二甲戊灵会改变土壤中微生物群落数量与活性,蔗糖酶活性随之变化以维持土壤代谢平衡[24-27]。脲酶则与土壤氮元素的转化、吸收、利用密切相关;实验结果表明在盆栽与大田条件下二甲戊灵对土壤脲酶活性呈激活作用,当浓度达到800 g·hm-2时,脲酶活性达到最大,这与Sireesha等[28]人的研究结果相似;并且大田条件下对脲酶活性的激活作用显著高于盆栽条件,原因可能是大田土壤光照充足、微生物较为丰富导致[28]。过氧化氢酶与微生物的活性密切相关,可以降低环境对微生物的毒害。在本研究中施用二甲戊灵的浓度为600 g·hm-2时,土壤中过氧化氢酶活性受到明显抑制,在施用二甲戊灵的浓度分别为200与800g·hm-2时,过氧化氢酶的活性也受到不同程度的抑制;胡佳月等[29]研究结果表明二甲戊灵对过氧化氢酶的活性影响不明确,具体作用规律还需要进一步探究。多酚氧化酶活性则随二甲戊灵浓度而变化,施用浓度在0~600 g·hm-2时,随着二甲戊灵浓度的增加多酚氧化酶活性不断增强,在盆栽与大田栽培条件下二甲戊灵浓度均为600 g·hm-2时多酚氧化酶活性达到最大值。
土壤微生物是土壤生态系统中的重要角色,对于土壤中农药的适应、降解以及转化具有不可替代的作用[30-31]。土壤微生物具有对环境细微变化的敏感性,可以作为敏感性指标来观测土壤的生物性状[32-33]。大量研究表明,部分除草剂对土壤微生物有抑制或杀灭作用,也有部分除草剂对土壤微生物有促进作用[34-35]。二甲戊灵作为一种二硝基苯胺类除草剂,对土壤微生物也有一定程度的影响[36]。随着施用二甲戊灵浓度的增加,对土壤微生物数量与群落多样性也有一定的影响。土壤细菌数量总体呈现不同程度的增加趋势,0~400 g·hm-2浓度下增加数量多,600~800 g·hm-2浓度下增加数量少。土壤真菌数量总体变化趋势与细菌不同,盆栽土壤的真菌数量有不同程度的下降,大田土壤中则逐渐增加。同时,土壤的细菌多样性呈现先降低、后增高的趋势;真菌多样性则呈现“增-减-增”的趋势,盆栽与大田栽培方式没有影响微生物群落多样性的变化趋势。在施用二甲戊灵的过程中,细菌和真菌之间是否互相影响,还有待进一步研究。
不同的农药在施用后其在土壤的残留会对土壤生态环境产生一系列的生物作用,土壤微生物作为土壤生态环境的主要参与者也通过自身的群落适应机制来改善农药带来的一系列污染[37-38]。从本研究来看,土壤微生物对化学农药的响应机制还有很多未解之处,土壤微生物在农药残留土壤的作用及价值还有待于进一步研究和开发。
4 结论
除草剂的长期使用会造成土壤生态系统的破坏,二甲戊灵是一种广谱、高效的二硝基苯胺类除草剂。在施用不同浓度的二甲戊灵后,盆栽和大田栽培条件下土壤中的蔗糖酶、脲酶、多酚氧化酶活性均被一定程度的激活,并且在400 g·hm-2时开始到达最大值,仅过氧化氢酶出现不同程度的抑制作用,在600 g·hm-2时抑制作用最强。土壤中的微生物数量和群落多样性也发生改变,表现出不同的生物多样性指数,群落间表现出了明显的差异;二甲戊灵对土壤中的细菌和真菌呈现出激活作用,激活程度随二甲戊灵施用浓度变化而变化。细菌和真菌群落均对二甲戊灵的浓度变化较为敏感,不同浓度二甲戊灵处理的土壤中共发现10个属的细菌和分属4个属的7种真菌,尤其Myxococcus属细菌、Stigmalychus属真菌相对丰度较高。

