两种土壤条件下山杨幼苗不同叶位叶片适应干旱胁迫的光合特性分析
陆燕元,潘立
(1.国家林业局西南地区生物多样性保育重点实验室,西南林业大学,云南 昆明 650224;2.西南林业大学 会计学院,云南 昆明 650224)
近年来,水资源短缺己成为全球性生态问题,干旱已经成为农林业生产的最大障碍[1-2]。土壤是植物生长发育的基础,土壤性质直接影响植物根系水分和养分的运输,以及土壤水分的蒸发,从而影响土壤的含水量,限制植物的生长[3-4]。短期干旱影响林木生长,长期干旱更可能导致林木枯萎死亡[5]。在干旱逐渐加剧的过程中,植物体内会顺序发生一系列生理生化响应,植物要在生长与生存之间进行协调,不同位置叶片的光合作用受干旱胁迫影响的顺序和程度必然有所差异,不同的土壤性质持水能力不同,对其也会产生一定的影响。为阐明这些内在机理,本文以山杨幼苗为对象,采用人工控水模拟干旱,测定其叶片在不同土壤类型下的光响应特征,揭示杨树不同叶位叶片光合作用对干旱胁迫的适应策略及耐旱机制,为不同土壤类型的旱区造林提供科学依据。
1 材料与方法
1.1 材料与设计
试验在加拿大阿尔伯塔大学(The University of Alberta)(53°34′N 113°31′W)温室完成。从阿尔伯塔省(Alberta),主要是埃德蒙顿市(Edmon⁃ton)周围进行山杨(Populus tremuloides)种子收集,然后用塑料穴盘进行播种育苗。采用2种土质(PMX和ELL)和干旱处理时间进行随机区组对比试验,PMX(Potting mix):加拿大常用的商业混合土,55%~65%泥炭土,珍珠岩、白云灰岩和石膏肥料,土质较为疏松,养分充足,但水分易于流失。ELL(Ellerslie Research Station):粘壤土,采集于阿尔伯塔大学研究工作站,是典型的山杨生长的土壤,土质较为紧实,土壤持水能力较强。所有土壤用前均过筛过滤,高压灭菌,冷却备用。播种2周后,种子萌发,1个月后,移栽至大点的塑料盆(长/宽/高:85 cm/40 cm/12 cm)。每天早上浇水,每隔1周施1次质量浓度为0.1%的营养液。温室条件:光强 350 µmol·m−2·s−1,光照 18 h,湿度:30%~55%,温度:16~25 ℃。为最大限度的减少边缘效应的影响,每周随机移动盆子的位置3次。播种约3个月后,植株长至75~85 cm高、约有40片叶子时开始进行控制水分处理。控制水分处理时留出10株苗子进行正常浇水,作为对照(CK);其余的山杨幼苗采取逐渐干旱的方法,即每天早上对盆子称重,计算出前一天水分的蒸发量,然后补充部分水分,所补充的水分为前一天蒸发量的一半,直至最后蒸发量为零时,停止浇水,并计算记录土壤含水量。
1.2 试验方法
1.2.1 干旱胁迫处理
每种土壤类型各随机选取20株植株进行连续干旱处理。处理前用天平记录首重,另外10株作为水分充足的对照处理。每个盆子表面覆盖铝箔纸以最大限度降低土壤水分蒸发。对干旱处理的植株每天中午称重记录,计算出土壤每天水分的损失量以及土壤含水量。每天称重完后补充一定的水分,处理组补充的水分为前一天失水量的50%,对照组补充的水分为失水量的100%。试验后期,处理组因土壤中的水分含量较低,每日水分减少量近似于0,因此不再补充任何水分,直至所有叶片全部枯死,试验结束。
1.2.2 测定指标
叶面积测定:干旱处理后每天用CI-203型便携式激光叶面积仪(CID Inc,Washington, USA)测定野外叶片面积,叶面积与叶长、叶宽的拟合公式:叶面积=0.702 7×叶长×叶宽,形态测量的叶面积通过拟合公式得出。
含水量测定:进行自然干旱胁迫后,以第0天作为对照,采用TDR 200土壤水分测量器结合称重的方法测定土壤中的相对含水量,每个树种每个处理测定3盆,每盆测定3次,取平均值作为数据分析。
气体交换参数测定:试验于水分处理后开始连续监测叶位为顶部倒数第3片成熟叶、中部第17~19位及底部第3~6位的叶片的光合参数。Li-6400光合仪(Li-Cor Inc., Lincoln, NE)便携式开放系统,配以LI-6400B红蓝光源(叶室面积=6 cm2)。根据温室光照强度,设定光强为350µmol·m−2·s−1,用 6400-01 CO2钢瓶把 CO2浓度固定为 386 µmol·m−2·s−1,气温(21±0.15) ℃,蒸汽压差(VPD)为(1.3±0.3) kPa。每个叶片测定 5 min,每30 s记录1次,记录每个光强下净光合速率(Pn,μmol·m-2·s-1)、蒸 腾 速 率(Tr,mmol·m-2·s-1)、气孔导度(Gs,mol·m-2·s-1)和胞间 CO2浓度(Ci,μmol·mol-1)等光合指标。山杨幼苗叶片水分利用效率(WUE,μmol·mmol-1)和气孔限制值(Ls)分别通过公式WUE=Pn/Tr和Ls=1−Ci/Ca得到,其中Ca为空气 CO2浓度(μmol·mmol-1),每个指标取10个记录值的平均值作为数据分析。
1.3 统计分析
统计所测数据,使用Excel 2010进行计算,Sigmaplot 10.0作图,由SPSS(20.0版本)进行数据统计分析,采用Duncan法进行多重比较。
2 结果与分析
2.1 干旱处理对土壤含水量的影响
在干旱处理下ELL土壤类型中土壤含水量呈缓慢下降的趋势,直至处理后期,与干旱处理前相比,土壤含水量只是下降了20%左右(图1),表明该类型土壤持水能力较强,但同时也表明,尽管ELL中含水量较大,但能供植物吸收的自由水分较少。而PMX表现则不同,从干旱处理初期就开始显著下降,至处理后期时降幅达到60%,仅为对照的30%左右,说明其保水能力较差。干旱胁迫第9天时,土壤水分减少量近似于0,表明2种类型土壤的含水量均达到最低值,可利用到的水分为0,因此不再补充任何水分,直至所有叶片全部枯死,试验结束。

图1 干旱处理对不同土壤类型土壤含水量的影响Fig.1 The effects of drought on soil water content in two soil types
2.2 干旱处理对山杨幼苗生长形态的影响
本试验结果表明,干旱处理下,由于土壤中的水分含量逐渐减少,最先受到影响的是植株旺盛的生长部位,即茎尖和幼叶,但其受影响的程度在2种土壤类型中显差异著(图2)。干旱处理初期,ELL土壤中幼苗继续生长,第8天时幼叶出现萎蔫,茎尖枯萎,随后逐渐蔓延到中下部叶片,第16天时整株幼苗叶片都已干枯。而在PMX土壤中,干旱处理至第8天时叶片出现轻微的萎蔫症状,第14天时上部叶片及茎尖萎蔫,第17天时整株幼苗干枯。整体上,与ELL上的植株相比,PMX上的幼苗受旱特征显现较早,但发展较为缓慢,最终存活的时间要延长1~2 d左右。该结果表明,虽然粘壤土ELL的持水量较大,干旱后失水也较少,但由于土质较黏,对水的束缚加大,土壤有效水分低,植株很难从中利用到,且这种质地的土壤受旱后容易板结,进而影响根系的呼吸和运输功能,所以受旱后植株的存活时间相对较短。

图2 干旱处理对不同土壤中幼苗生长的影响Fig.2 The effects of water stress on plants growth in two soil types
2.3 干旱程度对叶片伸长的影响
在干旱初期,2个土壤类型中叶片伸长生长受到的影响有明显差异(图3)。ELL土壤中幼苗的幼嫩叶片加速生长,叶片的伸长生长甚至高于对照。直至干旱第7天,幼叶的伸长生长与对照相比显著下降,随后持续下降,至干旱第11天时顶端的叶片萎蔫,伸长生长基本停止。与ELL土壤中幼苗相比,在PMX土壤中幼苗幼嫩叶片的伸长生长受到的影响较早,在干旱胁迫的第1天就开始显著下降,但降幅平缓,直至干旱的第14天时幼叶才出现萎蔫,幼叶停止生长(图3),幼叶停止生长的时间比ELL中植株延长了2 d。
2.4 干旱程度对不同叶位叶片光合特性的影响
2.4.1 干旱程度对不同叶位叶片净光合速率
(Pn)的影响
2种土壤类型中不同叶位的光合速率对干旱的反应趋势基本一致,均在干旱初期(干旱第2~3天)上升,随后下降(图4)。在ELL土壤中,叶片Pn下降的幅度更为显著,在干旱胁迫第10天时基本降为0;下部叶片Pn显著低于中上部的叶片,但上部的叶片受干旱的影响更大,在干旱第6天时低于中部叶片。在PMX土壤中,中部叶片的Pn最高,下部叶片最低,受到干旱胁迫后上、中、下3个叶位的Pn均是先升后降,与EEL土壤中山杨幼苗相比,PMX中的植株叶片Pn受干旱胁迫的影响较为滞后,一直到干旱胁迫的第8天才开始下降,在干旱的第8~12天时还略有上升,随后显著下降。
2.4.2 干旱程度对不同叶位叶片气孔导度(Gs)的影响
2种土壤类型中幼苗的气孔导度(Gs)对干旱胁迫的反应与对Pn的变化基本一致(图5),均是干旱初期上升,随后下降,这是因为气孔是植物叶片与外界进行气体交换的主要通道,O2、CO2、H2O都是通过气孔扩散,其开合程度直接影响Pn和Tr,从而间接影响到WUE。在ELL土壤中幼苗上部叶片的气孔导度较高,在干旱中后期受到影响较大,因此下降幅度显著高于中下部的叶片;而在PMX土壤类型中,中部叶片气孔导度较高,在干旱胁迫的中后期下降的幅度也低于上部和下部的叶片,在ELL土壤中,上、中、下部的叶片均在干旱的第10天左右萎蔫,气孔关闭,减少水分的散失,而PMX土壤的叶片则在第14天时萎蔫。
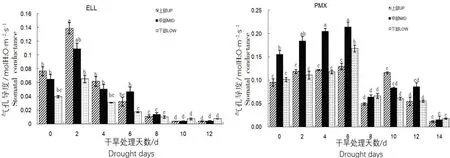
图5 干旱对不同叶位叶片气孔导度(Gs)的影响Fig.5 The effects of water stress on stomatal conductance (Gs) in two soil types
2.4.3 干旱对不同叶位叶片胞间CO2浓度(Ci)的影响
ELL土壤类型中,山杨幼苗3个部位叶片的WUE随干旱时间的持续其变化基本与WUE的趋势完全相反,即呈升-降-升-降的变化趋势,下部叶片的Ci显著高于其它2个部位(图6)。而PMX土壤类型中,3个部位叶片的WUE在干旱初期(0~6 d)略有下降,但变化较为平稳,第6~8天时下降并略有反复,中部叶片Ci较高,与其它2个部位叶片达到显著差异。
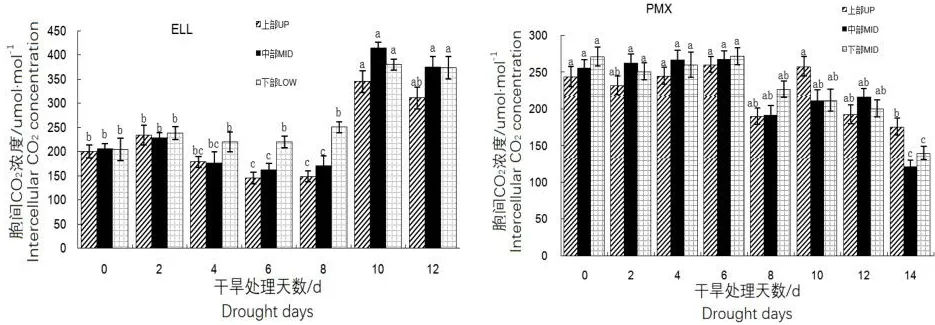
图6 干旱对不同叶位叶片CO2浓度(Ci)的影响Fig.6 The effects of water stress on intercellular CO2 concentra⁃tion (Ci) in two soil types
2.4.4 干旱对不同叶位叶片蒸腾速率(Tr)的影响
2种土壤类型中不同叶位山杨幼苗叶片的Tr随干旱胁迫的持续变化的趋势与Pn和Gs极为相似,均呈先升高后降低(图7)。ELL土壤类型中,山杨幼苗中、上部的叶片变化的幅度明显大于下部的叶片;而PMX土壤类型中,中、下部的叶片Tr较高,在干旱胁迫的初期和中期的变化幅度均明显大于上部叶片,但上部的叶片Tr在干旱第10天时突然增大,随后与其它2个部位的叶片一样显著下降,在干旱的第14天降至最低点,这由于气孔在此时已经关闭,因此植物的蒸腾也为0。

图7 干旱对不同叶位叶片蒸腾速率(Tr)的影响Fig.7 The effects of water stress on transpiration rate (Tr) in two soil types
2.4.5 干旱对不同叶位叶片水分利用效率(WUE)的影响
干旱胁迫下,2种土壤类型中山杨幼苗不同叶位叶片的WUE随干旱胁迫时间的持续变化趋势有所差异(图8)。ELL土壤类型中,山杨幼苗3个部位叶片的WUE随干旱时间的持续其变化基本一致,均呈降-升-降-升的趋势,即在干旱第2天显著下降,第4天上升,然后维持较平稳状态,至第10天时显著下降为最低值,随后略有回升,中上部叶片的WUE一直显著高于下部叶片;而PMX土壤类型中,随着干旱胁迫的加剧,上、中和下部叶片的WUE均呈升-降-升-降的变化趋势,中部叶片的WUE显著高于其它2个部位的叶片。
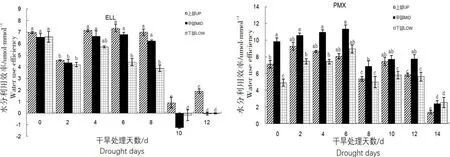
图8 干旱对不同叶位叶片水分利用效率(WUE)的影响Fig.8 The effects of water stress on water use efficiency (WUE)in two soil types
2.4.6 干旱对不同叶位叶片气孔限制值(Ls)的影响
ELL土壤类型中,山杨幼苗3个部位叶片的Ls随干旱胁迫加剧的变化趋势与WUE随干旱时间的变化趋势基本相似(图9)。干旱胁迫第2天时Ls均略有下降,随后平稳上升,在胁迫的第4~8天均维持在一个较为平稳的状态,第10天时降至最低值,随后略有回升,中上部叶片的Ls均明显高于下部叶片。而PMX土壤类型中,在干旱胁迫的第0~8天,呈先升后降再升的趋势,但变化幅度较为平缓,3个部位叶片的Ls无明显差异;干旱胁迫至第10天时显著下降然后又大幅上升至最高值,此时中下部叶片的Ls显著高于上部叶片的值。
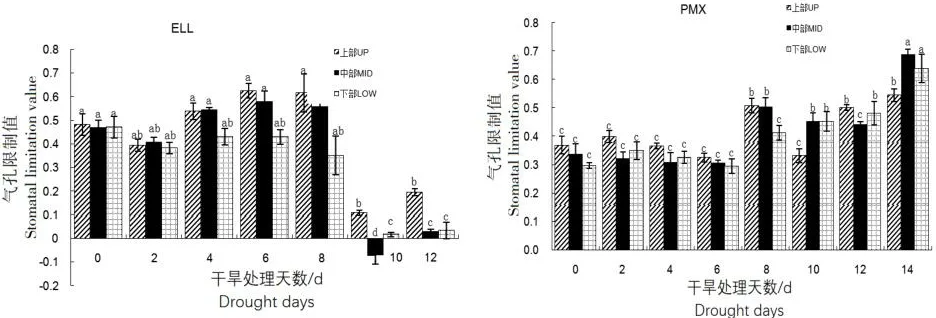
图9 干旱对不同叶位叶片气孔限制值(Ls)的影响Fig.9 The effects of water stress on stomatal limitation (Ls)value in two soil types
3 讨论
(1)干旱对山杨幼苗叶片伸长和生长的影响
干旱直接限制植物的生长,植物通过调整形态构造和生长速度来适应干旱胁迫[6],例如,植物叶片进行光合作用的能力随着叶龄和叶位不同而变 化[7-9],这在 杉 木[10]、葡 萄[11]、桃[12]、番 茄[13]、相思[14]、红松[15]等的研究中已得到证实,但在干旱胁迫条件下,不同土壤类型下生长的不同叶位的叶片光合对水分利用的响应特征还鲜见报道。本研究发现,在干旱初期处理的0~8 d内,ELL上幼苗叶片的生长甚至高于对照,说明一定程度的干旱反而促进了植物的生长,产生了超补偿效应,保证了胁迫前期的旺盛生长,这可能是有些研究发现轻度水分胁迫未引起生物量降低甚至增加的原因[5]。随着胁迫时间的延长,较大叶面积造成的蒸腾失水以及叶温升高都会进一步加剧水分胁迫的影响,因此,植物关闭气孔,减少蒸腾,停止生长,更多的能量用于抵御干旱。PMX土质疏松,保水能力差,受旱后土壤蒸发过快,山杨幼苗的生长速度迅速减缓,通过降低生长速率来换取存活时间的延长。有研究表明,干旱胁迫的强度和持续时间都对植物耐受胁迫的方式产生影响,从而导致了不同的适应策略[16]。正常供水或胁迫初期的植物生长快速,尽可能多的获取资源,采取挥霍策略;水分供应缺乏或长期干旱下的植物生长缓慢,有较高的抗旱性,采取保守策略[17]。不同环境和时期采取不同的策略,既保证了植物的生存,又使其能合理生长。ELL上生长的植株采取了第一个策略,在干旱初期加快生长,而PMX上的幼苗采取较为保守的策略,减缓生长,延长存活时间。整体上,PMX上的幼苗受同等干旱程度胁迫后比ELL上的植株存活时间延长了2 d左右,这也与土壤紧实度及土壤含水量有关。研究结果表明,过于紧实的土壤保持水分的能力加大,但非饱和导水率降低,土壤的通气状况和机械阻力成为主要限制因素,影响水分及养分在土壤中的移动,进而影响到了植物的生长;而中度紧实的土壤虽然土壤保持水分的能力相对较小,但非饱和导水率增加,增加了质流和扩散,这样会有更多的水分和养分离子运输到根系表面,植株反而能够维持更长时间的生长[2,18]。另一个原因是跟土壤的养分含量相关,这是我们下一步需要深入研究的问题。
(2)干旱对山杨幼苗叶片光合特征参数的影响
水分是植物进行光合作用所必不可少的主要因素之一,它不仅是进行光合作用的主要原料,在维持叶片水势、调节气孔等方面也起着更重要的作用[10]。干旱影响植物的生长在很大程度上要归结于光合作用的下调,其中气孔的调节起了重要的作用[19]。本研究中,干旱处理后ELL和PMX基质中杨树幼苗上、中、下部叶片各光合指标的变化差异表明干旱处理加速了杨树下部叶片的衰老,光合速率降低,但光合作用中心上移,使上部叶片保持较高的光合速率,表明较轻程度的干旱胁迫促使幼苗将有限的水分优先供给上、中部的光合作用中心,从而在水分胁迫条件下总体获得较高的光合速率,实现逆境条件下不减产或少减产的目的,这是植物为抵御干旱逆境的一种自我调节方式[16,20]。但当干旱较为严重时,上部幼嫩的叶片受到的影响更显著,因此降幅显著高于中部的叶片,此时整个植株的光合功能基本停止。根据Far⁃qhar和 Sharkey的理论[21],判断叶片光合速率降低的主要原因是气孔因素还是非气孔因素的2个可靠判据,是Ci和Ls的变化方向。本研究中,ELL基质中幼苗叶片在干旱胁迫处理0~8 d,山杨幼苗叶片Pn降低主要是由气孔限制因素引起的。水分胁迫使叶片气孔关闭,Gs降低导致进入叶片内的CO2浓度减少,光合作用的供应功能降低(Ci减少),光合作用的底物变少使植株净光合速率降低。干旱处理第9天后,气孔已经关闭,但Ci大幅上升,表明叶肉细胞光合活性下降,ATP和NADPH供应不足,从而限制了光合碳同化力,因而此时叶片Pn降低主要是由非气孔限制引起的,表明干旱胁迫第10天是气孔转向非气孔限制的转折点,然而干旱后期Ci下降Ls上升,这既不是气孔限制,也不是非气孔限制引起。最新的研究表明,光合速率的限制因素已不再简单地划分为气孔限制和非气孔限制,叶肉细胞导度(gm)被认为是除气孔限制和羧化限制外的光合效率第3个限制因素,并认为与气孔导度(Gs)同等重要[22-24]。水分亏缺条件下gm的降低与Gs一样是限制光合作用的主要因素。水分亏缺导致gm降低的因素主要包括结构因素(降低Sc、增加细胞壁厚度)和生化因素(AQPs活性的降低、CA活性的改变)。这些因素的变化抑制了水分亏缺条件下叶片组织内部的 CO2传输,因此胞间 CO2降低[25-26]。此外,也有研究表明,胞间CO2可能是作为一种信号分子参与红光诱导气孔开放,从而可以解释叶肉细胞中 Ci降低而 Ls上升这一现象[27-28],而在试验中,还需要作进一步的研究才能探明其原因。
WUE反映了生态系统碳水循环及其相互关系[29-30]。植物较高的WUE意味着较强的干旱环境适应能力,因此明确WUE影响因素,有助于了解植物对环境变化的响应和水分利用策略[13,31]。在本试验中,随着干旱胁迫时间的延长,ELL基质中幼苗叶片的WUE先降后逐渐回升,在后期显著下降,而PMX基质幼苗叶片WUE则先上升后下降,与气孔导度的变化趋势基本一致,表明较为疏松的土质在干旱胁迫中前期更有利于提高植物的水分利用效率。同时,研究也表明,植物叶片的年龄(叶龄)和所处的位置(叶位)不同,其光合能力也不同[7,12]。ELL基质中幼苗上部叶片的 WUE最高,其次是中、下部,而PMX中幼苗中部叶片的WUE最高,其次上部和下部叶片,表现为中间大,上下小。这反映了在新生叶→成熟叶→衰老叶的过程中,水分利用效率由低→高→低的变化趋势。
4 结论
土壤是植物生长发育的基础,而土壤紧实度影响着土壤有效水分的大小,通气状况,养分及水分向根系的运输。干旱胁迫下,紧实土壤(ELL)中的杨树幼苗在处理前期加速生长,尽可能多的获取资源来积累生物量,但存活时间较短;此外,ELL基质上的幼苗会把有限的水资源优先供应给生长比较旺盛的上部叶片,加速生长,并保持较高的光合活性,水分利用效率较高;疏松的土壤(PMX)中杨树幼叶的生长随处理的持续逐渐下降,但植株存活时间较长,处理前期土壤中有限的水分优先供应功能比较成熟的中部叶片,中部叶片的光合活性、WUE也较高。干旱中前期(≤8 d)光合速率的下降主要是气孔限制因素,后期主要是由非气孔限制因素引起,而PMX基质上幼苗叶片后期的光合能力则可能还受其它因素如叶肉细胞导度(gm)等影响,这需要做进一步的分析。

