利用小RNA深度测序技术鉴定白芷病毒病病原
杜江 ,姚东作 ,王晨燕 ,崔丽艳 ,王德富 ,牛颜冰 *
(1.山西农业大学 生命科学学院,山西 晋中 030801;2.山西农业大学 草业学院,山西 晋中 030801)
白芷是我国的一种传统中药材,为伞形科当归属多年生草本植物[1]。因其具有解表散湿、宣通鼻窍、祛风止痛等功效,常被用于治疗感冒头痛,鼻塞,疮疡肿痛等疾病[2]。白芷主要含有挥发油和香豆素类等有效成分,除了用于临床治疗,还在香料、护肤品等方面具有广泛的应用[3]。近年来白芷需求量逐年增长,人工种植面积逐年扩张,侵染白芷的病毒病种类也越来越多,但是关于白芷病毒病的研究仍然非常有限。
魏宁生等[4]研究表明,苗期的白芷被烟草环斑病毒(Tobacco ringspot virus,TRSV)侵染后,叶片表现出轻微的花叶症状,最终导致白芷叶片稀少、茎秆变细。Lim等[5]在感病白芷上检测到了花椰菜病毒属(Caulimovirus)的一种新病毒—归丛生病毒(Angelica bushy stunt virus,AnBSV)。有研究者在北京海淀区表现出环斑症状的白芷上检测到了黄瓜花叶病毒(Cucumber mosaic virus,CMV)的侵染[6]。本团队于2021年7月在山西农业大学药用植物园内的植物进行病害调查时,发现许多白芷叶片出现花叶、褪绿等症状。为了明确引起白芷花叶、褪绿等症状的病原,本研究通过小RNA深度测序技术以及RT-PCR检测的方法对采集的白芷疑似病毒病样品进行分子鉴定,同时对侵染山西农业大学药用植物园白芷的CMV进行外壳蛋白(Coat protein,CP)和运动蛋白(Movement protein,MP)基因全序列的克隆和序列进化分析,明确其分类地位,为白芷病毒病的防治提供一定的理论依据。
1 材料和方法
1.1 试验材料
2021年7 月从山西农业大学药用植物园内采集3份表现为花叶、褪绿等疑似病毒病症状的白芷叶片,液氮速冻后保存于−80 ℃冰箱(图1)。

图1 白芷田间症状图Fig.1 Field symptoms of A.dahurica
主要试剂:RNA Easy Fast植物组织RNA快速提取试剂盒(天根生化科技有限公司); First-Strand cDNA Synthesis SuperMix,2×Taq PCR Mix,pEASY-T1 Cloning Kit(北京全式金生物技术股份有限公司);Gel Extraction Kit(OMEGA公司);DL 2000 DNA Marker,DL 5000 DNA Marker(Takara公司)。
1.2 试验方法
1.2.1 植物总RNA提取及高通量测序
选取白芷幼嫩叶片参照植物RNA快速提取试剂盒说明书进行总RNA的提取,提取的RNA经检测合格后送至广州基迪奥生物科技有限公司进行高通量测序。
1.2.2 RT⁃PCR检测、克隆测序
根据小RNA测序获得的CMV核苷酸拼接序列,并结合前人的研究结果,设计了扩增CMV的2个编码基因(CP、MP)引物(表1)进行克隆。试验反应体系及流程参考牛颜冰等[7]的方法进行。扩增产物经电泳回收后连接至pEASY-T1 Cloning Kit克隆载体,挑选阳性单克隆送至生工生物工程股份有限公司测序。

表1 引物列表Table 1 Primers used in this study
1.3 序列测定及分析
将测序获得的CMVCP、MP基因序列利用NCBI中的 BLAST(https://blast.ncbi.nlm.nih.gov/Blast.)进行同源比对分析,再使用DNA⁃MAN 7.0软件进行序列相似性比较,使用MEGA 7.0软件以邻接法(Neighbor-joining)构建系统进化树,可信度设置为1000次自导复制验证。
2 结果与分析
2.1 小RNA测序结果与分析
对采集的白芷样品进行小RNA深度测序,共获得22 158 005个原始序列(raw reads),将raw reads中接头序列、没有插入的序列等不同的低质量序列去除后共获得长度在18~28 nt的clean reads数为19 894 844,占clean reads的百分比达到89.79%。对白芷测序获得的sRNA长度进行统计分析,发现小RNA长度主要集中于3个类型,21 nt(48.36%)、22 nt(12.12%)和24 nt(12.06%)(图2)。
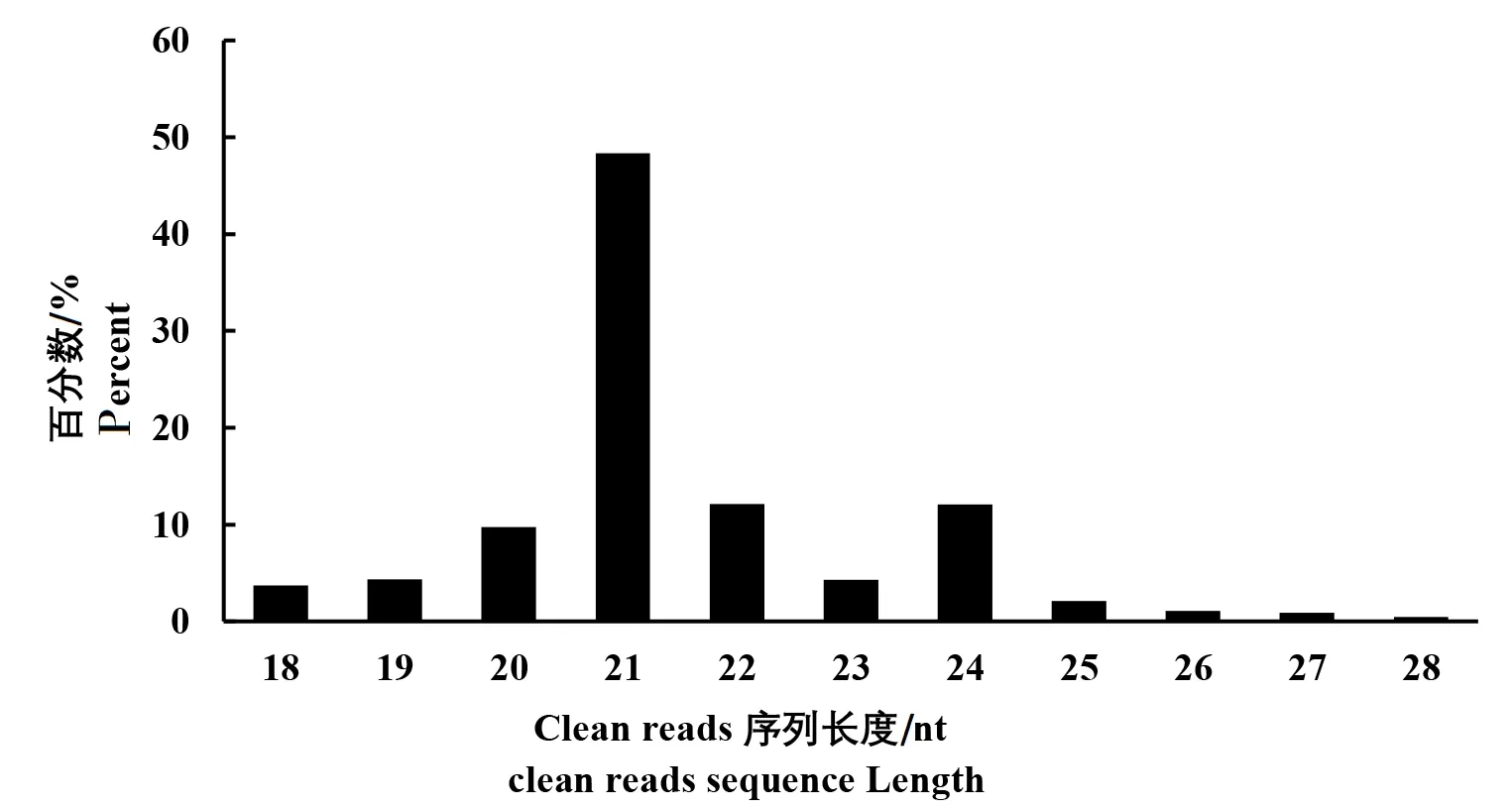
图2 sRNA长度分布Fig.2 Small RNA length distribution
将拼接获得的contigs与NCBI数据库中的病毒数据库进行比对注释,发现能够比对到的黄瓜花叶病毒(Cumber mosaic virus,CMV)3条正义链RNA3、RNA2、RNA1的比对率分别为 2.14%、1.28%和1.10%(表2)。

表2 比对病毒统计表Table 2 The match virus statistics
2.2 RT⁃PCR检测
以提取的白芷样品RNA为模板,反转录后利用CMV特异引物CMV-cp-F/CMV-cp-R、CMV-mp-F/CMV-mp-R分别对白芷样品中的CP、MP基因进行RT-PCR扩增,电泳后分别获得预期的 657 bp(GenBank登录号:OP157198)(图3A)和 847 bp(GenBank登录号:OP293346)(图3B)的目的条带,而在健康的样品中未扩增到相应大小的片段。

图3 MP和CP特异引物PCR检测结果Fig.3 Electrophoresis analysis of CMV-BZ coat protein and move⁃ment protein PCR products
2.3 CMV白芷分离物(CMV⁃BZ)与其它CMV分离物的序列相似性分析
经扩增、测序后得到了CMV白芷分离物(CMV-BZ),利用DNAMAN软件将其CP基因与来自中国、澳大利亚、日本、印度和韩国等不同国家的21个CMV不同分离物进行氨基酸以及核苷酸的序列相似性比较分析。结果表明,CMV白芷分离物(CMV-BZ)CP基因与CMV亚组I株系氨基酸同源性为95.8%~99.1%,核苷酸同源性为93.9%~99.5%;而与CMV亚组II株系氨基酸同源性仅为77.8%~79.6%,核苷酸同源性仅为75.9%~76.7%(表3)。对CMV-BZ编码的MP基因与来自中国、日本、澳大利亚、美国和韩国的12个CMV不同分离物进行氨基酸和核苷酸的序列相似性比较分析,结果表明CMV白芷分离物(CMV-BZ)MP基因与CMV亚组I株系氨基酸同源性为93.9%~99.3%,核苷酸同源性为93.2%~99.0%;而与CMV亚组II株系氨基酸同源性仅为82.8%~84.2%,核苷酸同源性仅为77.1%~78.2%;由此说明CMV-BZ属于CMV亚组I成员(表4)。
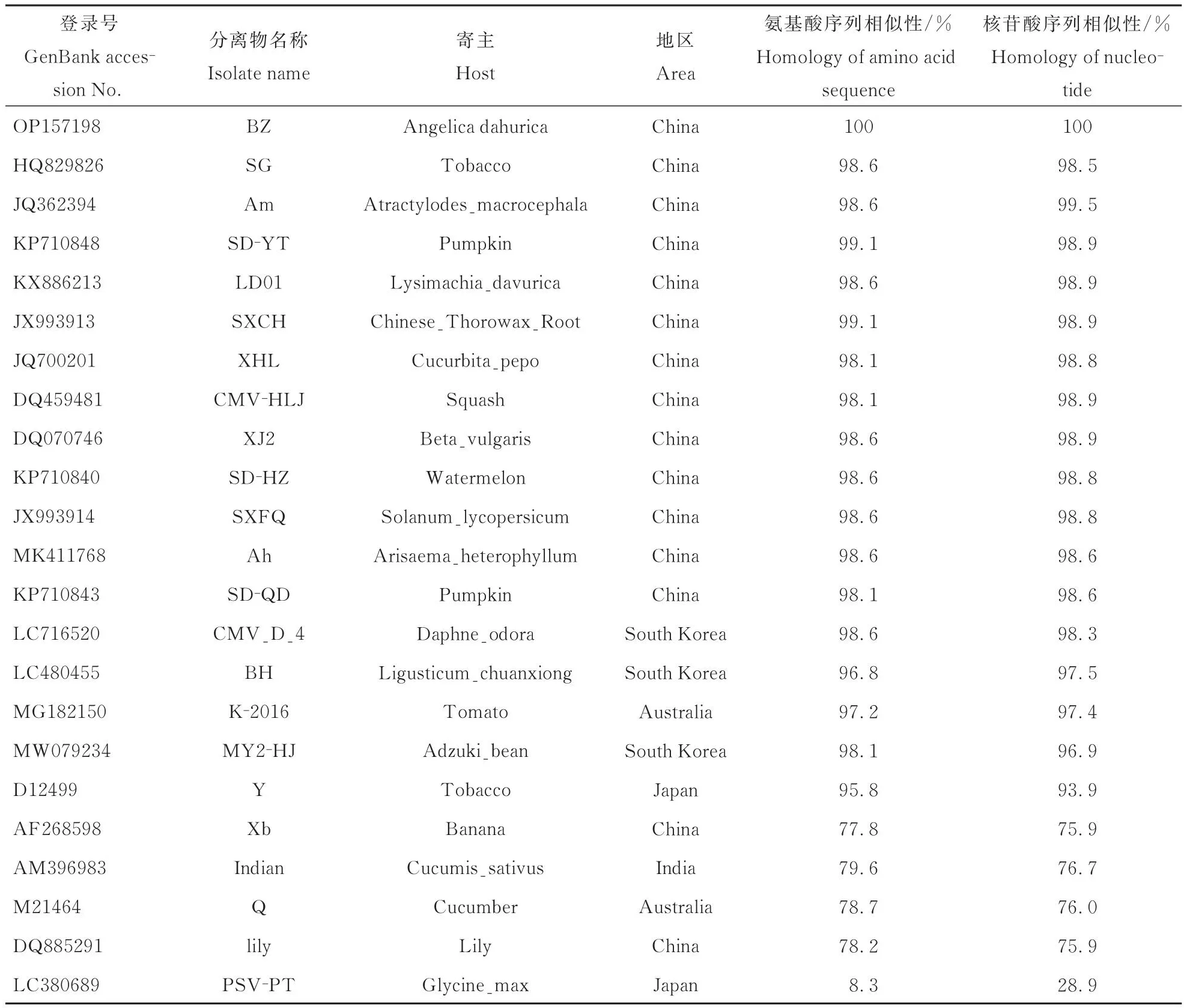
表3 CMV白芷分离物(CMV⁃BZ)CP与不同CMV分离物核苷酸和氨基酸序列的同源性分析Table 3 Homological analysis of nucleotide and amino acid sequences of CMV⁃BZ CP and different CMV isolates
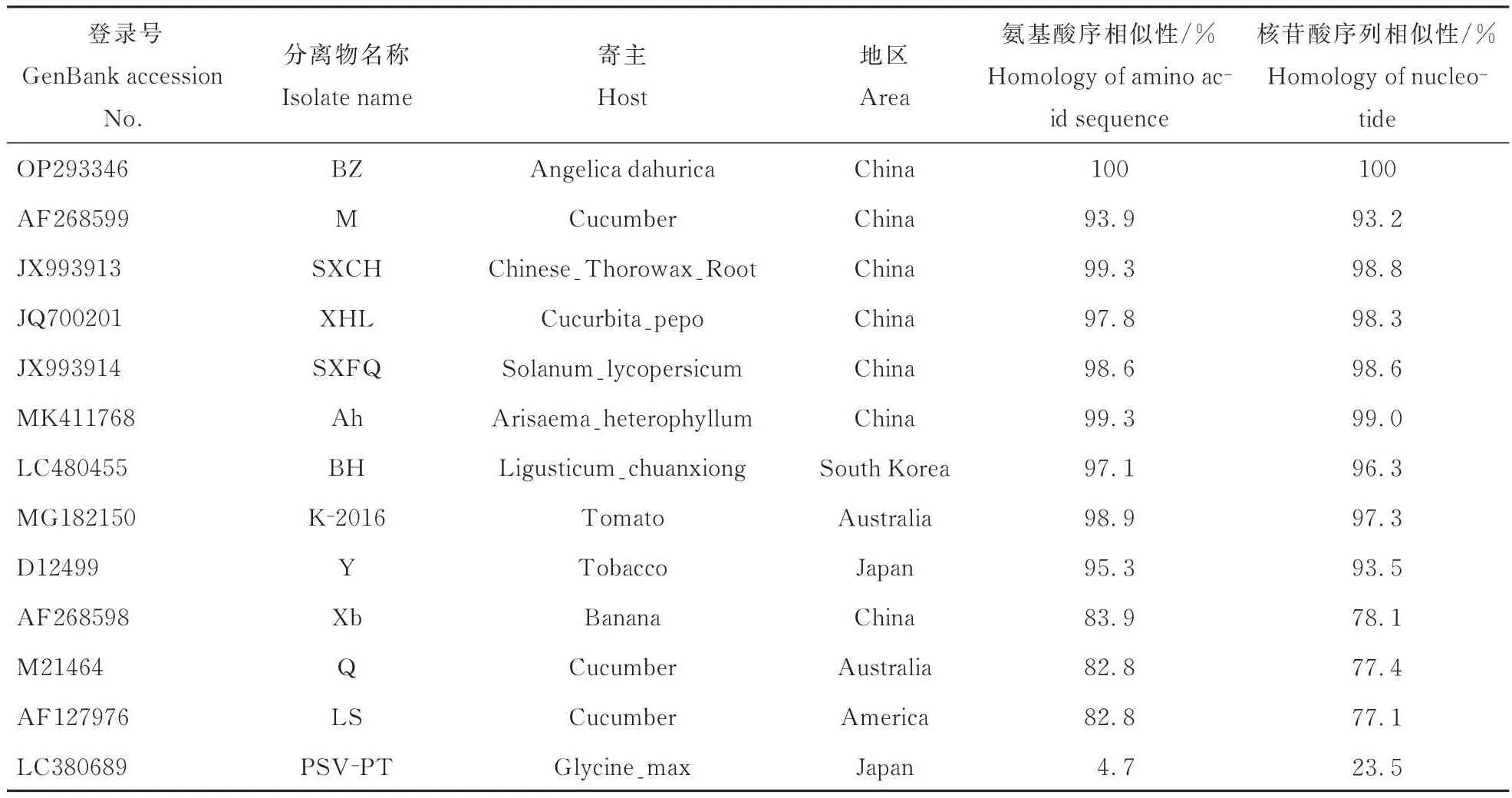
表4 CMV白芷分离物(CMV⁃BZ)MP与不同CMV分离物核苷酸和氨基酸序列的同源性分析Table 4 Homological analysis of nucleotide and amino acid sequences of CMV⁃BZ MP and different CMV isolates
2.4 CMV⁃BZ系统发育分析
为明确CMV白芷分离物(CMV-BZ)的分子进化关系,本研究采用MEGA 7.0软件对CMV白芷分离物(CMV-BZ)CP基因以及MP基因所编码的氨基酸序列,与已经报道的其它CMV不同分离物进行了系统发育进化分析(图4、图5)。结果显示,CMV白芷分离物(CMV-BZ)CP与CMV亚组I株系形成为一个分支,并且与同属于亚组I B中的CMV分离物SXCH和SD-YT亲缘关系最近,聚为一簇(图4);而CMV白芷分离物(CMVBZ)MP也同样与CMV亚组Ⅰ形成了单独的分支(图5),这些结果更进一步表明了CMV白芷分离物(CMV-BZ)属于CMV亚组Ⅰ成员。

图4 CMV白芷分离物(CMV-BZ)CP氨基酸系统发育分析Fig.4 Phylogenetic analysis of CMV-BZ CP amino acids
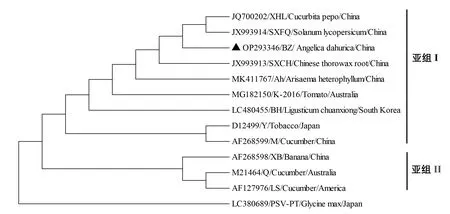
图5 CMV白芷分离物(CMV-BZ)MP氨基酸系统发育分析Fig.5 Phylogenetic analysis of CMV-BZ MP amino acids
3 讨论
高通量测序技术自从2009年首次在植物病毒检测中应用以来,已经从不同植物中鉴定出多种病毒或类病毒[9-10]。与传统的ELISA或PCR等病毒检测技术相比,高通量测序技术具有高效、通量高和非序列依赖性等特点[11]。Cheng等利用小RNA测序技术破解了大豆“症青”是由于一种新型的重组双生病毒-大豆症青相关病毒(Soybean stay⁃green associated virus,SoSGV)所致[12]。Coe⁃tzee等[13]对感病葡萄样品进行高通量检测,发现葡萄样品被葡萄A病毒(Grapevine virus A,GVA)、葡萄卷叶伴随病毒 3号(Grapevine leafroll⁃associ⁃ated virus 3,GLRaV-3)以及葡萄 E 病毒(Grape⁃vine virus E,GVE)复合侵染。Candresse等[14]通过高通量测序技术从甘蔗中检测到了埃及甘蔗线条病毒(Sugarcane streak Egypt virus,SSEV),同时还检测到1种新的双生病毒-甘蔗白条纹病毒(Sugarcane white streak virus,SWSV)。本研究利用小RNA深度测序技术和RT-PCR检测的方法对表现花叶、褪绿症状的白芷叶片进行病原鉴定,并且在山西晋中白芷上首次发现了黄瓜花叶病毒的侵染。将本论文中的外壳蛋白序列与北京白芷外壳蛋白分离物进行了氨基酸序列比对分析,发现二者的相似性极高,达到98.17%。此外,近年来在藿香、白术、太子参、百合、射干、虎杖等多种中药材上也发现了CMV的侵染[15-19]。
黄瓜花叶病毒属于雀麦花叶病毒科(Bromov⁃iridae)黄瓜花叶病毒属(Cucumovirus)成员,最初于感病的黄瓜和其它葫芦科植物上被发现[20]。CMV能够侵染100多个科1200多种植物,包括蔬菜、作物和花卉等单子叶植物和双子叶植物,是危害非常严重的一种植物病毒[21]。
CMV株系依据寄主范围及CP基因差异等不同特征,现被划分为亚组I和亚组II,而亚组I则又根据CMV RNA 3的5′端非编码序列的不同划分为亚组IA和亚组IB[22]。本研究对CMV白芷分离物(CMV-BZ)的CP基因核苷酸序列以及氨基酸序列进行系统发育进化分析表明,CMV-BZ属于CMV亚组IB成员。这与本课题组前期获得CMV-XHL分离物研究结果相似[8]。这是首次在山西发现白芷被CMV侵染,将为白芷病毒病防控提供一定参考依据。
4 结论
利用小RNA深度测序技术结合RT-PCR的方法,鉴定出造成山西农业大学药用植物园白芷花叶、褪绿等症状的病毒病种类为CMV,该分离物(CMV-BZ)属于CMV亚组IB成员,为白芷病毒病的防控提供了一定的理论依据。

