四川抗赤霉病小麦品种(系)抗病基因检测
邓清燕,罗江陶,郑建敏,万洪深,李式昭,杨漫宇,夏先全,蒲宗君
(1.四川省农业科学院作物研究所,成都 610066;2.农业农村部西南地区小麦生物学与遗传育种重点实验室,成都 610066;3.粮油作物绿色种质创新与遗传改良四川省重点实验室,成都 610066;4.四川省农业科学院植物保护研究所,成都 610066)
【研究意义】小麦是世界上种植面积最广的粮食作物。世界粮农组织统计数据显示目前全世界小麦种植面积超过2.19×108hm2,年产量超过7.6×108t。小麦作为最重要的粮食作物,遭受着多种生物和非生物胁迫,其中真菌病害是小麦生产面临的最严重威胁之一。小麦赤霉病(Fusariumhead blight, FHB)是由禾谷镰刀菌(F.graminearum)等多种镰刀菌引起的一种真菌病害,俗称小麦“癌症”,在流行年份造成小麦大面积减产并严重降低小麦籽粒质量。赤霉病主要侵染开花期的小麦穗部,在灌浆期迅速扩展繁殖,并在籽粒中产生多种毒素,包括脱氧雪腐镰孢菌烯醇(Deoxynivalenol, DON)、雪腐镰孢菌烯醇(Nivalenol, NIV)和玉米赤霉烯酮(Zearalenol, ZEN)等,严重威胁人畜健康[1]。我国赤霉病高发区主要分布于长江中下游麦区、南方沿海省份和东北春麦区等雨量充沛地区。但近二十年来,随着全球气候变暖以及耕作制度的变化,赤霉病逐渐呈现由传统病区北扩西移的趋势[2-3]。2012年小麦赤霉病严重爆发,全国危害面积超过1.00×107hm2,其中小麦主产区河南省达3.33×106hm2[4]。虽然西南麦区并非赤霉病的传统病区,但近年来受开花期阴雨暖湿气候及耕作方式等影响,赤霉病呈逐年加重的趋势。因此,加快抗赤霉病小麦的培育和推广是保障小麦安全生产最绿色有效的途径。【前人研究进展】赤霉病抗性基因/QTL的挖掘和研究是分子标记辅助选择抗病育种的遗传基础。小麦赤霉病抗病QTL广泛分布于小麦的21条染色体上,数量高达250多个[5]。目前,已被正式命名的主效基因有7个,其中Fhb1、Fhb2来源于苏麦3号和望水白[6-7],Fhb4、Fhb5来源于江苏溧阳的地方品种望水白[8-9],Fhb3、Fhb6和Fhb7分别来源于小麦的近缘种大赖草、披碱草及长穗偃麦草[10-12]。在众多抗病基因或QTL中,Fhb1的效应最大且抗性表现稳定,已被广泛用于赤霉病的抗性改良,且已育成一批抗性显著的小麦品种[13]。在7个主效基因中仅Fhb1和Fhb7已被克隆,其中Fhb1的候选基因编码一个富含组氨酸的钙结合蛋白His(Histidine rich calcium-binding protein,HRC),但His参与调控抗病的分子机制尚不清楚[14-15],Fhb7的候选基因编码谷胱甘肽转移酶(Gluthanione S-transferase, GST),功能研究表明,Fhb7编码的蛋白可作用于DON毒素的环氧基团催化形成谷胱甘肽加合物(DON-GSH)解除毒性,从而赋予小麦对赤霉病的抗性[16]。我国小麦赤霉病抗性育种起步于20世纪40年代,经过历代育种家的选育,培育出了苏麦3号、万年2号、望麦15、荆州1号等赤霉病中抗及以上的品种[2,17]。其中苏麦3号作为最优质的抗源之一已应用于全世界抗赤霉病育种中。利用抗性品种(系)作亲本进行抗病育种是最快速高效的育种方式。近年来,关于小麦赤霉病抗性鉴定和抗病基因检测的研究较多,但主要集中于长江中下游麦区和黄淮麦区。贾宝森等[18]采用单花滴注法鉴定198份长江中下游麦区和黄淮麦区小麦品种,获得中抗以上品种37个,其中含有Fhb1基因的品种33份。张煜等[19]利用土表接种法鉴定黄淮南部麦区762个品种(系),获得15个中抗赤霉病品种(系),其中11个含有Fhb1基因。徐婷婷等[20]利用单花滴注法对107份黄淮麦区小麦资源进行鉴定,并检测Fhb1、Fhb2、Fhb4、Fhb5抗病基因,获得的13个抗病品种携带1个或多个抗病位点。蒋正宁等[21]对202份扬麦品种(系)进行田间抗病鉴定和抗病位点检测,其中抗病品种(系)68份,携带Fhb1、Fhb2和QFhb-2DL位点的分别有37、30、39份。随着小麦基因组测序的完成,小麦抗赤霉病QTL及主效基因逐渐被精细定位和克隆,利用分子标记辅助选择育种成为现代育种的重要手段之一。张一铎等[22]通过分子标记辅助回交选育的方法,培育出聚合多个抗赤霉病基因的小麦新品系百农4299。但在大面积生产中,大面积丰产性和赤霉病抗性结合仍难以突破,仅在扬麦、宁麦和鄂麦等系列的少数品种表现较好[23],赤霉病抗性育种任重道远,利用抗赤霉病基因的分子标记辅助选育新品种或许会成为赤霉病抗性育种的新突破。【本研究切入点】四川盆地是我国小麦的重要生产区之一,具有寡日照,多阴雨,生态多样和种植制度多样等特点。近年来,随着赤霉病的北扩西移,四川盆地小麦赤霉病发病面积和发病态势逐年加重,严重限制了四川小麦种植面积的恢复和扩展。由于四川并非赤霉病的传统发病区,多年来缺乏系统的抗赤霉病育种研究,导致四川小麦育成推广品种赤霉病抗性普遍较差[24]。因此,培育适于大面积生产的小麦抗赤霉病新品种成为四川小麦育种家亟需解决的问题。【拟解决的关键问题】本研究鉴定出156份赤霉病中抗及以上的品种或高代品系,通过已有的抗赤霉病基因及部分抗条锈病和白粉病基因的分子标记检测,解析赤霉病抗性品种或高代品系中抗病基因的组成,为抗赤霉病的分子标记辅助育种提供参考。
1 材料与方法
1.1 供试材料
本研究所用的156份小麦材料包括13份四川省内育成品种和143份选育的高代品系,对照材料为苏麦3号。所有试验材料于2021年种植于成都试验点,经四川省农业科学院植物保护研究所鉴定,赤霉病达中抗及以上。赤霉病抗性基因检测的对照材料为聚合抗赤霉基因Fhb1、Fhb2、Fhb4、Fhb5的川麦64近等基因系,引自南京农业大学马正强教授课题组。
1.2 试验方法
1.2.1 赤霉病鉴定方法 本研究156份小麦赤霉病鉴定方法采用赤霉病土表接种法,参照《小麦品种抗赤霉病性田间鉴定技术规程》(DB51/T1680—2013),病圃设置在小麦赤霉病适发区,肥力、除草和播期与当地大田生产一致,各参试鉴定品种实行条播鉴定,每50~100份鉴定材料设置1组抗病、感病对照品种材料。鉴定小区每份材料播种1行,行长0.80 m,行距0.24~0.28 m,每隔10行设置1行诱发行,所有材料设置2次试验重复。小麦抽穗前30 d进行赤霉病土表接种,将制备好的病粒均匀撒于鉴定圃的小麦行间,接种后做好田间灌溉保持土壤水分。病情记载于材料乳熟中后期进行,并在1周后复查1次,计算发病麦穗的平均严重度。0级为无发病小穗;1级为零星小穗发病,发病小穗占总小穗数5%以下;2级为发病小穗占总小穗的5%~24%;3级为发病小穗占总小穗数25%~50%;4级为发病小穗占总小穗数50%以上。其中,严重度0为免疫;1级为高抗;2~4级且发病普遍率不高于20%时为中抗;3级且发病普遍率大于20%为中感;4级且发病普遍率大于20%为高感。
1.2.2 叶片基因组DNA的提取 室温培养小麦,取萌发1周后的幼苗叶片用于基因组DNA提取,提取方法采用SDS法[25]。提取的叶片总DNA溶解于100 μL TE溶液中,用NanoDrop2000超微量分光光度计检测DNA的浓度和质量,保存于-20 ℃冰箱备用。
1.2.3 PCR的扩增和电泳分析 PCR扩增采用15 μL体系,包括2×TaqPCR Mix(生工生物),20 ng DNA,每种引物0.5 μmol/L。扩增使用ABI基因扩增仪,扩增程序:94 ℃ 3 min;94 ℃ 30 s,50~60 ℃ 30 s,72 ℃ 40 s,36个循环;最后72 ℃延伸5 min。PCR产物在1.5%(w/v)的琼脂糖凝胶或8%的聚丙烯酰胺凝胶上进行电泳分析。
1.2.4 分子标记 赤霉病抗性基因Fhb1、Fhb2、Fhb4、Fhb5的分子标记采用南京农业大学马正强教授团队提供的引物,其中抗赤霉病基因Fhb1的分子标记为诊断性标记,Fhb2、Fhb4、Fhb5的分子标记为紧密连锁的SSR标记。抗条锈病基因Yr5、Yr15、Yr18、Yr26、YrAs2388和抗白粉病基因Pm21的分子标记来自于文献报道。所有引物的详细信息如表1所示,引物的合成委托生工生物公司完成。
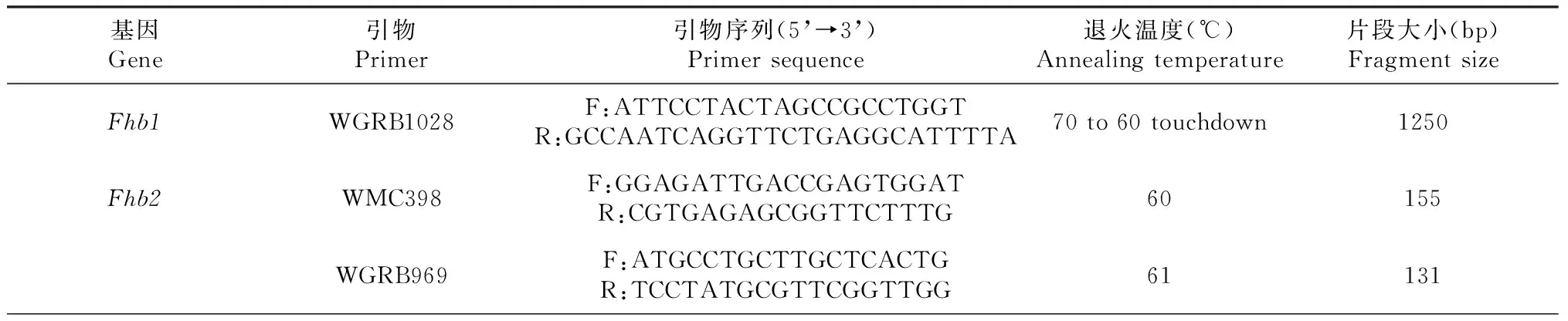
表1 用于检测小麦抗性基因的分子标记信息Table 1 Molecular marker information for detection of wheat resistance genes

续表1 Continuedtable 1
2 结果与分析
2.1 赤霉病抗性的鉴定和抗性基因Fhb1、Fhb2、Fhb4和Fhb5分子检测结果
通过四川目前流行的赤霉病混合菌种对收集的小麦品种(系)进行土表病粒接种,于乳熟中后期进行病情调查。鉴定结果显示有156份小麦材料对赤霉病表现中抗,无免疫和高抗的品种(系)。为明确156份中抗品种(系)中是否存在已知抗赤霉病基因,利用抗性基因Fhb1、Fhb2、Fhb4、Fhb5的共8个分子标记对其进行分子标记扩增(图1~2),阳性对照为川麦64近等基因系。Fhb1基因的诊断性标记WGRB1028仅在高代品系20引979中扩增出1.25 kb的目标条带,Fhb5的紧密连锁标记MAG9482和WMC752在高代品系20间2506-10中扩增出与对照相同的条带。在供试的156份赤霉病中抗材料中仅有2份含有已知赤霉病抗性基因,说明四川小麦种质中缺乏已知赤霉病抗性基因,后续的育种工作要加强赤霉病抗性基因的导入。

M:Trans2K DNA Marker;1:绵麦904;2:绵麦908;3:蜀蓝麦171;4:绵糯麦2号;5:中梁22;6:西科麦11;7:绵麦318;8:川麦83;9:蜀麦1743;10:川育35;11:川辐19;12:川育32;13:蜀麦1871;14:20引705;15:20引706;16:20引978;17:20引979;18:20引1113;19:20引1114;20:20引1115;21:20引1118;22:18051-1;23:H2017;24:川麦64(Fhb1+2+4+5)。箭头指示的为目标条带。M:Trans2K DNA Marker; 1:Mianmai 904; 2:Mianmai 908; 3:Shulanmai 171; 4:Miannuomai 2; 5:Zhongliang 22; 6:Xikemai 11; 7:Mianmai 318; 8:Chuanmai 83; 9:Shumai 1743; 10:Chuanyu 35; 11:Chuanfu 19; 12:Chuanyu 32; 13:Shumai 1871; 14:20 yin 705; 15:20 yin 706; 16:20 yin 978; 17:20 yin 979; 18:20 yin 1113; 19:20 yin 1114; 20:20 yin 1115; 21:20 yin 1118; 22:18051-1; 23:H2017; 24:Chuanmai 64(Fhb1+2+4+5).Arrow indicates the target band.图1 Fhb1扩增部分供试小麦品种(系)Fig.1 Amplification of Fhb1 in some tested wheat varieties(lines)
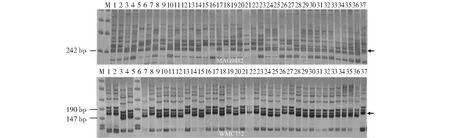
M:Trans2K DNA Marker;1:绵麦904;2:绵麦908;3:蜀蓝麦171;4:绵糯麦2号;5:中梁22;6:西科麦11;7:绵麦318;8:川麦83;9:蜀麦1743;10:川育35;11:川辐19;12:川育32;13:蜀麦1871;14:20引705;15:20引706;16:20引978;17:20引979;18:20引1113;19:20引1114;20:20引1115;21:20引1118;22:18051-1;23:H2017;24:H2018;25:H2006;26:H2020;27:203137;28:21195;29:21205;30:21207;31:21210;32:21226;33:21229;34:21230;35:21233;36:21235;37:川麦64(Fhb1+2+4+5)。箭头指示的为目标条带。M:Trans2K DNA Marker; 1:Mianmai 904; 2:Mianmai 908; 3:Shulanmai 171; 4:Miannuomai 2; 5:Zhongliang 22; 6:Xikemai 11; 7:Mianmai 318; 8:Chuanmai 83; 9:Shumai 1743; 10:Chuanyu 35; 11:Chuanfu 19; 12:Chuanyu 32; 13:Shumai 1871; 14:20 yin 705; 15:20 yin 706; 16:20 yin 978; 17:20 yin 979; 18:20 yin 1113; 19:20 yin 1114; 20:20 yin 1115; 21:20 yin 1118; 22:18051-1; 23:H2017; 24:H2018; 25:H2006; 26:H2020; 27:203137; 28:21195; 29:21205; 30:21207; 31:21210; 32:21226; 33:21229; 34:21230; 35:21233; 36:21235; 37:Chuanmai 64 (Fhb1+2+4+5).Arrow indicates the target band.图2 Fhb5紧密连锁的分子标记扩增部分供试小麦品种(系)Fig.2 Amplification of Fhb5-linked molecular markers in some tested wheat varieties(lines)
2.2 抗锈病基因Yr5、Yr15、Yr18、Yr26和YrAs2388的分子检测结果
为了便于赤霉病抗性材料的育种应用,分别以抗锈病基因Yr5、Yr15、Yr18、Yr26和YrAs2388的分子标记扩増供试的156份赤霉病抗性小麦材料,检测抗条锈病基因的组成(图3)。利用Yr5基因的特异标记扩增156份供试材料,结果仅在4份材料中检测出100 bp的阳性条带,占供试材料的2.56%。而利用Yr15的特异标记在63份材料中检测出993 bp的阳性条带,占供试材料的频率高达40.38%。此外,在9份材料中检测出Yr18基因,在3份材料中检测出Yr26基因,分别占供试材料的5.77%和1.92%。在14份材料中检测出YrAs2388基因,占供试材料的8.97%。说明,除Yr15基因的分布频率较高外,其余抗条锈病基因在供试材料中的分布频率均较低。
2.3 抗白粉病基因Pm21分子检测结果
小麦抗白粉病基因Pm21是目前应用最广的广谱抗性基因。本研究利用抗白粉病基因Pm21的分子标记扩增156份供试材料,以绵麦60为阳性对照(图3)。扩增结果显示,44份材料扩增出477 bp的阳性条带,占供试材料的28.21%,说明抗白粉病基因Pm21在供试材料中的分布较广泛。

M:Trans2K DNA Marker;1:H2006;2:H2020;3:203137;4:21195;5:21205;6:21207;7:21210;8:21226;9:21229;10:21230;11:21233;12:21235;13:21PL4998;14:21PL5027;15:21PL5028;16:21PL5037;17:21PL5039;18:21PL5040;19:21PL5061;20:21PL5062;21:21PL5067;22:21PL5076;23:21PL5080;24:21PL5084;25:绵麦904;26:绵麦908;27:蜀蓝麦171;28:绵糯麦2号;29:中梁22;30:西科麦11;31:绵麦318;32:川麦83;33:蜀麦1743;34:川育35;35:川辐19;36:川育32;箭头指示的为目标条带。M:Trans2K DNA Marker; 1:H2006;2:H2020; 3:203137; 4:21195; 5:21205; 6:21207; 7:21210; 8:21226; 9:21229; 10:21230; 11:21233; 12:21235; 13:21PL4998; 14:21PL5027; 15:21PL5028; 16:21PL5037; 17:21PL5039; 18:21PL5040; 19:21PL5061; 20:21PL5062; 21:21PL5067; 22:21PL5076; 23:21PL5080; 24:21PL5084; 25:Mianmai 904; 26:Mianmai 908; 27:Shulanmai 171; 28:Miannuomai 2; 29:Zhongliang 22; 30:Xikemai 11; 31:Mianmai 318; 32:Chuanmai 83; 33:Shumai 1743; 34:Chuanyu 35; 35:Chuanfu 19; 36:Chuanyu 32.Arrow indicates the target band.图3 部分品种(系)中白粉病和条锈病基因检测Fig.3 Detection of powdery mildew and stripe rust genes in some tested wheat varieties(lines)
2.4 抗病基因的组成
通过赤霉病、条锈病和白粉病的抗病基因的分子标记检测,在156份供试材料中共有122份材料检测出含有至少1个抗病基因(表2)。其中,20间2506-10同时含有赤霉病、条锈病和白粉病3种抗病基因。此外,共检测出6个材料含有条锈病和白粉病2种抗病基因,9个材料中聚合了2个抗条锈病基因,剩余的106份材料仅含有1个抗病基因(图4)。以上结果为今后抗病基因的聚合育种提供理论基础。
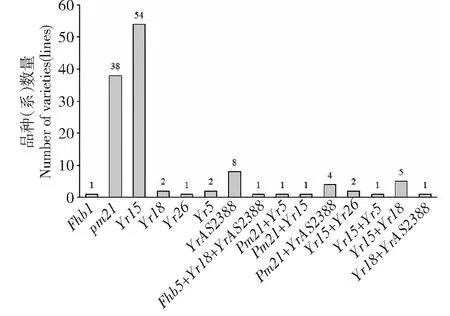
图4 156份供试品种(系)中抗病基因的分布Fig.4 Distribution of resistance genes in 156 tested wheat varieties(lines)
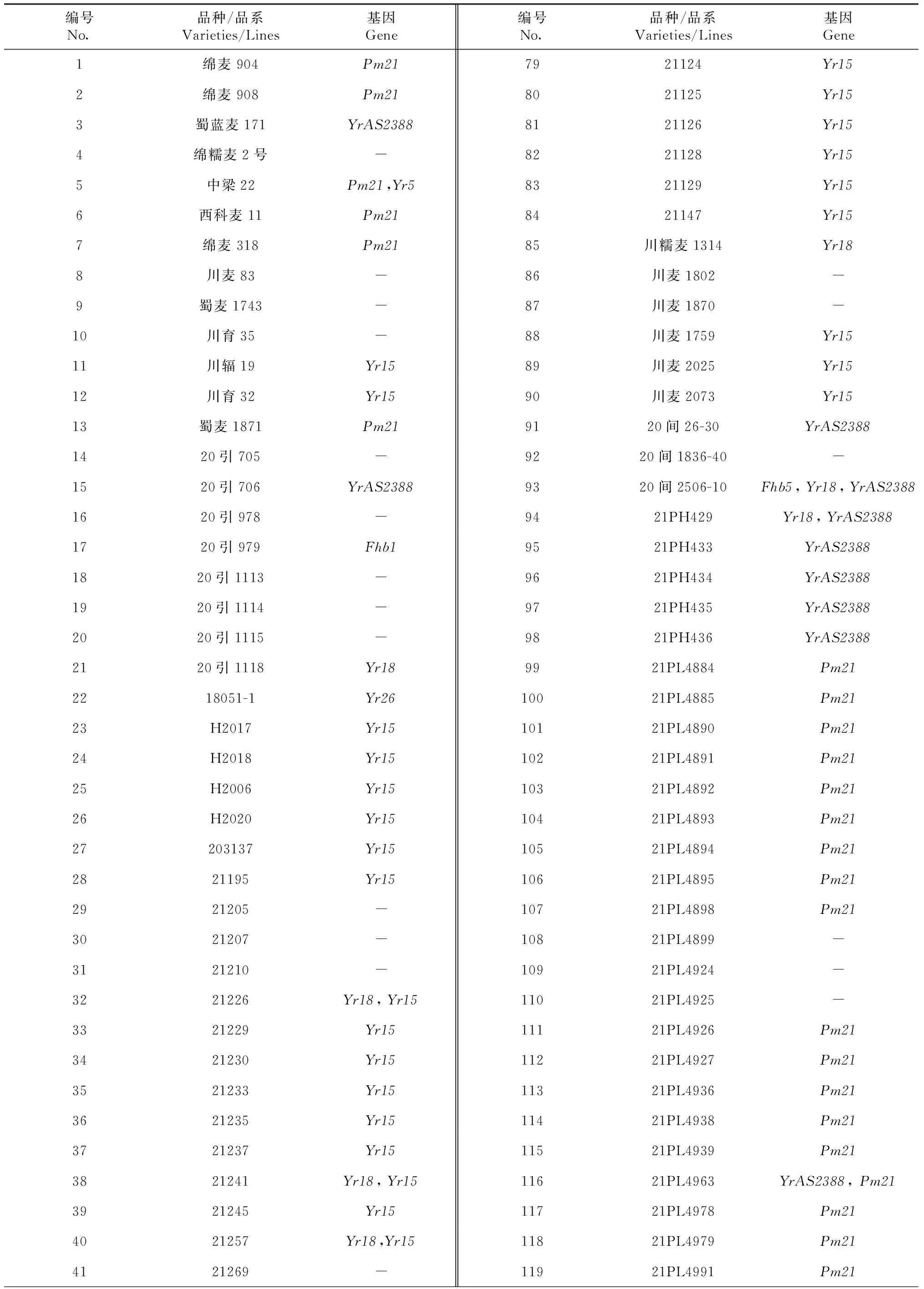
表2 156份小麦赤霉病抗性品种(系)抗病基因检测Table 2 Detection of resistance genes in 156 FHB resistant wheat varieties(lines)
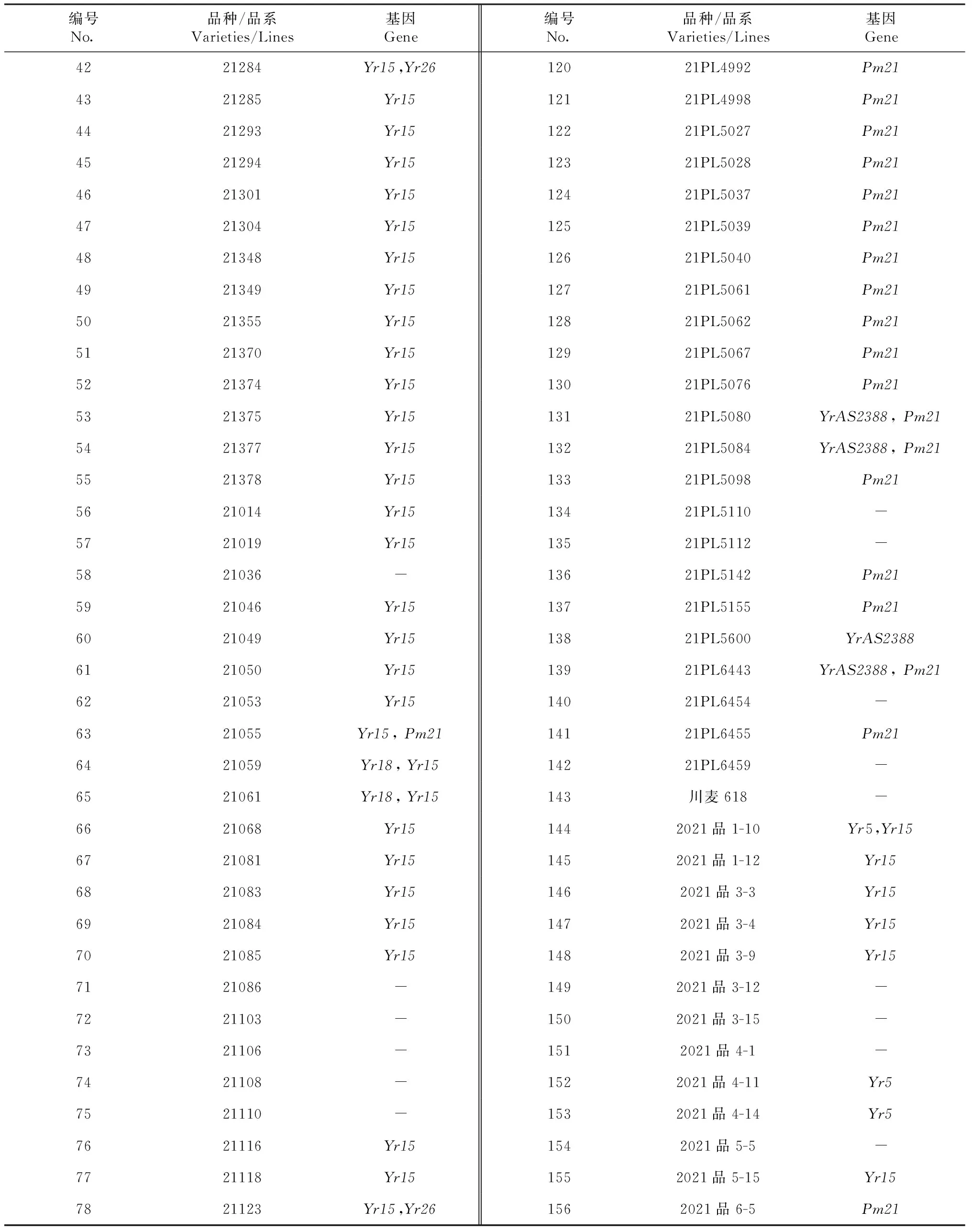
续表2 Continuedtable 2
3 讨 论
3.1 四川小麦赤霉病抗性基因与抗性育种
四川作为条锈病的重发区及白粉病的常发区,多年的抗性育种主要围绕条锈病和白粉病的抗性展开,而未重视抗赤霉病小麦的培育,故四川小麦品种大多缺乏赤霉病抗性。本研究通过土表接种法鉴定获得了156份小麦赤霉病中抗的品种或高代品系。经过抗赤霉病基因Fhb1、Fhb2、Fhb4和Fhb5的分子标记检测,共发现2份材料分别含已知抗病基因Fhb1和Fhb5,其余154份材料的赤霉病抗性的遗传组成尚不清晰。分析其原因,一方面由于四川并非赤霉病的传统病区,缺乏自然选择压,四川小麦缺乏自然抗病变异。另一方面由于缺乏自然和人工选择,近几十年四川在引进外来小麦品种进行新品种培育的过程中可能丢失了一些已知赤霉病抗性的主效基因。
随着四川小麦赤霉病发病逐年加重,四川小麦育种愈发重视抗赤霉病品种的培育。利用四川现有的抗病基因资源进行新品种培育是最便捷有效的方法。然而,关于四川小麦赤霉病抗性鉴定和抗病位点检测的研究相对较少。张华等[32]对153份四川主推品种和后备品系抗病基因检测发现,可能携带Fhb1的材料仅为12份,但该研究缺少赤霉病的田间鉴定结果。本研究通过田间抗病鉴定获得的156份赤霉病中抗材料,并利用赤霉病抗性基因Fhb1、Fhb2、Fhb4和Fhb5的分子标记进行检测,明确了供试四川小麦品种(系)的赤霉病抗病性和抗病基因的组成,可直接应用于抗病品种的培育和赤霉病抗性改良。但本研究的抗病鉴定采用的土表接种法可能存在接种效果不佳和花期错过发病高峰期等缺点,并且只收集了1年的接种鉴定数据,所以可能导致某些品种(系)的抗性表型不准确。因此,引进赤霉病高发区的抗病品种进行新品种培育是另一个主要的途径。
3.2 四川小麦抗病基因组成
为了明确156份赤霉病中抗材料中抗条锈病和白粉病基因的组成,以便为后续的抗性育种应用提供遗传依据。小麦抗白粉病基因是来自小麦近缘种簇毛麦的广谱抗性基因[33]。利用Pm21基因育成了扬麦系列、镇麦系列及绵麦系列等多个抗白粉病品种[34]。供试材料中含有抗白粉病基因Pm21材料的比例较高,说明供试的材料不仅具有赤霉病抗性,同时部分材料兼具白粉病抗性。
四川是小麦条锈病菌源的冬繁区和新小种的策源地之一[35]。四川小麦品种审定过程中,条锈病的抗性评价实行一票否决制。因此,四川品种都具有较好的条锈病抗性。分子标记检测发现,供试材料中75%的品种(系)检测出了已知抗条锈病基因,其中抗条锈病基因Yr15的应用最广。余下的25%也可能含有其他未检测的抗病基因。前人研究发现,Yr15是来自野生二粒小麦的广谱抗性基因,在小麦的全生育期对当前流行的条锈菌小种表现较好的抗性[28,36],育种应用价值大,要继续保持广谱抗性基因Yr15的应用。然而过度依赖某一抗性基因,长期使用单一品种,将导致对新产生的变异毒性小种丧失抗性[37]。所以应该加强与成株期抗条锈病基因Yr18和YrAS2388以及仍具有抗性的全生育期抗性基因Yr5聚合应用。
4 结 论
本研究通过土表接种法鉴定了赤霉病中抗品种(系)156份,利用已知抗赤霉病基因Fhb1、Fhb2、Fhb4和Fhb5的分子标记检测赤霉病抗性的来源,仅在高代品系20引979中检测出Fhb1基因,高代品系20间2506-10中检测出Fhb5基因。同时,为了更好地应用这些赤霉病抗性材料进行抗病育种,检测了部分主要应用的抗条锈病基因和抗白粉病基因。在156份赤霉病抗性材料中检测出抗白粉病基因Pm21占供试材料的28.21%,抗条锈病基因占供试材料的75%,其中Yr15的分布最广,占供试材料的频率达40.38%。本研究为四川小麦赤霉病的抗病育种提供了遗传理论依据。

