温肾醒脾化浊方对慢性肾功能衰竭模型肾损伤干预机制的研究*
顾茜兰,吴敏曼,朱 丹,祁 燕,司怡然,徐 莹,万春平
(云南中医药大学第一临床医学院,云南 昆明 650021)
慢性肾功能衰竭(chronic renal failure,CRF)是由多种慢性肾脏疾病发展至晚期引起的肾小球滤过率下降(GFR<90 mL/min)以及肾脏其他功能损害,导致体内代谢产物潴留、酸碱平衡失调和水电解质代谢紊乱等临床症状组成的综合征[1]。该病复杂多变,已成为医学领域面临的重大挑战。中医治疗作为延缓慢性肾衰竭进程的非透析疗法逐渐引起人们的重视[2-3]。
中医学认为慢性肾功能衰竭属久病入络,多因肾病日久,脾运失调,浊毒不化所致,治疗原则通常以补肾健脾、通络降浊为法[4-5]。温肾醒脾化浊方由大黄、炒草果仁、黄芪等16 味中药组成,该方具有温肾健脾、补肾固精、扶正祛邪、解毒化浊等功效,临床广泛应用于慢性肾功能衰竭的治疗。临床观察显示,血肌酐在300 mmol/L 以内的慢性肾衰患者治疗有效率达80%。然而,目前尚未明确温肾醒脾化浊方治疗CRF的作用机制,因此有必要进一步研究。
肾纤维化(renal fibrosis) 是所有慢性肾病(chronic kidney disease,CKD)发展至终末期的共同途径[6],其病变主要以肾小球硬化与肾小管萎缩为主要病理表现,炎性细胞浸润、上皮细胞转化成纤维细胞、细胞外基质(extracellular matrix,ECM)过度积累共同参与了肾纤维化的发病机制[7]。基于此,本研究拟通过建立慢性肾衰竭大鼠模型,以肾纤维化为切入点,旨在揭示温肾醒脾化浊方防治和延缓慢性肾衰竭作用的效应机制,为温肾醒脾化浊方临床应用于治疗慢性肾功能衰竭提供科学基础。
1 材料与仪器
1.1 实验动物 SPF 级SD 正常大鼠41 只,雌性,7~8 周龄,体质量200~250 g,购自斯贝福(北京)生物技术有限公司,合格证号:SCXK(京)2019-0010;动物饲养在SPF 级动物房,实验动物最少饲养1 周后使用。温度(22±1)℃,湿度55%±5%,12 h 光暗循环。饲料、水均在消毒后由动物自由摄取。所有实验均严格按照实验动物相关条例进行。
1.2 主要药物与试剂 注射用盐酸多柔比星即盐酸阿霉素(深圳万乐药业有限公司,国药准字H44024359,批号:2101E1);尿酸检测试剂盒、尿素氮检测试剂盒和肌酐检测试剂盒(罗氏诊断公司,批号分别为:53538501、53860001、53423001);SYBR Premix Ex Taq Ⅱ染料(大连Takara,批号:RR820A);逆转录试剂盒(大连Takara,批号:RR036A);Trizol 裂解液(天根生化(北京)科技有限公司,批号:RK145)。
1.3 主要仪器 酶标仪购自美国Molecular Devices公司;离心机购自德国贺利氏仪器公司;PCR 基因扩增仪购自美国ABI 公司;全自动生化仪购自美国罗氏公司;荧光定量PCR 仪购自美国Aglient 公司;NANODROP 2 000 核酸蛋白检测仪购自美国Thermo公司。
2 方法及评价
2.1 受试药物浸膏的制备 温肾醒脾化浊方由大黄、炒草果仁、黄芪等16 味中药组成,由云南中医药大学第一附属医院中药房提供,称取配方中药材1 940.4 g,粉碎、浸泡30 min 及以上,加入生药体积10 倍、8 倍和6 倍的饮用水,各煎煮3 次,过滤,合并滤液,浓缩,旋转蒸发浓缩成浸膏,浸膏938.3 g,折合成浸膏,1 g 浸膏中相当于含2.1 g 生药,置于4℃冰箱中保存,备用。
2.2 肾功能衰竭大鼠模型的建立、分组及给药 选取41 只SPF 级健康成年雌性SD 大鼠,随机分成5组,即正常组、模型组、温肾醒脾化浊方低剂量组(1.49 g/kg)、中剂量组(2.98 g/kg)和高剂量组(5.95 g/kg)。采用1 次性尾静脉注射盐酸阿霉素构建肾功能衰竭大鼠模型,具体方法如下:造模大鼠按照6 mg/kg 剂量经尾静脉1 次性注射盐酸阿霉素,正常组大鼠经尾静脉1 次性注射等体积生理盐水。于造模当天开始给药,温肾醒脾化浊方低、中、高剂量组分别灌胃给予温肾醒脾化浊方1.49g/kg、2.98g/kg 和5.95 g/kg,1 次/d,连续灌胃27 d。
2.3 指标检测
2.3.1 CRF 大鼠24 h 尿蛋白检测 观察点时,大鼠禁食但不禁水,采用代谢笼收集24 h 尿液,记录尿量后取1 mL,离心去除沉淀,参照考马斯亮蓝G-250法测定尿蛋白,检测方法如下:标准品和离心后尿液加入96 孔板中后再加入200 μL 稀释考马斯亮蓝工作液,室温放置5 min,酶标仪595 nm 测定OD 值,计算各组大鼠24 h 尿蛋白含量。
24 h 尿蛋白含量=检测值×尿量
2.3.2 CRF 大鼠血清肾功能生化指标检测 末次给药后,按5 mg/100 g 体质量,腹腔注射戊巴比妥钠麻醉大鼠,腹主动脉取血,3 000 r/min,离心15 min,分离血清,采用全自动生化分析仪测定血清尿素氮(BUN)、肌酐(Scr)和尿酸(UA)水平。
2.3.3 H&E 染色检测肾脏的病理损伤程度 处死后,用生理盐水主动脉灌注后,右肾脏横切一半,放于10%福尔马林固定,用于病理组织切片检测。H&E 染色如下:将固定好的肾组织通过75%、85%、95%、100%浓度梯度乙醇进行脱水,二甲苯透明,石蜡包埋,切成4 μm 薄片,苏木素-伊红(H&E)染色,封片,光学显微镜下观察肾脏组织病理损伤程度。
2.3.4 Real-time PCR 检测肾纤维化相关基因mRNA 表达水平 分析天平称取50 mg 肾组织,加入1 mL Trizol 裂解液,用匀浆器冰上匀浆,采用Trizol 试剂盒抽提总RNA,然后将总RNA 定量为1 000 ng。RT-PCR 法逆转成cDNA,取同1 个cDNA 为模板,按实时定量PCR 试剂盒说明书,以GAPDH 为内参基因,进 行TGF-β1、MMP-9、Col4a2R、Fn1、TIMP-1 mRNA 表达检测,结果以Ct 值显示。目的基因表达的相对差异量用2-△△Ct法进行统计分析。特异基因引物序列如下:

2.4 数据处理 数据统计分析采用SPSS 17.0 软件,数据采用均数±标准差(±s)表示,若方差齐,组间比较采用单因素方差分析(ANOVA)统计,若方差不齐,采用LSD 法分析,统计结果P<0.05、P<0.01、P<0.001 为差异有统计学意义。
3 结果
3.1 一般情况观察 与正常组比较,模型组大鼠出现行动迟缓,精神状态较萎靡等状况,并出现死亡情况,取肾脏并进行观察,发现与正常组比较,模型组大鼠肾脏体积明显增大,肾脏包膜泛白,皮质变薄;与模型组比较,温肾醒脾化浊方干预组行动、精神状态均有所改善,未出现死亡情况,肾脏体积减少。
3.2 温肾醒脾化浊方对CRF 大鼠24 h 尿蛋白含量和肾体质量的影响 与正常组比较,病理模型组大鼠24 h 尿蛋白、尿体积、肾体质量、肾脏指数显著增加,差异具有统计学意义,提示肾功能衰竭大鼠模型制备成功。与模型组比较,温肾醒脾化浊方低、中和高剂量组24 h 尿蛋白、尿液含量剂量依耐性地减少,其中,中、高剂量组差异具有统计学意义。温肾醒脾化浊方药物干预显著抑制CRF 大鼠肾体质量、肾脏指数;提示温肾醒脾化浊方对CRF 具有较好的疗效。见表1。
表1 温肾醒脾化浊方对肾功能衰竭大鼠24 h 尿蛋白含量和肾体质量的影响(±s)
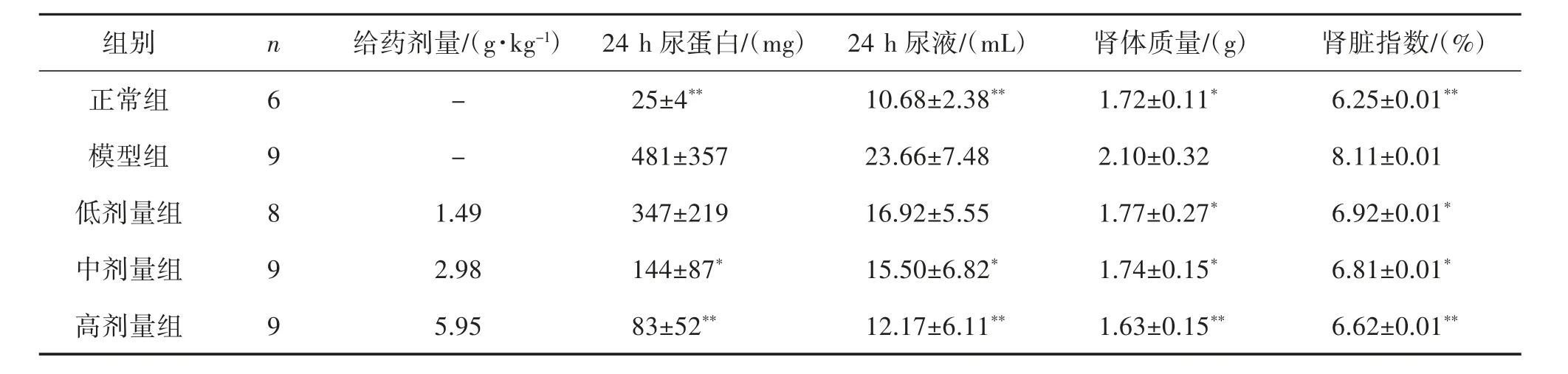
表1 温肾醒脾化浊方对肾功能衰竭大鼠24 h 尿蛋白含量和肾体质量的影响(±s)
注:与模型组比较,*P<0.05,**P<0.01。
?
3.3 温肾醒脾化浊方对CRF 大鼠肾功能的影响 肾功能检测结果显示,与正常组大鼠比较,模型组大鼠血清肌酐、尿素氮和尿酸水平显著升高,差异具有统计学意义。与模型组比较,温肾醒脾化浊方低、中、高剂量组肌酐剂量依耐性地减少,其中,中、高剂量组差异具有统计学意义;温肾醒脾化浊方各剂量干预后,显著减少尿素氮的产生,其中,低、高剂量组差异具有统计学意义;温肾醒脾化浊方各给药组血清尿酸水平低于模型组,差异具有统计学意义;提示温肾醒脾化浊方对慢性肾功能衰竭具有显著的肾功能保护效应。见表2。
表2 温肾醒脾化浊方对肾功能衰竭大鼠肾功能指标的影响(±s)
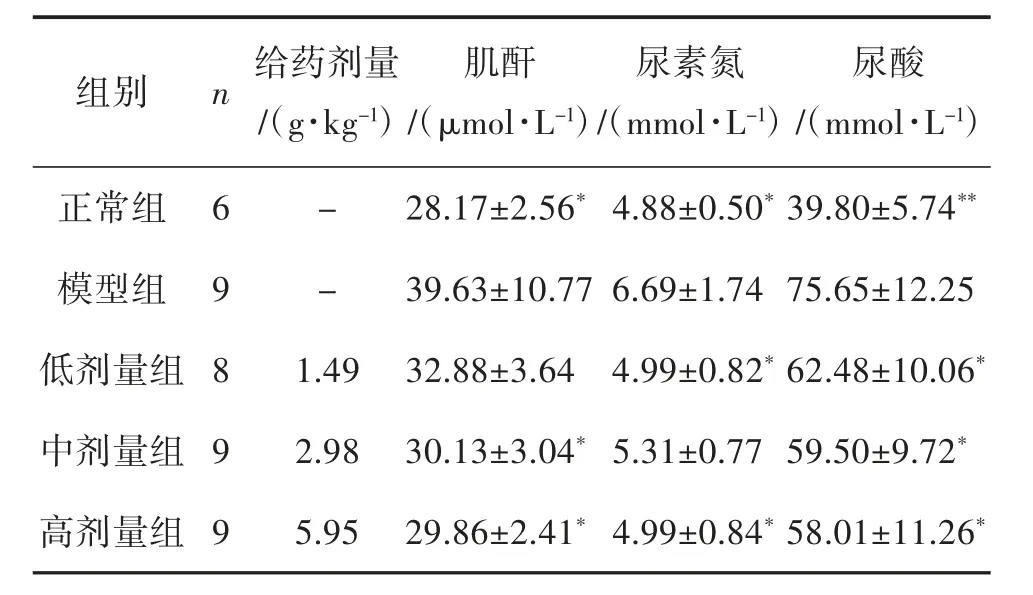
表2 温肾醒脾化浊方对肾功能衰竭大鼠肾功能指标的影响(±s)
注:与模型组比较,*P<0.05,**P<0.01。
尿酸/(mmol·L-1)正常组 6 - 28.17±2.56* 4.88±0.50* 39.80±5.74**模型组 9 - 39.63±10.77 6.69±1.74 75.65±12.25低剂量组 8 1.49 32.88±3.64 4.99±0.82* 62.48±10.06*中剂量组 9 2.98 30.13±3.04* 5.31±0.77 59.50±9.72*高剂量组 9 5.95 29.86±2.41* 4.99±0.84* 58.01±11.26*组别 n给药剂量/(g·kg-1)肌酐/(μmol·L-1)尿素氮/(mmol·L-1)
3.4 温肾醒脾化浊方对CRF 大鼠肾脏组织病理损伤的影响 H&E 染色结果可见,正常组大鼠肾小球和肾小管排列整齐、形态完整,间质无明显的炎性细胞浸润与纤维病变;肾功能衰竭大鼠肾小管排列无规则、出现不同程度的扩张,伴有大量棕褐色代谢产物沉积,肾小球变形萎缩,数量减少,肾间质大量炎性浸润,伴纤维化增生。温肾醒脾化浊方各剂量组干预后,CRF 大鼠肾组织的炎性浸润、纤维化增生以及肾小球变形萎缩等病变均有所改善。见图1。
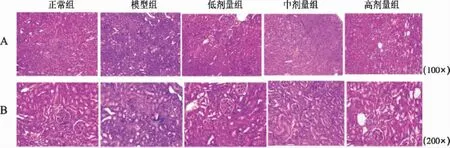
图1 温肾醒脾化浊方对CRF 大鼠肾脏组织病理变化的影响
3.5 温肾醒脾化浊方对CRF 大鼠肾组织纤维化信号通路相关基因转录表达的影响 为进一步揭示温肾醒脾化浊方对CRF 大鼠肾纤维化通路的影响,我们以最有效剂量温肾醒脾化浊方高剂量与模型组进行比较,采用荧光定量PCR 技术检测肾纤维化信号通路相关基因mRNA 表达情况。结果显示,与病理模型组比较,温肾醒脾化浊方高剂量组肾组织TGFβ1、Fn1、TIMP-1、Col4a2R mRNA 显著下调,差异具有统计学意义,而MMP-9 mRNA 表达明显上调,MMP-9/TIMP-1 比值显著增加,差异均具有统计学意义。见图2。
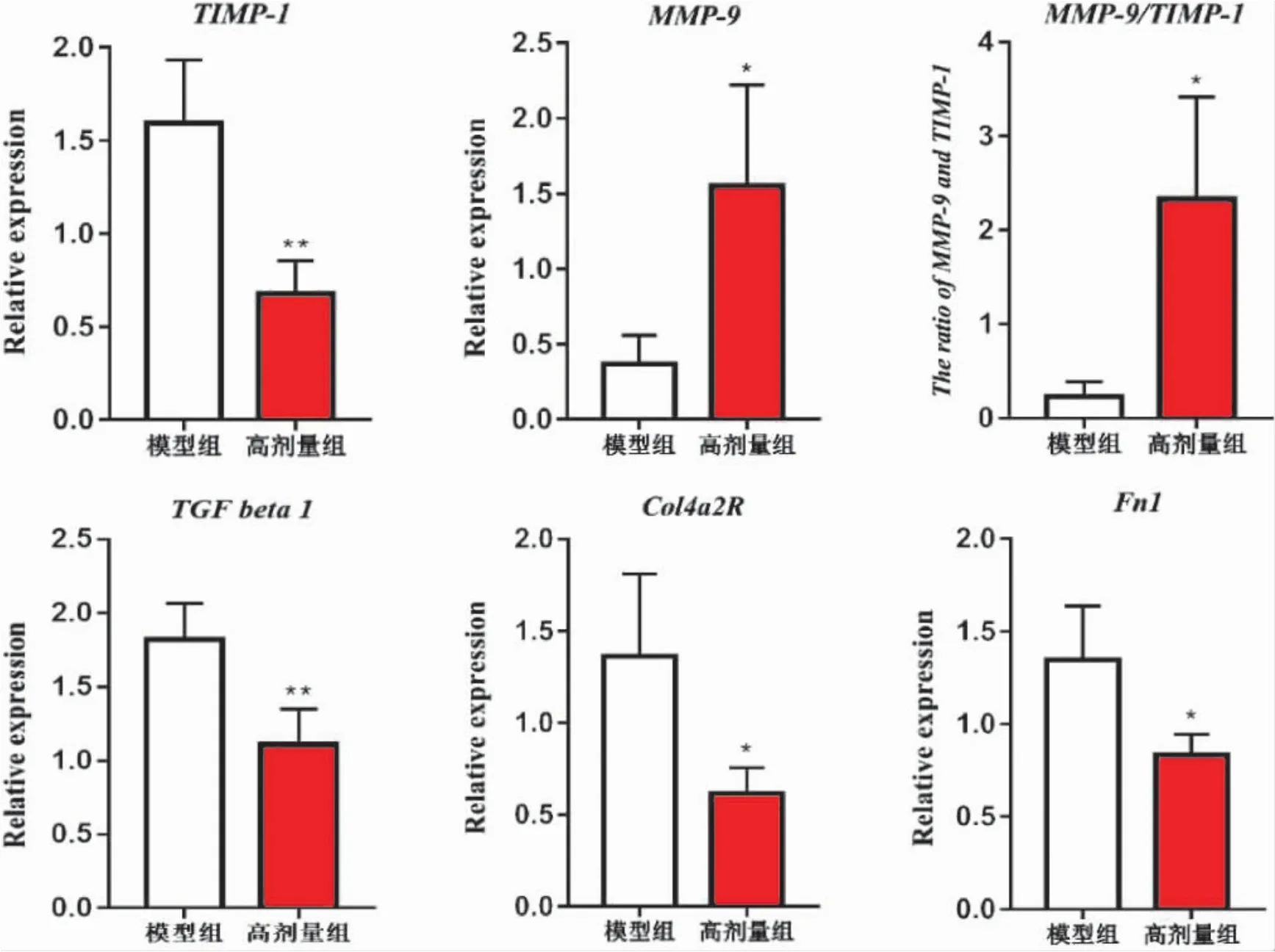
图2 温肾醒脾化浊方对CRF 大鼠肾组织肾纤维化信号通路相关基因转录表达的影响
4 讨论
阿霉素肾病大鼠是一种经典的慢性肾脏病模型,主要早期表现为肾小球微小病变,而后期表现为肾小球局灶阶段性硬化为主,最终导致肾间质纤维化和慢性肾功能衰竭,伴有尿蛋白、肌酐和尿素氮明显异常[8]。其发病临床表现和病理特征与临床慢性肾病的病理特征极为相似,具有模型方法简便、病变稳定、发病率高、观察指标改变明显等优点。因此是研究慢性肾病理想的疾病动物模型。利用此模型,本研究采用一次尾静脉注射阿霉素诱导建立慢性肾衰竭大鼠模型,研究温肾醒脾化浊方对慢肾衰大鼠24 h 尿蛋白和肾功能的影响。H&E 染色检测肾脏的病理变化明确其防治慢性肾功的药效。结果显示,温肾醒脾化浊干预显著减少24 h 蛋白尿和肾体质量的异常增加,降低肾功尿素氮和肌酐的水平,改善肾组织的炎性细胞浸润、纤维化增生以及肾小球变形萎缩等病变,表现出对慢性肾脏功能较好的保护作用,值得临床进一步推广应用。
肾纤维化是所有慢性肾病发展至终末期的共同途径[6],因此如何保护肾功能并延缓肾脏纤维化的进展速度是慢性肾病治疗的关键。肾纤维化的形成涉及系膜细胞的增殖、单核细胞的浸润、成纤维细胞异常增殖、ECM 降解减少或积聚过多等病变[7]。MMP-9 是MMPs 超基因家族成员之一,主要降解IV、V、VII、XI型胶原、弹性蛋白和蛋白聚糖等,其主要生物学作用是在一定的条件作用下(如锌离子和PH 值),参与细胞外基质(ECM)降解与重建。而TIMP- 1 作为MMPs的主要抑制物之一,抑制绝大多数的MMPs,因此在细胞外基质(ECM)积聚与降解动态平衡中发挥着重要作用[9-10]。最新研究表明,在肾脏基质合成阶段,MMP-9/TIMP-1 失衡与胶原降解受抑、ECM 聚集密切相关,最终会诱导肾脏纤维化快速进入硬化阶段,使肾脏失去功能[11]。荧光定量PCR 检测结果显示,与病理模型组比较,温肾醒脾化浊方组大鼠肾组织TIMP-1 mRNA 表达增加、MMP-9 mRNA 表达减少,MMP-9/TIMP-1 比值增加,提示温肾醒脾化浊方可能通过提高MMP-9/TIMP-1 比值,提高对细胞外基质(ECM)降解作用,维持ECM 积聚和降解的生理平衡,从而达到抗肾纤维化的作用。我们进一步检测胶原酶Col4a2R mRNA 表达,发现温肾醒脾化浊方组模型大鼠肾组织Col4a2R 转录表达显著下降,进一步佐证我们的推测:温肾醒脾化浊方可能通过提高MMP-9/TIMP-1 比值,增加对胶原酶的降解,从而延缓了肾纤维化进展。
细胞外基质的增多和聚集是导致肾组织进行性纤维化的主要病理基础。转化生长因子-β1(transforming growth factor-β1,TGF-β1)属于生长因子超家族的一部分,它通过与细胞表面TGF-β 受体结合,以Smads 和非Smads 信号通路,对炎症反应、细胞增殖、分化、凋亡及细胞外基质的合成等起关键性调节作用,其不仅是目前发现的一种促纤维化的信号转导分子,还是肾纤维化进程中重要的调节因子,其表达水平与肾纤维化呈显著正相关性[12]。而纤维连接蛋白(fibronectin,Fn)则是重要的细胞外基质蛋白非胶原糖蛋白,介导肾纤维化的病理过程。实时荧光PCR 检测结果表明,温肾醒脾化浊方干预可显著下调TGFβ1 及Fn1 mRNA 的表达,提示下调TGF-β1 表达和Fn1 mRNA 表达,减少细胞外基质的合成可能是其延缓肾纤维化机制之一。本研究证实温肾醒脾化浊方可能通过调控MMP-9/TIMP-1 失衡,下调TGF-β1 及Fn1 的表达,减少ECM 积聚,进而延缓肾纤维化形成和保护肾功能,该研究初步解析温肾醒脾化浊法治疗慢性肾功能衰竭的现代生物学特征,并为临床温肾醒脾化浊方治疗慢性肾功能衰竭提供一定的实验基础。

