鼠尾草属植物中松香烷型和意烯萜烷型二萜及其生物活性的研究进展*
夏 凡,汤楚明,赵建军,许 刚
(中国科学院昆明植物研究所,云南 昆明 650201)
鼠尾草属名“Salvia”源于拉丁语“salvare”,寓意治愈、安全[1]。鼠尾草属隶属于唇形科(Lamiaceae),全世界约1 000 种,遍布全球,有中南美洲、中亚—地中海和东亚3 个主要的多样性分布中心[2]。鼠尾草属植物具有广泛的生物活性,如抗菌、解痉、止血等,在世界各地的民间医学中普遍使用[1]。我国有82 种鼠尾草,是东亚的多样性分布中心,分布于全国各地,尤以西南地区最多[2]。该属植物是我国治疗心脑血管疾病最著名的药用植物类群之一,其中丹参(S. miltiorrhiza)是应用最早、最广的一种,记载于我国第一本中药书籍《神农本草经》,具有清肝热、活血祛瘀、安神宁心和排脓止痛等功效[3]。甘西鼠尾草(S. przewalskii)、毛地黄鼠尾草(S. digitaloides)、云南鼠尾草(S. yunnanensis)、南丹参(S. bowleyana)作为丹参的替代品被广泛应用[4]。丹参、复方丹参片及复方丹参滴丸自2000 年起均被《中国药典》收录,用于活血祛瘀、通经止痛[5]。
鉴于鼠尾草属植物的药用背景,该属植物的化学成分研究一直是国际研究的热点之一,其化学成分主要是二萜类和多酚类化合物。鼠尾草属植物中二萜的结构类型主要包括松香烷型(abietane)、克罗登烷型(clerodane)、半日花烷型(labdane)、海松烷型(pimarane)和意烯萜烷型(icetexane)。多样的化学结构,赋予这些二萜类天然产物广泛而显著的生物活性。例如:丹参的活血化瘀活性成分丹参酮ⅡA(tanshinoneⅡA),其磺酸钠盐在临床上用于治疗冠心病、心绞痛及心肌梗死[6];从丹参中发现的抗肿瘤活性成分neotanshinlactone 对乳腺癌表现出选择性抑制作用[7];从红根草(S. prionitis)中分离得到的saprothoquinone[8]经结构修饰得到了抗肿瘤活性显著的salvicine[9],其对多种实体瘤均表现出显著的抑制活性,为新的DNA 拓扑异构酶Ⅱ抑制剂;从产自墨西哥的S. divinorum 中分离得到的化合物salvinorin A 为吗啡受体κ 亚型的选择性激动剂,是罕见的非含氮型阿片受体激动剂[10](图1)。

图1 从鼠尾草属植物中分离得到的代表性活性二萜类成分
松香烷二萜类化合物的研究最早追溯到公元19 世纪,人们从松香中得到了一种酸性化合物abietic acid(松香酸)[11]。日本化学家Fujita 于1968 年首次化学全合成了该类化合物,并第一次以abietane 命名其中的一个产物[12]。松香烷型二萜为具有6/6/6 环系的三环二萜,其基本骨架为氢化菲,C-4位存在1 组偕二甲基,C-10 位连接1 个角甲基,C-13 位连接1 个异丙基(图2)。1968-2011 年间从鼠尾草属植物中分离鉴定了545 个二萜,包含了365个松香烷二萜[1]。松香烷二萜结构多变,包括在基本骨架上形成内酯环、醚环、呋喃环,或衍生出裂环、重排、降碳、增碳及二聚等[11]。
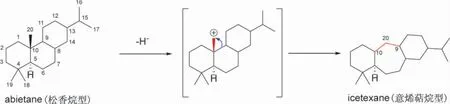
图2 松香烷和意烯萜烷型二萜的基本骨架和生源关系
意烯萜烷型二萜具有6/7/6 环系,生源上认为意烯萜烷源于松香烷,由松香烷的C-9 迁移至C-20 位形成了七元的B 环[13(]图2)。上述生源途径得到了化学合成的佐证,如,鼠尾草酸衍生物通过PPh3/DIAD(diisopropyl azodicarboxylate)介导的Mitsunobu 重排反应可以顺利扩环得到意烯萜烷型二萜[14-15]。本文对2012-2022 年间从鼠尾草属植物中发现的139 个新松香烷型和意烯萜烷型二萜(表1-6)及其生物活性(表7 和表8)进行归纳,以期为该属植物的深入研究和利用提供参考。
1 松香烷型二萜(abietane)及其生物活性
1.1 常规松香烷二萜及其生物活性 常规骨架的松香烷二萜在鼠尾草属植物中最为常见。2012-2022 年从中发现了38 个新常规松香烷二萜,其呈现出高氧化度的特点,氧化位点多位于C-7/C-17/C-19/C-20(表1,图3)。其中,化合物5、7、16、19、25、33 和36 对不同的肿瘤细胞株表现出较显著的细胞毒活性,IC50多小于10 μM(表7)。此外,化合物28 和29 具有显著的抗氧化活性,对脂质过氧化的抑制作用优于α-生育酚,IC50分别为5.9 和2.7 μM(表8)。

表1 鼠尾草属植物中常规松香烷二萜类成分
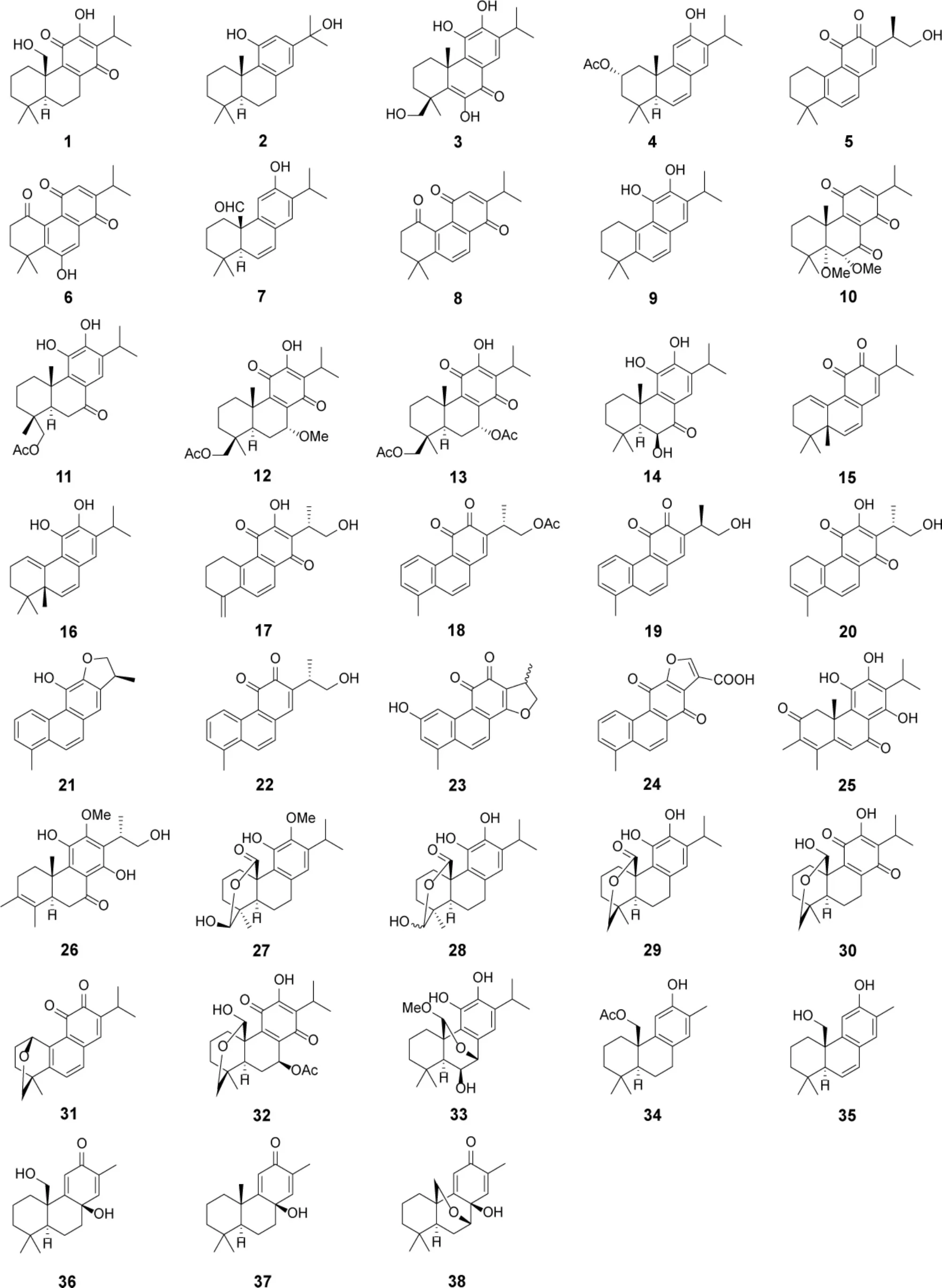
图3 鼠尾草属植物中常规松香烷二萜类成分
1.2 A 环裂环型松香烷二萜及其生物活性 A 环裂环型松香烷是松香烷二萜家族中的小众成员,类型包括C-2/C-3、C-3/C-4、C-4/C-5 和C-1/C-10裂环型松香烷。其中,C-4/C-5 裂环型松香烷二萜占多数:(1)在生源途径上,其由常规松香烷衍生而来。常规松香烷二萜在C-5 位形成碳正离子,驱动Me-20 从C-10 迁移到C-5。随后C-4/C-5 键断裂,并经进一步转化得到C-4/C-5 裂环型松香烷二萜,化学合成也佐证了这一生源途径[40-41]。(2)A 环裂环后容易形成新的环系,如五元、六元、七元、八元氧环或碳环等。见图4。

图4 A 环C-4/5 位裂环型松香烷二萜可能的生源途径
从鼠尾草属植物中分离鉴定了9 个C-4/C-5(39-46)、2 个C-1/C-10(47-48)以及1 个C-2/C-3(49)裂环型松香烷二萜(表2,图5)。其中,化合物47 和48 可能的生源途径是松香烷前体的C-5 位形成碳正离子,驱动C-1/C-10 位裂环重排,经过电子的转移,C-4 进一步与C-6 环合形成新的6/6/6 环系[42]。化合物44a 和44b 是一对对映异构体,通过手性拆分,进一步ECD 计算确定其绝对构型[46]。生物活性方面,化合物48 对MCF-7(人乳腺癌细胞)、B16F10(小鼠皮肤黑色素瘤细胞)、PC-3(人前列腺癌细胞)和C26(小鼠结肠癌细胞)具 有 潜 在 的 细 胞 毒 活 性,IC50在5.4 ~10.3 μM 之间[48](表7)。

图5 鼠尾草属植物中A 环裂环型松香烷二萜类成分
1.3 B 环裂环型松香烷二萜及其生物活性 目前,关于B 环裂环型松香烷二萜的报道较少,结构涉及C-6/C-7、C-7/C-8 和C-9/C-10 裂环型。化合物50-53 和55-57 属于C-6/C-7 裂环型松香烷二萜;58 属于C-9/C-10 裂环型松香烷二萜,均是从S.deserta 中分离得到的。化合物54 为C-7/C-8 裂环型松香烷二萜。见表2 和图6。
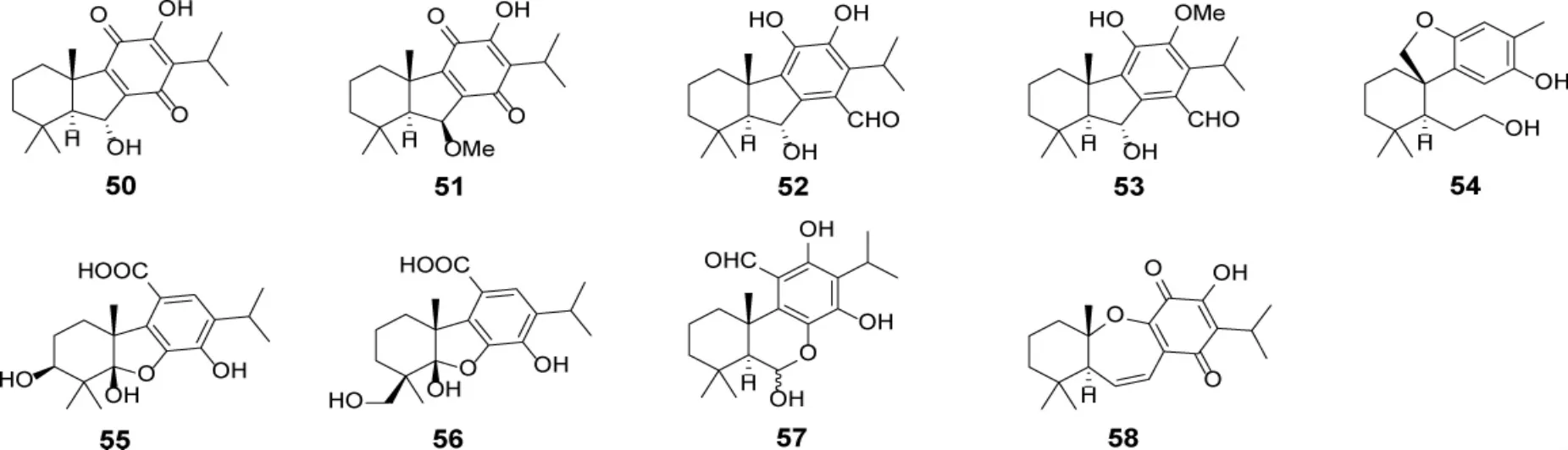
图6 鼠尾草属植物中B 环裂环型松香烷二萜类成分

表2 鼠尾草属植物中裂环型松香烷二萜类成分
1.4 C 环裂环型松香烷二萜及其生物活性 C 环裂环型松香烷二萜分为C-9/C-11、C-11/C-12、C-12/C-13 以及C-8/C-14 裂环型。其中,C-11/C-12裂环型松香烷占多数,生源上可能由松香烷二萜的C-11/C-12 位双键氧化断裂形成羧基转化而来。若发生脱羧,则进一步形成C-11 或C-12 降碳型内酯;若羧基与其它位置的羟基或羰基缩合,则形成多种不同的环系(图7)。
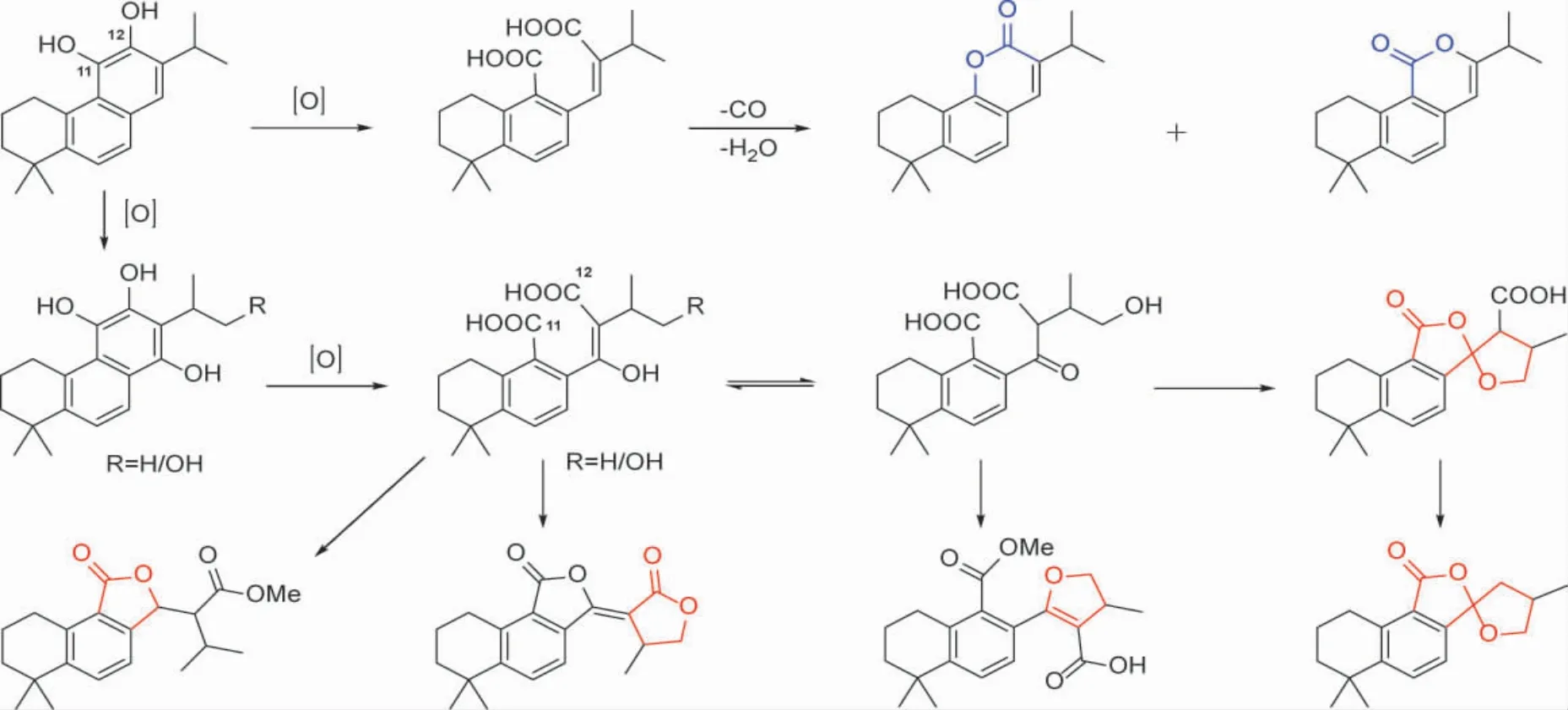
图7 C 环C-11/12 位裂环型松香烷二萜可能的生源途径
从鼠尾草属植物中分离鉴定了23 个新C 环裂环型松香烷二萜(表2,图8)。化合物64-77 属于C-11/C-12 裂环型,其中70 是C-11/C-12 裂环后C-12 与C-7 进一步环合产物。78-81 为C-12/C-13裂环型,裂环后进一步形成了新的环系。化合物69对HeLa(人宫颈癌细胞)表现出显著的细胞毒活性,IC50为0.8 μM[36]。抗菌活性方面,76 对菌株Aerobacter aerogenes 具有微弱的抑制活性[50]。
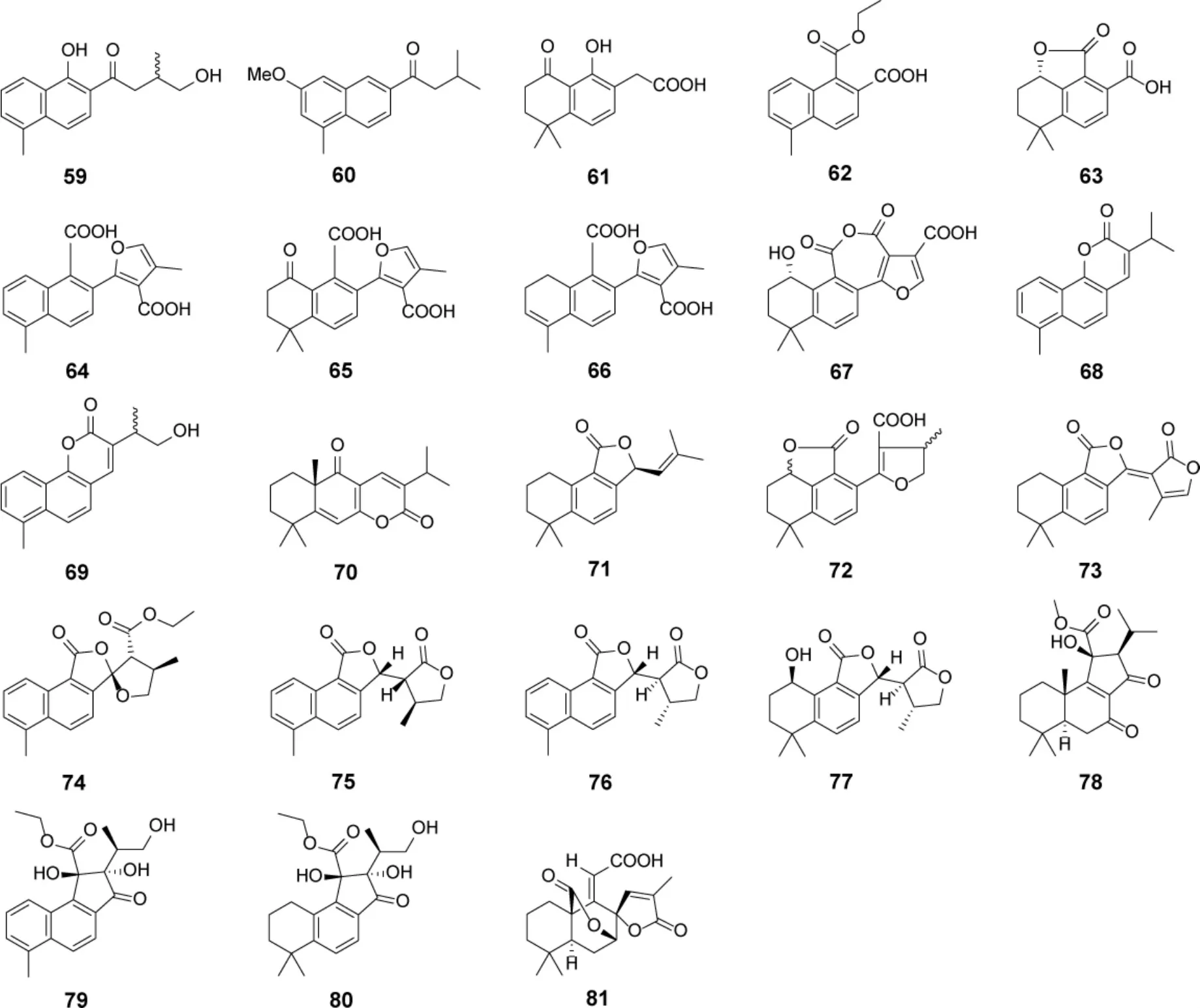
图8 鼠尾草属植物中C 环裂环型松香烷二萜类成分
1.5 双裂环型松香烷二萜及其生物活性 从鼠尾草属植物中报道了5 个双裂环型松香烷二萜(表2,图9)。82 和83 为双键顺反互变异构体,它们在质子溶剂(如甲醇)中会相互转化。82 和83 及其混合物能同等程度增强Cav3.1 T-型钙通道(TTCC)峰值电流,是首次发现的Cav3.1 TTCC 天然激活剂。其中,82 对Cav3.1 TTCC 电流的增强作用在1 μM 至100 μM 浓度范围内成剂量效应关系,EC50为12.48 μM[55](表8)。化合物84 具有罕见的7/5/6 环系,生源上可能源于常规松香烷二萜的C-5 和C-6 双羟化,再经频哪醇重排而来。另外,84 具有较显著的肿瘤细胞毒活性,对MCF-7、SMMC-7721(人肝癌细胞)、HL-60(人急性早幼粒白血病细胞)、SW-480(人结肠腺癌细胞)和A-549(人非小细胞肺癌细胞)的IC50在1.1~4.8 μM 之间[59]。
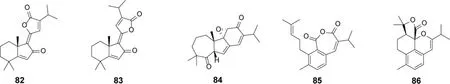
图9 鼠尾草属植物中双裂环型松香烷二萜类成分
1.6 C23型松香烷二萜及其生物活性 C23萜类化合物是一类由二萜与其它小分子加合而得到的具有23 个骨架碳原子的化合物,在天然产物中较少见。2012-2022 年间,从鼠尾草属植物中分离鉴定了9 个C23型萜类分子(表3,图10)。该类分子形成过程中常伴随着缩合、氧化、重排等反应,倾向于形成新的骨架[60-61],如92-95 形成了新的七元C 环。化合物95 对菌株Bacillus subtilis 具有一定的抑制作用[50]。

表3 鼠尾草属植物中C23 型松香烷二萜类成分
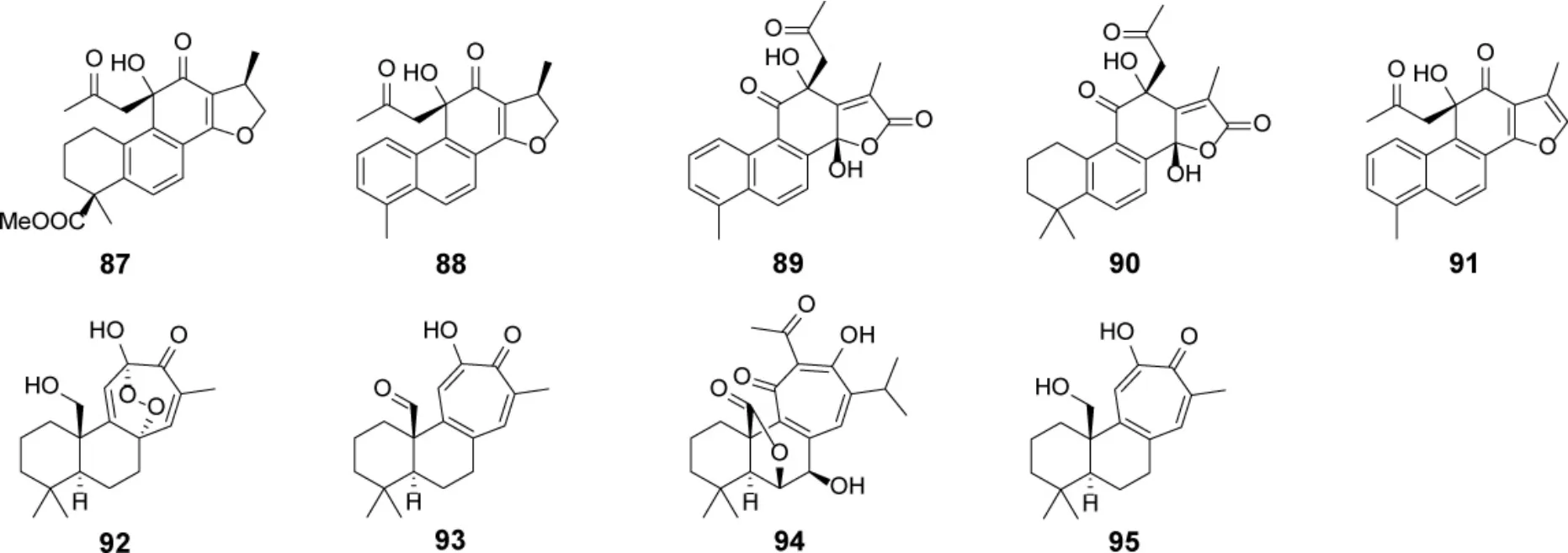
图10 鼠尾草属植物中C23 型松香烷二萜类成分
1.7 含氮型松香烷二萜及其生物活性 从鼠尾草属植物中分离鉴定了7 个松香烷型二萜生物碱(表4,图11),其结构特点为C-11 和C-12 参与形成噁唑环。化合物97 对Wild-Type HIV-1(wild-type human immunodeficiency virus-1)、VSVG/HIV-1(vesicular stomatitis virus glycoprotein/human immunodeficiency virus-1)、HIV-1(NL4-3 strain)和VSVG/MLV(vesicular stomatitis virus glycoprotein/murine leukemia virus) 具有显著的抑制活性,IC50分别为0.03、0.03、5.4 和0.15 μM[63]。98 对Wild-Type HIV-1 病毒的IC50为1.2 μM[63];102 对HSV-1(herpes simplex virus 1)和influenza virus A/Hanfang/359/95(H3N2) 病毒表现出潜在的抑制作用,IC50分别为11.1 和8.6 μM[52]。
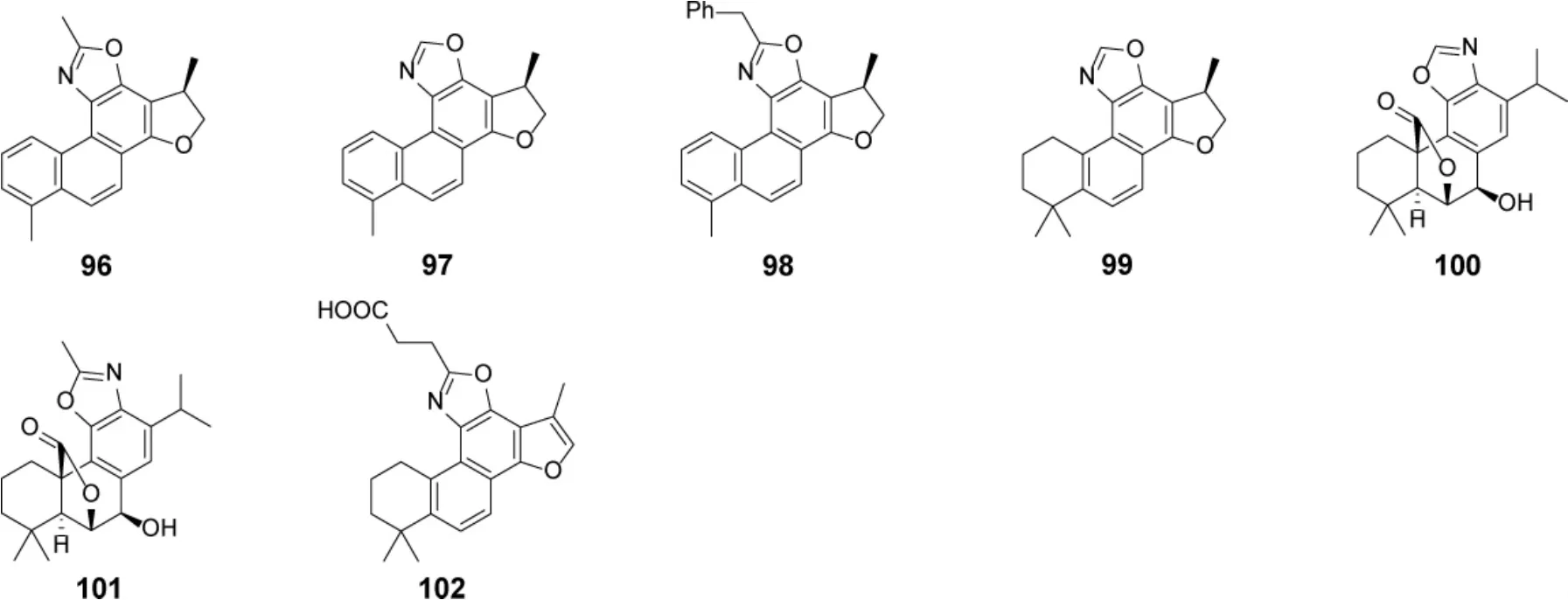
图11 鼠尾草属植物中含氮型松香烷二萜类成分
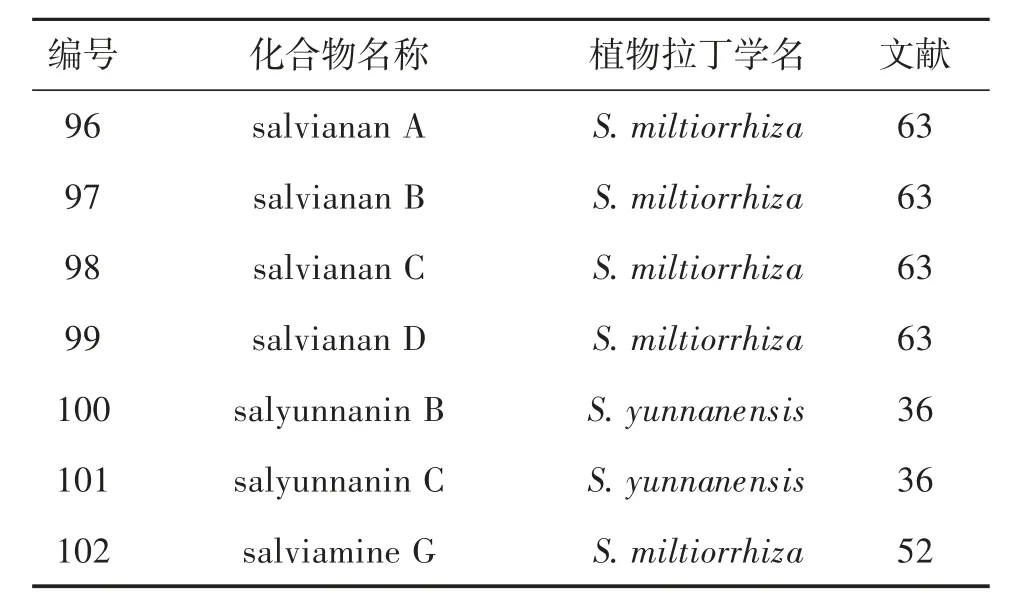
表4 鼠尾草属植物中含氮型松香烷二萜类成分
1.8 松香烷型二萜二聚体及其生物活性 2012-2022 年间报道了6 个松香烷型二萜二聚体,其聚合方式包括松香烷单体间聚合、松香烷与意烯萜单体聚合(表5,图12)。生源上推测二聚体可能由分子间的Diels-Alder 加成反应构建,形成新的碳碳键或碳 氧 键。化 合 物105 对HL-60、SMMC-7721、A-549、MCF-7 和SW-480 表现出显著的增殖抑制活性,IC50分别为0.6、2.3、1.8、0.9 和0.7 μM[23](表7)。
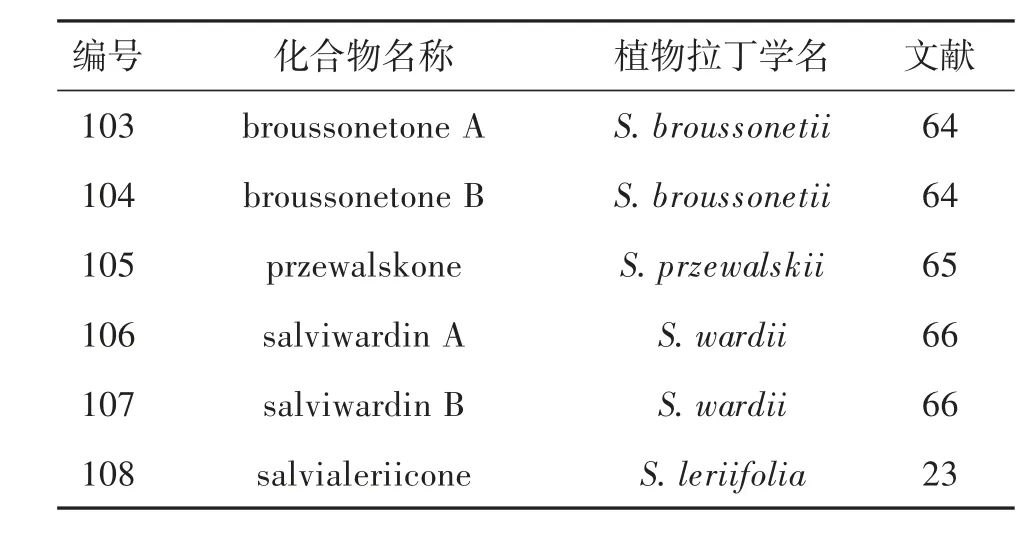
表5 鼠尾草属植物中松香烷型二萜二聚体
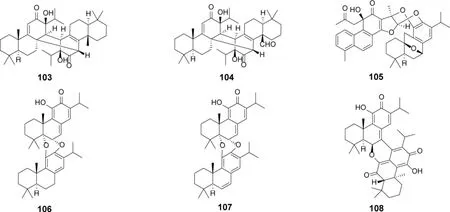
图12 鼠尾草属植物中松香烷型二萜二聚体
2 意烯萜烷型二萜(icetexane)及其生物活性
从鼠尾草属植物中发现了29 个新意烯萜烷型二萜(表6,图13),包括首次发现的C-6/C-7 裂环意烯萜烷型二萜(131-133)以及C23增碳型意烯萜烷型二萜(137 和138)。化合物118、127、131、132和135 具有潜在的抗肿瘤活性(表7)。其中,127 活性最显著,对U251(人胶质瘤细胞)、SKLU-1(人低分化肺腺癌细胞)和COS-7(非洲绿猴SV40 转化的肾细胞)的IC50分别为1.4、0.8 和1.6 μM[26]。109 和110 表现出一定的抗血管新生活性,IC50分别为13.4 和39.3 μM[67]。137 和138 可显著抑制脂多糖诱导的一氧化氮释放,IC50分别为2.0 和6.3 μM[71]。此外,意烯萜烷型二萜对离子通道具有调节活性。126、134 和136 对Cav3.1 型离子通道具有显著的抑制作用,IC50在7.0~11.7 μM 之间[70](表8);115 和121 对Cav3.2 具有显著的抑制作用,IC50分别为2.9和5.1 μM[68]。并且,115 和121 的合成衍生物在小鼠醋酸扭体实验中,表现出呈剂量依赖性的止痛效果,与药物临床试验中的T 型钙离子通道抑制剂Z944 活性相当[68]。
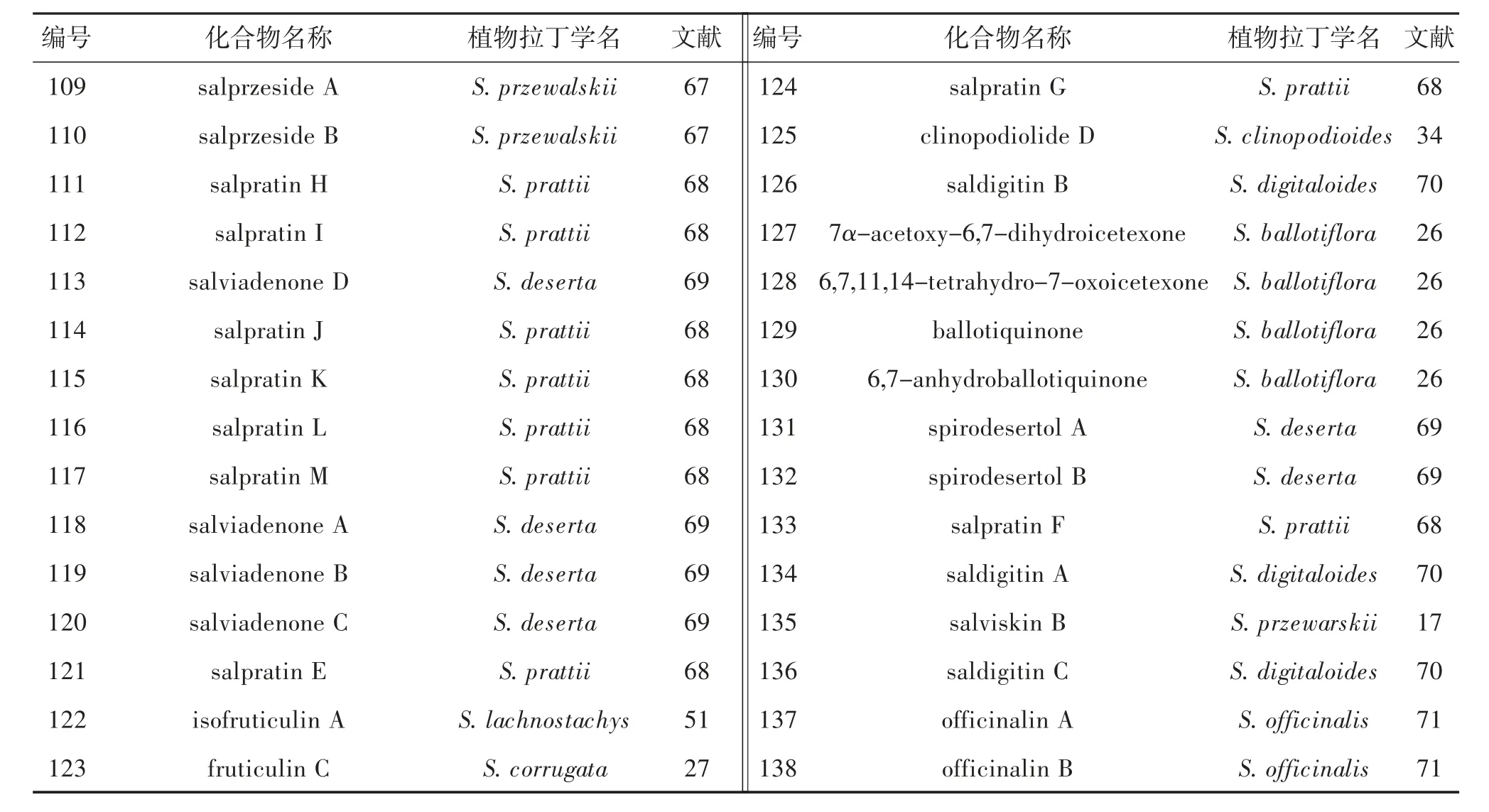
表6 鼠尾草属植物中意烯萜烷型二萜类成分

表7 二萜类成分的肿瘤细胞毒活性

表8 二萜类成分的其它生物活性

续表8
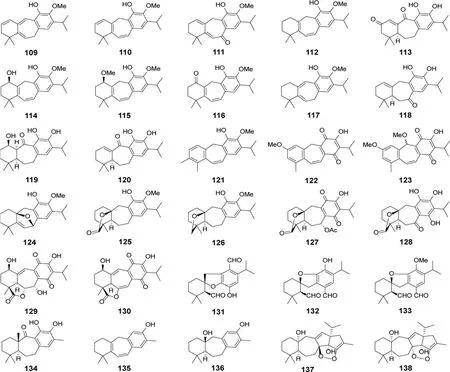
图13 鼠尾草属植物中意烯萜烷型二萜类成分
3 总结与展望
本文对2012-2022 年间从鼠尾草属植物中分离鉴定的139 个新松香烷型和意烯萜烷型二萜及其生物活性进行了归纳总结。结合松香烷和意烯萜烷型二萜可能的生源途径,分类阐述了其结构类型,包括常规松香烷、开环型松香烷、增碳型松香烷、松香烷型含氮生物碱、松香烷型二聚体和意烯萜烷型二萜。松香烷和意烯萜烷型二萜的生物活性研究相对不足,主要集中于肿瘤细胞毒活性研究,在抗炎、抗氧化、抗HIV 和离子通道调节活性方面也有所涉及。虽然发现了少数分子具有显著的抗肿瘤和抗HIV 活性,但都缺乏深入的机制研究及药效学验证,具有成药前景的二萜鲜有发现,制约着鼠尾草属植物及二萜类成分的开发和应用。鼠尾草属植物是经典的活血化瘀类传统中药,其化学成分应该多围绕心脑血管药物靶点进行活性探索,如:PCSK9(proprotein convertase subtilisin/kexin type 9)[72]、Factor Xa(blood coagulation factor Xa)[73]、P2Y12(Purinergic P2Y 12 receptor)[74]、ACLY(ATP citrate lyase)[75]、GDF-15 (growth differentiation factor-15)[76]、NPC1L1 (Niemann-Pick C1-Like 1)[77]、GLP-1(glucagon-like peptide-1)[78]等,以期发现药物先导分子。

