巢湖后生浮游动物群落及不同湖区营养状态评价
李静 梁阳阳 唐晓先 韩琦 尹峰 郭匿春 卢文轩


摘要:为了给巢湖水质管理及富营养化防治提供科学依据,根据水系特征,在巢湖东、西湖区湖心、裕溪河出湖口、丰乐河、派河和南淝河共设置8个采样点,2013年12月至2014年11月共采样12次,分别代表冬季(12月-次年2月)、春季(3-5月)、夏季(6-8月)和秋季(9-11月),对巢湖水体理化指标和后生浮游动物(枝角类、桡足类、轮虫)群落进行逐月周年调查。基于叶绿素(Chl-a)、总磷(TP)、总氮(TN)、化学需氧量(CODMn)、透明度(SD)等水体理化因子,运用综合营养状态指数(TLI)和生物多样性指数,对不同湖区受污染程度和营养状态进行综合评价。结果显示,巢湖共检出后生浮游动物42种(属),优势种矩形龟甲轮虫(Keratella quadrata)、萼花臂尾轮虫(Brachionus calyciflorus)为富营养化水体或有机质较多水体的常见种,不同季节的优势种存在较大差异;总体上,后生浮游动物全年平均丰度371.6 个/L(191.5~600.0 个/L)和全年平均生物量3.0 mg/L(2.0~4.6 mg/L)均呈现西半湖高于东半湖、夏秋季高于冬春季的时空分布特点;其群落结构也存在显著的季节差异和空间差异,矩形龟甲轮虫、萼花臂尾轮虫等是造成差异的主要种类。水温(WT)和Chl-a是影响枝角类丰度的重要因子,桡足类丰度与WT呈显著正相关,而轮虫丰度受TLI(∑)指数的显著影响。TLI(∑)指数均值为58.41(52.18~66.28),指示巢湖总体处于轻度至中度富营养化状态。Shannon-Wiener多样性指数和Margalef丰富度指数表明,巢湖总体处于中度污染状态,不同湖区水体具有明显的不均衡性。
关键词:后生浮游动物;营养状态;综合营养状态指数;生物多样性指数;巢湖
中图分类号:Q145, X824 文献标志码:A 文章编号:1674-3075(2023)01-0073-09
湖泊具有饮用水源、水产养殖、维护生物多样性、维持区域生态系统平衡等功能,是支撑我国经济和社会发展的重要资源之一。巢湖是引江济淮工程的重要组成部分,自20世纪80年代以来,随着区域经济发展和人口增加,工农业生产和城市生活污水大量输入,导致湖水中氮、磷等营养盐和有机质浓度迅速增加,湖泊富营养化问题日益突出,湖泊生态系统愈发脆弱(殷福才和张之源,2003;Zhong et al,2019;王艳平等,2021)。水体营养程度评价是湖泊生态环境评价的关键,湖泊水体的营养程度评价可较为准确地反应其水质现状和生态系统健康程度,是针对性开展湖泊生态修复和制定“一湖一策”管理方案的重要前提。
目前,用水质指标评价湖泊营养状态的方法主要有营养状态指数(Trophic status index,TSI)、综合营养状态指数(Comprehensive trophic level index,TLI)、模糊数学法、灰色聚类法和人工神经网络模型等(方娜等,2019;王明翠等,2002)。模糊数学模型边界隶属清晰但隶属函数选择随机性强,灰色聚类法评价结果精确度高但分辨率低,人工神经网络模型自学习能力强但应用性较差。以水体透明度指标为基准的TSI法因其可操作性和简洁性而被广泛应用和推广(Carson,1977;王芳等,2022),但其中透明度等单项指标变化较快且权重较大,不如考虑多项因子的综合评价方法更科学。TLI法可有效解决上述问题,其以相对稳定的叶绿素a(Chl-a)浓度为基准参数,并适当减弱变化较快的透明度等其他指标权重,因此更适用于巢湖等风力和沉积物再悬浮较强的大型浅水湖泊(王明翠等,2002;Shang & Shang,2007)。
在内陆水体中,浮游动物通常包括体长2 μm以上的原生动物、轮虫、枝角类和桡足类等生物类群(卡尔夫,2011)。鉴于分类、分析方法以及生态功能等与其他类群差异较大,原生动物通常被单独作为一个类群进行研究(Foissner et al,1999;Frantal et al,2022)。为准确描述和区分不同浮游动物类群,本研究用后生浮游动物(Metazooplankton)来代表轮虫、枝角类和桡足类。后生浮游动物可通过摄食藻类、细菌、原生动物和有机碎屑获得生长和繁殖所必需的能量,同时其也是鱼类的天然饵料,因此在水生食物链中具有承上启下的作用;另外,浮游动物因其对污染物极为敏感,且有积累和转移作用,从而在生态毒理和环境监测评价等方面具有很大的潜在与实用价值(Wei et al,2017) 。对武汉东湖浮游动物长期研究发现,桡足类群落结构、数量以及优势种和污染指示种的变化可以较好地反映水质情况(Xie & Yang,2000)。由此可见,查明后生浮游动物群落结构变化,将有助于更加全面地了解水质状况。本文试图采用TLI指数和后生浮游动物群落结构(优势种、多样性指数等),对长江中下游典型湖泊——巢湖不同湖区水体受污染程度和营养状态进行综合评价,旨在为其水质管理及富营养化防治提供科学依据。
1 材料与方法
1.1 样点设置与样品采集
根据巢湖水系特征,共设8个采样点,分别为东、西湖区湖心(CH1和CH5)、裕溪河出湖口(CH4)、丰乐河(CH6)、派河(CH7)和南淝河(CH8);其中CH1~CH4号点属东巢湖,CH5~CH8号点属西巢湖,河流入湖口采样点位于湖区,距离河口约500 m(图1)。于2013年12月至2014年11月进行为期一周年的逐月监测。共采样12次,分别代表冬季(12月-次年2月)、春季(3-5月)、夏季(6-8月)和秋季(9-11月)。
用2.5 L采水器分别采集表层(水下50 cm)、中层(1/2水深处)和底层(底泥界面以上50 cm)湖水进行混合。浮游甲壳动物样品取混合水10 L,用25号浮游生物网(64 μm)过滤,浓缩后用4%甲醛溶液保存。轮虫样品是取1 L混合水样,加入鲁哥氏液固定,经自然沉淀48 h后,浓缩至50 mL保存、备用。
1.2 样品分析
水温(WT)、溶解氧(DO)、pH 值和透明度(SD)分别用YSI ProPlus多参数水质分析仪和塞氏盘进行现场测定。样品理化指标主要包括总氮(TN)、总磷(TP)、铵态氮(NH4+-N)、化学需氧量(CODMn)、硝态氮(NO3-N)、亚硝态氮(NO2--N)、叶绿素a浓度(Chl-a)、总溶解碳(TDC)和总悬浮质(TSS),测定方法参照《湖泊富营养化调查规范》(金相灿和屠清瑛,1990)。浮游动物的定性和定量分析在显微镜(Olympus BX53)下进行,浮游甲壳动物枝角类和桡足类鉴定、轮虫鉴定及其生物量估算参考相关文献(王家楫,1961;蒋燮治,1979;沈嘉瑞,1979;章宗涉和黄祥飞,1991)。
1.3 数据处理
(1)综合营养状态指数(王明翠等,2002)计算公式如下:
TLI(∑)=∑Wj·TLI(j) ①
式中:TLI(∑)表示综合营养状态指数,Wj表示第j种参数营养状态指数的相关权重,TLI(j)表示第j种参数的营养状态指数。
以Chl-a作为基准参数,则第j种参数的归一化相关权重计算公式为:
Wj=[r2ijj=1mr2ij] ②
式中:rij为第j种参数与基准参数Chl-a的相关系数,m为评价参数的个数。Chl-a浓度与TP、TN、SD、CODMn的相关关系rij分别为0.84、0.82、-0.83、0.83。
(2)营养状态指数计算公式如下:
TLI(Chl-a)=10(2.500+1.086lnChl-a) ③
TLI(TP)=10(9.436+1.624lnTP) ④
TLI(TN)=10(5.453+1.694lnTN) ⑤
TLI(SD)=10(5.118-1.940lnSD) ⑥
TLI(COD)=10(9.436+1.624lnCOD) ⑦
式中:SD单位为m,Chl-a单位为mg/m3,其他指标单位均为mg/L。采用0~100的系列连续数字对水体营养状态进行分级,指数值越高,营养程度越重。TLI(∑)<30为贫营养,30~50为中营养,>50为富营养,其中50~60为轻度富营养,60~70为中度富营养,大于70为重度富营养。
(3)后生浮游动物优势度指数(Y)计算公式如下:
Y=(ni/N)×fi ⑧
式中:ni为物种i密度,N为所有物种总密度,fi为物种i的出现频率。Y>0.02时定义为优势种(Lampitt et al,1993)。
(4)Shannon-Wiener多样性指数(H')和Margalef丰富度指数(D)计算公式如下:
[H'=-i=1s(PilnPi)] ⑨
D = [S-1lnN] ⑩
式中:S为种类数,Pi代表第i种密度占总密度的比例。
运用PERMANOVA和SIMPER分析检验浮游动物群落结构差异显著性及造成差异的主要种类,分别由R 4.0.4和Primer V5软件完成;通过SPSS 26.0(Pearson相关系数)和CANOCO 5.0(多元分析)研究后生浮游动物与水环境因子之间的关系。在进行多元分析之前,将优势种数据进行平方根转换,将环境因子数据(pH 除外)进行lg(x+1)转化,使其无量纲化且提高分布的正态性。
2 结果与分析
2.1 后生浮游动物种类组成
2013年12月至2014年11月调查共检出后生浮游动物42种(含无节幼体);其中轮虫12科15属24种,枝角类6科8属共10种,桡足类4科5属共8种,优势种多为耐污种。不同季节优势种存在较大差异(表1)。轮虫优势种主要有矩形龟甲轮虫、萼花臂尾轮虫和裂足臂尾轮虫;浮游甲壳动物优势种主要有柯氏象鼻溞、角突网纹溞、盔形溞和中华窄腹剑水蚤。东半湖轮虫、枝角类和桡足类种类数量分别为16.5种、10.3种和6.3种,西半湖则依次为14.5种、10.0种和6.0种(表2),东半湖显著高于西半湖(P<0.05)。
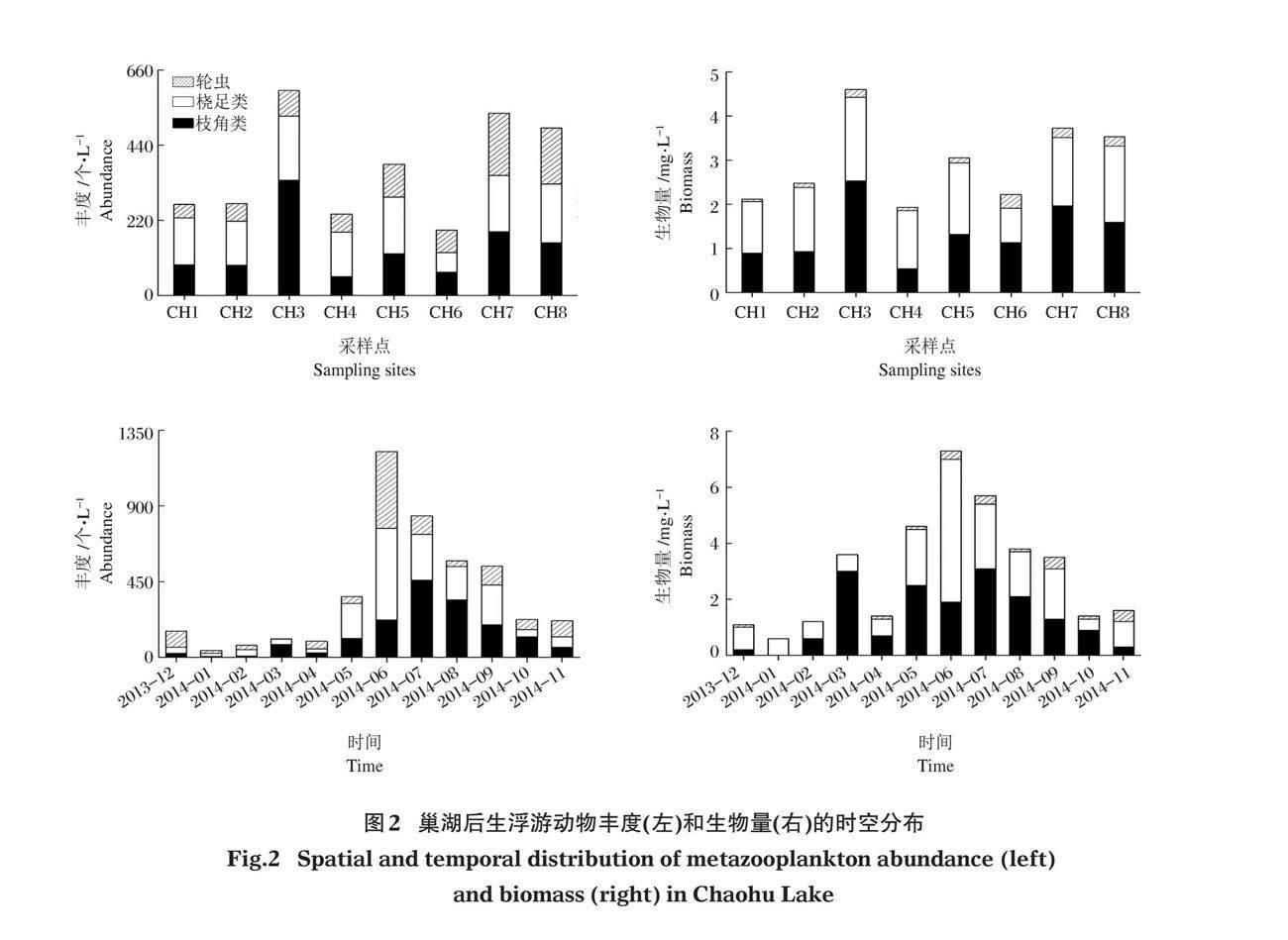
2.2 后生浮游动物丰度和生物量的时空分布
后生浮游动物丰度和生物量时空差异较大(图2,表2),三大类群全年平均总丰度为371.6 个/L,其中轮虫、枝角类、桡足类全年平均总丰度分别为91.1、137.6和142.9 个/L,且均在夏季(6月)达到最高峰,冬季(1月)最少,季节间差异显著(P<0.01)。从空间分布来看,以近中庙点位CH3年均总丰度最高,为600.0 个/L,丰乐河CH6点位(191.5 个/L)最低,各采样点后生浮游动物总丰度存在显著差异(P<0.01)。各采样点后生浮游动物年均总丰度按从大到小排序为:CH3>CH7>CH8>CH5>CH2>CH1>CH4>CH6。后生浮游动物全年平均总生物量为3.0 mg/L,其中,轮虫、枝角类、桡足类全年平均总生物量分别为0.2、1.4、1.4 mg/L,CH3点位最大(4.6 mg/L),近裕溪河口CH4 点位最小(2.0 mg/L),各采样点年均总生物量排序为:CH3>CH7>CH8>CH5>CH2>CH6>CH1>CH4,8个点位之间存在显著差异(P<0.01)。
SIMPER分析显示,两湖区后生浮游动物群落结构平均差异为23.57%,造成差异的种类(平均差异及贡献率)主要为矩形龟甲轮虫(8.43%,35.74%)、萼花臂尾轮虫(6.78%,28.78%)、腔轮虫(2.08%,8.83%)、暗小异尾轮虫(2.08%,8.83%)、无节幼体(1.47%,6.24%)和柯氏象鼻溞(0.95%,4.04%)。但PERMANOVA分析显示,东、西两湖区后生浮游动物群落结构(丰度)差异不显著(P=0.871,R2=0.0058)。总体来说,巢湖西半湖后生浮游动物丰度和生物量高于东半湖,夏秋季高于冬季和春季,全年呈单峰分布。
2.3 巢湖水体营养状态和污染程度评价
各采样点位水体理化指标见表3。其中Chl-a浓度全湖平均为35.8 μg/L(东、西半湖平均值分别为25.3 μg/L和46.2 μg/L),以该单项指标评价巢湖水质为中-富营养化水平(东、西半湖分别为中富营养和富营养),以TP浓度(全湖平均为0.06 mg/L)、透明度(平均为34.0 cm)来评价也均指示巢湖为中-富营养水平。以TN浓度(平均为2.9 mg/L)和溶解氧(平均为7.4 mg/L)为评价指标,则巢湖处于富营养化水平。TLI值显示综合营养状态指数为58.41;其中,东巢湖综合营养状态指数为54.61,指示水体为轻度富营养状态,西巢湖综合营养状态指数平均为62.21,为中度富营养状态。
通过后生浮游动物生物多样性评价巢湖水体营养状态和受污染程度(表2)。Shannon-Wiener多样性指数(H')平均为1.50,指示水体为α中污染型,各采样点污染程度排序是:CH3>CH1>CH5>CH2>CH4>CH6=CH7=CH8。Margalef物种丰富度指数(D)平均为2.79,指示水体为β中污型污染,其中CH3点位指示污染程度最重(2.48),CH4点位指示污染程度最轻(3.02),各采样点污染程度排序是:CH3>CH5>CH7>CH8>CH1=CH2= CH6>CH4。综合生物多样性指数看,巢湖水体除近裕溪河口CH4样点为寡污染外,其他均处于中等污染水平。
2.4 环境因子对后生浮游动物群落结构影响
因DCA分析显示,第1轴梯度长度大于3.0,浮游甲壳动物和轮虫与环境因子的关系由CCA多元统计分析来完成(图3)。
图3-左中环境因子解释了浮游甲壳动物物种变异的42.9%,其中第一、二轴分别为44.7%和20.07%,对所有轴均为P=0.002;图3-右中环境因子解释了轮虫物种变异的23.7%,其中第一、二轴分别为30.5%和26.8%,对所有轴均为P<0.01。浮游甲壳动物优势种如柯氏象鼻溞、角突网纹溞等与WT和DO呈显著正相关。轮虫优势种如萼花臂尾轮虫、矩形龟甲轮虫、前节晶囊轮虫等均与TLI呈显著正相关。总体来说,WT、DO、TN/TP等是影响枝角类和桡足类的主要环境因子,SD、TLI、pH等则是影响轮虫的主要环境因子。
对各类群丰度与水环境因子进行Pearson相关性分析,发现后生浮游动物总丰度与WT、Chl-a极显著正相关(P<0.01),与NO3-N浓度呈显著负相关(P<0.05)(表4)。枝角类丰度与WT、Chl-a极显著正相关(P<0.01),与NO3-N浓度呈显著负相关(P<0.05)。桡足类丰度与WT显著正相关(P<0.05)。TP、pH及DO对巢湖浮游甲壳动物丰度并无显著影响,水体主要理化因子与轮虫也无显著相关性。
3 讨论
3.1 巢湖后生浮游动物群落结构时空差异显著
巢湖后生浮游动物种类组成比以往有所变化。根据Deng等(2008)调查发现,2002-2003年巢湖浮游甲壳动物共计23种,本研究共检出17种,其中前者发现的矩形尖额蚤 、绿色近邻水蚤、锯禄真剑水蚤、中华咸水剑水蚤在本次调查中未检出,这可能与巢湖水质变化、采样方法不同等有关。本次调查中,占据种类丰度及生物量绝对优势的主要是一些耐污种(富营养化水体指示种),如萼花臂尾轮虫、矩形龟甲轮虫、柯氏象鼻溞和中华窄腹剑水蚤等(García-Chicote et al,2019;刘俏等,2022)。
后生浮游动物群落有明显的时空分布差异。从空间分布来看,西半湖种类数低于东半湖,河湖交汇区种类数低于敞水区,这可能与西半湖和河湖交汇区相对较高的营养水平有关;在季节性分布上,夏季种类数最多,其次是春季、秋季和冬季。随着水体营养水平的升高,后生浮游动物的群落结构由大型个体向小型个体转变。巢湖夏季后生浮游动物丰度较春季高出近4倍,但生物量仅高出近1倍,这可能与夏季大型枝角类个体减少、小型枝角类和轮虫大量增加有关。Fulton & Paerl(1987)研究发现,富营养化湖泊中蓝藻水华暴发总是伴随着大型枝角类(如Daphnia)数量的下降以及小型枝角类、桡足类和轮虫数量的增加。近40年来,当浮游生物食性鱼类和其他无脊椎动物捕食者密度比较高时,其直接或间接的(下行效应)对浮游动物现存量和群落结构产生重大影响的这种观点已被广泛接受。Gliwicz & Pijanowska(1989)研究发现,夏季鱼类摄食强度增加,枝角类中个体较大的种类更容易被捕食,而个体较小且逃避捕食能力较强的浮游动物更容易存活并逐渐成为优势种;陈光荣等(2008)将惠州西湖中浮游动物小型化的趋势归结为水温、鱼类捕食和水体富营养化等因素共同作用的结果。笔者前期对巢湖的相关研究发现,巢湖夏季的后生浮游动物总丰度明显比春季高,其中夏季较高的水温及随高温产生的高密度细菌、藻类、原生动物等食物资源发挥了重要作用(李静等,2015)。
后生浮游动物种类组成及其现存量表征了巢湖的富营养化现状,各湖区的优势种类及其体型大小、种群数量变化则反映了不同湖区水体的营养状态差异。本次调查发现,后生浮游动物年度分布呈单峰模式,以夏季最高、冬季最低,丰度和生物量的季节差异显著。相对于浮游植物而言,关于浮游动物群落季节变动,尤其是年间、10年间或更长时间尺度群落变化的定量研究要少得多(卡尔夫,2011)。由于后生浮游动物,尤其是桡足类(个体发育时间长且需进行两性生殖)世代时间较长,种群更迭相对较慢,开展长期的观察研究可能具有更加重要的意义(Elliott,1990)。
3.2 综合多项水生态指标更能反映巢湖营养现状
统计分析发现,WT是影响巢湖浮游甲壳动物群落结构的主要环境因子,枝角类和桡足类丰度均与WT呈极显著正相关。Gillooly(2000)发现,水温在5~20℃,温度越高,后生浮游动物世代时间越短。本研究中,枝角类丰度除了与WT呈极显著正相关关系外,还与Chl-a浓度呈极显著正相关,这与李娟等(2014)的研究结论一致。但笔者前期研究发现,大型枝角类(如Daphnia)的种群变动不仅受温度和营养盐(如TP)的影响(李静和陈非洲,2010),也受捕食压力和浮游植物现存量的影响。因此,捕食者和浮游植物现存量对后生浮游动物乃至整个浮游生物网的影响也需多加关注。在评价巢湖水体富营养化程度时,仅选用某一类参数(如透明度)作为评价指标并不完全准确,且巢湖水域广阔、湖区污染情况复杂,水质指标常变化较快且幅度较大,这就要求在研究巢湖水污染和富营养化程度时,应结合多项指标(如后生浮游动物种群结构等水生态指标)进行综合评价。
3.3 不同水体营养状态评价方法的准确性比较
巢湖东半湖综合营养状态指数(TLI值)平均为54.61,指示水体为轻度富营养状态;而西半湖(TLI值)为62.21, 为中度富营养状态,西半湖富营养化程度高于东半湖。殷守敬等(2018)利用遥感反演与综合营养状态指数法(TLI)相结合的方法,对巢湖水体富营养化状态进行综合分析,所得的结论与本研究一致。前者认为西北部南淝河和十五里河水体营养物质的输入导致巢湖Chl-a浓度升高,东部、南部新河和兆河河水入湖对Chl-a浓度起到了稀释作用,从而解释了西半湖富营养化程度高于东半湖的现象。本研究发现,即便东半湖的富营养化水平、受污染程度和后生浮游动物多样性指数总体优于西半湖,东半湖水生态环境不断恶化趋势仍未得到有效缓解,而且东半湖个别点位(如CH3和CH1)的受污染程度也不容忽视。
生物多样性与生态系统功能之间的关系一直是现代生态学研究的核心问题,其中浮游动物群落结构变化与水体富营养化之间的关系也备受关注(Hulot et al,2000;García-Chicote et al,2019)。利用浮游动物群落结构特征进行水质和营养状态评价的可行性,在其他湖泊(水库)也得到验证(Wei et al,2017;林海等,2019;刘俏等,2022)。有学者发现,利用浮游动物群落特征与利用水体理化指标评价草海水质状况所得结果基本一致(蔡国俊等,2016)。与枝角类和桡足类相比,轮虫指示种对湖泊富营养化程度的指示作用更强,这可能与轮虫相对较短的世代时间和较快的群落更迭速度有关(卡尔夫,2011;Wei et al,2017)。林海等(2019)在北京市妫水河中发现,多种轮虫与水体中氮磷含量相关性极为显著,可将其作为水质监测和富营养化水体指示生物。本研究中,巢湖东半湖轮虫、枝角类和桡足类种类数量高于西半湖,西半湖多污带指示生物种类占总数的57.12%,β中污带指示生物种类占总数的82.37%。后生浮游动物生物指示作用也表明,西半湖的富营养化程度更高,这与通过TLI法得出的结论一致。
另外,以后生浮游动物多样性指数对巢湖水质进行评价时,Shannon-Wiener多样性指数显示巢湖水质均为中度污染,Margalef丰富度指数则指示东半湖的CH1样点为轻度污染,后者与水体理化指标评价结果更为接近。因此,相对于Shannon-Wiener多样性指数,Margalef丰富度指数对巢湖水质的评价更加准确。
志谢:采样过程中得到朱斌、侯冠军、蒋阳阳、吴明林和巢湖渔政管理总站34001、34003、34007号渔政船工作人员的大力支持,在此一并感谢!
参考文献
蔡国俊,周晨,林艳红,等,2016. 贵州草海高原湿地浮游动物群落结构与水质评价[J]. 生态环境学报, 25(2):279-285.
陈光荣,钟萍,张修峰,等,2008. 惠州西湖浮游动物及其与水质的关系[J]. 湖泊科学, 20(3):351-356.
方娜,游清徽,刘玲玲,等,2019. 基于云模型的鄱阳湖秋季周边湿地水体富营养化评价[J]. 生态学报, 39(17):6314-6321.
蒋燮治,1979. 中国动物志:节肢动物门:甲壳纲:淡水枝角类[M]. 北京:科学出版社.
金相灿,屠清瑛,1990. 湖泊富营养化调查规范[M].2版. 北京:中国环境科学出版社.
卡尔夫,2011. 湖沼学:内陆水生态系统[M]. 古滨河,刘正文,李宽意,等译. 北京:高等教育出版社:388-423.
李静,陈非洲,2010. 太湖夏秋季大型枝角类(Daphnia)种群消失的初步分析[J]. 湖泊科学, 22(4):552-556.
李静,崔凯,卢文轩,等,2015. 春季和夏季巢湖浮游生物群落组成及其动态分析[J]. 水生生物学报, 39(1):185-192.
李娟,温周瑞,李庚辰,等,2014. 太湖梅梁湾和贡湖湾浮游甲壳动物群落结构及其与环境因子的相互关系[J]. 长江流域资源与环境, 23(Z1):81-90.
林海,王源,李冰,2019. 北京市妫水河浮游动物群落结构与水质评价[J]. 生态学报, 39(20):7583-7591.
刘俏,刘智暘,王江滨,等,2022. 福建山美水库浮游动物群落结构时空特征及其影响因子分析[J]. 湖泊科学, 34(6):2039-2057.
沈嘉瑞,1979. 中国动物志:节肢动物门:甲壳纲:淡水桡足类[M]. 北京:科学出版社.
王芳,青松,刘楠,等,2022. 基于色度角的岱海水体营养状态遥感评估[J]. 湖泊科学, 34(4):1150-1163.
王家楫,1961. 中国淡水轮虫志[M]. 北京:科学出版社.
王明翠,刘雪芹,张建辉,2002. 湖泊富营养化评价方法及分级标准[J]. 中国环境监测, 18(5):47-49.
王艳平,徐伟伟,韩超,等,2021. 巢湖沉积物氮磷分布及污染评价[J]. 环境科学, 42(2):699-711.
殷福才,张之源,2003. 巢湖富营养化研究进展[J]. 湖泊科学,15(4):377-384.
殷守敬,吴传庆,王晨,等,2018. 综合遥感与地面观测的巢湖水体富营养化评价[J]. 中国环境监测, 34(1):157-164.
章宗涉,黄祥飞,1991. 淡水浮游生物研究方法[M]. 北京:科学出版社.
Carson R E, 1977. A trophic state index for lakes[J]. Limnology and Oceanography, 22(2):361-369.
Deng D G, Xie P, Zhou Q, et al, 2008. Field and experimental studies on the combined impacts of cyanobacterial blooms and small algae on crustacean zooplankton in a large, eutrophic, subtropical, Chinese lake[J]. Limnology, 9(1):1-11.
Elliott J M, 1990. The need for long-term investigations in ecological and the contribution of the Freshwater Biological Association[J]. Freshwater Biology, 23:1-5.
Foissner W, Berger H, Schaumburg J, 1999. Identification and ecology of limnetic plankton ciliates[M]. Landesamtes für Wasserwirtschaft: Informationsberichte des Bayer.
Frantal D, Agatha S, Beisser D, et al, 2022. Molecular data reveal a cryptic diversity in the genus Urotricha (Alveolata, Ciliophora, Prostomatida), a key player in freshwater lakes, with remarks on morphology, food preferences, and distribution[J]. Frontiers in Microbiology, 12:787290.
Fulton R S, Paerl H W,1987. Toxic and inhibitory effects of the blue-green alga Microcystis aeruginosa on herbivorous zooplankton[J]. Journal of Plankton Research, 9(5):837-855.
García-Chicote J, Armengol X, Rojo C, 2019. Zooplankton species as indicators of trophic state in reservoirs from Mediterranean River basins[J]. Inland Waters, 9(1):113-123.
Gillooly J F, 2000. Effect of body size and temperature on generation time in zooplankton[J]. Journal of Plankton Research, 22(2):241-251.
Gliwicz Z M, Pijanowska J, 1989. The role of predation in zooplankton succession. Plankton Ecology[M]. Springer Berlin Heidelberg.
Hulot F D, Lacroix G, Lescher-Moutoué, et al, 2000. Functional diversity governs ecosystem response to nutrient enrichment[J]. Nature, 405:340-344.
Lampitt R S, Wishner K F, Turley C M, et al, 1993. Marine snow studies in the Northeast Atlantic Ocean: Distribution, composition and role as a food source for migrating plankton[J]. Marine Biology, 116(4):689-702.
Shang G P, Shang J C, 2007. Spatial and temporal variations of eutrophication in western Chaohu Lake, China[J]. Environmental Monitoring and Assessment, 130:99-109.
Wei W Z, Chen R M, Wang L F, et al, 2017. Spatial distribution of crustacean zooplankton in a large river-connected lake related to trophic status and fish[J]. Journal of Limnology, 76(3):546-554.
Xie P, Yang Y, 2000. Long-term changes of copepoda community (1957-1996) in a subtropical Chinese lake stocked densely with planktivorous filter-feeding silver and bighead carp[J]. Journal of Plankton Research, 22(9):1757-1778.
Zhong F, Wu J, Dai Y R, et al, 2019. Responses of water quality and phytoplankton assemblages to remediation projects in two hypereutrophic tributaries of Chaohu Lake[J]. Journal of Environmental Management, 248:109276.
(责任编辑 万月华)
Metazooplankton Community Structure and Trophic
State Assessment of Chaohu Lake
LI Jing1, LIANG Yang‐yang1, TANG Xiao‐xian2, HAN Qi2, YIN Feng3, GUO Ni‐chun4, LU Wen‐xuan1
(1. Anhui Province Key Laboratory of Aquaculture & Stock Enhancement,
Fisheries Research Institute, Hefei 230001, P.R. China;
2. Institute of Lake Ecology and Environment, Chaohu Lake Bureau of Anhui Province,
Hefei 230601, P.R. China;
3. Fishery Administration Station of Chaohu, Hefei 238000, P.R. China;
4. College of Resources and Environment, Anhui Agricultural University, Hefei 230036, P.R.China)
Abstract:In this study, metazooplankton (rotifers, cladocerans, and copepods) community structure and physicochemical factors of the water in Chaohu Lake were investigated periodically. The comprehensive trophic status index (TLI, based on Chl-a, TP, TN, transparency and COD), and the biodiversity index were used to comprehensively evaluate the pollution and trophic state of the lake. From December 2013 to November 2014, monthly monitoring of metazooplankton and water quality was carried out at eight sampling sites (CH1-4 in eastern Chaohu Lake and CH5-8 in western Chaohu Lake). A total of 42 metazooplankton species were detected, including 24 rotifers, 10 cladocerans and 8 copepods. The dominant species, varying by season, were Keratella quadrata and Brachionus calyciflorus, indicators of eutrophic water or water bodies with abundant organic matter. The range of annual metazooplankton abundance and biomass in Chaohu Lake were 191.5-600.0 ind/L and 2.0-4.6 mg/L, with average values of 371.6 ind/L and 3.0 mg/L. Both measures were higher in the western area of the lake than in the eastern, and higher in summer and autumn than in winter and spring. The metazooplankton community structure differed significantly with season and location, primarily due to fluctuations in the two dominant species. Water temperature and Chl-a were the important factors affecting cladoceran abundance, while copepod abundance displayed a significant positive correlation with water temperature and rotifer density correlated significantly with TLI. The range of TLI in Chaohu Lake was 52.18-66.28, with an average value of 58.41, indicating mild to moderate eutrophication, while the metazooplankton biodiversity indices (Shannon-Wiener diversity index, Margalef richness index) indicate moderate pollution, although the pollution status varied with location. Our results provide a scientific basis for managing water quality and controlling eutrophication in Chaohu Lake.
Key words:metazooplankton; nutritional status; comprehensive trophic level index (TLI); biodiversity index; Chaohu Lake
