不同氮素对冠盘藻生长和光合荧光特性的影响
郑传坤 刘晓真 李卫国 贺玉晓 张运兴 赵同谦

摘要:硅藻水华广泛存在于富营养化水体中,常造成恶劣的环境影响,氮素输入是造成硅藻水华现象的主要因素之一。为明确氮素营养对硅藻水华的影响,揭示其对氮素的响应机理,以常见硅藻水华优势种冠盘藻(Stephanodiscus hantzschii)为研究对象,分别以硝酸钠、氯化铵和尿素作为氮源,分析了不同氮素条件下冠盘藻生长和叶绿素荧光参数(Fv /Fm、α、Ik、ETRmax)的变化特征。结果显示,不同形态氮素对冠盘藻的生长及叶绿素荧光参数影响显著,一定程度上提高水体氮素浓度能够提升冠盘藻的叶绿素荧光,促进其生长。相比于氨氮和尿素,硝氮营养更有利于冠盘藻的生长,高浓度硝氮条件下,冠盘藻生长良好,而氨氮浓度大于5 mg/L、尿素浓度达到10 mg/L时,冠盘藻叶绿素荧光参数显著降低,生长受到抑制。较高浓度氨氮及尿素对冠盘藻叶绿素荧光参数的抑制作用主要发生在其生长的前中期,随着氮素消耗,冠盘藻的光合参数Fv /Fm、Ik、ETRmax均随氮素浓度的增加而增加,低氮条件下的冠盘藻会提高α值来增大对光能的利用效率,从而提高其环境适应性。研究表明,氮素一定程度上能够通过影响冠盘藻的光合作用而影响其在水环境中的生长。
关键词:冠盘藻;氮素;硅藻水华;叶绿素荧光参数
中图分类号:Q142 文献标志码:A 文章编号:1674-3075(2023)01-0131-08
氮素作为水环境中主要的营养元素之一,对整个水环境生态系统的平衡和稳定具有重要作用,是评价水环境健康状态的重要指标。氮素输入增加是引起水体富营养化的重要原因,常导致水华现象的发生。20世纪90年代至今,长江以南部分地区硅藻水华频繁出现,尤其是汉江、长江三峡更是硅藻水华发生的常见区域,并有向支流蔓延的趋势。水华发生期间,水体透明度显著下降,呈黄褐色并伴有大量悬浮物,死亡分解的硅藻往往会散发恶臭,影响区域用水安全,其造成的恶劣生态影响日益受到广泛关注。硅藻水华的发生受多种因素影响,其中氮素输入的增加被认为是重要的原因之一(卢大远等,2000;胡恩等,2020;李建等,2020)。因此,研究硅藻对氮素营养的响应机制能有效控制水华发生。
硅藻是水环境中常见的浮游植物,同时也是重要的水环境指示物种。硅藻对水中氮素的变化非常敏感,其对不同形态及不同浓度的氮源吸收、同化均有所不同。光合作用是硅藻重要的生理过程之一,能够显著影响其在水环境中的生长。氮素作为构成叶绿素的主要元素,能够通过影响硅藻的光合速率、暗反应过程中主要酶的合成以及光呼吸,直接或间接影响着光合效率(Jiang et al, 2012;Adams et al, 2013)。环境条件的改变主要影响硅藻的光系统Ⅱ(PSⅡ) ,硅藻PSⅡ的荧光诱导曲线以及快速光曲线的相关参数可以反应其不同环境条件下的光合特性(White & Critchley, 1999;Ralph & Gademann, 2005)。因此,研究水华硅藻响应氮素的生长及光合特性,能够明确水体氮素输入对水华硅藻生长和生理状态的影响,进一步揭示水华发生的机理。
冠盘藻(Stephanodiscus hantzschii)属于中心硅藻纲(Centriae)、圆筛藻目(Coscinodiscales)、圆筛藻科(Coscinodiscaceae),广泛分布于湖泊、河流、水库等水域,是近年来国内外报道的硅藻水华主要优势种之一(Jung et al,2011;郑凌凌等,2017;李建等,2020)。冠盘藻的环境适应性强,适宜生长温度为3~22℃,相较于其他藻类,具有良好的光保护能力,在高强光下也能够很好地生长。有研究表明,水体中氮素浓度的升高是诱导冠盘藻水华暴发的主要因素之一(吴兴华等,2017;王俊等,2018;辛小康等,2019)。目前,国内外对于冠盘藻的氮素响应机制研究多集中于氮素营养对其生长的影响,鲜见有关其光合特性的相关报道。为此,本研究以冠盘藻为研究对象,通过室内模拟实验,探究不同形态以及浓度氮素对其生长和光合参数的影响,以期为硅藻的氮素响应机制及其水华防治提供参考。
1 材料与方法
1.1 实验材料
本实验的冠盘藻购自于中国科学院水生生物研究所藻种库,藻种编号为FACHB-2842。藻类培养条件为(20±0.1)℃,光照强度5 000 lx,光暗比为12h:12h,静置培养,每天轻摇1~3次,选用D1培养基,扩大培养至所需藻液量时开始进行实验。
1.2 实验设计
实验设3种氮素处理组, 分别为氯化铵(A组)、硝酸钠(B组)和尿素(C组),浓度设定为0.5、1、2、5、10 mg/L(以N计),部分氮素浓度设置参考《地表水环境质量标准(G3838-2002)》中的总氮标准限值。将对数增长期的冠盘藻在离心机中以5 000 r/min离心5 min, 收集藻种,在无氮基质中培养3 d,用以消耗冠盘藻细胞内存储的氮素营养,然后接种于500 mL三角瓶中,接种后藻液体积为300 mL,各组设3个平行。接种当天测定藻细胞密度、叶绿素a含量、叶绿素荧光相关参数,以后每隔2 d测定1次。
1.3 藻细胞比生长速率及叶绿素a含量测定
取处于对数生长期的冠盘藻藻液,用紫外分光光度计扫描其在400~800 nm波长下的吸光值,确定其最大吸收峰波长为678 nm。用分光光度计测定不同浓度藻液吸光值 (OD678),并用血球计数板测定藻细胞密度,建立细胞数与吸光值(OD)的回归方程,藻细胞密度用OD678代替。比生长速率(μ)计算方法如下:
[μ] = (lnX2 - lnX1)/(T2 - T1) ①
式中:X2为培养第T天时的藻细胞密度OD678,X1为培养初始时的藻细胞密度OD678。
叶绿素a测定采用丙酮提取法。用移液枪取10 mL摇匀后的藻液至离心管中,以5 000 r/min离心5 min,去除上清液,加入10 mL、90%丙酮溶液,于冰箱中4℃静止24 h,再次离心。使用分光光度计,90%丙酮溶液调0,测定其波长663 nm和645 nm的上清液OD值,叶绿素a浓度(mg/mL)计算公式(李红霞等,2009)如下:
Chl-a = 12.7OD663 - 2.69OD645 ②
1.4 叶绿素荧光参数测定
使用双通道叶绿素荧光仪 (Dual-pam-100,德国) ,向比色皿中加入20 μL藻液和3 mL蒸馏水混匀,暗适应5 min后测定荧光诱导曲线,其中快速光曲线拟合采用Eilers-Peeters模型,计算公式如下:
p = PAR/(a×PAR2+b×PAR+c) ③
α = 1/c ④
ETRmax = 1/(b+2[ac]) ⑤
Ik = c/(b+2[ac]) ⑥
式中:p为光合速率,PAR为光强,a、b、c为计算参数;根据拟合结果求得α为光能利用效率[μmol/(m2·s)](以光子数计,下同),反映生物体的光能利用效率;ETRmax为最大电子传递速率[μmol/(m2·s)],反映生物体的光合活性高低;Ik为半饱和光强[μmol/(m2·s)],反映生物体对强光的耐受能力。
1.5 数据统计与分析
数据采用Excel和SPSS进行整理和统计分析,P<0.05表示差异显著,使用Origin作图。
2 结果与分析
2.1 不同浓度氮素对冠盘藻比生长速率的影响
不同氮素条件下冠盘藻的比生长速率见图1。可见冠盘藻的比生长速率随着硝氮浓度的增大而增加,各组之间差异显著(P<0.05),比生长速率最高为10 mg/L组,达到0.124,较最低组(0.5 mg/L)提高了53.2%;氯化铵培养条下,随着氨氮浓度的升高,冠盘藻的比生长速率呈先上升、后下降的趋势,各组之间差异显著(P<0.05),5 mg/L以及10 mg/L氨氮条件下,冠盘藻的比生长速率分别为0.071和0.067,相较于2 mg/L组的最大值0.093分别下降了24.7%和27.9%;以尿素作为氮源,冠盘藻的比生长速率整体上随氮素浓度上升而上升,10 mg/L尿素条件下冠盘藻的比生长速率为0.101,相较于5 mg/L处理组的0.108略有降低,降幅为6.4%。
不同形态氮素对冠盘藻的比生长速率也有明显的影响。总体来看,以硝酸钠为氮源,冠盘藻的生长速率最高,尿素组次之,氯化铵组最低。0.5 mg/L、1.0 mg/L以及10 mg/L氮素浓度,硝酸钠组的比生长速率均大于同浓度条件下的氨氮以及尿素组,其中10 mg/L高浓度硝氮组的比生长速率能够达到0.124,较10 mg/L氯化铵、尿素组分别提高了46.1%、19.4%。
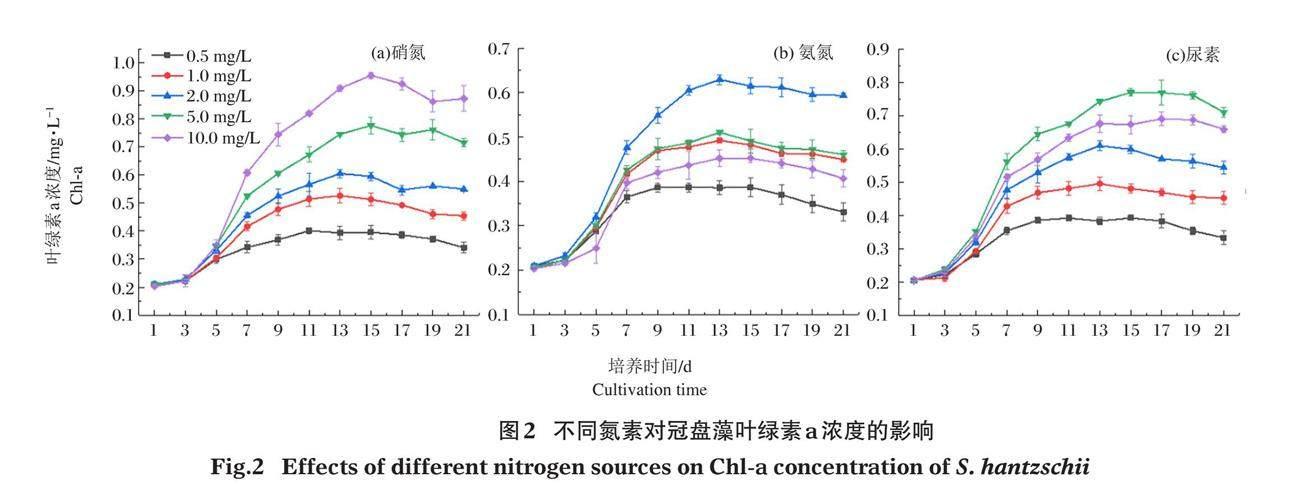
2.2 不同氮素对冠盘藻叶绿素a的影响
各氮素组对冠盘藻叶绿素a浓度的影响见图2。在接种后的第3天,3种氮素处理组的冠盘藻细胞均迅速分裂增殖,叶绿素a浓度迅速增加。图2-a可见,叶绿素a浓度随硝氮浓度的增大而增大,各组之间差异显著(P<0.05),硝氮浓度的提高对冠盘藻的叶绿素a的合成具有明显的促进作用,在硝氮浓度为10 mg/L时,其叶绿素a浓度最高,达到0.925 mg/L。硝氮浓度为0.5 mg/L的低氮浓度组,冠盘藻叶绿素a的增长最为缓慢,在整个培养过程中,叶绿素a浓度处于较低水平,其最大值为0.401mg/L,相较于10 mg/L组减少了56.7%。图2-b可见,在5 mg/L以及10 mg/L氨氮培养条件下,冠盘藻的叶绿素a浓度显著低于2 mg/L组(P<0.05),叶绿素a浓度最高值出现在第13天,分别为0.51mg/L以及0.45mg/L,相较于2 mg/L氨氮培养组下降了18.9%和28.5%。图2-c显示了尿素对于冠盘藻叶绿素a浓度的影响,10 mg/L尿素培养组,叶绿素a浓度显著低于5 mg/L组;10 mg/L以下,叶绿素a浓度随着尿素浓度的增大而增大,5 mg/L尿素培养组,叶绿素a的浓度显著大于其余各组(P<0.05)。
2.3 不同氮素对冠盘藻叶绿素荧光的影响
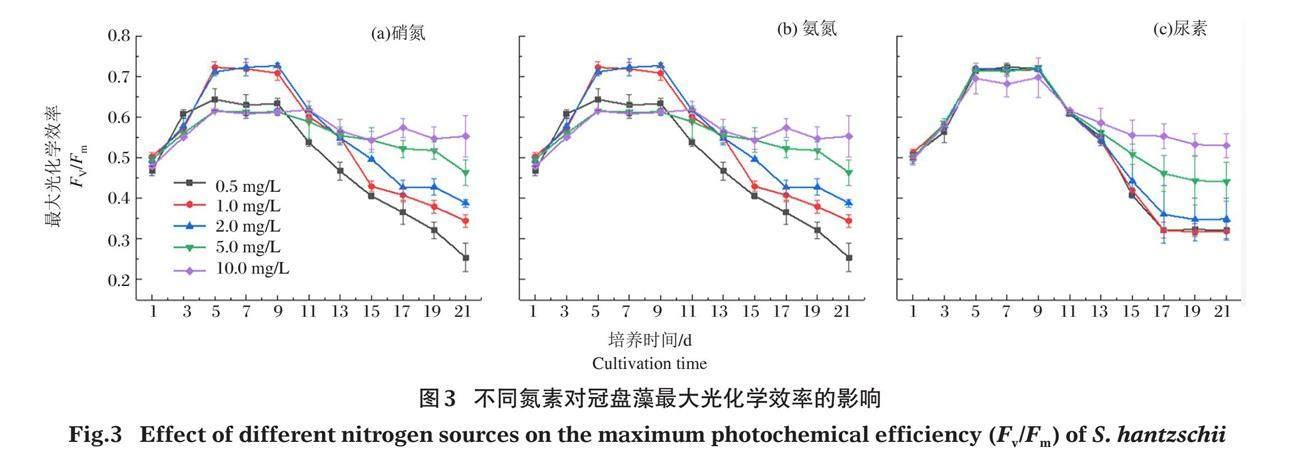
2.3.1 最大光能转化效率 不同浓度氮素条件下冠盘藻最大光能转化效率(Fv/Fm)变化见图3。Fv/Fm反映了植物潜在的最大光合能力,正常生理状态下,绝大多数硅藻的Fv/Fm值在0.6~0.7,当Fv/Fm下降时,代表植物受到了胁迫。
由图3可以看出,经过无氮培养条件下的冠盘藻,在接种了3种氮素后,Fv/Fm总体上都呈先上升、后下降的趋势。由图3-a可见,硝氮培养条件下,第1~9天冠盘藻的Fv/Fm均显著上升,各浓度组之间无显著差异;第9~21天,各浓度组的Fv/Fm均呈下降趋势,其中5 mg/L、10 mg/L组的Fv/Fm显著大于其他各组(P<0.05);第15~21天,0.5~2.0 mg/L浓度组的Fv/Fm随着硝氮浓度的降低而减小,各组之间差异显著(P<0.05)。图3-b可见,以氨氮为氮源,第1~9天,0.5、5、10 mg/L培养组冠盘藻的Fv/Fm增长趋势显著小于1 mg/L和2 mg/L组(P<0.05);第9~21天,各浓度组的Fv/Fm均随氨氮浓度的减小而显著下降(P<0.05)。图3-c可见,10 mg/L尿素培养组冠盘藻的Fv/Fm在第5~9天显著低于其他组(P<0.05);第9~21天,各浓度组的Fv/Fm均显著下降(P<0.05),5 mg/L和10 mg/L尿素组的Fv/Fm显著大于其他各组,与氨氮的变化保持一致。
2.3.2 光能利用效率 不同浓度氮素条件下冠盘藻光能利用效率α值的变化见图4。α值反映了藻细胞对光能的利用效率,能直观反映藻类捕光色素对光能的吸收能力,可以看出,3种氮素培养条件下,随着培养时间的延长,α值整体变化趋势为先上升后下降而后上升。图4-a可见,硝氮培养条件下,0.5 mg/L和1 mg/L组冠盘藻的α值在第5~13天显著低于其他3个浓度组(P<0.05);在培养后期,2 mg/L浓度以下的α值具有随着浓度增大而降低的趋势,2 mg/L以上浓度组的α值具有随着浓度增大而增大的趋势。图4-b显示了氨氮对冠盘藻α值的影响,5 mg/L、10 mg/L氨氮培养条件下,第3天α值显著低于其他各组(P<0.05);0.5 mg/L组在第5~15天的α值显著低于1、2、5 mg/L组(P<0.05),第15~21天显著上升,且大于其他各组(P<0.05),由第15天最低点0.165上升至第21天的0.265,上升幅度为60.6%。图4-c显示了同样是在培养后期,尿素处理组各浓度α值均显著上升(P<0.05),其中0.5 mg/L组的上升幅度最大,由最低点的0.163上升至最高点的0.267,上升幅度为38.9%。
2.3.3 半饱和光强 不同浓度氮素条件下冠盘藻光和参数Ik值的变化见图5。可以看出,3种氮素培养条件下,随着培养时间的延长,Ik值整体变化趋势保持一致,总体上都先上升、后下降。图5-a可见,在培养的第1~5天,5种浓度硝氮培养条件下的Ik值同时显著上升(P<0.05),其中10 mg/L浓度组的Ik值上升幅度最大,是刚接种时的5.66倍;第5~9天,5 mg/L、10 mg/L组的Ik值基本保持稳定,在第9天Ik值开始下降,其余各组在培养的第5天Ik值均已开始下降;整个培养阶段Ik值均保持随浓度增大而上升的趋势,各组之间差异显著(P<0.05)。图5-b可见,氨氮培养条件下,各浓度组在培养前期都会显著上升(P<0.05),0.5、1、2 mg/L浓度组上升的时间与幅度均显著大于5 mg/L和10 mg/L浓度组(P<0.05);第5~7天,0.5 mg/L组的冠盘藻Ik值显著低于1 mg/L和2 mg/L组(P<0.05),培养后期,5 mg/L和10 mg/L浓度组冠盘藻的Ik值显著大于中低浓度组(P<0.05),Ik值的大小均保持随浓度增大而上升的趋势。图5-c可见,第1~13天,以尿素为氮源,10 mg/L浓度冠盘藻的Ik值显著低于其他各组(P<0.05);第13~21天,Ik值保持上升并显著大于其他各组(P<0.05),其余各组的Ik值大小同样与浓度高低保持相同的变化趋势。
2.3.4 最大电子传递效率 不同浓度氮素条件下冠盘藻光和最大电子传递效率(ETRmax)的变化见图6。ETRmax可反映一定光强下单位藻细胞内光合作用速率的快慢,可见各组ETRmax均呈上升后显著下降的趋势(P<0.05)。图6-a可见,ETRmax具有随着硝氮浓度增大而增大的趋势,各组之间差异显著(P<0.05)。图6-b可见,5 mg/L以上浓度的氨氮在前期会对冠盘藻ETRmax产生一定的抑制,且浓度越大抑制性越强;培养后期,5 mg/L、10 mg/L氨氮组又会显著大于其余各组(P<0.05)。图6-c可见,培养前期,10 mg/L尿素组冠盘藻的ETRmax显著低于其他4组(P<0.05);培养后期,ETRmax均随尿素浓度的增大而增大。
3 讨论
3.1 冠盘藻对氮素变化的生长响应
大量研究表明,不同形态氮素对于藻类的生长影响不同(Altman & Paerl,2012)。从能量消耗的角度看,还原态的氨氮被认为是浮游植物优先利用的氮源,原因在于其能够被浮游植物直接利用;硝氮以及尿素需要先还原成氨氮才能被同化利用,而还原过程需要消耗光合作用储存的能量(Lincoln et al,1983)。本研究结果显示,相比于氨氮以及尿素,硝氮培养条件下冠盘藻的生长速率最高,表明硝氮营养条件更有利于冠盘藻的生长。有研究发现,硅藻偏向于硝氮丰富的水体,在一定范围内提高硝氮浓度有助于其快速增殖(Goldman,1993;Lomas & Glibert,2000;Andersen et al,2020);还有研究发现,在硝氮培养条件下,部分藻类体内硝酸盐转运相关酶活性显著增强(王爱业等,2008;李斌等,2009;Li et al,2020)。硝氮通过硝酸盐转运蛋白的主动运输进入冠盘藻细胞内,部分被分解利用,部分有可能储存在藻细胞液泡内,较高浓度的硝氮对其也不会产生不良影响。因此,随着外界氮源浓度的提高,硝氮作为氮源的优势明显上升。
先前的研究发现,氨氮浓度达到0.5 mg/L时,包括舟形藻、菱形藻在内的10种不同类型硅藻的生长均受到抑制(Admiraal,1977)。藻类在代谢氨氮时,氨系统内的NH4+去质子化形成的NH3对藻类会产生毒害作用,而随着NH4+被利用,也会导致培养液的pH下降;此外,高浓度氨氮能够抑制微藻细胞谷氨酰胺合成酶的活性,影响其蛋白质合成和氨基酸代谢(蒋汉明和高坤山,2004;唐全民等,2008;孟鸽等,2018)。因此,当培养基内氨氮为唯一氮源时,其毒害作用会随着浓度上升而加剧。
尿素作为有机氮源,能够为微藻所吸收利用。但有研究认为,高浓度的尿素对藻类有显著的抑制性(Matsuda et al,1999)。Schiffrine等(2020)在研究不同氮素对C.gelidus生长的影响中发现,该硅藻在以尿素为氮源培养条件下的生物量显著低于硝氮以及氨氮。尿素在微藻体内的代谢需要脲酶参与,只有被分解为碳酸铵或者碳酸氢铵才能够被微藻吸收利用,不同属浮游植物在脲酶生理学上存在的差异,直接影响其对尿素的吸收利用能力。因此,高浓度的尿素对于部分藻类生长来说有限制作用,高浓度尿素对于冠盘藻生长产生抑制作用的原因,可能是因为其细胞内缺少与尿素代谢相关的酶类,影响了冠盘藻对于尿素的吸收利用。
3.2 冠盘藻对氮素变化的光合响应
氮素是构成叶绿素分子的主要元素之一,能够直接或间接影响藻类的光合作用。氮限制或者氮浓度过高时,都会导致微藻叶绿素荧光参数下降(徐兴莲等,2016)。本研究发现,接种前期,经过了饥饿培养的冠盘藻叶绿素荧光参数迅速增高,在一定范围内提高水体中的氮素浓度能够显著提升冠盘藻的光合作用;培养到中后期,随着培养基内氮素营养的消耗,生存环境受到抑制的冠盘藻光合参数逐渐降低,Fv/Fm,Ik、ETRmax值均随氮素浓度增大而增加,而光能利用效率α值在后期会有所提升。叶绿素荧光参数与PSⅡ反应中心的开放程度相关,而PSⅡ反应中心的开放需要微藻从外界吸收氮素来维持。随着冠盘藻细胞的生长以及对氮素需求的增加,氮素浓度的上升会提高冠盘藻PSⅡ反应中心的开放程度,增强其光强耐受性Ik;同时,PSⅡ反应中心的开放程度限制了冠盘藻PSⅡ受体PQA的氧化程度,制约微藻光合系统PSⅡ向PSⅠ电子传递速率ETRmax,最终导致冠盘藻PSⅡ最大光能转化效率Fv/Fm呈现出随着氮素浓度增加而上升的趋势;此外,高浓度氨氮条件下,细胞外渗透压增大或者水体pH下降都会对冠盘藻PSⅡ反应中心产生毒害作用,导致其叶绿素荧光参数Fv/Fm、Ik、ETRmax显著低于中低浓度氨氮处理组;而高浓度氨氮的毒害作用在一定条件下是可修复的,PSⅡ修复过程中,藻细胞对于氮素的需求量会增加,一定范围内提高氮素浓度能够加快恢复PSⅡ反应中心的活性(Li et al,2015),这可能是培养中后期,Fv/Fm、Ik、ETRmax随着氮素浓度增大而上升的原因。与Fv/Fm、Ik、ETRmax下降趋势不同的是,α值在冠盘藻培养后期都会有所提升,α值反映了藻类利用光能的能力,与藻细胞内光合作用有关的色素含量有关。一般认为,在氮充足条件下,色素含量会有所增加,从而促进光合效率的提升。而本研究中,氮缺乏条件下α值的升高,可能是藻细胞对于光能存在一套主动利用机制,导致冠盘藻细胞启动自我保护机制,重新分配光能在藻胆蛋白和光系统Ⅱ、Ⅰ的能量配比,从而使部分叶绿素荧光值增大以适应生存环境。
综上所述,在一定范围内的提高水体中氮素尤其是硝氮的浓度会显著提升冠盘藻的光合作用,加快其分裂增殖;高浓度的氨氮会对冠盘藻光系统产生毒害作用,尿素培养条件下的冠盘藻对氮素的吸收利用存在着一定的限制,导致了光合作用有所下降,藻细胞生长受抑制;冠盘藻体内的光系统Ⅱ能够做出反应以应对短时间内输入的氮素营养负荷;同时,当水体处于较低氮营养水平甚至寡氮营养水平时,冠盘藻也能够通过调节光系统Ⅱ的参数适应环境变化,这可能是冠盘藻成为典型硅藻水华优势种的主要原因。
4 结论
(1)0~10 mg/L氮素浓度范围,提高硝氮浓度会促进冠盘藻生长,氨氮浓度在5 mg/L以上、尿素浓度达到10 mg/L均会对冠盘藻的生长产生抑制。
(2)比生长速率比较显示,硝氮、氨氮、尿素分别作为冠盘藻唯一氮源时,硝氮营养更有利于冠盘藻的生长。
(3)一定浓度范围内,提高氮素浓度会促进冠盘藻的光化学反应以及光保护能力;较高浓度的氨氮和尿素会对冠盘藻的光化学反应产生抑制,氮缺乏条件下的冠盘藻会增强对光能的利用,从而提高其环境适应性。
参考文献
胡恩,王文科,张振文,等,2020. 蔺河口水库硅藻水华特征及影响因素研究[J]. 生物学杂志, 47(4):58-61.
蒋汉明,高坤山,2004. 氮源及其浓度对三角褐指藻生长和脂肪酸组成的影响[J]. 水生生物学报, 28(5):545-551.
李斌,欧林坚,吕颂辉,等,2009. 不同氮源对海洋卡盾藻生长和硝酸还原酶活性的影响[J]. 海洋环境科学, 28(3):264-267.
李红霞,那广水,伍筱琳,等,2009. 孔雀石绿对两种藻类的毒性[J]. 环境化学, 28(2):225-228.
李建,尹炜,贾海燕,等,2020. 汉江中下游硅藻水华研究进展与展望[J]. 水生态学杂志, 41(5):136-144.
卢大远,刘培刚,范天俞,等,2000. 汉江下游突发水华的调查研究[J]. 环境科学研究, 13(2):28-31.
孟鸽,黄罗冬,高保燕,等,2018. 氮源类型和水平对3株球状绿藻生长、油脂和花生四烯酸积累的影响[J]. 微生物学通报, 45(12):2624-2638.
唐全民,陈峰,向文洲,等,2008. 铵氮对铜绿微囊藻(Microcystis aeroginosa)FACHB-905的生长、生化组成和毒素生产的影响[J]. 暨南大学学报(自然科学版), 29(3):331-337.
王爱业,吉雪莹,陈卫民,等,2008. 亚硝态氮对铜绿微囊藻和四尾栅藻生长的影响[J]. 安全与环境学报, 8(4):12-15.
王俊,汪金成,徐剑秋,等,2018. 2018年汉江中下游水华成因分析与治理对策[J]. 人民长江, 49(17):7-11.
吴兴华,尹大聪,李翀,等,2017. 2015-2016年汉江中下游硅藻水华发生成因分析[J]. 水生态学杂志, 38(6):19-26.
辛小康,王英才,胡圣,等,2019. 2018年汉江下游硅藻水华成因分析[J]. 水电能源科学, 37(3):25-28.
徐兴莲,宋煕坤,岳瑞,等,2016. 氮限制对硅藻三角褐指藻光系统II光化学反应的影响[J]. 生态学杂志, 35(1):183-188.
郑凌凌,张琪,李天丽,等,2017. 三种不同环境因子对汉江硅藻水华优势种冠盘藻(Stephanodiscus sp.)生长生理的影响[J]. 海洋湖沼通报, (6):91-97.
Adams C, Godfrey V, Wahlen B, et al, 2013. Understanding precision nitrogen stress to optimize the growth and lipid content tradeoff in oleaginous green microalgae[J]. Bioresource Technology, 131:188-194.
Admiraal W, 1977. Tolerance of estuarine benthic diatoms to high concentrations of ammonia, nitrite ion, nitrate ion and orthophosphate[J]. Marine Biology, 43(4):307-315.
Altman J C, Paerl H W, 2012. Composition of inorganic and organic nutrient sources influences phytoplankton community structure in the New River Estuary, North Carolina[J]. Aquatic Ecology, 46(3):269-282.
Andersen I M,Williamson T J, González M J, et al, 2020. Nitrate, ammonium, and phosphorus drive seasonal nutrient limitation of chlorophytes, cyanobacteria, and diatoms in a hyper-eutrophic reservoir[J]. Limnology and Oceanography, 65(5):962-978.
Goldman J C, 1993. Potential role of large oceanic diatoms in new primary production[J]. Deep Sea Research Part I: Oceanographic Research Papers, 40(1):159-168.
Jiang Y, Yoshida T, Quigg A, et al, 2012. Photosynthetic performance, lipid production and biomass composition in response to nitrogen limitation in marine microalgae[J]. Plant Physiology and Biochemistry, 54:70-77.
Jung S W, Joo H M, Kim Y, et al, 2011. Effects of temperature and nutrient depletion and reintroduction on growth of Stephanodiscus hantzschii (Bacillariophyceae): implications for the blooming mechanism[J]. Journal of Freshwater Ecology, 26(1):115-121.
Li G, Chirstopher M B, Jnnifer A J, et al, 2015. The nitrogen costs of photosynthesis in a diatom under current and future pCO2[J]. The New phytologist, 205(2):533-543.
Li K, Li M, He Y F, et al, 2020. Effects of pH and nitrogen form on Nitzschia closterium growth by linking dynamic with enzyme activity[J]. Chemosphere, 249:126-154.
Lincoln E P, Hall T W, Koopman B, 1983. Zooplankton control in mass algal cultures[J]. Aquaculture, 32(3):331-337.
Lomas M, Glibert P, 2000. Comparisons of nitrate uptake, storage, and reduction in marine diatoms and flagellates[J]. Journal of Phycology, 36:903-913.
Matsuda A, Nishijima T, Fukami K, 1999. Effects of Nitrogenous and Phosphorus Nutrients on the Growth of Toxic Dinoflagellate Alexandrium catenella[J]. Nippon Suisan Gakkaishi, 65(5):847-855.
Ralph P J, Gademann R, 2005. Rapid light curves: A powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 82(3):222-237.
Schiffrine N, Tremblay J, Babin B, 2020. Growth and Elemental Stoichiometry of the Ecologically-Relevant Arctic Diatom Chaetoceros gelidus: A Mix of Polar and Temperate[J]. Frontiers in Marine Science, 6:790.
White A J, Critchley C, 1999. Rapid light curves: A new fluorescence method to assess the state of the photosynthetic apparatus[J]. Photosynthesis Research, 59(1):63-72.
(责任编辑 万月华)
Effects of Nitrogen on the Growth and Chlorophyll Fluorescence
of Stephanodiscus hantzschii
ZHENG Chuan‐kun1, LIU Xiao‐zhen1, LI Wei‐guo1, HE Yu‐xiao1, ZHANG Yun‐xin2, ZHAO Tong‐qian1
(1. Institute of Resources and Environment, Henan Polytechnic University, Jiaozuo 454000, P.R. China;
2. School of Architectural and Artistic Design, Henan Polytechnic University, Jiaozuo 454000, P.R. China)
Abstract:Diatom blooms are a common phenomenon in eutrophic water bodies. The blooms adversely affect the environment, and excessive inputs of nitrogen is a primary factor leading to diatom blooms. Stephanodiscus hantzschii is widely distributed in lakes, rivers, and reservoirs, and has been the dominant species in diatom blooms reported at home and abroad. In this investigation, S. hantzschii was selected for study, and we explored different concentrations and forms of nitrogen (sodium nitrate, ammonium chloride and urea) on the growth and chlorophyll fluorescence parameters of S. hantzschii using indoor simulation experiments. Our focus was on the specific growth rate, chlorophyll a concentration, and the following fluorescent parameters: maximum photochemical efficiency (Fv /Fm), light use efficiency (α value), half-saturation light intensity (Ik) and maximum electron transport rate (ETRmax). The aim was to reveal the nitrogen response mechanism of diatoms and provide a reference for controlling algal blooms. Five nitrogen concentrations (0.5, 1, 2, 5, 10 mg/L) were set for each of the three nitrogen sources, with each treatment in triplicate. The algal cell density, chlorophyll a concentration and chlorophyll fluorescence parameters of each treatment were determined every two days during the 21-day experiment. Results show that the growth and chlorophyll fluorescence parameters of S. hantzschii varied significantly with treatment (nitrogen source). Higher nitrogen concentrations, to a degree that depended on the form, promoted the growth and improved chlorophyll fluorescence of S. hantzschii. The specific growth rate of the sodium nitrate treatment group was highest, followed by the urea group and ammonium chloride group. The specific growth rates of sodium nitrate groups with nitrogen concentrations of 0.5 mg/L, 1.0 mg/L and 10 mg/L were all higher than those of the ammonium chloride and urea groups with the same nitrogen concentrations. The specific growth rate for the 10 mg/L nitrate-N treatment group reached 0.124, which was 46.1% higher than the ammonium chloride group and 19.4% higher than the urea group. Nitrate clearly promotes the growth of S. hantzschii better than ammonia or urea. Further, a nitrogen concentration exceeding 5 mg/L in the form of ammonium chloride or 10 mg/L in the form of urea, significantly reduced the chlorophyll fluorescence parameters and growth of S. hantzschii, and the reduction in photosynthetic parameters occurred in the early and middle growth stages. In addition, we found that S. hantzschii adapted to nitrogen deficiency by increasing the utilization efficiency of light energy (i.e., the α value increased at low nitrogen concentrations). To summarize, the concentration of nitrogen in water affects the photosynthesis of S. hantzschii, consequently affecting its growth.
Key words: Stephanodiscus hantzschii;nitrogen;diatom blooms;chlorophyll fluorescence
