黑果枸杞花色苷提取工艺优化及抗氧化研究
薛海瑞 李国秀 孙意冉 王韬宇 樊云芳 唐琳

摘 要 :為探究黑果枸杞花色苷最佳提取工艺和抗氧化活性,采用超声酶辅助提取法、乙醇/硫酸铵双水相萃取法、乙醇/磷酸二氢钠双水相萃取法提取黑果枸杞花色苷,通过响应面优化提取工艺,并使用 t -BHP诱导BRL 3A细胞建立抗氧化模型来探索黑果枸杞花色苷的氧化应激保护作用.结果表明,超声酶辅助提取得率为:(17.92±0.04) mg/g;乙醇/硫酸铵双水相萃取得率为:(15.46±0.31) mg/g; 乙醇/磷酸二氢钠双水相萃取得率为:(15.02±0.19) mg/g.体外抗氧化实验表明,乙醇/硫酸铵双水相萃取的花色苷(LRN)抗氧化活性最强,纯化后的乙醇/硫酸铵双水相萃取的花色苷(LRNA)可通过减少细胞中ROS的产生来缓解t-BHP诱导的氧化损伤.综上所述,该工艺便捷、稳定可用于黑果枸杞花色苷的提取,同时证明了LRN抗氧化活性最强.
关键词 :黑果枸杞; 花色苷; 响应面; 抗氧化; 活性氧;
中图分类号 : Q949.95 文献标识码 :A DOI : 10.19907/j.0490-6756.2023.046004
收稿日期: 2022-10-21
基金项目: 宁夏回族自治区重点研发计划(2022BBF0100103)
作者简介: 薛海瑞(1997-), 男, 山西省太原人, 硕士研究生, 主要研究领域为药用天然产物.
通讯作者: 唐琳.E-mail:tanglin@scu.edu.cn
Research on optimization of the extraction process and antioxidant activity of anthocyanins from Lycium ruthenicum Murr.
XUE Hai-Rui 1, LI Guo-Xiu 1, SUN Yi-Ran 1, WANG Tao-Yu 1, FAN Yun-Fang 2, TANG Lin 1
(1. Key Laboratory of Bio-Resource and Eco-Environment of Ministry of Education, College of Life Sciences, Sichuan University, Chengdu 610065, China;
2. Lycium Barbarum Research Institute, Ningxia Academy of Agricultural and Forestry Sciences, Yinchuan 750000, China)
To investigate the optimal extraction process and antioxidant activity of anthocyanins of Lycium ruthenicum Murr., the anthocyanins of Lycium ruthenicum Murr. were extracted by ultrasonic enzyme-assisted extraction, ethanol/ammonium sulfate aqueous two-phase extraction, ethanol/sodium dihydrogen phosphate aqueous two-phase extraction, and the extraction process was optimized by response surface methodology, the antioxidant model of BRL 3A cells induced by t -BHP was used to explore the protective effect of Lycium ruthenicum Murr. anthocyanins on oxidative stress. The results showed that the yield of ultrasonic enzyme assisted extraction was (17.92 ± 0.04) mg/g; the yield of ethanol/ammonium sulfate aqueous two-phase extraction was (15.46 ± 0.31) mg/g; the extraction yield of ethanol/sodium dihydrogen phosphate aqueous two-phase system was (15.02 ± 0.19) mg/g. The in vitro antioxidant experiments showed that the antioxidant activity of anthocyanins (LRN) extracted by EtOH/(NH 4) 2SO 4 aqueous two-phase extraction was the strongest, purified EtOH/(NH 4) 2SO 4 aqueous two-phase extraction of anthocyanins (LRNA) can alleviate t -BHP-induced oxidative damage by reducing ROS production in cells. In summary, this process is convenient and stable and can be used for the extraction of anthocyanins from Lycium ruthenicum Murr. At the same time, it also proves that LRN has the strongest antioxidant activity.
Lycium ruthenicum Murr.; Anthocyanins; Response surface; Antioxidant; ROS
1 引 言
黑果枸杞( Lycium ruthenicum Murr.)为茄科枸杞属植物,是我国西北地区特有的耐旱、耐碱、耐盐生灌木植物.其果实中含有丰富的花青素、类胡萝卜素、维生素等多种营养成分 [1] , 关于黑果枸杞化学成分的研究目前主要有多糖类、黄酮类、花色苷类、生物碱类、精油和脂肪酸类,现代药学研究表明,黑果枸杞具有抗氧化、抗疲劳、降血糖、降血脂、保肝护肾、免疫调节 [2-4].
花色苷是黑果枸杞中重要的抗氧化活性成分,目前已知的黑果枸杞花色苷种类主要有:飞燕草素、矮牵牛素、矢车菊素、天竺葵素、芍药素等以及衍生的糖苷 [5].前人对花色苷物质进行了大量的活性研究,包括抗氧化、降血脂、抗衰老、抗肿瘤、抑菌等活性研究,但当前对黑果枸杞花色苷提取工艺的研究不够全面,存在的问题主要是花色苷得率较低、目的物质失活、提取物杂质成分较多难以获取较高纯度花色苷、提取成本较高且污染较大等 [6,7],如何高效经济的获取高纯度花色苷是研究重点.提取花色苷的常用方法主要有有机溶剂萃取法、超临界流体萃取法、微波提取法、超声波辅助提取法、生物酶辅助提取法等,随着生物学提取工艺的发展,现在单一的提取方法并不能满足对活性成分得率高、活性强的需求,双水相萃取法由于得率较高、经济环保、且有一定的纯化作用逐渐应用到花色苷的提取中 [8].
响应面作为一种优化提取的方法,它将提取实验中目的物质得率作为一个或多个因素(如料液比、乙醇浓度等)的函数,并通过图形将这种函数关系直观的体现出来,并提供最优的提取方案,此方法普遍应用于中药活性成分的提取工艺研究中 [9].在本实验室以往的研究中对比了青海、甘肃、宁夏、新疆等地黑果枸杞花色苷的含量,其中青海省最高,所以本实验以青海省黑果枸杞为实验材料,通过超声酶辅助提取、乙醇/硫酸铵双水相萃取、乙醇/磷酸二氢钠双水相萃取提取黑果枸杞花色苷,并通过响应面对提取工艺进一步优化获取最佳提取工艺,为后续的工业提取提供理论参考.
目前对双水相萃取得到的花色苷抗氧化能力研究较少,且针对黑果枸杞不同提取方法所得花色苷体外抗氧化能力对比研究的资料缺乏.因此本研究采用体外抗氧化及细胞实验探究不同提取方法得到的花色苷样品体外抗氧化效果以及对 t -BHP诱导的正常大鼠肝细胞(BRL 3A)氧化应激损伤的保护作用,为后续的机制研究提供参考资料.
2 材料与方法
2.1 材料与仪器
以青海省的黑果枸杞为实验材料,经四川大学生命科学学院白洁副教授鉴定为茄科枸杞属黑果枸杞.
纯化后超声酶辅助法花色苷(LREA)、纯化后EtON/(NH 4) 2SO 4双水相萃取花色苷(LRNA)、纯化后EtOH/NaH 2PO 4双水相萃取花色苷(LRPA)由本实验室提供.大鼠肝细胞系(BRL 3A)为本实验室所冻存;
乙醇、VC、磷酸二氢钠、硫酸铵、铁氰化钾、三氯乙酸、三氯化铁、2,6-二叔丁基-4-甲基苯酚(BHT)等试剂均为分析纯(成都市科龙试剂化工厂);纤维素酶、果胶酶购买于成都瑞芬思公司;DMEM培養基、磷酸盐缓冲液(PBS)、胰蛋白酶均购于美国Hyclone公司,胎牛血清购于塞尔博克斯生物制品有限公司;DCFH-DA荧光探针购于南京建成生物工程研究所;DPPH和ABTS购于Sigma-Aldrich中国公司;水为超纯水.MS 半微量电子精密分析天平 ( 瑞士 Mettler-Toledo 公司 );离心机 H1850 型 ( 长沙 湘仪离心机仪器有限公司 );冷冻干燥机(宁波市鄞州仪器有限公司); pH计(希玛科技有限公司);KH-300DB型数控超声波清洗器(昆山禾创超声仪器有限公司).
2.2 方 法
2.2.1 超声酶辅助提取单因素实验 固定各因素变量为酶添加量1.0 mg/g、70%乙醇(v/v)、料液比25 mL/g、温度45 ℃、pH 3.0、时间30 min;选择超声提取时间、液料比、乙醇浓度为3个因素;时间(10 min、20 min、30 min、40 min、50 min);液料比(15、20、25、30、35 mL/g);乙醇浓度(50%、60%、70%、80%、90%),采用pH示差法测定花色苷含量 [10],每组实验重复3次.
2.2.2 双水相萃取单因素实验 固定各因素变量为24%乙醇、液料比25 mL/g、温度45 ℃、pH3.0、时间30 min、硫酸铵质量分数24%、磷酸二氢钠质量分数24%;选择乙醇质量分数、萃取时间、硫酸铵质量分数、磷酸二氢钠质量分数为4个因素;乙醇质量分数(20%、22%、24%、26%、28%);萃取时间(20 min、30 min、40 min、50 min、60 min);硫酸铵质量分数(21%、22%、23%、24%、25%);磷酸二氢钠质量分数(20%、22%、24%、26%、28%),花色苷含量测定同2.2.1,每组实验重复3次.
2.2.3 Box-Behnken法优化实验 根据单因素实验的实验结果选择提取时间-液料比-乙醇浓度、乙醇浓度-萃取时间-硫酸铵质量分数、乙醇浓度-萃取时间-磷酸二氢钠为超声辅助提取法(LRE)、乙醇/硫酸铵双水相萃取法(LRN)、乙醇/磷酸二氢钠双水相萃取法(LRP)的自变量,以花色苷含量作为响应值 [11],花色苷含量测定同2.2.1,利用Design-Expert 8.0.6软件,根据Box-Behnken法设计三因素三水平的响应面,设计实验因素水平见表1~3.每组实验重复3次.
2.2.4 DPPH自由基清除实验 准确移取2 mL样品溶液(6.25~200 μg/mL)至试管内,另加入2 mL DPPH乙醇溶液(0.1 mol/L),搖匀后,避光放置30 min,以无水乙醇作空白对照,VC做阳性对照测517 nm波长处吸光度,平行测定3次. DPPH自由基清除率=[ 1-(Ai-As)/Ac]×100%其中,Ai代表实验组吸光度值,As代表样品本底吸光度值,Ac代表空白组吸光度值 [12].
2.2.5 ABTS自由基清除实验 准确移取2 mL样品溶液(6.25~200 μg/mL)至试管内,与ABTS自由基溶液等体积混合,以无水乙醇作空白对照,VC做阳性对照,室温反应30 min.用酶标仪测定734 nm处的吸光值 [13].ABTS自由基清除能力计算公式同“2.2.1”项.
2.2.6 总还原力测定 先加入25 μL不同浓度(6.25~200 μg/mL)的样品溶液、BHT,25 μL的无水乙醇,分别作为实验组、阳性对照组及空白组.每组再加入50 μL PBS溶液(0.2 mol/L、pH 6.6)和25 μL 1%的铁氰化钾水溶液,震荡摇匀,45 ℃孵育1 h.最后加入50 μL 10%的三氯乙酸和60 μL 0.1%的三氯化铁,震荡摇匀,在700 nm处用酶标仪测定各反应液的吸光值,总还原力的强弱与吸光值大小呈正比 [14].
2.2.7 细胞培养 大鼠肝细胞系BRL 3A细胞用DMEM低糖培养基(培养基中含有1%青霉素-链霉素、10%胎牛血清)置于37 ℃细胞培养箱中培养,CO 2浓度为5%.待细胞汇合度达到约80%~90%时,将细胞传代培养,然后取处于对数生长期的细胞进行后续实验.
2.2.8 t -BHP诱导BRL 3A细胞损伤模型的建立 取处于对数生长期的BRL 3A细胞,经胰酶消化后,用DMEM低糖培养基重悬为单细胞悬液,以 4×10 4细胞/mL接种于96孔板中,每孔加100 μL细胞悬液,过夜培养,待细胞汇合度达到70%~80%后吸出培养基,进行后续实验.实验分组如下:(1) 对照组:加入100 μL无血清培养基继续培养;(2) 模型组:加入100 μL含不同浓度 t- BHP(200、 300、 400、 500、 600、 700、 800和900 μmol/L)的无血清培养基.每组设置3个复孔,于细胞培养箱中培养2 h后,吸去培养基,每孔加入100 μL含10% CCK-8的无血清培养基, 于细胞培养箱中避光孵育1 h,用酶标仪测定各孔在450 nm处的吸光值,细胞存活率用模型组/对照组×100%表示.
2.2.9 细胞毒性实验 细胞前期处理同2.2.8.实验分组如下:(1)对照组:加入100 μL无血清培养基继续培养;(2)实验组:加入100 μL含不同浓度花色苷样品(25~200 μg/mL)的无血清培养基.每组设置3个复孔,于细胞培养箱中培养24 h后,后续测定步骤同2.2.8,细胞存活率用实验组/对照组×100%表示.
2.2.10 细胞保护实验 细胞前期处理同2.2.8.实验分组如下:(1) 对照组:加入100 μL无血清培养基继续培养,培养12 h后,再加入100 μL无血清培养基继续培养2 h;(2) 药物组:加入100 μL无血清培养基,培养12 h后,再加入100 μL含200 μmol/L t -BHP的无血清培养基处理2 h;(3) 实验组:加入100 μL含不同浓度花色苷样品(10~100 μg/mL)的无血清培养基处理细胞12 h,再加入100 μL含200 μmol/L t -BHP的无血清培养基处理2 h.后续测定步骤同2.2.8,细胞存活率分别用药物组/对照组×100%和实验组/对照组×100%表示.
2.2.11 活性氧检测 取处于对数生长期的BRL 3A细胞,以5×10 4细胞/mL接种于12孔板中,每孔加1 mL细胞悬液.过夜培养后吸出培养基,PBS清洗细胞2次.对照组和模型组加入500 μL无血清培养基,实验组加入500 μL含LRN、LRNA(60 μg/mL)无血清培养基,在培养箱培养12 h后,对照组继续加入500 μL的无血清培养基,模型组和实验组均加入500 μL含200 μmol/L t -BHP的无血清培养基,继续培养2 h后,吸去培养基,PBS 清洗两次,对照组、模型组和实验组均加入500 μL 10 μmol/L的DCFH~DA探针,在37 ℃避光中染色30 min用倒置荧光显微镜观察各组细胞荧光强度的变化.
细胞培养操作同上,将细胞收集转移到流式专用管,用流式细胞仪检测细胞ROS含量变化情况,并用FlowJo软件进行分析.
2.2.12 细胞线粒体膜电位变化检测 取对数生长期的BRL 3A细胞以5×10 4细胞/mL的密度接种于12孔板,培养12 h,对照组和模型组加入500 μL无血清培养基,实验组加入500 μL 60 μg/mL的LRN、LRNA预处理4 h,再加入200 μmol/L t -BHP损伤2 h,吸走培养液,用500 μL PBS漂洗2次,每孔加入500 μL JC-10染液,于室温避光孵育30 min,吸走染液,用PBS洗去未结合的JC-10染液,每孔加入500 μL无血清培养基,在倒置荧光显微镜下观察并拍照.
细胞培养操作同上,将细胞收集转移到流式专用管,用流式细胞仪检测细胞线粒体膜电位变化情况,并用FlowJo软件进行分析.
3 结果与分析
3.1 黑果枸杞花色苷提取单因素实验
采用2.2.1所述方法,超声酶辅助提取法图1a~1c表明,乙醇浓度70%,提取时间为30 min,液料比为25 mL/g条件下花色苷的提取效果最好.在50%~90%浓度范围内,提取溶剂的极性由大变小,提取溶剂的渗透力由小变大.超声时间过短,不利于黑果枸杞细胞内花色苷的释放;时间过长,花色苷的分子结构会受到超声所产生的机械能量的破坏,降低花色苷的提取含量.液料比过低在一定的时间内不能完全溶解花色苷,所以在15~25 mL/g范围内,花色苷的含量逐渐上升.
乙醇/硫酸铵双水相萃取法图1 d、1 e和1 f表明,乙醇质量分数为24%,硫酸铵质量分数为23%,萃取时间30 min时花色苷的提取含量达到最大.当乙醇质量分数为24%时体系极性刚好与黑果枸杞花色苷相近,极性过高过低都不利于花色苷的释放.硫酸铵质量分数过高,下相无机盐富集相争夺水分子相较上相乙醇溶液增强,导致上相乙醇富集相极性下降,花色苷是高极性物质,因此花色苷提取含量下降.
随萃取时间的延长,花色苷含量逐渐上升,30 min后花色苷含量随时间的延长而逐渐减少.可能是较长的萃取时间伴随超声作用所产生的机械能量会使花色苷结构受到破坏,从而引起花色苷提取含量下降.
乙醇/磷酸二氢钠双水相萃取法图1f、1g和1i表明,乙醇质量分数为24%,磷酸二氢钠质量分数为26%,萃取时间在30 min时花色苷含量最高.当硫酸铵质量分数超过26%时,花色苷的提取含量出现下降趋势,原理与EtOH/(NH 4) 2SO 4双水相体系相似,但是花色苷含量最大值对应的无机盐质量分数不同,可能是因为磷酸二氢钠较硫酸铵更溶于水. 萃取时间在30~40 min含量几乎没有变化,但随着萃取时间延长,40 min后花色苷含量有所下降,可能是因为萃取时间延长伴随超声产生的机械能量破坏花色苷结构,导致花色苷降解,从而使花色苷含量降低.
3.2 黑果枸杞花色苷提取工艺优化
3.2.1 超声酶辅助提取工艺优化 实验方案设计及结果如表4,经Design-Expert 8.0.6 软件回 归拟合,得到二次多项回归方程:花色苷含量(mg/g)= 13.22+0.29 A+ 0.21B+0.36C-0.11AB-0.055AC+0.027BC-0.67A 2-0.45B 2+0.000C 2.由方程可知,表示方程所对应的曲线是开口向下的抛物线,抛物线的最高点为花色苷含量最大值点.各提取因素对花色苷提取含量的影响程度可以由此方程中各单项系数绝对值的大小反映,值越大,影响程度越重要.各提取因素影响的重要程度为: C (乙醇浓度)> A (液料比)> B (提取时间).
由表5可知,0.01< P <0.05代表模型差异显著;失拟项( P =0.3207>0.05)不显著,表明模型能有效模拟实际情况;矫正 R 2=0.8361 能够说明83.61%花色苷含量的变化.一次项 C 影响显著,A、B 影响不显著,交互项影响不显著,二次项 A 2、 B 2影响显著.说明此法对花色苷提取含量影响最大的因素是乙醇浓度.
应用Design-Expert 8.0.6软件求解经过优化的回归方程得出,当提取温度为45 ℃,纤维素酶添加量为1.0 mg/g时,超声酶辅助提取黑果枸杞花色苷的最佳工艺条件为:液料比25.07 mL/g,提取时间30 min,乙醇浓度75%.修正条件为:液料比25 mL/g,提取时间30 min,乙醇浓度75%.在此条件下提取得到的花色苷含量为(17.92±0.02)mg/g,与预测值基本相近,说明此响应面得出的最优条件是可行的.
3.2.2 乙醇/硫酸铵双水相萃取工艺优化 实验方案设计及结果如表6,经Design-Expert 8.0.6 软件回归拟合,得到二次多项回归方程:花色苷含量(mg/g)=15.51+0.31 A+0.091B-0.39C+0.94AB-0.49AC+0.34BC-1.03A 2-0.76B 2-0.83C 2.通过对A、B、C项系数绝对值的大小比较,各提取因素影响的重要程度顺序为:C(硫酸铵质量分数)>A(乙醇质量分数)>B(萃取时间).
由表7可知, P <0.01代表模型差异极显著;0.01< P <0.05代表模型差异显著;失拟项( P =0.25>0.05)不显著,表明模型能有效模拟实际情况;矫正 R 2=0.9410 能够说明94.1%花色苷含量的变化.一次项 C影响极显著,A影响显著,B影响显著,交互项影响中AB、AC极显著,BC 显著,二次项 A 2、 B 2、 C 2影响极显著.在 EtOH/(NH 4) 2SO 4双水相萃取花色苷中,每个提取因素都对花色苷的提取含量有显著影响.
应用Design-Expert 8.0.6软件求解经过优化的回归方程得出,响应面预测最佳方案为乙醇质量分数为24.61% ,萃取时间35.92 min,硫酸铵质量分数22.72%,预测黑果枸杞花色苷的提取含量为15.62 mg/g.根据实验条件修正方案为乙醇质量分数为25% ,萃取时间36 min,硫酸铵质量分数为23%,在此条件下得到的花色苷含量为(15.46±0.31) mg/g,实际结果与预测值基本相符,说明了模型很好地预测了实际情况,响应面得到的最优条件是可行的.
3.2.3 乙醇/磷酸二氢钠双水相萃取工艺优化 实验方案设计及结果如表8,经Design-Expert 8.0.6 软件回归拟合,得到二次多项回归方程:花色 苷含量(mg/g)=15+ 0.15A+0.58B+0.42C- 0.20AB-0.075AC+0.25C-0.65A 2-0.93B 2-0.72C 2.通过对A、B、 C项系数绝对值的大小比较,各因素影响的重要程度顺序为:B(萃取时间)> C(磷酸二氢钠质量分数)>A(乙醇质量分数).
由表9可知,0.01< P <0.05代表模型差异显著; P <0.01代表模型差异极显著;失拟项( P =0.0959>0.05)不显著,表明模型能有效模拟实际情况;矫正 R 2=0.9754 能够说明97.54%花色苷含量的变化.在EtOH/NaH 2PO 4双水相萃取花色苷中,每个提取因素都对花色苷的提取含量有显著影响.应用Design-Expert 8.0.6软件求解经过优化的回归方程得出,最佳方案为乙醇质量分数24.08%,萃取时间为36.77 min,磷酸二氢钠质量分数为26.71%.为实验方便修正为乙醇质量分数24%,萃取时间为37 min,磷酸二氢钠质量分数为27%,在此条件下提取花色苷含量为(15.02±0.19) mg/g,说明响应面很好的预测了实际情况,得出的最优条件是可行的.
3.3 黑果枸杞花色苷体外抗氧化活性结果
采用2.2.1所述方法,结果如图2a、2b和2c所示,在6.25~200 μg/mL范围内,黑果枸杞花色苷LRN、LRP、LRE对DPPH自由基清除效果呈浓度依赖效应,不同提取方法的清除能力强弱顺序为:LRN>LRP>LRE. 在6.25~200 μg/mL范围内,黑果枸杞花色苷LRN、LRP、LRE均浓度依赖性对ABTS有清除作用,不同提取方法的清除能力强弱顺序为:LRN>LRP>LRE.在6.25~200 μg/mL浓度范围内,黑果枸杞花色苷LRN、LRP、LRE均浓度依 赖性地反映了总还原能力的强弱,不同提取方法总还原能力强弱顺序为:LRN>LRP> LRE.采用斜率K值来反映不同花色苷样品的总还原能力,斜率值越大,表明总还原能力越强,如表10所示. 不同花色苷样品的IC 50值见表10.
3.4 t -BHP诱导BRL 3A细胞损伤模型的建立
本实验采用不同处理浓度 t -BHP(200、300、400、500、600、700、800和900 μmol/L)处理2 h来建立BRL 3A细胞损伤模型,由图3可知, t -BHP浓度为200 μmol/L时,细胞存活率与对照组相比显著下降,为26%左右;确定本实验中 t -BHP 对BRL 3A细胞最佳损伤浓度和时间为200 μmol/L和2 h.
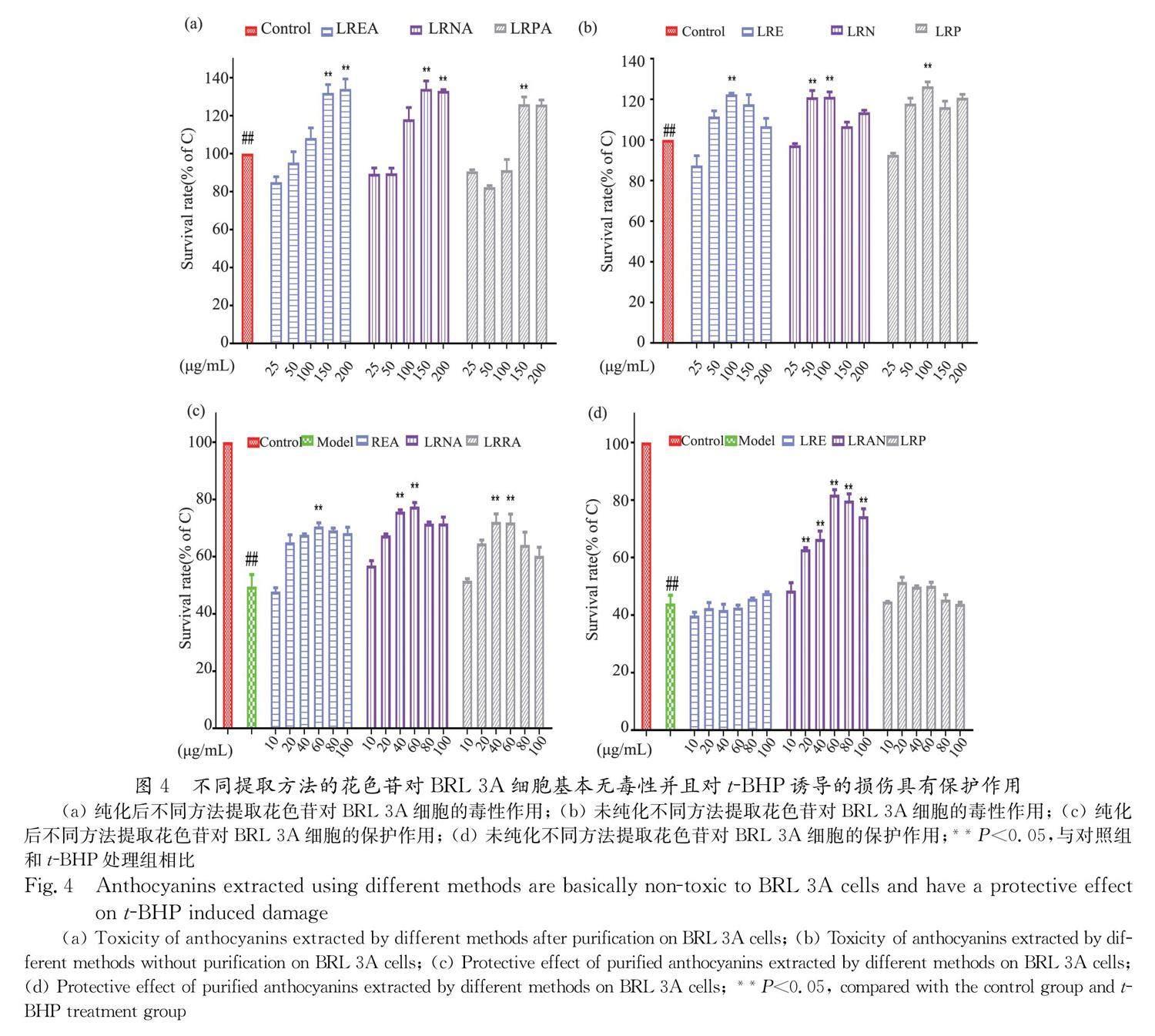
3.5 黑果枸杞花色苷对BRL 3A细胞毒性实验和保护作用
由图4a和4b可知,在25~200 μg/mL浓度范围内,花色苷样品对BRL 3A细胞基本无毒副作用,此浓度范围可用于后续的实验研究.由图4c和4d可知, t -BHP损伤之后细胞存活率下降到44%,在10~100 μg/mL浓度范围内,LREA、LRNA、LRPA、LRE、LRN、LRP细胞存活率最高分别恢复到71%、78%、72%、46%、81%和51%.当花色苷浓度小于60 μg/mL时,LREA、LRNA、LRPA、LRN对BRL 3A 细胞的保护作用均呈浓度依赖效应,花色苷浓度为60 μg/mL时对损伤细胞的保护效果最好.当花色苷浓度大于60 μg/mL,LREA、
LRNA、LRPA、LRN花色苷对细胞的保护效果逐渐降低.LRE、LRP在10~100 μg/mL浓度范围内 没有显著细胞保护作用.综上,在后续实验中,选用60 μg/mL继续探究不同花色苷样品的细胞保护作用.
3.6 黑果枸杞花色苷对 t -BHP诱导损伤的BRL 3A细胞内活性氧的清除作用
利用 DCFH-DA 荧光探针,通过倒置荧光显微镜观察ROS的生成,荧光强度与细胞内 ROS积累量呈现正相关.由图 5荧光图以及流式量化结果分析可知,与对照组相比,模型组荧光强度显著增加,而LRN、LRNA花色苷处理组细胞的活性氧积累量显著降低,清除ROS效果优于LRP、LRPA、LRE、LREA,说明 LRN、LRNA、LREA、LRPA 都能有效减缓 t -BHP诱导的BRL 3A 细胞内 ROS生成.流式结果图5c表明LRN、LRNA清除 ROS效果较好,后续选择LRN、LRNA进行细胞膜损伤实验分析.
3.7 黑果枸杞花色苷对 t -BHP诱导的BRL 3A 线粒体损伤的保护作用
本实验利用JC-10荧光探针,通过倒置荧光显微镜和流式细胞仪观察线粒体的损伤程度.由图6a可知模型组绿色荧光明显,说明线粒体膜电位下降,细胞膜受损,加药处理后可以观察到绿色荧光显著降低红色荧光显著增强,说明LRN、LRNA对线粒体具有保护作用,结合流式结果图6b、6c可知LRN、LRNA对 t -BHP诱导的细胞凋亡和线粒体损伤具有明显的保护作用.
4 讨 论
本研究采用单因素实验和响应面分析对不同提取方法进行了工艺优化,对比了不同方法提取得到的黑果枸杞花色苷的体外抗氧化活性.
传统提取方法辅助手段单一且提取效率不高,本课题组采用超声波与纤维素酶两种手段辅助提取花色苷,得率更高.采用双水相萃取,与传统方法相比可以实现主要成分的纯化,条件更加温和,且不容易导致目的物质变性 [15].通过响应面,优化了提取工艺,从而获得了黑果枸杞花色苷的最佳提取得率,为进一步的工业提取提供了基础资料.
体外抗氧化实验(DPPH、ABTS自由基清除实验、总还原力测定实验),可以直接反应被检测物质的抗氧化活性,可以作为初步的 体外抗氧化活性筛选.经过三种体外抗氧化实验研究,不同提取方法取得的花色苷体外抗氧化能力强弱的顺序为:LRN>LRP>LRE,说明双水相萃取的花色苷活性更强.
在细胞实验中,使用 t -BHP 建立了BRL 3A 细胞损伤模型,通过检测细胞活力、ROS水平、细胞线粒体膜电位变化,探究不同花色苷样品对 t -BHP诱导的BRL 3A细胞氧化应激损伤的保护作用.细胞毒性实验中,不同方法提取的花色苷样品均对BRL 3A细胞无毒性,甚至表现出了一定的增殖效果. LRE、LRP在DPPH自由基清除实验、ABTS自由基清除实验、总还原力测定实验中表现出了一定的抗氧化能力,但是体外抗氧化实验并不能完全模拟生物的体内环境,所以在细胞内进一步验证了抗氧化能力.在细胞保护实验中,未纯化的LRE、LRP花色苷样品没有表现出明显的保护作用,但纯化后的LRE、LRP对细胞的保护作用显著提升,基本达到了和LRNA一样的水平,可能是纯化后生物活性成分纯度增加,从而提升了其对BRL 3A的保护能力.根据细胞保护实验结果,筛选出LRN、LRNA继续进行ROS和细胞线粒体膜电位检测.通过荧光显微镜和流式细胞仪定量分析结果表明LRN、LRNA可通过减少细胞中ROS的产生及减少细胞膜损伤,缓解 t -BHP诱导的 BRL 3A细胞氧化应激损伤.
核转录因子E2相关因子(Nrf2)通路是体内重要的抗氧化应激通路,在静息状态下,Nrf2维持在一个较低的水平,当机体受到氧化应激时,Nrf2磷酸化与Keap1解耦联,迅速核转位与下游的抗氧化反应元件(ARE)结合,调节一系列下游抗氧化蛋白的表达 [16].在肝细胞、肠细胞、上皮细胞和外周单核血细胞中,花色苷给药降低了ROS的产生 [17].在小鼠巨噬细胞中,富含花色苷的生物活性成分增加了Nrf2的表达,SOD、CAT、GR、GPx、GSH和HO-1表达也增加 [18].在Tang等人 [19]的研究中枸杞花色苷可以保护H 2O 2诱导的PC12细胞氧化损伤,增强CAT,SOD和GSH-Px等抗氧化酶的表达.因此,我们认为黑果枸杞花色苷可能是通过Nrf2/ARE通路缓解 t -BHP诱导BRL 3A细胞的氧化损伤.
综上所述,本实验优化了黑果枸杞提取工艺,比较了不同提取工艺的花色苷体外抗氧化活性,以及对 t -BHP诱导的正常大鼠肝细胞BRL-3A细胞氧化应激损伤的保护作用,为后续的功能验证实验提供了重要的理论依据.
参考文献:
[1] 韩文凯, 汪璐, 王水潮, 等. 不同产地黑果枸杞的生药学研究[J]. 上海中医药大学学报, 2021, 35: 82.
[2] Liu Z, Dang J, Wang Q, et al . Optimization of polysaccharides from Lycium ruthenicum fruit using RSM and its anti-oxidant activity[J]. Int J Biol Macromol, 2013, 61: 127.
[3] Ni W, Gao T, Wang H, et al . Anti-fatigue activity of polysaccharides from the fruits of four Tibetan plateau indigenous medicinal plants[J]. J Ethnopharmacol, 2013, 150: 529.
[4] Wang J H, Chen X Q, Zhang W J. Study on hypoglycemic function of polysaccharides from Lycium ruthenicum Murr. fruit and its mechanism [J]. Food Sci, 2009, 30: 244.
[5] 罗静, 丁永胜, 赵程博文, 等. Box-Behnken响应面法优化黑果枸杞花色苷纯化工艺及其成分分析[J]. 中华中医药杂志, 2020, 35: 406.
[6] 范业刚, 曹利慧.花色苷提取方法研究进展[J].安徽化工, 2022, 48: 6.
[7] Hu A J, Hao S T, Zheng J, et al . Multi-frequency ultrasonic extraction of anthocyanins from blueberry pomace and evaluation of its antioxidant activity [J]. J AOAC Int, 2020, 104: 811.
[8] 李敏. 双水相萃取与双水相浮选技术在生物产品及中药材分离测定中的应用[D].北京: 北京化工大学, 2010: 2.
[9] 李灵, 熊芸, 张钰瑶, 等. 响应面法优化猕猴桃类胡萝卜素提取工艺[J]. 四川大学学报: 自然科学版, 2022, 59: 056002.
[10] 齐美娜. 紫色马铃薯中花色苷的提取、产品研制及其抗氧化活性的研究[D]. 哈尔滨: 东北农业大学, 2013: 14.
[11] Benchikh Y, Aissaoui A, Allouch R, et al . Optimising anthocyanin extraction from strawberry fruits using response surface methodology and application in yoghurt as natural colorants and antioxidants [J]. J Food Sci Technol, 2021, 58: 1987.
[12] Peng X, Tan Q, Wu L, et al . Ferroptosis Inhibitory aromatic abietane diterpenoids from ajuga decumbens and structural revision of two 3, 4-Epoxy Group-Containing abietanes [J]. J Nat Prod, 2022, 85: 1808.
[13] Fu R, Zhang Y T, Guo Y R, et al . Antioxidant and anti-inflammatory activities of the phenolic extracts of Sapium sebiferum (L.) Roxb. leaves [J]. J Ethnopharmacol, 2013, 147: 517.
[14] He J, Huang B, Ban X, et al . In vitro and in vivo antioxidant activity of the ethanolic extract from Meconopsis quintuplinervia [J]. J Ethnopharmacol, 2012, 141: 104.
[15] 李国秀, 王晶金, 高婷彦, 等. 不同方法提取黑果枸杞花色苷效果比较[J]. 农村科学实验, 2021, 30: 181.
[16] Ulasov A, Rosenkranz A, Georgiev G, et al . Nrf2/Keap1/ARE signaling: towards specific regulation[J]. Life Sci, 2021, 291: 120111.
[17] Jensen G S, Wu X, Patterson K M, et al . In vitro and in vivo antioxidant and anti-inflammatory capacities of an antioxidant-rich fruit and berry juice blend. Results of a pilot and randomized, double-blinded, placebo-controlled, crossover study [J]. J Agric Food Chem, 2008, 56: 8326.
[18] Garcia C, Blesso C N. Antioxidant properties of anthocyanins and their mechanism of action in atherosclerosis [J]. Free Radic Biol Med, 2021, 172: 152.
[19] Lee S G, Kim B, Yang Y, et al . Berry anthocyanins suppress the expression and secretion of proinflammatory mediators in macrophages by inhibiting nuclear translocation of NF-κB independent of NRF2-mediated mechanism[J]. J Nutr Biochem, 2014, 25: 404.

