成都东华门遗址土壤中细菌的分离鉴定及防治研究
吕杉 杨盛 劳光杰 谭雪梅


为了探究成都东华门遗址土壤中细菌群落的结构组成,研制具有针对性的抑菌剂,本研究在东华门遗址的微生物病害发生点进行采样,用稀释涂布平板法获得可培养细菌,纯培养后进行形态学和16S rDNA分子生物学鉴定. 结果显示:分离到的27株细菌中,以芽孢杆菌、假单胞菌和金黄杆菌为主.根据菌株亲缘关系和菌落颜色,选择8株亲缘关系较远、菌落颜色与病害发生点接近的关键菌株为靶标进行细菌防治探究. 研究表明:使用0.1%次氯酸钠与中药提取液(0.03 g/L大黄、0.3 g/L黄芩、0.3 g/L艾叶)复配后,具有与0.4%高浓度次氯酸钠相当的杀菌效果. 表明使用中药成分复配次氯酸钠,在不降低抑菌效果的前提下,能显著降低次氯酸钠的使用浓度.
东华门遗址; 细菌; 微生物病害; 文物保护
Q938A2023.016003
收稿日期: 2022-05-25
基金项目: 成都市文物考古工作队砖石类考古遗址现场保护服务项目(21H0698)
作者简介: 吕杉(2001-), 女, 陕西渭南人, 本科生, 研究方向为文物微生物病害.E-mail: 840419661@qq.com
通讯作者: 谭雪梅.E-mail: txmyyf@scu.edu.cn
Isolation, identification and control of bacteria in archeological earthen heritage site of Donghuamen in Chengdu
L Shan1, YANG Sheng2, LAO Guang-Jie1, TAN Xue-Mei1
(1. Key Laboratory of Bio-Resource and Eco-Environment of Ministry of Education, College of Life Sciences, Sichuan University, Chengdu 610064, China;
2.Chengdu Institute of Cultural Relics and Archaeology, Chengdu 610075, China)
To study the structure of bacterial community in the soil of Donghuamen Site in Chengdu in order to develop a targeted bacteriostatic agent, culturable bacterial strains were isolated from soil collected from the Donghuamen Site by the plate method, followed by the analysis of morphology and 16S rDNA sequence for the bacterial identification. The results showed that 27 dominant bacterial strains were isolated and identified, among which Bacillus, Pseudomonas and Aureus were the main ones. According to the phylogenetic tree and color of the colonies, eight key strains were selected for bacteriostatic trial. Sodium hypochlorite of 0.1%, if mixed with Chinese medicine extract of 0.03 g/L rheum officinale, 0.3 g/L baical skullcap root and 0.3 g/L artemisia argyi, had a comparable bacteriostatic effect compared with 0.4% sodium hypochlorite. This indicated that the use of sodium hypochlorite compounded with traditional Chinese medicine extract may reduce the concentration applied without decreasing its bacteriostatic effect.
Earthen heritage site of Donghuamen in Chengdu; Bacteria; Microbial corrosion; Preservation of cultural relics
1 引 言
古遗址是人类社会发展的历史见证,是历史研究的重要依据,反映了人类社会在各个阶段的文明特征,是人类宝贵的遗产[1]. 近年来,生物腐蚀对古遗址的损害也越来越受到关注[2]. 古遗址被发掘后暴露在空气中,低代谢速率的动态平衡被打破,大量微生物开始生长繁殖,造成严重的微生物病害,对文物产生不可逆转的损害[2]. 解析古遗址表面微生物组成结构是古遗址微生物病害防治研究的基础,为古遗址的保护提供了研究依据和思路.
东华门遗址位于成都市青羊区东华门街18号,是我国重要的城市遗址中心(图1a),浓缩了成都2000多年的历史,见证了民族文明的兴衰更迭[3]. 成都东华门遗址包括唐代摩诃池、明代蜀王府水道和清代贡院等重要历史遗址,是成都作为历史文化名城的重要文物支撑[4],具有极高的科学研究价值、历史价值和文化价值[4].
东华门遗址从2019年开始有微生物病害发生.通过现场生物病害调查发现,遗址表面发生了严重的微生物病害(图1b~1d). 微生物个体微小、能够迅速繁殖,其广泛存在于文物表面,对文物造成不可逆的损坏[5]. 微生物生长所分泌的酸性物质可能造成遗址表面严重腐蚀[6]. 细菌在代谢中产生的多种酸性次级代谢产物,可与文物的无机组分反应,严重损害其艺术价值和历史价值[7]. 研究表明细菌分泌的粘液可以腐蚀大理石等材质的文物[8]. 细菌产生的无机酸,如硝酸和亚硝酸等,会直接腐蚀文物表面[9]. 除细菌外,真菌也是一类最活跃的腐蚀石质文物的微生物,能够通过改变环境中的pH来适应自身的生长[10]. 真菌和细菌生长繁殖后可能会产生色素,影响古遗址本体外观,严重威胁古遗址的原真性和完整性. 因此,研究成都东华门遗址的微生物病害及其防治研究具有重要的意义. 本文针对东华门微生物病害,进行了真菌病害和细菌病害的研究.由于真菌生长后给细菌提供营养成分,细菌可以在干燥等更严苛的石质环境中生存,所以本文重点研究了腐蚀细菌及其防控.
传统化学抑菌剂存在污染环境和腐蚀遗迹等问题,而文物因为常年埋藏,被发掘后暴露在空气中,容易发生开裂、剥离,因此,选用温和、高效的抑菌剂是文物保护的重要原则. 中草药属于天然药物,具有无污染、无毒副作用和残留毒物量少等优点,从中草药中筛选抗菌药物越来越受到国内外学者的广泛重视[11]. 次氯酸钠是一种广谱抑菌剂,杀菌效果优异,然而具有强氧化性,应用于文物可能会对文物结构造成损害. 艾叶为我国传统中药,具有除湿止痒、抗菌消炎和抗肿瘤等功效[12]. 大黄具有泻热毒、破积滞和行瘀血的作用,临床上也将其应用于治疗金黄色葡萄球菌感染导致的炎症[13]. 黄芩有较广抗菌谱,对痢疾杆菌、白喉杆菌、绿脓杆菌、葡萄球菌、链球菌、肺炎双球菌以及脑膜炎球菌等均有抑制作用,煎剂作喉头喷雾,对脑膜炎带菌者亦有效,即使对青霉素等抗菌素已产生抗药性的金黄色葡萄球菌对黄芩仍属敏感[14].
2 材料与方法
2.1 材 料
细菌基因组DNA提取试剂盒(天根生化科技有限公司),次氯酸钠,大黄、黄芩、五倍子、艾叶、蒲公英(成都贝斯特药房).
2.2 方 法
2.2.1 样本采样 依据前期对成都东华门遗址现场生物病害调查的结果,选取6个典型的微生物病害发生点,用无菌勺刮取样本于50 mL无菌离心管中,置于低温泡沫箱中,带回实验室.
2.2.2 细菌的分离、纯化及鉴定 取约2 g样本于15 mL无菌水中,在200 r/min,37 ℃下培养20 min使其混合均匀,将混合液浓度梯度稀释至10-3后涂布于LB固体培养基,并置于37 ℃培养箱中培养过夜;挑取不同形态特征的单菌落于LB固体培养基上继续纯化. 重复上述操作3~4次直至所有菌落形态一致,完成纯化.
挑取纯化后单菌落于4 mL LB液体培养基中,于200 r/min,37 ℃下培养过夜,按照1∶1的比例将菌种和50%的甘油混合保存,一份置于-20 ℃冰箱保存,一份置于-80 ℃冰箱保存[15].
2.2.3 细菌分子生物学鉴定 观察并记录纯化完成的菌株的形态特征,挑取纯化后细菌于4 mL LB液体培养基中,于200 r/min,37 ℃下培养过夜. 利用试剂盒提取细菌DNA,PCR扩增16S rDNA,正向引物为27F(5′-AGAGTTGATCCTGGCTCAG-3′),反向引物为1492R(5′-TACGGCTACCTTCTTACGACCTT -3′)[16]. PCR扩增体系为50 μL:将25 μL的2×Taq PCR PreMix、2 μL的27F、2 μL的1492R,1 μL的细菌DNA,20 μL的ddH2O混合反应. 反应结束后使用1%的琼脂糖凝胶电泳检验其产物,将条带清晰且明亮的PCR产物送至生工生物工程股份有限公司测序[17].
2.2.4 细菌的产酸情况测定 为了筛选出关键腐蚀菌株,本研究对分离到的细菌通过甲基红试验(M.R试验),伏普试验(V.P试验)[18],进行初筛.
2.2.5 抑菌实验 根据菌株的颜色和16S rDNA分子生物学鉴定结果,分析成都东华门遗址腐蚀微生物的关键菌株. 参考文献资料,选择对文物损伤较小的抑菌剂,初步选定化学成分的抑菌剂:低浓度次氯酸钠;中药:大黄、黄芩、五倍子、艾叶、蒲公英作为待选抑菌剂.
化学抑菌剂:配制浓度为4%的次氯酸钠溶液. 中药抑菌剂:使用水煎法[13]制备水提物,所配置的溶液近似认为1 g/mL[13],将配制的溶液高温高压灭菌.
采用十倍稀释法测定最小抑菌浓度(MIC),以LB液体培养基为稀释液,取培养基900 μL,在第1管中加入抑菌剂母液100 μL,使用涡旋震荡仪混匀[13],吸取该管混合液100 μL加至第2管,依次至第5管.取10 μL抑菌剂和90 μL 8log10 CFU/mL菌液混合均匀[13]. 于37 ℃下培养18~24 h 后,观察并记录细菌的生长状况,以浑浊度为指标检查试管中有无细菌生长,以不显示浑浊,细菌未生长的试管对应的药液稀释度即为最小抑菌浓度(MIC).
将直径为6 mm的定性滤纸片于梯度稀释后的抑菌剂中浸泡1 h后烘干,取 8log10 CFU/mL的对数期菌悬液100 μL于LB固体培养基涂布. 在平板上放置不同浓度的载药滤纸片,做好标记,培养过夜后,用游标卡尺测量抑菌圈直径.
3 结果和分析
3.1 细菌的分离和纯化
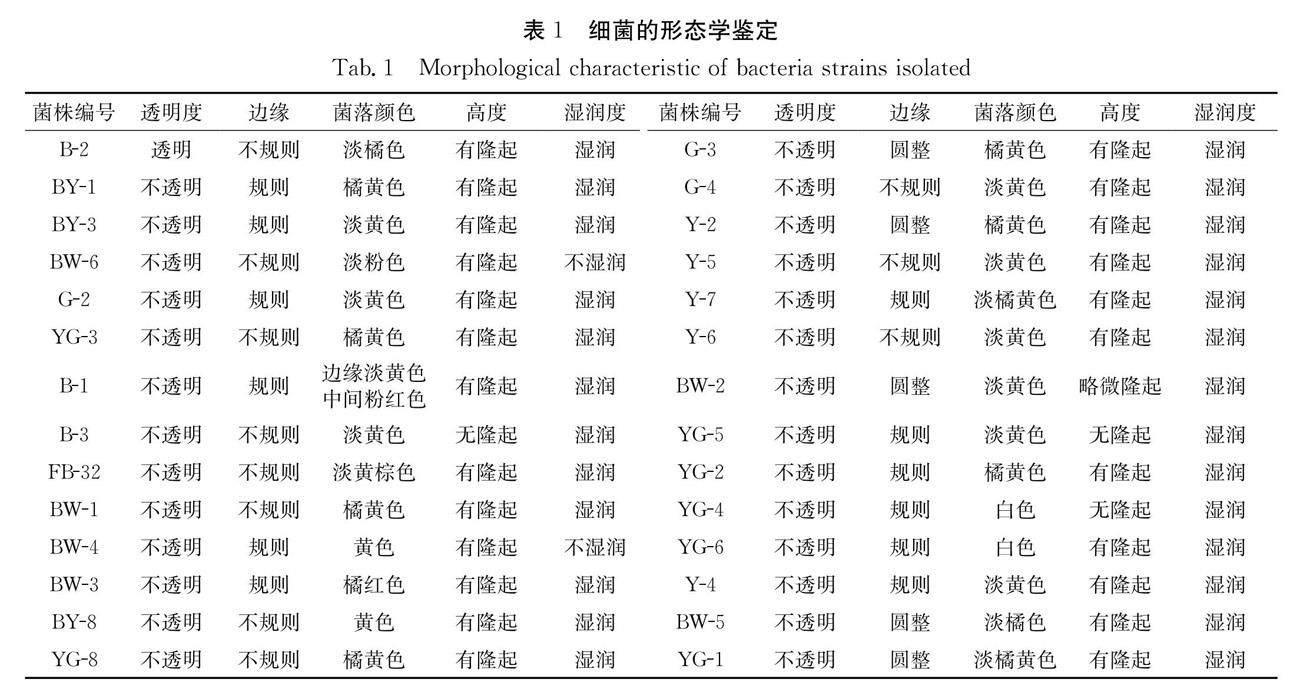
本研究共分离到27株细菌,除菌株B-2以外,其他26株的菌落均为不透明状态(表1),呈现多种颜色,以橘黄色和淡黄色为主,其次为淡橘黄色和白色(图2).
3.2 细菌的分子生物学鉴定
对分离纯化的 27株细菌的16S rDNA 序列进行BLAST对比,结果表明:成都东华门遗址典型微生物以芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)和金黄杆菌属(Chryseobacterium)为主(表2).其中芽孢杆菌属菌株14株,占总分离菌株的51.85%;假单胞属菌株5株,占18.52%;金黄杆菌属菌株3株,占11.11%. 本研究还分离到链霉菌属(Streptomyces)2株,橄榄形菌属(Olivibacter)2株,拟杆菌属(Fictibacillus)1株. 鉴定出所有菌株与已知菌株的同源性均在 98%以上.
根据16s rDNA测序结果,使用MEGA软件,选定标准菌株12株,绘制系统进化树(图3). 系统进化树表明,从不同微生物病害发生点采样分离的很多菌株的亲缘关系较近,部分菌株的亲缘达到100%,说明在露天环境下,部分种属的细菌在东华门遗址微生物病害中占据优势地位.
3.3 细菌的产酸测定
对分离的细菌进行M.R,V.P试验,测定其产酸情况,实验结果(表3)表明,假单胞菌属菌株Y-4、BW-3,芽孢杆菌属菌株BW-6、G-3、YG-4、YG-6、B-3和B-1,链霉菌属菌株G-2,橄榄形菌属菌株YG-1、YG-2,能够水解葡萄糖产酸,因此可能对东华门古遗址文物产生微生物腐蚀.
3.4 关键腐蚀菌株的确定
本研究根据种属关系,筛除亲缘关系相似的菌株,根据细菌的产酸情况,筛选能够产酸的菌株,并结合细菌菌落产生的颜色,选择产酸能力较强、对文物外观颜色影响较大的差异较大的菌株为关键菌,包括假单胞菌属菌株B-2,芽孢杆菌属菌株BW-6、BW-4、Y-6和BW-5,链霉菌属菌株G-2,金黄杆菌属菌株YG-8,橄榄形菌属菌株YG-2,进行后续的抑菌试验.
3.5 抑菌剂的最小抑菌浓度
以3.4中确定的关键菌株为靶标菌株,测定2种无机广谱杀菌剂与5种中药提取物的MIC(表4). 结果表明:无机杀菌剂中次氯酸钠杀菌效果显著且稳定,在0.04%~0.4%浓度范围内对关键腐蚀细菌生长有显著抑制效果,作用最强;5种中药提取物的杀菌效果各不相同,其中大黄的杀菌效果最显著,黄芩与艾叶也有比较明显的杀菌效果.
3.6 复配抑菌剂的抑菌圈测定
由于强氧化性的次氯酸钠等化学抑菌剂对文物可能有一定的损伤,为了降低化学抑菌剂的使用量,本研究选择以0.4%的次氯酸钠为主,复配以杀菌效果相对优良,同时作用温和的中药成分大黄、黄芩、艾叶,进行杀菌效果探究. 将0.01 g/mL的大黄、1 g/L黄芩和0.4%次氯酸钠等比例混合,制备终浓度约为0.03 g/L大黄、0.3 g/L黄芩和0.1%次氯酸钠的复配抑菌剂A;将1 g/L艾叶、1 g/L黄芩、0.4%次氯酸钠等比例混合,制备终浓度约为0.3 g/L艾叶、0.3 g/L黄芩、0.1%次氯酸钠的复配抑菌剂B.
使用抑菌圈法测定复配抑菌剂A和B的杀菌效果(表5),结果表明:复配抑菌剂A和B对关键细菌杀菌效果显著. 因此,化学抑菌剂次氯酸钠稀释3倍后与其他中药抑菌成分复配,复配抑菌剂与稀释前次氯酸钠的杀菌效果相比较无明显降低,说明与温和的中药成分复配,能够大幅降低化学抑菌剂的使用浓度,也能达到基本相当的杀菌效果.
4 讨 论
中国具有5000多年璀璨的文明,除成都东华门遗址外,还有很多的文化遗址遭受严重的微生物病害,现有的保护措施仍然难以解决微生物造成的损害. 对于石质文物遗址,腐蚀微生物会导致文物疏松、多孔、断裂,造成细胞壁的中胶层、次生细胞壁等严重变形[19]. 从成都东华门遗址分离出的主要腐蚀细菌为芽孢杆菌、金黄杆菌和假单胞菌. 芽孢杆菌属的细菌能够形成芽孢,芽孢杆菌能够在各种极端环境中存活,如高温、极酸、极盐、杀菌剂等,在自然环境中广泛存在[20]. 芽孢杆菌都能够形成带有芽孢的生物膜,产生相似的代谢产物,都能产生环肽、抗生素、酸(多聚谷氨酸、聚天冬氨酸)和聚多糖等[21]. 但由于微生物腐蚀机理复杂,目前,芽孢杆菌属微生物腐蚀作用机理仍有待研究[22]. 金黄杆菌属形态呈现黄色、淡黄色,颜色鲜亮,严重损害了文物的艺术价值和观赏价值,此外,其能产黏液、参与脱氮并产生EPS,促进物体表面形成生物膜,造成文物表面溶解氧的浓度差异,形成适宜铁氧化菌、硫酸盐还原菌和产酸菌生长的环境,加剧文物腐蚀[23].
目前,微生物多样性研究主要是于编码核糖体RNA的核酸序列保守区进行的. 细菌主要是基于16S区,16S rDNA 是编码原核生物核糖体小亚基16S rRNA的DNA序列,这些序列中既有保守区又有可变区,保守序列区域反映了生物物种间的亲缘关系,而高变序列区域则能体现物种间的差异.
本研究结果表明,将低浓度的化学抑菌剂和温和的中药成分复配使用,与高浓度化学抑菌剂相比较,针对东华门古遗址分离出的关键菌株仍具有良好的杀菌效果,为东华门遗址的微生物病害的防治工作奠定了一定的基础.但本研究仍需要深入探究大黄、黄芩、艾叶和低浓度次氯酸钠在长期使用过程中对文物和环境的影响,以及在东华门遗址现场进行细菌的杀菌效果研究.
参考文献:
[1] Yang S, Wu L, Wu B, et al. Diversity and structure of soil microbiota of the Jinsha earthen relic [J]. Plos One, 2020, 15: e0236165.
[2] Liu W, Zhou X, Jin T, et al. Multikingdom interactions govern the microbiome in subterranean cultural heritage sites [J]. Proc Natl Acad Sci USA, 2022, 119: e2121141119.
[3] 易立, 江滔, 张雪芬. 四川成都东华门明蜀王府宫城苑囿建筑群发掘简报[J]. 文物, 2020(3): 11.
[4] 田立强, 徐珂, 马志平. 成都东华门遗址保护顶棚结构选型[J]. 结构工程师, 2021, 37: 191.
[5] Li J, Zhang X, Xiao L, et al. Changes in soil microbial communities at Jinsha earthen site are associated with earthen site deterioration [J]. BMC Microbiol, 2022, 20: 147.
[6] Andrei A S, Pausan M R, Tamas T, et al. Diversity and biomineralization potential of the epilithic bacterial communities inhabiting the oldest public stone monument of Cluj-Napoca (Transylvania, Romania) [J]. Front Microbiol, 2017, 8: 372.
[7] Li Q, Zhang B, Wang L, et al. Distribution and diversity of bacteria and fungi colonizing ancient Buddhist statues analyzed by high-throughput sequencing [J]. Int Biodeterior, 2016, 11: e0163287.
[8] Duan Y, Wu F, Wang W, et al. The microbial community characteristics of ancient painted sculptures in Maijishan Grottoes, China [J]. Plos One, 2017, 12: e0183598.
[9] Li Q, Zhang B, Yang X, et al. Deterioration-associated microbiome of stone monuments: structure, variation, and assembly [J]. Appl Environ, 2018, 84: e02680.
[10] Ma Y, Zhang H, Du Y, et al. The community distribution of bacteria and fungi on ancient wall paintings of the Mogao Grottoes[J]. Sci Rep, 2015, 5: 7752.
[11] 黄雪泉. 八种中草药体外抑制大肠杆菌的效果观察[J]. 贵州畜牧兽医, 2009, 33: 3.
[12] 白静, 胡雷, 张丽, 等. 艾叶发酵物治疗系统性白念珠菌感染[J]. 医药导报, 2014, 33: 1438.
[13] 李淑红, 王京仁, 成钢, 等. 8种中草药对猪大肠杆菌的体外抑菌试验[J]. 广东农业科学, 2012, 39: 131.
[14] 韩佳慧, 刘唐娟, 罗劲, 等. 不同浓度黄芩苷对高毒力肺炎克雷伯菌生长及生物被膜形成能力影响的初步探讨[J]. 临床肺科杂志, 2022, 27: 342.
[15] 杜昕波, 赵耘, 李伟杰. 菌种保藏中的细菌鉴定方法[J]. 中国兽药杂志, 2009, 43: 50.
[16] 白燕燕, 杜文彪, 张彦芳, 等. 一株可降解苹果废弃枝条的生防细菌鉴定[J]. 西北农业学报, 2022, 31: 990.
[17] 宋佳蓉, 尚可, 雷光伦, 等. 双歧杆菌对慢性腹泻猕猴肠道微生物组的影响[J]. 四川大学学报: 自然科学版, 2022, 59: 066003.
[18] 周龙霞, 郑学云, 薛锋, 等. 天山雪莲菌酸奶中菌株的分离及生理生化鉴定[J]. 安徽农业科学, 2013, 41: 7963.
[19] Sallinger E, Robeson M S, Haselkorn T S. Characterization of the bacterial microbiomes of social amoebae and exploration of the roles of host and environment on microbiome composition [J]. Environ Microbiol, 2021, 23: 126.
[20] Huang H, Fan L, Zhao Y, et al. Integrating Broussonetia papyrifera and two bacillus species to repair soil antimony pollutions [J]. Front Microbiol, 2022, 13: 871581.
[21] Tran C, Cock I E, Chen X, et al. Antimicrobial bacillus: metabolites and their mode of action [J]. Antibiotics: Basel, 2022, 11: 88.
[22] Wang Y S, Liu L, Fu Q, et al. Effect of bacillus subtilis on corrosion behavior of 10MnNiCrCu steel in marine environment[J]. Sci Rep, 2020, 10: 5744.
[23] Kowalkowski T, Krakowska A, Zloch M, et al. Cadmium-affected synthesis of exopolysaccharides by rhizosphere bacteria[J]. J Appl Microbiol, 2019, 127: 713.

