单氟类黄酮的合成及其与牛血清蛋白相互作用的光谱学、热力学和分子动力学模拟研究
安超娜 姚甜 吴睿 刘存芳 刘波 田光辉

摘要:本研究通过荧光光谱、热力学和分子动力学模拟研究了六种不同的黄酮类化合物(Ⅳa~c和Va~c)与牛血清蛋白(BSA)的相互作用. Ⅳa~c和Ⅴa~c与BSA的荧光行为有定量关系,用Stern-Volmer方程计算的结果表明,Ⅳa~c和Ⅴa~c与BSA有明显的荧光猝灭,均为静态猝灭. 当单氟黄酮的氟原子处于对位时,与BSA的结合能力最好,当单氟黄酮醇的氟原子处于间位时,与BSA的结合能力最好,当单氟黄酮Ⅳa~c的C(3)具有羟基时,单氟黄酮醇与BSA的结合能力强于单氟黄酮. 计算出的Ⅳa~c和Ⅴa~Vc的热力学参数结果为ΔG<0、ΔH<0和ΔS<0,表明Ⅳa~c和Ⅴa~Vc与BSA的相互作用是一个自发的放热过程,其相互作用主要依靠氢键和范德华力结合.
关键词:丹皮酚; 黄酮; 合成; 牛血清蛋白; 荧光光谱
收稿日期: 2023-05-19
基金项目: 陕西省科技厅社会发展科技攻关(2022SF-356,2021SF-382); 陕西省教育厅重点实验室(21JS1004); 国家级大学生创新创业训练计划(202210720017); 陕西理工大学研究生创新基金(SLGYCX2227); 陕西省科技厅青年项目(2021JQ-750)
作者简介: 安超娜(1998-),女,甘肃敦煌人,硕士研究生,研究方向为小分子药物的设计与合成.
通讯作者: 田光辉.E-mail: tiangh@snut.edu.cn
Spectroscopic, thermodynamic and molecular dynamics
simulations of the synthesis of monofluorinated flavonoids and
their interactions with bovine serum proteins
AN Chao-Na, YAO Tian, WU Rui, LIU Cun-Fang, LIU Bo, TIAN Guang-Hui
(Shaanxi Key Laboratory of Catalysis, School of Chemical and Environmental Science,
Shaanxi University of Technology, Hanzhong 723000, China)
In this study, the interactions of six different flavonoids (IVa~cand Va~c)with bovine serum proteins (BSA)were investigated by fluorescence spectroscopy, thermodynamic and molecular dynamics simulations. The fluorescence behaviors of IVa~cand Va~cwere quantitatively related to BSA, and the results calculated using the Stern-Volmer equation showed that IVa~cand Va~chad significant fluorescence quenching with BSA, both of which were static quenching. The binding ability of monofluoroflavone with BSA was best when its fluorine atom was at para position, while the binding ability of monofluoroflavonol with BSA was best when its fluorine atom was at meta position. The binding ability of monofluoroflavonol with BSA was stronger than that of monofluoroflavone when hydroxyl group was attached to the C(3)of monofluoroflavone IVa~c. The calculated thermodynamic parameters of Ⅳa~cand Va~Vcwere ΔG<0, ΔH<0 and ΔS<0, indicating that the interaction of Ⅳa~cand Va~Vcwith BSA was a spontaneous exothermic process, which mainly relies on hydrogen bonding and van der Waals force.
Salvianol; Flavonoid; Synthesis; Bovine serum protein; Fluorescence spectroscopy
1 引 言
小分子药物与生物大分子之间的相互作用机制是药物代谢等领域的研究热点.生物大分子为许多药物小分子提供代谢修饰,并将其运送到特定场所发挥最大药效,是药物运输的重要载体[1]. 配体与生物大分子的结合过程,会产生使药物毒害性减小、半衰期增长等在药动学或药效学方面的影响.因此,研究生物大分子与药物间的作用关系,能更加直观地了解药物在体内的作用情况[2]. 血清白蛋白(SA)是血浆中最丰富的蛋白质,其特点是与配体有非凡的结合能力[3].牛血清白蛋白(BSA)有多个活性较强的结合位点,可以和配体药物小分子结合并有靶向的运送至作用部位,将配体药物小分子的作用高效发挥[4].
查尔酮是合成黄酮类衍生物的重要前体,独特的苯烯酮体系和活性双键使其具有诸多药理作用,如抗肿瘤[5]、抗炎[6,7]、抗菌等作用[8]. 近年来对查尔酮结构的修饰和活性研究备受关注.Zhan等[9]通过6-(三氟甲基)嘧啶-4-醇和1-(4-羟基苯基)乙基-1-酮反应得到含嘧啶的查尔酮衍生物并评估其抗烟草花叶病毒(TMV)活性;韩柳等[10]在室温下将4-羟基苯乙酮和2-溴苯甲醛缩合得到2-溴-4′-羟基查尔酮-苯磺酸酯衍生物,产率在60.9%~80.3%,并采用MTT法测试其对宫颈癌Hela细胞的增殖抑制活性; 赖普辉和刘存芳等[11-14]以丹皮酚为原料合成4-甲基-2′-羟基-4′-甲氧基查尔酮、丹皮酚蒽醛查尔酮、2-羟基-4-甲氧基-4′-氟查尔酮等一系列查尔酮化合物.以上报道均未进一步合成黄酮化合物.查尔酮是合成黄酮的一个关键中间体,能建构其基础的骨架,开发高效的查尔酮合成工艺可促进其后续产物的开发.
黄酮化合物广泛地存在于蓝莓等植物果实的浆果当中,具有抗炎[15]、抗氧化[16]、抑菌[17]等生物活性.天然产物中黄酮含量较低、提取工序复杂耗时、价格昂贵,所以人们不断提出高效合成黄酮的新策略. 目前黄酮的全合成有两种经典方法[18]:一种为Baker-Venkataraman即BK-VK法,也叫β-丙二酮酸化关环法;另一种为Algar-Flynn-Oyamada即AFO法,也叫查尔酮氧化关环法.其中BK-VK法是一种经过酯化和重排两步反应的合成黄酮常用方法之一,但该反应存在反应条件剧烈、碱量、催化剂对产率影响较大等问题.牛雁宁等[19]以5-甲基-1-苯基-1H-1,2,3-三唑-4-甲酸和邻羟基苯乙酮为底物合成,经重排、酸化得到1,2,3-三唑修饰黄酮.实验中,当碱用弱碱K2CO3和KOH时,所得黄酮收率为12%; 当催化剂用路易斯酸FeCl3、ZnCl2时,所得黄酮收率为15%. AFO法是以查尔酮为前体氧化关环得到黄酮化合物的常用方法.该方法反应条件温和,但存在反应步骤多等问题.2018年报道的鱼腥草素合成[20]经过I2氧化关环、过氧丙酮氧化羟基化、HOAc/H2O等三步反应后得到黄酮化合物.该方法操作繁琐,对产率有较大影响.
天然黄酮中含有卤素基团的化合物很少见,氯代黄酮的合成已有文献报道. 张晨等[21]以Baker-Venkataraman为依据,经酯化、重排、关环合成了卤代5-羟基黄酮衍生物,反应总收率为15%~20%. 黄初升等[22]综述了黄酮不同位置引入卤原子的方法,主要是在黄酮C环3位引入氟、氯、溴、碘,A环8位引入氯、溴、碘和6位引入碘的方法. 一般认为,当黄酮骨架上引入卤素基团时,其在诱导乳腺细胞周期阻滞方面比黄酮更有效[23].含卤素基团的黄酮及黄酮醇化合物往往有良好的可塑性和生物活性,合成含卤素基团的查尔酮和黄酮可为开发其潜在活性提供先导化合物.
人们在黄酮化合物与蛋白的相互作用方面已做了大量的研究工作.如Li等[24]考察九种黄酮类化合物(黄芩苷、槲皮素、杨梅素、芦丁、葛根素、大豆黄酮、甘草苷和异甘草苷)与胰蛋白酶相互作用,阐明了黄酮化合物与胰蛋白酶是一个自发结合过程且黄酮化合物与胰蛋白酶之间的相互作用力可能为范德华力、静电力、疏水相互作用力;Tang等[25]比较系列膳食黄酮与牛血清白蛋白(BSA)的结合亲和关系并通过荧光猝灭法测定结合常数,解释了黄酮化合物的不同结构、元素及取代基的位置都对二者结合有巨大影响,C3、C6、C4′、C5′(I型)和C5、C3′(II型)位上的羟基化有利于与BSA牛血清白蛋白的氨基酸形成氢键,在黄酮与酶蛋白之间的结合和相互作用中非常重要.
本文以价廉易得的天然产物丹皮酚为原料,与一氟代苯甲醛经Claisen-Schmidt反应得到高产率的查尔酮Ⅲa~c中间体,进而控温120 ℃下碘催化关环得到相应的单氟代黄酮; 同时,在室温下用过氧化氢氧化关环合成出了单氟代黄酮醇,并用单晶X-衍射技术确认了Ⅴa的结构,开辟一条简易而高效的合成单氟代黄酮和单氟代黄酮醇的新途径. 利用荧光光谱,在模拟生理条件下探究单氟代黄酮与单氟代黄酮醇与BSA的相互作用,有助于探索氟代黄酮、黄酮醇进入人体内与血清蛋白的结合并实现转运的基本情况.该结果探索出一条合成氟代黄酮的新途径,为后续研究其生物活性提供了参考.
2 实验部分
2.1 材 料
丹皮酚,纯度99.5%,成都化夏化学试剂有限公司; 薄层层析硅胶GF254,安徽良臣硅源材料有限公司; 牛血清蛋白(Bovine serum albumin,BSA),上海阿拉丁生化科技股份有限公司. 氢氧化钠、碘、二氯甲烷、乙醇、甲醇、石油醚、乙酸乙酯、盐酸、二甲基亚砜、邻氟苯甲醛、间氟苯甲醛、对氟苯甲醛、硫代硫酸钠、过氧化氢(H2O2 质量分数30%)等试剂均为国产分析纯. 水为蒸馏水.
C80微量热仪(法国塞塔拉姆公司); Bruker-600 MHz核磁共振仪(瑞士布鲁克公司,内标TMS,溶剂CDCl3、CD2Cl2); KQ-700DE数显智能控温磁力搅拌器(上海齐欣科学仪器有限公司); X-4B显微熔点仪(上海仪电物理光学仪器有限公司); FTIR-650傅里叶红外光谱仪(天津港东科技股份有限公司); Cary Esclipse荧光分光光度计(美国安捷伦科技公司); TU-1900双光束紫外可见分光光度计(济南笃尚科学仪器有限公司); SZCL-2数显智能控温磁力搅拌器(上海齐欣科学仪器有限公司); BSA124S-4W电子天平(德国赛多利斯仪器公司); ZF-5手提式紫外分析仪(山东普创工业科技有限公司); SHZ-D循环水真空泵(南宁瑞德仪器公司).
2.2 黄酮类化合物的合成
碱催化Claisen-Schmidt反应是合成查尔酮的有效方法之一,据此利用丹皮酚上的乙酰基在NaOH作用下和邻、间、对的一氟苯甲醛反应生成不同位取代的一氟查尔酮Ⅲa~c,进而以Ⅲa~c为中间体,借助丹皮酚上的酚羟基在高温碘催化下关环得到氟代黄酮Ⅳa~c; 同时,在室温下H2O2作用关环在氟代黄酮骨架上引入羟基得到氟代黄酮醇Ⅴa~c.合成过程如图1所示,实现了以天然产物丹皮酚为原料合成氟代黄酮和氟代黄酮醇. 其中Ⅴa晶体大小为0.10 mm×0.10 mm×0.10 mm,经X-衍射分析确定的晶体结构见图2及其晶胞堆积见图3.该晶体属三斜晶系的P1空间群,其晶胞参数a = 0.72453(3)nm,b = 0.916 14(5)nm,c = 1.045 97(4)nm,α = 68.1°,β = 86.1°,γ = 84.0°,晶胞体积V = 6.402(5)nm3,密度Dc=1.485 g/cm3,每个晶胞中有2个分子Z = 2,F(000) = 296.其全部数据以CIF-file的形式存放于The Cambridge Crystallographic Data Centre中,CCDC Number: 2 225 860.
2.2.1 氟代查尔酮Ⅲa~c的合成
依次向50 mL圆底烧瓶中加入丹皮酚0.5 g(1 mmol)、氢氧化钠0.24 g(2 mmol)和20 mL无水乙醇,搅拌均匀,再加入邻氟苯甲醛0.56 g(1.5 mmol),搅拌反应4.5 h后,升温60 ℃再持续搅拌1.0 h,TLC检测反应至完全,趁热将反应液倾倒在盛有等体积反应冷水的烧杯里,滴加盐酸(0.1 mol/L)至溶液pH=5~6,有黄色固体析出,冷却后过滤,冷水洗涤,乙醇重结晶,得到黄色针晶Ⅲa. 用相同的方法合成Ⅲb和Ⅲc.
E-3-(2-氟苯基)-1-(2-羟基-4-甲氧基苯基)丙基-2-烯-1-酮(Ⅲa): 黄色针晶,产率92.2%,m.p. 106.4~106.6 ℃,Rf=0.5.1H NMR (600 MHz,CDCl3)δ: 13.39 (s,1H),7.96 (d,J=15.7 Hz,1H),7.81 (s,1H),7.72~7.62 (m,2H),7.40 (s,1H),7.19 (s,1H),7.13 (s,1H),6.51~6.48 (m,2H),3.86 (s,3H);13C NMR (150 MHz,CDCl3)δ: 166.81 (s),161.09 (s),137.30 (s),131.92 (s),131.30 (s),130.02~129.88 (m),124.55 (s),123.13 (s),116.30 (s),107.85 (s),101.29 (s),55.70 (s); 135° DEPT (150 MHz,CDCl3)δ: 137.27 (s),131.97 (d,J=8.9 Hz),131.37 (s),130.10 (d,J=2.9 Hz),124.57 (d,J=3.6 Hz),123.11 (d,J=7.7 Hz),116.46 (s),116.31 (s),107.87 (s),101.08 (s),55.64 (s); FTIR(v): 610,795,836,1014,1127,1216,1276,1364,1504,1617,1631,3451 cm-1,vC-F=795 cm-1,vC-OH=3451 cm-1,vC=O=1617 cm-1,v=795 cm-1为苯环二元邻位取代.
E-3-(3-氟苯基)-1-(2-羟基-4-甲氧基苯基)丙基-2-烯-1-酮(Ⅲb): 黄色针晶,产率93.7%,m.p. 106.9~107.1 ℃,Rf=0.5.1H NMR (600 MHz,CDCl3)δ: 13.35 (s,1H),7.84~7.80 (m,3H),7.56 (d,J=15.5 Hz,1H),7.41~7.33 (m,2H),6.51~6.48 (m,3H),3.86 (s,3H); 13C NMR (150 MHz,CDCl3)δ: 191.67 (s),166.80 (s),166.54 (s),142.85 (s),137.09 (s),131.26 (s),124.50 (s),121.48 (s),117.40 (s),114.59 (s),114.42~114.29 (m),101.02 (s),55.64 (s); 135°DEPT (150 MHz,CDCl3)δ: 142.88 (d,J=2.7 Hz),131.28 (s),130.57 (d,J=8.4 Hz),124.66 (d,J=2.8 Hz),121.63 (s),117.56 (s),117.42 (s),114.60 (s),114.46 (s),107.95 (s),101.11 (s),55.66 (s); FTIR(v): 531,613,836,960,1021,1131,1219,1280,1367,1438,1630,2655,3450 cm-1,vC-F=613 cm-1,vC-OH=3450 cm-1,vC=O=1630 cm-1,v=836 cm-1为苯环二元间位取代.
E-3-(4-氟苯基)-1-(2-羟基-4-甲氧基苯基)丙基-2-烯-1-酮(Ⅲc): 黄色粉晶,产率92.1%,m.p. 106.1~106.3 ℃,Rf=0.4.1H NMR (600 MHz,CDCl3)δ: 13.41 (s,1H),7.86~7.81 (m,2H),7.66~7.63 (m,2H),7.50 (d,J=15.5 Hz,1H),7.14~7.10 (m,2H),6.49 (dt,J=7.0,2.5 Hz,2H),3.87 (s,3H);13C NMR (600 MHz,CDCl3)δ: 191.64 (s),166.74 (s),166.30 (s),143.09 (s),131.19 (s),130.45 (d,J=8.5 Hz),120.06 (s),116.27 (s),116.12 (s),114.03 (s),107.84 (s),101.09 (s),55.63 (s); 135°DEPT (600 MHz,CDCl3)δ: 143.10 (s),131.20 (s),130.47 (d,J=8.7 Hz),120.06 (d,J=2.3 Hz),116.28 (s),116.14 (s),107.86 (s),101.10 (s),55.65 (s); FTIR(v): 573,623,665,777,850,1130,1212,1365,1445,1630,2658,3467 cm-1,vC-F=777 cm-1,vC-OH=3467 cm-1,vC=O=1630 cm-1,v=850 cm-1为苯环二元对位取代.
2.2.2 氟代黄酮Ⅳa~c的合成
依次在50 mL烧瓶中加入0.5 gⅢa、10 mL DMSO、微量I2,控温120 ℃下搅拌4 h,TLC检测,反应完全后,将反应液倒入烧杯里,加入热水不断搅拌待有黑色物质出现时加入硫代硫酸钠,冰浴、萃取、抽滤,甲醇重结晶,得到无色针晶. 用相同方法分别合成Ⅳb和Ⅳc.
2-(2-氟苯基)-7-甲氧基-4H-色烯-4-酮(Ⅳa): 淡黄色针晶,产率89.4%. m.p. 131.4~131.6 ℃,Rf=0.6.1H NMR (600 MHz,CDCl3)δ: 8.13 (d,J=8.9 Hz,1H),7.90 (td,J=7.7,1.6 Hz,1H),7.52~7.47 (m,1H),7.30 (dd,J=11.0,4.2 Hz,1H),7.24~7.19 (m,1H),6.98 (dd,J=8.9,2.3 Hz,1H),6.93 (d,J=2.3 Hz,1H),6.86 (s,1H),3.92 (s,3H);13C NMR (150 MHz,CDCl3)δ: 164.64 (s),158.11 (s),128.91 (s),127.20 (s),125.02 (s),117.97 (s),116.83 (s),114.65 (s),55.72 (s); 135°DEPT (150 MHz,CDCl3)δ: 137.27 (s),131.97 (d,J=8.9 Hz),131.37(s),130.10 (d,J=2.9 Hz),124.57 (d,J=3.6 Hz),123.11 (d,J=7.7 Hz),116.46 (s),116.31 (s),107.87 (s),101.08 (s),55.64 (s); FTIR(v): 610,673,758,820,863,913,946,1023,1085,1132,1170,1442,1630,2790 cm-1,vC-F=758 cm-1,vC-C-O-C=1170 cm-1,v=913 cm-1为苯环二取代双键.
2-(3-氟苯基)-7-甲氧基-4H-色烯-4-酮(Ⅳb): 淡黄色针晶,产率89.7%. m.p. 132.8~133.0 ℃,Rf=0.6.1H NMR (600 MHz,CDCl3)δ: 9.64 (d,J=8.9 Hz,1H),8.90 (td,J=7.7,1.6 Hz,1H),7.78~7.66 (m,1H),7.50 (dd,J=11.0,4.2 Hz,1H),7.41~7.24 (m,1H),7.08 (dd,J=8.9,2.3 Hz,1H),6.73 (d,J=2.3 Hz,1H),6.66 (s,1H),3.52 (s,3H);13C NMR (150 MHz,CDCl3)δ: 174.64 (s),156.11 (s),128.24 (s),126.07 (s),121.792 (s),106.43 (s),101.83 (s),100.65 (s),55.72 (s); 135°DEPT (150 MHz,CDCl3)δ: 130.72 (d,J=8.3 Hz),127.13 (s),121.86 (d,J=3.1 Hz),118.39 (s),118.25 (s),114.68 (s),113.32 (s),113.16 (s),108.14 (s),100.39 (s),55.91 (s); FTIR(v): 552,697,848,960,1046,1131,1160,1261,1438,1630,2658,vC-F=848 cm-1,vC-C-O-C=1160 cm-1,v=960 cm-1为苯环二取代双键.
2-(4-氟苯基)-7-甲氧基-4H-色烯-4-酮(Ⅳc): 淡黄色针晶,产率89.2%. m.p. 131.5~131.7 ℃,Rf=0.5.1H NMR (600 MHz,CDCl3)δ: 8.13 (d,J=8.8 Hz,1H),7.92~7.90 (m,1H),7.23~7.20 (m,2H),7.01~6.94 (m,2H),6.71 (s,1H),5.30 (s,1H),3.94 (s,3H);13C NMR (150 MHz,CDCl3)δ: 177.71 (s),164.26 (s),163.85 (s),162.05 (s),157.94 (s),127.12 (s),117.75 (s),116.34 (s),116.19 (s),114.47 (s),100.42 (s),77.24 (s),77.03 (s),76.82 (s),55.87 (s),53.44 (s); 135°DEPT (150 MHz,CDCl3)δ: 128.37 (d,J=8.8 Hz),127.13 (s),116.34 (s),116.20 (s),114.48 (s),107.36 (s),100.42 (s),55.88 (s); FTIR(v): 541,612,732,759,819,914,1261,1438,1631,2768,vC-F=819 cm-1,vC-C-O-C=1261 cm-1,v=914 cm-1为苯环二取代双键.
2.2.3 氟代黄酮醇Ⅴa~c的合成
室温下在50 mL烧瓶中搅拌将Ⅳa0.5 g溶于15 mL乙醇,加入0.7345 g NaOH和15 mL过氧化氢持续搅拌,反应5 h,TLC检测,反应完全后将反应液转移至烧杯中,稀盐酸调节pH=8~9,析出淡黄色固体,抽滤冷水洗涤,甲醇重结晶,得到淡黄色正四方型晶体,达到单晶X-衍射测定的要求. 用相同方法分别合成Ⅴb和Ⅴc.
7-甲氧基-2′-氟黄酮醇(Ⅴa): 淡黄色正四体型晶体,产率为47.4%,m.p. 297.8~298.6 ℃.1H NMR (600 MHz,CDCl3)δ: 8.23~8.10 (m,3H),7.50 (d,J=8.7 Hz,2H),7.01 (dd,J=40.4,29.2 Hz,3H),3.95 (s,3H);13C NMR (150 MHz,CDCl3)δ: 172.75 (s),164.47 (s),157.36 (s),143.09 (s),138.21 (s),135.88 (s),129.71 (s),128.82 (d,J=16.6 Hz),126.86 (s),115.04 (s),99.87 (s),55.91 (s); 135°DEPT (150 MHz,CDCl3)δ: 128.82 (d,J=16.7 Hz),126.85 (s),115.04 (s),99.86 (s),55.92 (s); FTIR(v): 554,614,653,690,785,837,1018,1091,1167,1271,1374,1441,1642,3482,vC-F=837 cm-1,vC-C-O-C=1271 cm-1,vC=O=1642 cm-1,v=1018 cm-1为苯环二取代双键.
7-甲氧基-3′-氟黄酮醇(Ⅴb): 淡黄色针状晶体,产率为45.4%,m.p. 231.4~231.6 ℃.1H NMR (600 MHz,CDCl3)δ: 8.23~8.10 (m,3H),7.50 (d,J=8.7 Hz,2H),7.01 (dd,J=40.4,29.2 Hz,3H),3.95 (s,3H);13C NMR (150 MHz,CDCl3)δ: 177.77 (s),164.48 (s),161.34 (s),157.99 (s),135.28 (s),131.35 (s),130.32 (s),127.17 (s),126.28 (s),124.29 (s),117.82 (s),114.74 (s),108.20 (s),100.41 (s),55.92 (s); 135°DEPT (150 MHz,CDCl3)δ: 131.35 (s),130.32 (s),127.16 (s),126.27 (s),124.29 (s),114.74 (s),108.20 (s),100.41 (s),77.22 (s),55.91 (s); FTIR(v): 552,612,651,783,836,952,1011,1087,1163,1270,1374,1441,1504,1659,3452,vC-F=836 cm-1,vC-C-O-C=1270 cm-1,vC=O=1659 cm-1,v=952 cm-1为苯环二取代双键.
7-甲氧基-4′-氟黄酮醇(Ⅴc): 淡黄色针状晶体,产率为45.4%,m.p. 237.3~237.5 ℃.1H NMR (600 MHz,CDCl3)δ: 8.06 (d,J=8.8 Hz,1H),7.85 (d,J=1.6 Hz,1H),7.70 (d,J=7.8 Hz,1H),7.41 (dt,J=15.7,8.0 Hz,2H),6.99~6.88 (m,2H),6.68 (s,1H),3.88 (s,3H);13C NMR (150 MHz,CDCl3)δ: 176.59 (s),163.36 (s),160.38 (s),156.94 (s),134.24 (s),132.71 (s),130.31 (s),129.29 (s),126.13 (s),125.24 (s),123.25 (s),116.82 (s),113.68 (s),107.19 (s),99.38 (s),54.88 (s); 135° DEPT (150 MHz,CDCl3)δ: 131.35 (s),130.32 (s),127.16 (s),126.27 (s),124.29 (s),114.74 (s),108.20 (s),100.41 (s),55.91 (s); FTIR(v): 555,611,690,787,837,839,1090,1166,1271,1372,1441,1642,3475,vC-F=837 cm-1,vC-C-O-C=1271 cm-1,vC=O=1642 cm-1,v=1090 cm-1为苯环二取代双键.
2.3 Tris-HCl 缓冲液与BSA溶液的配置
称取适量三(羟甲基)氨基甲烷溶于蒸馏水配成0.1 mol/L溶液与0.1 mol/L的HCI混合均匀,加蒸馏水稀释到100 mL,制得浓度为0.05 mol/L的Tris-HCl 缓冲液,低温保存备用. 称取适量BSA溶解于Tris-HCl 缓冲液,定容,制成浓度为3.0×10-5mol/L的BSA溶液,在低温密封下保存,备用.
2.4 化合物Ⅳa~c、Ⅴa~c对BSA作用的荧光光谱测定及分析方法
测试25 ℃、31 ℃、37 ℃等温度下Ⅳa~c、Ⅴa~c对BSA的荧光光谱,其荧光光谱变化不大. 便于操作选择在25 ℃下考察不同浓度0、1×10-5、2×10-5、4×10-5、6×10-5、8×10-5mol/L的Ⅳa~c、Ⅴa~c对BSA的荧光猝灭光谱,设定290 nm为最大激发波长、350 nm为最大发射波长,狭缝宽为5 nm,测定荧光光谱. 通过Stern-Volmer方程确定
Ⅳa~c、Ⅴa~c对BSA作用的猝灭类型,并计算确定结合常数(KA)、结合位点数(n)和作用力类型,根据ΔH(热力学参数焓变)和ΔS(熵变)确定分子间的作用力类型以及热力学参数.
2.5 化合物Ⅳa~c、Ⅴa~c对BSA作用的荧光光谱测定及分析方法
用Tris-HCl 缓冲液配置浓度为2×10-5mol/L
的Ⅳc-BSA溶液、Ⅴb-BSA溶液,配置浓度为2×10-5mol/L的Ⅳc和Ⅴb溶液做对比. 将浓度2×10-5mol/L的Ⅳc和Ⅴb溶液加入不锈钢反应池作为对照组,将浓度2×10-5mol/L的Ⅳc-BSA溶液、Ⅴb-BSA溶液作为实验组加入另一个不锈钢反应池中,将两个不锈钢反应池放入C80微量热仪中,控温27 ℃下测定Ⅳc、Ⅴb与BSA作用的热流-时间曲线,曲线恢复至基线时,结束实验.
3 结果与讨论
3.1 黄酮类化合物对BSA荧光光谱的影响
3.1.1 化合物Ⅳa~b和Ⅴa~c对BSA荧光光谱的影响
在室温下浓度分别为0、1×10-5、2×10-5、4×10-5、6×10-5、8×10-5mol/L的Ⅳa~b对BSA的荧光猝灭光谱如图4所示,Ⅴa~c对BSA的荧光猝灭光谱如图5所示.
由图4和图5可知,变化局势总体一致. 当Ⅳa~c、Ⅴa~c浓度增加时,其BSA荧光图谱中特征峰均呈下降的趋势,说明BSA和Ⅳa~c、Ⅴa~c的相互作用存在着规律性的荧光猝灭关系,特征峰的变化趋势有差异. 随着Ⅳb浓度的增加,荧光强度F降低程度最大; Ⅳc次之; Ⅳa与BSA发生荧光猝灭后,荧光强度F降低程度最小; 随着Ⅴc浓度的增加,荧光强度F降低程度最大; Ⅴb次之; Ⅴa与BSA发生荧光猝灭后,荧光强度F降低程度最小.据此表明,当Ⅳa~c、Ⅴa~c上的氟原子取代位置不同时会影响与BSA的结合. 比较黄酮、黄酮醇与BSA结合后的荧光强度F的降低程度,发现黄酮醇Ⅴc随着浓度的增加,荧光强度F从537.6083降低到330.2509,降低程度最大.当在黄酮分子的C(3)位引入羟基时会影响与BSA的结合.
3.1.2 化合物Ⅳa~b和Ⅴa~c对BSA的荧光猝灭类型
Ⅳa~c和Ⅴa~c是猝灭剂,与BSA作用发生荧光猝灭有三种可能的猝灭机制[26-28].具体是: (1)BSA与猝灭剂在基态时配合形成基态复合物的静态猝灭; (2)BSA与猝灭剂在碰撞时引起的动态淬灭; (3)静态与动态猝灭联合引起的猝灭. 动态猝灭不影响BSA的结构和生理活性,而静态猝灭对蛋白质的构象产生影响,影响其活性. 对温度的依赖性是区分动态和静态猝灭的方法之一,动态猝灭随着温度升高扩散系数逐渐增大,双分子猝灭常数Kq增大,动态猝灭常数Ksv增大,静态猝灭则反之. 一般动态猝灭遵循Stern-Volmer方程[29,30], 见式(1).
F0/F=1+Ksv[Q]=1+Kqτ0[Q] (1)
其中,F0为加入猝灭剂前BSA的荧光强度;F为加入猝灭剂后BSA的荧光强度;[Q]为猝灭剂浓度(0、1×10-5、2×10-5、4×10-5、6×10-5、8×10-5mol/L);Ksv为动态猝灭常数(L/mol);Kq为动态荧光猝灭速率常数(L/mol·s-1),最大动态荧光猝灭速率常数约为2.0×1010L/mol·s-1;τ0为未加入淬灭剂时BSA平均寿命,其平均荧光寿命约为10-8s[31]. 不同温度下,Ⅳa~c、Ⅴa~c对BSA荧光猝灭的Stern-Volmer方程拟合图如图6和图7所示,分别以[Q]猝灭剂的浓度、F0/F为横纵坐标,用OriginPro8.5软件线性回归作图得到Stern-Volmer曲线.
根据式(1)计算不同温度下BSA与Ⅳa~c和Ⅴa~c的动态猝灭常数、动态荧光猝灭速率常数及相关系数如表1和表2. 结合图6和图7可知,Ksv动态猝灭常数是曲线图斜率,Ⅳa~c和Ⅴa~c在25 ℃、31 ℃、37 ℃三个温度下,Ksv随着温度的上升都呈现下降的趋势,且Ⅳa~c对BSA的最大动态荧光猝灭速率常数远大于2.0×1010L/mol·s-1(各类猝灭剂对生物大分子最大动态猝灭速率常数),表明Ⅳa~c和Ⅴa~c对BSA的荧光猝灭不是分子碰撞所产生的动态猝灭,而是形成了Ⅳa~c-BSA复合物、Ⅴa~c-BSA复合物引起的静态猝灭.
3.1.3 化合物Ⅳa~b和Ⅴa~c对BSA的结合常数(KA)、结合位点数(n)及作用力类型
Ⅳa~c与BSA因分子间作用力形成超分子复合物使荧光强度减弱属静态猝灭,这一关系可用公式(2)来表达[32].
lg[(F0-F)/F]=lgKA+nlg[Q] (2)
式中,F0为加入Ⅳa~c前BSA的荧光强度;F为加入Ⅳa~c后BSA的荧光强度;[Q]为Ⅳa~c浓度分别为0、0、1×10-5、2×10-5、4×10-5、6×10-5、8×10-5mol/L;KA为结合常数;n为结合位点数.
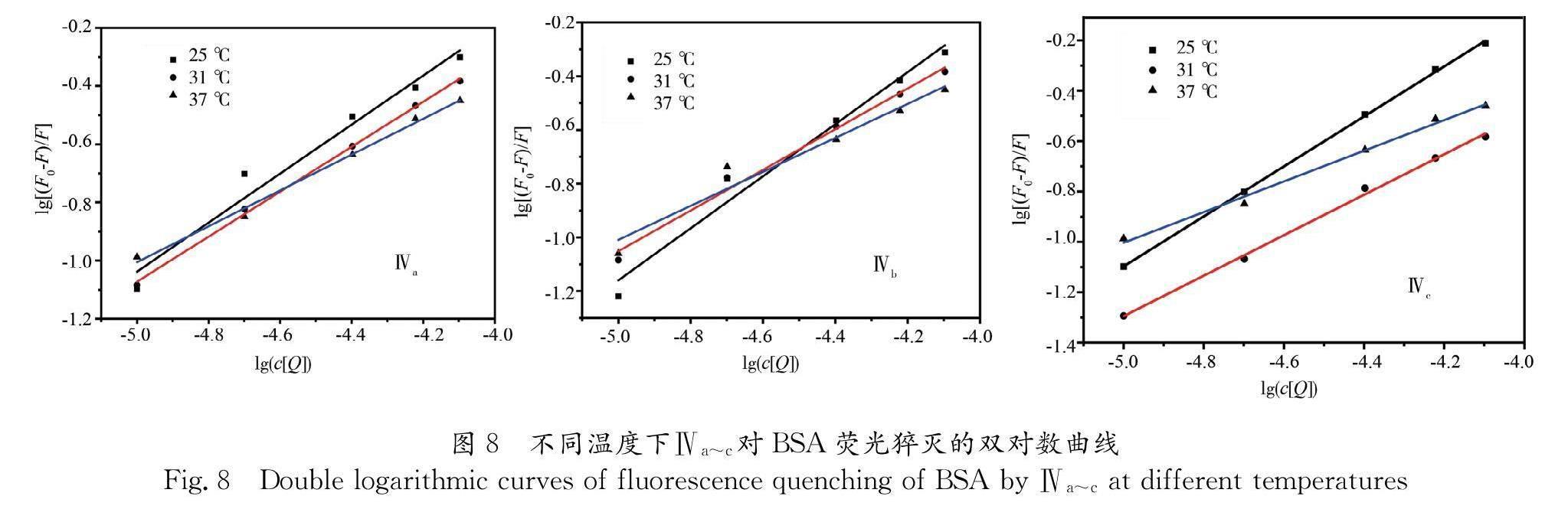
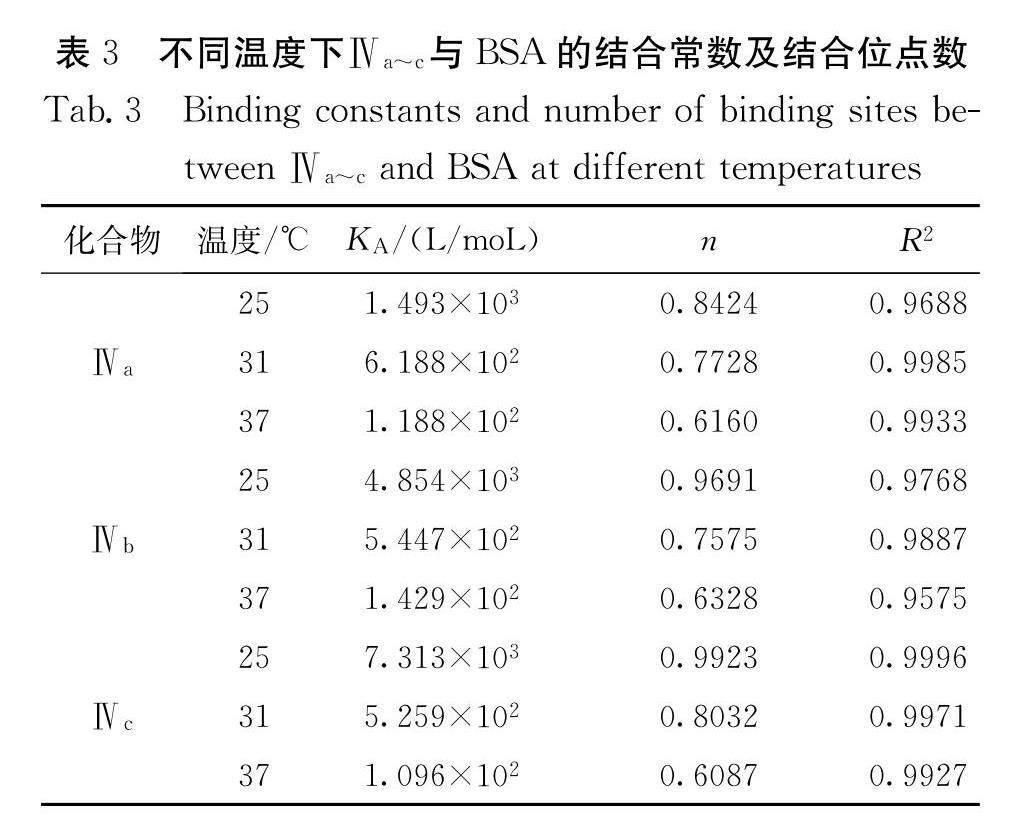
以lg[(F0-F)/F]为纵坐标,lg[Q]为横坐标作图,得到Ⅳa~c对BSA的荧光猝灭双对数图如图8所示,其结合常数及结合位点数如表3所示. 从图8可知,在25 ℃时,Ⅳa~c的线性回归方程分别为y=0.8424x+3.1741、y=0.7728x+2.7916、y=0.616x+2.0748,31 ℃时分别为y=0.9691x+3.6861、y=0.7575x+2.7362、y=0.6328x+2.1552,37 ℃时分别为y=0.9923x+3.8641、y=0.8032x+2.7209、y=0.6087x+2.04. 依据表3,Ⅳa~Ⅳc与BSA的结合位点数均接近1,验证了2.3中Ⅳa~c对BSA的猝灭方式属静态猝灭.当温度升高时,对应的结合常数降低,说明温度对Ⅳa~c在荧光猝灭形成基态复合物有着影响.在相同温度下,Ⅳa~c与BSA的结合常数KA有一定的差异,KA大小排序为: Ⅳc>Ⅳb>Ⅳa.这说明当氟原子处于对位时的黄酮与BSA结合能力最好,而氟原子处于间位和邻位时的黄酮与BSA结合能力最弱.
Ⅴa~c对BSA的荧光猝灭双对数图如图9所示,结合常数及结合位点数如表4所示. 可得25 ℃时Ⅴa~c的线性回归方程分别为y=0.9509x+
3.438、y=1.0286x+3.5473、y=0.9443x+3.6578,31 ℃时分别为y=0.9299x+2.8876、y=0.6325x+1.988、y=0.8993x+3.4857,37 ℃时分别为y=0.8717x+2.4969、y=0.5266x+1.6226、y=0.6825x+2.5846. 结合表4,Ⅴa~c与BSA的结合位点数均接近1,验证了Ⅴa~c对BSA的猝灭方式属静态猝灭. 当温度升高时,对应的结合常数降低,说明温度对Ⅴa~c在荧光猝灭形成基态复合物有影响,且在相同温度下,Ⅴa~c与BSA的结合常数KA有一定的差异,KA大小排序为: Ⅴb>Ⅴa>Ⅴc,说明当氟原子处于间位时的Ⅴb与BSA结合能力最好,随之为氟原子处于邻位时的Ⅴa、氟原子处于对位时的Ⅴc与BSA结合能力最弱. 比较Ⅳa~c和Ⅴa~c与BSA的结合常数KA,Ⅴa~c与BSA结合能力强于Ⅳa~c.
3.1.4 化合物Ⅳa~c和Ⅴa~c对BSA的作用力及热力学参数
Ⅳa~c、Ⅴa~c与BSA的作用可能有静电力、范德华力、疏水作用力等类型,通常情况下当作用力是氢键、范德华力时,ΔH<0、ΔS<0; 当作用力是静电力时,ΔH<0、ΔS>0; 当作用力是疏水作用力时,ΔH>0、ΔS<0. 这一过程可用式(3)和式(4)表达[33-35].
lnKA=-ΔH/RT+ΔS/R (3)
ΔG=ΔH-TΔS=-RTlnKA (4)
化合物Ⅳa~c与BSA作用的热力学参数如表5所示,ΔG<0,说明Ⅳa~c与BSA相互作用的过程是自发进行的,由于△H<0,△S<0,表明两者之间相互作用主要靠氢键和范德华力,且反应是一个放热过程.
化合物Ⅴa~c与BSA作用的热力学参数如表6所示,ΔG<0,说明Ⅴa~c与BSA相互对接作用的过程是自发进行的,由于△H<0,△S<0,两者之间相互作用主要靠氢键和范德华力,且反应是一个放热过程.
3.2 化合物Ⅳc和Ⅴb对BSA作用的热流输出曲线
控温27 ℃下微量热法测定Ⅳc和Ⅴb与BSA作用热量变化,采用停留法表达的Ⅳc和Ⅴb与BSA作用热流输出曲线,如图10所示,Ⅳc和Ⅴb与BSA作用有明显热效应. 随着时间递增,Ⅳc和Ⅴb与BSA作用过程持续放热,Ⅳc与BSA作用50 s后放热结束,Ⅴb与BSA作用75 s后放热结束,Ⅳc与BSA作用的放热量为270.39 kJ/mol,Ⅴb与BSA作用的放热量为483.10 kJ/mol.
3.3 化合物Ⅳc和Ⅴb对BSA作用的分子对接
分子对接是预测小分子-蛋白质复合物可见结合模式的一种重要的方法[36,37],本实验将Ⅳc和Ⅴb小分子导入ChemBio3D Ultra 21.0.0.28 进行能量最小化,将Minimum RMS Gradient设置为0.01. 将优化好的Ⅳc和Ⅴb小分子导入AutodockTools-1.5.6进行加氢、计算电荷、分配电荷、设置可旋转键后保存为“pdbqt”格式. 将牛血清蛋白结构导入Pymol 2.3.0去除蛋白结晶水、原始配体等,将蛋白结构导入AutoDocktools(v1.5.6)进行加氢、计算电荷、分配电荷、指定原子类型并保存为“pdbqt”格式. 采用AutoDock Vina1.1.2进行对接,3G2G相关参数设置为:center_x =33.177,center_y = 8.204,center_z = 124.621 ; 搜索空间:size_x: 60,size_y: 60,size_z: 60(每个格点的间距为0.375 ),exhaustiveness:8,其余参数为默认设置. 利用PyMOL 2.3.0和discovery studio对接结果进行相互作用模式分析,如图11和图12所示.
通常结合能小于0说明受体与配体可以自发结合,小于-5 kcal/mol则说明具有较强亲和力,可以稳定结合. 本次结果中Ⅳc、Ⅴb与BSA的结合能为-7.8 kcal/mol和-8.4 kcal/mol,证明具有较好的结合作用,且Ⅴb与BSA的结合能力更好. 小分子Ⅳc与BSA发生相互作用,主要是通过形成疏水作用力、氢键作用力、π-Cation和卤键作用. 通过4条疏水键与受体蛋白的189号LEU、196号ARG、455号ILE、458号ARG氨基酸残基结合,通过1条氢键与受体蛋白的186号GLU氨基酸残基结合;通过1条π-Cation键与受体蛋白的458号ARG氨基酸残基结合; 通过1条卤键与受体蛋白的108号ASP氨基酸残基结合. 小分子Ⅴb与BSA发生相互作用,主要是通过形成疏水作用力、氢键作用力和π-Stacking作用. 通过5条疏水键与受体蛋白的524号LYS、528号LEU、550号PHE、551号VAL氨基酸残基结合,通过2条氢键与受体蛋白的404号ASN、524号LYS氨基酸残基结合;通过1条π-Stacking键与受体蛋白的400号TYR氨基酸残基结合.
4 结 论
以价廉易得的天然产物丹皮酚为原料,和一氟代苯甲醛经Claisen-Schmidt反应得到高产率的查尔酮Ⅲa~c中间体,进而控温120 ℃下碘催化关环得到相应的单氟代黄酮Ⅳa~c; 同时,在室温下用过氧化氢氧化关环合成出了单氟代黄酮醇Ⅴa~c,并用单晶X-衍射技术确认了Ⅴa的结构,开辟一条简易而高效地合成单氟代黄酮和单氟代黄酮醇的新途径. Ⅳa~c、Ⅴa~c分别与BSA存在着量效关系作用的荧光行为.经Stern-Volmer方程计算的结果表明,Ⅳa~c、Ⅴa~c与BSA作用有明显的荧光猝灭现象,均属于静态猝灭. 依据结合常数KA,说明Ⅳa~c、Ⅴa~c与BSA作用的结合能力存在差异:当单氟代黄酮的氟原子处于对位时与BSA的结合能力最好,单氟代黄酮醇的氟原子处于间位时与BSA的结合能力最好,单氟代黄酮Ⅳa~c的C(3)有羟基时与BSA的结合能力增强,单氟代黄酮醇结合能力强于单氟代黄酮. Ⅳa~c、Ⅴa~Ⅴc热力学参数计算的结果为ΔG<0、△H<0和△S<0,说明Ⅳa~c、Ⅴa~Ⅴc与BSA作用是一种自发的放热过程,其作用主要是依靠氢键和范德华力结合. 通过微量热法测定的Ⅳc和Ⅴb与BSA作用的热流输出曲线表明,二者的结合是一个放热过程,且放出的热量分别为270.39 kJ/mol和483.10 kJ/mol. 分子对接表明,Ⅳc和Ⅴb与BSA的结合可形成氢键,且二者的结合高度稳定. 该结果探索出一条合成氟代黄酮的新途径,为后续研究其生物活性提供了参考.
参考文献:
[1]Fasano M, Curry S, Terreno E, et al. The extraordinary ligand binding properties of human serum albumin [J]. Iubmb Life, 2005, 57: 787.
[2]Kaklamanos G, Theodoridis G J. Determination of dapsone in muscle tissue and milk using high-performance liquid chromatography-tandem mass spectrometry [J]. Agric Food Chem, 2012, 60: 29.
[3]Ascenzi P, Fasano M. Serum heme-albumin: an allosteric protein [J]. Iubmb Life, 2010, 61: 1118.
[4]Matei I, Ariciu A M, Neacsu M V, et al. Cationic spin probe reporting on thermal denaturation and complexation-decomplexation of BSA with SDS. Potential applications in protein purification processes [J]. Phys Chem B, 2014, 118: 11238.
[5]李梦杰, 练小卫, 许志玲, 等. 七元瓜环对 2′-羟基查尔酮溶解性、稳定性及抗氧化活性的影响[J]. 高等学校化学学报, 2017, 38: 442.
[6]牛艳芬, 刘恺, 高丽辉, 等. 3,5,2′,4′-四羟基查尔酮对小鼠血尿酸及肝脏XOD/XDH的影响[J]. 中国药学杂志, 2015, 50: 34.
[7]金灿, 邓希乐, 周勇, 等. 含肟酯基L-香芹酮衍生物的设计、合成、晶体结构及杀菌活性[J]. 有机化学, 2021, 41: 2008.
[8]万金林, 巫受群, 甘宜远, 等. 含1,3,4-噻二唑结构的查尔酮缩氨基脲类化合物的合成及抗细菌活性[J]. 高等学校化学学报, 2018, 39: 1683.
[9]Zhan W L, Mao P, Yuan C M, et al. Design, synthesis and antiviral activities of chalcone derivatives containing pyrimidine [J]. J Saudi Chem Soc, 2023, 27: 101590.
[10]韩柳, 毋浩雄, 高连丛, 等. 2-溴-4′-羟基查尔酮-苯磺酸酯衍生物的合成及抗肿瘤活性[J]. 精细化工, 2023, 40: 1100.
[11]赖普辉, 田光辉, 刘存芳. 新型丹皮酚类衍生物的合成及其结构表征[J]. 中国实验方剂学杂志, 2011, 17: 95.
[12]赖普辉, 田光辉, 赵桦. 一种丹皮酚衍生物的合成及其抗菌活性[J]. 武汉大学学报: 理学版, 2010, 56: 523.
[13]赖普辉, 田光辉, 季晓晖, 等. 新型2′-羟基-4′-甲氧基-3-硝基查尔酮的合成及其抗菌活性[J]. 合成化学, 2010, 18: 465.
[14]刘存芳, 王俊宏, 邵先钊, 等 碱催化合成4-甲基-2′-羟基-4′-甲氧基查尔酮及其晶体结构[J]. 天然产物研究与开发, 2017, 29: 1573.
[15]Shamsudin N F, Ahmed Q U, Mahmood S, et al. Flavonoids as antidiabetic and anti-inflammatory agents: a review on structural activity relationship-based studies and meta-analysis[J]. Int J Mol Sci, 2022, 23: 12605.
[16]骆娟, 侯静, 杨舒婷, 等. 日本落叶松凋落针叶总黄酮的提取工艺及抗氧化活性研究[J]. 四川大学学报: 自然科学版, 2021, 58: 036004.
[17]段志芳, 付莉, 李充璧. 7-取代三唑硫乙氧基黄酮衍生物的合成及生物活性[J]. 高等学校化学学报, 2015, 36: 102.
[18]徐焕基, 李哲明, 吴云秋, 等. 黄酮苷的合成研究进展[J]. 有机化学. 2019, 39: 1875.
[19]牛雁宁, 袁媛, 董翔, 等. 1,2,3-三唑修饰黄酮的合成[J]. 化学试剂, 2018, 40: 695.
[20]Jian J, Fan J, Yang H, et al. Total synthesis of the flavonoid natural product houttuynoid A [J]. J Nat Prod, 2018, 81: 371.
[21]张晨, 吕宁, 李学燕, 等. 卤代5-羟基黄酮衍生物的合成及工艺研究[J]. 当代化工, 2022, 51: 1380.
[22]黄初升, 陈积常, 刘红星. 卤代黄酮类化合物的合成及生物活性的研究[J]. 天然产物研究与开发, 2013, 25: 288.
[23]Choi E J, Lee J I, Kim G H. Anti-carcinogenic effect of a new analogue 4′-chloroflavanone from flavanone in human breast cancer cells [J]. Int J Mol Med, 2010, 25: 293.
[24]Li X R, Peng Y R, Liu H Y, et al. Comparative studies on the interaction of nine flavonoids with trypsin[J]. Spectrochim Acta A, 2020, 238: 118440.
[25]Tang H J, Huang L, Zhao D S, et al. Interaction mechanism of flavonoids on bovine serum albumin: insights from molecular property-binding affinity relationship[J]. Spectrochim Acta A, 2020, 239: 118519.
[26]De Brito D H A, Almeida-Neto F W Q, Ribeior L R, et al. Synthesis, structural and spectroscopic analysis, and antiproliferative activity of chalcone derivate (E)-1- (4-aminophenyl)-3- (benzo [b] thiophen-2-yl)prop2-en-1-one in Trypanosoma cruzi[J]. J Mol Struct, 2022, 1253: 132197.
[27]Wang Q, Huang C R, Jiang M, et al. Binding interaction of atorvastatin with bovine serum albumin: Spectroscopic methods and molecular docking[J]. Spectrochim Acta A, 2016, 5: 155.
[28]Zhang J, Wang X J, Yan Y J, et al. Comparative studies on the interaction of genistein, 8-chlorogenistein, and 3′, 8-dichlorogenistein with bovine serum albumin[J]. J Agric Food Chem, 2011, 59: 7506.
[29]徐科, 黄亚励, 刘红, 等. 荧光光谱法研究氢化可的松与牛血清白蛋白的结合作用[J]. 化学与生物工程, 2012, 29: 32.
[30]马贵斌, 高飞, 任斌知, 等. 荧光法研究药物分子与人血清白蛋白的结合作用[J]. 化学学报, 1995, 53: 1193.
[31]Shahabadi N, Mohammadpour M. Study on the interaction of sodium morin-5-sulfonate with bovine serum albumin by spectroscopic techniques[J]. Spectrochim Acta A, 2012, 86: 191.
[32]柴秀航, 毕艳兰, 彭丹, 等. 棉酚及其氧化物与牛血清蛋白相互作用的研究[J]. 现代食品科技, 2015, 31: 36.
[33]Bojko B, Sukowska A, Macizek-Juczyk M, et al. The influence of dietary habits and pathological conditions on the binding of theophylline to serum albumin [J]. J Pharmceut Biomed, 2009, 52: 384.
[34]刘春叶, 卫引茂, 张雪娇, 等. 盐酸异丙肾上腺素与牛血清蛋白相互作用的光谱研究[J]. 化学研究与应用, 2013, 25: 952.
[35]张爱平, 郝娟, 黄茜, 等. 三种查尔酮类化合物与人血清白蛋白相互作用及其构效关系研究[J]. 分析科学学报, 2013, 29: 73.
[36]邓聿杉, 徐莺. 麻疯树核糖体失活蛋白Curcin和Curcin C与腺苷及腺嘌呤的互作方式分析[J]. 四川大学学报: 自然科版, 2022, 59: 046004.
[37]吴朋, 邓聿杉, 陈放, 等. Curcin和curcin C与腺嘌呤互作位点的比较分析[J]. 四川大学学报: 自然科学版, 2020, 57: 1186.
引用本文格式:
中 文: 安超娜, 姚甜, 吴睿, 等. 单氟类黄酮的合成及其与牛血清蛋白相互作用的光谱学、热力学和分子动力学模拟研究[J]. 四川大学学报: 自然科学版, 2023, 60: 065002.
英 文: An C N, Yao T, Wu R, et al. Spectroscopic, thermodynamic and molecular dynamics simulations of the synthesis of monofluorinated flavonoids and their interactions with bovine serum proteins [J]. J Sichuan Univ: Nat Sci Ed, 2023, 60: 065002.

