金丝楸幼苗响应盐碱胁迫的生理和转录组分析
郜新强 王小艳 焦伟等


关键词:金丝楸;盐碱胁迫;转录组;差异表达基因;耐盐碱机制
中图分类号:S722 文献标志码:A 文章编号:1001-1498(2023)01-0166-13
当前,全球土地盐碱化是人类面临的主要生态危机之一,给农业生产带来了巨大损失,严重威胁人类生存。据不完全统计,全球盐碱地面积约为9.54×109hm2,约占可耕地面积的10%,而我国盐碱地面积约有9.87×108hm2,位居世界第三,大部分为土壤盐化和碱化同时存在的复合盐碱地。目前,科学合理地开发和利用盐碱地已经成为我国农业和林业发展过程中面临的严峻挑战。
楸树(Catalpa bungei C.A.Mey.)是我国特有的珍贵优质用材和园林观赏树种,属于紫葳科(Bignoniaceae)梓属(Catalpa)落叶乔木,其材质好、用途广、经济价值高,自古就有“木王”的美誉。金丝楸自然分布于河南、山东和安徽等省,是楸树的一个地理变种,具有特殊金色纹理、生长快和干型通直的优点,近年来得到大面积推广。目前,楸树的研究主要集中在嫁接繁育、组培快繁、扦插繁殖、遗传转化、遗传多样性分析等方面,关于楸树耐盐碱的研究鲜有报道。认识和了解楸树耐盐碱机制,对指导楸树抗盐碱遗传改良和利用盐碱地具有重要的理论价值和现实意义。
近年来,转录组测序技术(RNA-Seq)发展迅速,该技术无须了解物种基因组信息,弥补了非模式植物转录组研究中缺乏基因组信息的不足。利用转录组解析植物的抗逆机制已经成为逆境研究的热点之一。目前,利用RNA-Seq已进行了大麦、水稻、高粱等盐胁迫的转录组分析,对这些植物响应盐胁迫机理的探讨,加深了人们对植物耐盐机制的认识。但是,通过转录组分析楸树耐盐碱分子机制的研究尚未见报道,仅有通过转录组分析楸树雄性不育和不定根发育分子机制的极少数报道。
本研究以金丝楸幼苗为试验材料,分析不同盐碱胁迫对金丝楸生长情况、光合及生理特性的影响,探究其耐盐碱生理机制。进一步利用RNA-Seq,对处理组和对照组进行DEGs分析,在转录水平上对楸树耐盐碱机制进行探索,以期为楸树应答盐碱胁迫的分子机制研究提供理论参考,同时也为重要基因的克隆及其功能研究等奠定基础。
1研究方法
1.1试验材料和设计
试验于安阳工学院温室中进行,2020年6月,选择生长健壮、形态一致、根系完整的金丝楸幼苗种子盆中,每盆种3株,共种40盆。正常栽培管理,60 d后进行盐碱胁迫处理。分别设置中性盐A(NaCl)、碱性盐B(Na2CO3)、混合盐碱C(NaCl:Na2CO3=1:1)3种盐碱胁迫处理,总盐浓度设置50、100、150、200 mmol·L-14个梯度,A1-A4、B1-B4、C1-C4分别代表从低到高的NaCl、Na2CO3、混合盐碱胁迫的4个浓度,共12个处理浓度。2020年8月,将试验材料随机分成13组,每组3盆,每盆浇2.0 L相应浓度的处理液,对照组浇等体积的清水。期间正常栽培管理,胁迫30 d后进行生长、光合及生理指标的测定。胁迫7d后取长势一致且大小相近的4组(CK、A2、B2和C2)叶片用于转录组测序,生物学重复2次。
1.2盐碱胁迫危害调查
各处理组在盐碱胁迫后定期(14、21、28d)对植株和叶片进行危害调查,根据胁迫伤害症状,设置分级标准(图1)如下:
0级:枝条和叶片未见盐碱胁迫危害症状;
1级:有极少部分叶尖、叶缘和叶脉变黄,枝条外观正常;
2级:有少部分的叶尖、叶缘焦枯,枝条外观正常;
3级:约有1/4叶片有叶尖、叶缘焦枯和落叶现象;
4级:约有1/2叶片枝枯、叶落直至死亡。
1.3生长、光合及生理测定
1.3.1新增株高和地径测定 对照组和处理组均选择3株进行编号,处理前用卷尺和游标卡尺测定株高和地径,胁迫30d后,再次测定上述指标,计算净生长量。
1.3.2生物量测定 胁迫30 d后,取对照组和处理组编号植株的根和地上部称其鲜质量,80℃烘干至恒质量,称其干质量,计算生物量(根干质量+地上部干质量)、根冠比(根干质量/地上部于质量)及生长胁迫指数(处理组植株干质量,对照组植株干质量)。
1.3.3光合指标测定
用SPAD-502Plus叶绿素仪测定叶绿素总量,EBA-PE1001高光效仪测定光合速率。
1.3.4生理生化指标测定 用电导仪法测定相对电导率,用硫代巴比妥酸法测定MDA含量,用氮蓝四唑法测定SOD酶活,用蒽酮显色法测定可溶性糖含量,用酸性茚三酮法测定Pro含量。
1.4转录组测序和分析
1.4.1转录组测序 样品经过RNA抽提、纯化、建库后,基于Illumina HiSeq测序平台进行双末端测序。
1.4.2测序读长分析及拼接对原始数据进行过滤,将带接头、小于50 bp、平均质量在Q20以下的Reads去除,得到高质量序列(CleanReads),使用Trinity对Clean Reads进行De novo拼接得到转录本序列,挑选最长的转录本作为Unigene。
1.4.3 Unigenes功能注释、分类、代谢途径分析以及表达量计算 用Blast对Unigenes进行NR、GO、KEGG、eggNOG、SwissProt和Pfam注释;对所有Unigenes进行GO功能分析和KEGG代谢途径分析。用转录组表达定量软件RSEM,计算每个基因的FPKM值,来代表每个基因的表达水平。
1.4.4差异表达基因分析 用DESeq对基因表达进行差异分析,筛选DEGs条件为:表达差异倍数|log2FoldChange|>1,显著性P-value<0.05。然后将得到的DEGs再进行GO和KEGG分析。
1.4.5转录因子分析 将蛋白质序列与Plant TFDB数据库比较,分析得到转录因子及其所属家族信息。
2结果与分析
2.1不同盐碱胁迫对金丝楸生长的影响
不同盐碱胁迫后,金丝楸均出现盐碱胁迫危害症状。Na2CO3胁迫对叶片伤害较大,随胁迫浓度和时间的增加,伤害等级增大,胁迫处理14 d,150 mmol·L-1时伤害等级达到3级,而200mmol·L-1时达到4级;而NaCl胁迫对叶片伤害较小,胁迫处理21 d,150 mmol·L-1时伤害等级达到2级,200 mmol·L-1时达到4级;混合盐碱胁迫下叶片伤害介于Na2CO3和NaCl之间。
不同盐碱胁迫下,金丝楸的生长情况受到不同程度的影响(表1)。NaCl胁迫下,50mmol·L-1时新增株高被极显著的抑制,且浓度越高抑制作用越显著;Na2CO3胁迫对新增株高的影响较小,在50 mmol·L-1时新增株高显著降低,且随浓度增加株高极显著降低;混合盐碱胁迫对新增株高抑制作用最轻,但也都达到极显著水平。此外,低浓度NaCl和Na2CO3胁迫对地径有增粗作用,在50mmol·L-1NaCl胁迫下,新增地径显著增加,而在150、200 mmol·L-1不同盐碱胁迫下,新增地径均极显著减小。
植物在盐碱胁迫下生物量的变化可直观反映生长状况(表1)。与对照组相比,NaCl和混合盐碱处理组,50 mmol·L-1时地上部干质量和鲜质量都有增加,但随浓度增加而下降;Na2CO3处理组地上部干质量和鲜质量随着浓度增加而下降。根干质量和鲜质量只在50 mmol·L-1混合盐碱处理组有增加,其它处理组都随浓度增加而下降。生物量的变化趋势与地上部干质量的变化基本一致。各处理组的根冠比均显著降低。不同盐碱胁迫下生长胁迫指数均随胁迫浓度的增加而降低,200 mmol·L-1时各处理组生长胁迫指数分别为0.26、0.18、0.23,可以看出Na2CO3胁迫降幅较大,NaCl和混合盐碱胁迫对生长胁迫指数影响较小。这些结果表明,Na2CO3和混合盐碱胁迫对金丝楸的生长发育抑制更严重,与对叶片危害的影响一致。
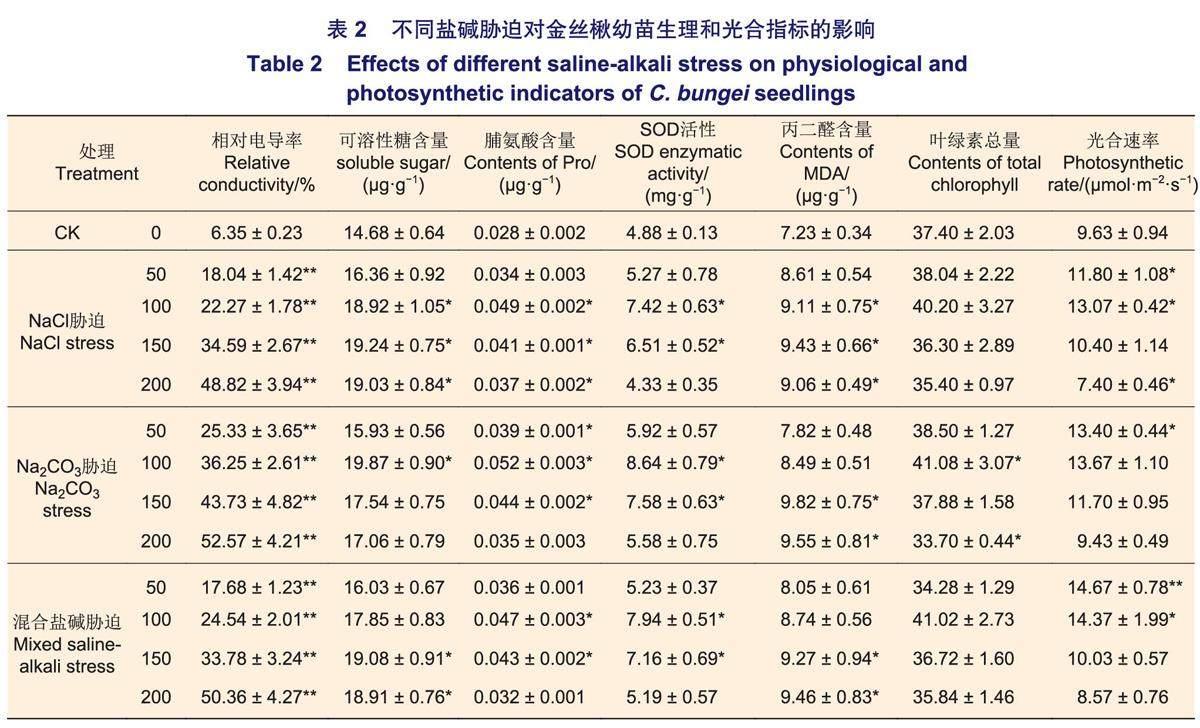
2.2不同盐碱胁迫对金丝楸生理和光合指标的影响
不同盐碱胁迫对金丝楸生理和光合指标的影响见表2。各处理组中,MDA含量和相对电导率都随处理浓度的增加而显著上升。NaCl和混合盐碱处理组中,可溶性糖含量在50~150 mmol·L-1时逐渐积累,而在200 mmol·L-1时小幅下降;而Na2CO3处理组中,在100 mmol·L-1时达到最大值,随浓度增加而下降。各处理组中,Pro含量都明显增加,均在100 mmol·L-1时达到最大值,之后随处理浓度的增加而逐渐下降,但仍明显高于对照组。各处理组中,SOD活性在中低浓度都有所增加,其中,100~150 mmol·L-1时显著增加,200 mmol·L-1时下降。各处理组中,低浓度时叶绿素总量和光合速率增加,都在100 mmol·L-1时达到最大值,之后随处理浓度的增加而逐渐下降。
2.3转录组测序、组装和分析
对试验中的8个样品测序后分别获得了约50 000 000条原始序列,共测得约60.4 Gb原始数据。过滤后Clean datas约占原始序列数据的93%;碱基数约占原始碱基数的93%;Q20和Q30值分别在97%和93%以上。混合2个样品的Clean datas,用Trinity软件进行De novo组装,共得到171339个Transcripts, 55793个Unigeneso Transcript和Unigene序列平均长度分别为1768.34 bp和1275.65 bp,
N50分别为2597 bp和2263 bp, GC含量分别为39.59%和38.72%。
2.4注释结果分析
对55 793个Unigenes进行基因功能注释,在NR、GO、KEGG、Pfam、eggNOG和Swiss-Prot数据库中分别注释28 722个(51.48%)、13185个(23.63%)、11967个(21.45%)、15837个(28.39%)、27 242个(48.83%)和21694个(38.88%),其中,29534 (52.93%)个Unigenes最少被1个数据库注释,5124(9.18%)个Unigenes被6个数据库注释。28722个Unigenes在NR数据库中获得注释,其中,5.8% Unigenes与之完全匹配,15.94% Unigenes不完全匹配。相似度在95%~100%、80%~95%、60%~80%、40%~60%和≤40%的Unigenes比例分别为5.98%、32.12%、35.43%、20.45%和6.02%。被注释到芝麻(Sesamum indicum L.)、地黄猴面花(Erythranthe guttata DC.)、施蒴苣苔(Dorcoceras hygrometricum B.)、葡萄(Vitisvinifera L.)、咖啡(Coffea canephora PF.)、大麦(Hordeum vulgare L.)、可可(Theobroma cacao L.)和其他物种Unigenes比例分别为55.95%、14.67%、3.35%、2.09%、0.97%、0.91%、0.76%和21.31%。
基因GO注释后,将成功注释的基因依照GO的三个大类进行分类。Unigenes富集最多的是代谢过程和细胞过程、细胞膜和细胞、结合和催化活性。KEGG代谢通路上,基因注释最多的分别为碳水化合物代谢、翻译、信号分解代谢、运输分解代谢和内分泌系统。eggNOG比对注释,基因注释最多目录分别为功能未知、仅通用功能预测、信号传导机制和翻译后修饰、蛋白质周转、伴侣。
2.5差异表达基因分析
为进一步了解楸树对不同盐碱胁迫反应的转录组特征,分析比较了对照组和3种处理组的DEGs。对照组与NaCl处理组(A vs C)产生1779个DEGs(上调844个,下调935个),对照组与Na2CO3处理组(A vs D)产生2835个DEGs(上调1326个,下调1509个),对照组与混合盐碱处理组(A vs E)产生4059个DEGs(上调2295个,下调1764个),说明这些DEGs与不同盐碱胁迫应答密切相关。根据差异分析的结果,维恩图进一步展示了各比较组间特异DEGs的个数以及比较组间的重叠关系。A vsC与Avs D之间有1 036个共有DEGs,A vsD与Avs E之间有1530个共有DEGs,A vsC与Avs E之间有963个共有DEGs,3个比较组之间有717个共有DEGs。Avs C有497个特异DEGs,Avs D有986个特异DEGs,A vsE有2 283个特异DEGs(图2)。说明共有DEGs可能由不同的盐碱胁迫共同引起的,特异DEGs可能响应不同的盐碱胁迫反应。
2.6差异表达基因富集分析
对DEGs进一步GO富集分析发现,在细胞组分、分子功能和生物过程方面存在差异。在细胞组分方面,膜的整体成分、膜的内在成分、膜等在不同盐碱胁迫下被显著富集。在分子功能方面,催化活性、氧化还原酶活性、信号传感器活性、单加氧酶活性、水解酶活性、水解o-糖基化合物等在不同盐碱胁迫下被显著富集。在生物过程方面,类异戊二烯代谢和生物合成过程、防卫反应、碳水化合物代谢过程等在不同盐碱胁迫下被显著富集(图3~5)。
通过对DEGs进一步KEGG分析发现,DEGs主要集中在代谢途径。NaCl胁迫下显著富集的通路为:萜类主干生物合成、苯丙素的生物合成、植物激素信号转导、光合生物中的碳固定(图6);Na2CO3胁迫下显著富集的通路为:淀粉和蔗糖代谢、苯丙素的生物合成、氰氨基酸代谢、精氨酸生物合成(图7);混合盐碱胁迫下显著富集的通路为:淀粉和蔗糖代谢、萜类主干生物合成、苯丙素的生物合成、植物激素信号转导(图8)。
2.7转录因子分析
植物转录因子广泛参与多种生物过程,并在转录水平上调控基因的表达,是许多逆境胁迫响应基因的重要调控因子,在植物对逆境胁迫的应答过程中发挥重要作用。为了进一步研究楸树中可能参与盐碱胁迫的转录因子,笔者共鉴定出6725个差异表达转录因子,分属于57个不同的转录因子家族,其中,bHLH、ERF、MYB-related、NAC、C2H2、WRKY、MYB和bZIP转录因子家族成员最多。
3讨论
3.1不同盐碱胁迫对金丝楸生长的影响
盐碱胁迫对植物最直接的影响就是抑制其正常的生长发育。本研究发现,Na2CO3胁迫对金丝楸叶片伤害程度最大,NaCl最小,与前人研究结果一致。不同盐碱胁迫导致了金丝楸新增株高和地径、生物量、根冠比不同程度的降低,并且随着胁迫浓度的增加而加强(表1),表明其对不同盐碱胁迫的忍耐能力存在差异,这与其它植物中的研究结果相同。分析对新增株高的影响程度依次为NaCl>Na2CO3>混合盐碱,3种胁迫的中高浓度都极显著抑制新增地径的增长(表1)。对地上部和根的干质量以及生物量积累的影响程度依次为Na2CO3>NaCl>混合盐碱,但50 mmol·L-1时NaCl和Na2C03胁迫对地径有增粗作用,其中NaCl胁迫显著增加,50 mmol·L-1时混合盐碱胁迫对地上部和根的干质量和鲜质量均显著或极显著增加(表1),其它植物的研究也得到类似结果。
3.2不同盐碱胁迫对金丝楸生理代谢和光合作用的影响
盐碱胁迫还会影响植物的生理代谢和光合作用。MDA是植物体内膜脂过氧化的产物,常作为对逆境反应强弱的指标。本研究发现,不同盐碱胁迫后MDA都不同程度增加,其中,在中高浓度胁迫后显著增加(表2),该结果与前人研究结果一致。Pro能调节渗透势和改善细胞内环境,可溶性糖能维持细胞渗透势和提供碳源,它们是植物通过渗透调节作用对逆境胁迫的一种生理响应。本研究发现,不同盐碱胁迫后,Pro和可溶性糖含量都显著上升,在100或150 mmol·L-1时达到最大值,浓度继续升高后会小幅降低,但仍高于对照组(表2),这一结果与之前关于盐碱胁迫对Pro和可溶性糖含量影响的研究结果相吻合。说明在一定浓度范围内楸树可以通过增加体内Pro和可溶性糖的含量,降低细胞渗透势,超过这个范围,Pro和可溶性糖合成受到抑制。盐碱胁迫会使植物产生大量的活性氧自由基,破坏细胞膜系统,抗氧化酶活性的升高可增强自由基清除能力,减轻伤害。本研究发现,不同盐碱胁迫下SOD都随浓度增加呈先升后降的趋势(表2),这与孙海菁等之前发现的情况一致。说明当盐碱胁迫超出阈值后,过量的自由基对植物造成损伤,SOD活性降低。叶绿素是植物光合作用的物质基础,是反映光合能力的重要指标。本研究发现,在低浓度盐碱胁迫下叶绿素总量升高,光合速率显著提高(表2),说明低浓度胁迫能够促进叶绿素的合成和光合作用,而在高浓度胁迫下叶绿素总量和光合速率下降。该结果和地上部生物量的结果基本一致,但与前人的研究结果不完全一致,可能与物种差异有关,有待进一步研究。
3.3差异表达基因分析
RNA-Seq是研究植物非生物胁迫分子机制的良好手段,楸树作为非模式植物,缺乏基因组背景,RNA-Seq为从转录水平研究楸树耐盐碱分子机制、基因挖掘及相关代谢通路的发现提供了可能。本研究分别对NaCl、Na2CO3和混合盐碱处理组及对照组进行转录组测序及分析。DEGsGO富集结果表明,在细胞组分方面,膜的整体成分、内在成分和膜在不同盐碱胁迫下均显著富集,说明膜及其成分在不同盐碱胁迫下都发挥积极作用。在分子功能方面,富集结果相差较大,催化活性和氧化还原酶活性主要响应NaCl胁迫;信号传感器活性和单加氧酶活性主要响应Na2CO3胁迫;催化活性和水解o-糖基化合物主要响应混合盐碱胁迫,说明不同分子功能响应不同的盐碱胁迫。在生物过程方面,类异戊二烯代谢和生物合成过程在不同盐碱胁迫下都显著富集,说明类异戊二烯对植物耐盐碱非常重要;二甲基烯丙基二磷酸生物合成过程、防卫反应和碳水化合物代谢过程分别单独显著富集(图3~5)。DEGs KEGG分析结果表明,苯丙素生物合成在不同盐碱胁迫中均显著富集,植物激素信号转导和萜类主干生物合成在NaCl和混合盐碱胁迫中都显著富集,淀粉和蔗糖代谢在Na2CO3和混合盐碱胁迫中都显著富集,还有光合生物碳固定、精氨酸代谢和生物合成分别在NaCl、Na2CO3胁迫中单独显著富集(图6~8)。说明苯丙素生物合成、植物激素信号转导、淀粉和蔗糖代谢、萜类主干生物合成、类异戊二烯通路在应答盐碱胁迫时至关重要,与前人转录组测序分析结果一致。以上结果暗示这些功能与途径可能在楸树响应不同盐碱胁迫中起着重要作用,这些注释信息也为进一步挖掘楸树抗不同盐碱基因提供了数据资源。
3.4转录因子分析
转录因子在植物对多种逆境胁迫的应答过程中发挥重要作用。目前,已报道的响应盐碱胁迫的转录因子有WRKY、NAC、bZIP、MYB、bHLH等家族成员。WRKY是一类锌指蛋白家族,对植物抗逆有着重要作用。玉米ZmWRKY33、高粱SbWRKY50和花生AhWRKY75等WRKY转录因子对耐盐性起作用。NAC是植物特有的转录因子家族,在植物发育、逆境应答等过程中发挥多重作用。水稻ONAC022、小麦TaNAC67和大豆GmSIN1等NAC转录因子与耐盐能力有关。bZIP转录因子参与依赖ABA信号的途径,调控相关抗盐碱基因的表达。棉花GhABF2、玉米ABP9和大豆GmbZIP2等bZIP转录因子控制盐碱耐性。MYB转录因子广泛参与植物的生长发育、逆境响应和激素信号转导。拟南芥MYB111、大豆GmMYB12和菠萝AcoMYB4等MYB转录因子调控盐胁迫响应基因。bHLH转录因子同样在非生物胁迫应答中起着重要作用。小麦TabHLH1、水稻OsbHLH035和杨梅MfbHLH38等bHLH转录因子应答盐胁迫反应。本研究鉴定出bHLH、ERF、MYB-related、NAC、C2H2、WRKY、MYB和bZIP转录因子家族成员最多,这些转录因子与不同盐碱耐性相关,说明楸树耐盐碱机制是由多种转录因子共同调控的。
4结论
本研究通过对不同盐碱胁迫下金丝楸幼苗生长情况、生理指标和光合特性进行测定及分析,新增株高和地径、生物量、根冠比等都明显受到抑制,生长情况受抑制程度为Na2CO3>混合盐碱>NaCl。金丝楸幼苗主要通过积累渗透调节物质、提高抗氧化酶系统和光合作用来共同抵御盐碱胁迫,但都呈现“低促高抑”的现象,具有一定阈值。通过对对照组和3种处理组叶片进行转录组测序及分析,3个比较组分别筛选出1779、2835和4059个DEGs。通过DEGs GO功能和KEGG通路分析,理清了DEGs富集的生物过程与代谢通路。金丝楸通过调节膜成分、催化活性、类异戊二烯代谢和生物合成过程、苯丙素生物合成、淀粉和蔗糖代谢、植物激素信号转导等生物过程和代谢途径,并结合相关转录因子共同响应盐碱胁迫(图9)。综上所述,本研究的首次尝试为全面解析楸树耐盐碱机制研究提供理论参考,同时也为后期重要基因克隆及其功能分析等奠定基础。

