横断山脉亚高山带几种高山栎林下丛枝菌根菌(AMF)调查
李鸿博 黄耀华 康定旭等
关键词:横断山脉高山栎;丛枝菌根真菌(AMF);系统发育构建;分类地位
中图分类号:Q945.31 文献标志码:A 文章编号:1001-1498(2023)01-0079-12
菌根是建立于植物根系和土壤菌根真菌之间的古老共生体系,在自然界中存在已有4亿年之久,有研究统计,地球上大约86%的陆生被子植物能够与真菌互作形成菌根共生体。丛枝菌根真菌(AMF)作为植物根系所在土壤环境中微生物群落的重要组成者之一,在个体层面可以促进植物对K+、Ca2+、Mg2+离子的有效吸收,帮助植物抵御逆境中来自生物或非生物的胁迫,宏观群落层面则能够优化植被分布,森林中地下的庞大菌根系统能够将林木个体有机相连而形成一个物质资源共享体,加速种群建成并形成植物优势种,从而改变生态格局,可以说,菌根真菌和植物共生,是维护森林生态系统稳定及发展的基础。
高山栎(Quercus spp.)作为一类广泛分布在我国西部川、滇、藏地区的常绿硬叶栎类植物,是横断山脉地区重要的野生植被群落优势种,多以成规模的林地出现或以离散点状方式与其他乔木混生生长于海拔1800~4800 m的地区,其热值高、生长速度快及萌蘖更新能力强的特点对该地区生态环境保持具有重要意义。当前,外界公认松科植物共生菌根类型为外生菌根已毋庸置疑,而栎属植物存在外生菌根共生现象的同时,是否能与内生菌根真菌共生尚鲜有报道。杨淑娇等对云南香格里拉高山栎和高山松(Pinus densata Mast.)的林下菌塘微生物分布研究发现,高山栎林下菌塘有大量AMF存在,且高山栎林下菌塘中真菌和AMF生物量显著高于高山松,但AMF种类丰度只有1种,综合高山栎和高山松林型下菌塘的多种微生物比较认为,菌塘中的微生物类型是其菌落结构组成的重要影响因素,林型则未影响林下微生物群落特征构成。该研究说明在错综复杂的地下根系网络中,不同类型土壤微生物之间的相互联系往往对宿主植物林下菌群结构和分布具有重要影响。张中峰将摩西球囊霉(Glomus mosseae (Nicol.&Gerd.)Gerd.&Trapp)和根内球囊霉(Glomus intraradices Schenck&Smith)接种至青冈栎(Quercus glauca (Thunberg) Oersted)幼苗发现,AMF能够显著促进青冈栎幼苗叶面积和生物量增长,提升幼苗成活率,该结果表明,在人为干扰措施下,栎属植物能够与AMF形成互惠共生关系。基于上述前人研究不难推测,AMF与高山栎组植物间应当存在相应的联系。这种联系是否具有广泛性和普遍性?同为被子植物门下的栎属植物高山栎根系在非人为干扰的野生生境中,其根际及根系是否同AMF共生等问题值得深入探究。基于此,本研究假设横断山脉亚高山地区高山栎林下同样具有AMF分布,并且在自然条件下高山栎植物根系存在AMF。分三步验证上述假设:第一,利用湿筛沉淀法对采自横断山脉不同地区高山栎林下土壤样本进行孢子湿筛,利用形态学、分子生物学结合的手段对其种类进行鉴定。第二,利用分子克隆方法选取针对AMF 18S rRNA gene的特异引物对高山栎外根际潜在的AMF进行扩增,测序检验扩增结果中是否存在AMF。第三,利用染色观察的方法观察高山栎根系样本内是否存在典型的AMF丛枝、泡囊结构,结合对比单孢提取与克隆扩增结果,以期明确横断山脉亚高山带自然环境中生长的高山栎林下根围、根际AMF种类,揭示横断山脉亚高山高山栎林下AMF的演化方向。
1采样地与材料
1.1采样地概况
横断山脉作为世界年轻的山脉群之一,纵跨川、滇二省西部及西藏东部,山岭曲折蜿蜒,谷高差悬殊,植被分布以海拔梯度差异明显,受高空西风环流、印度洋及太平洋季风环流影响,气候主要分为干湿两季,降水多集中于5—10月,但因地形地势复杂,地域辽阔,年均气温13.6℃,年降水量942.6 mm,部分地区降雨差异较明显。由于该地区地势陡峭,降雨所致的水土流失成为潜在威胁。
1.2样品采集
于2020年7月、10月和2021年8月分别前往位于28°45′3″~30°59′35″N,97°40′25″~102°50′18″E(四川、西藏等地)以及99°11′46″E、28°11′51″N(云南香格里拉)地段,横断山脉亚高山带的不同海拔(2340~3630 m)地区(表1)阳坡地段高山栎天然林,各高山栎林均为乔木或灌木纯林,林下无其他植被。采集其根部10~30 cm处的土壤混合装入9号自封袋,沿主根对高山栎根系进行挖掘,找到高山栎根系侧根、须根等与根际土装入自封袋,放入含冰袋的保温箱隔离贮存,标记并编号,带回实验室将根系于-80℃保存,土壤平铺风干置于塑封袋用于后续实验。
2试验方法
2.1高山栎根系土壤AMF湿筛与鉴定
2.1.1高山栎根部土壤AMF孢子筛取 将高山栎根部土壤过40目筛后,精确称量20 g土壤,倒入玻璃烧杯,加500 mL超纯水浸泡12 h后,利用湿筛沉淀法过4目(100目165μm、140目105μm、200目74μm、300目50μm)筛出并将每一目筛出的孢子及细土倒入容积为1L的烧杯静置,静置15min后倒300 mL入封液漏斗,后向烧杯内加水至500 mL。静置15 min后向漏斗中填200 mLddH2O,此步骤重复3次。后静置15min并弃漏斗废液300 mL。将每一目筛孢子用的封液漏斗置于铁架台,使用抽滤机(Rocker 600)将孢子抽滤至实验前预备好的画有方格的滤纸上,编号标记并放入4℃冰箱保存备用。
2.1.2孢子形态学鉴定与孢子密度统计 在体式镜(LAICA SE6)下从培养皿中的滤纸上挑出形态、颜色等不同的孢子,单个置于滴加ddH2O的载玻片上在光学显微镜(LEICA MC170)下观察并拍照,记录孢子颜色、大小,轻轻将其压破,观察孢壁颜色、类型、厚度、层数及内含物特征等,载玻片上还可加入Melzer's染液观察是否存在显色反应,并拍照保存。同时,每拍摄一个孢子将与其形态相同的孢子挑至1.5mL的离心管内-20℃冰冻保存,以便做分子鉴定时一一对应。参照《VA菌根真菌鉴定手册》(1988)和http://invam.caf.wvu.edu网址上的图片对照及近年来所发表的研究文献成果,进行形态学鉴定。
在体式镜下统计每个土样下的孢子数目,并计算出孢子密度,每个土样4次重复。
孢子密度(SD):指每克土样中丛枝菌根真菌的孢子个数。
SD=某土样中AMF所有孢子数/土壤干质量。
2.1.3孢子的分子生物学鉴定 利用Chelex-100提取单孢DNA,向装有孢子的离心管中加入600μLddH2O,置入超声波震荡洗涤仪器(30Hz)震荡3min,挑出孢子转移至新的离心管,重复上述步骤以清洗孢子表面存在的杂质。将清洗后的单孢转移至新的离心管中(1.5 mL),加入30μL TE buffer,置于盛有液氮的保温瓶速冻,取已灭菌的研磨棒在体式显微镜下将孢子研碎。加入15μL 20% Chelex-100后置于金属恒温水浴锅98℃裂解10 min,放入-20℃冰箱冰浴5 min后取出,置于离心机(Eppendorf Centrifuge 5417R)12000r·min-1离心10 min,所得上清液即为用于扩增的孢子的DNA模板。
参照《菌根学》中的扩增办法,对孢子DNA模板进行巢式PCR扩增。第一轮扩增上下游引物为GeoLl(5'-ACCTTGTTACGACTTTTACTTCC-3),GeoA2 (5-CCAGTAGTCATATGCTTGTCTC-3')反应体系为50μL(ddH2O 20μL,Taq PCRMaster Mix 25μL,
GeoL1 1.5μL,
GeoA2 1.5μL,DNA 2μL)。94℃预变性4 min,94℃变性30s,54℃退火1min,72℃延伸2 min,其中变性、退火、延伸进行35个循环,后72℃延伸10 min。将扩增后的PCR原液稀释10~20倍作为第二轮DNA扩增模板,第二轮PCR上下游引物为AM1(5'-GTTTCCCGTAAGGCGCCGAA-3')和NS31-GC(5'-TTGGAGGGCAAGTCTGGTGCC-3')94℃预变性2 min,94℃变性45s,55℃退火1min,72℃延伸45s,其中变陛、退火、延伸进行35个循环,后72℃延伸7 min,回收PCR扩增产物进行1%琼脂糖凝胶电泳(110V,25min)经凝胶成像系统(Molecular Imager GEL Doc TM XR)检测,观察结果,拍照并记录。将条带清晰的产物送擎科生物公司(TSINGKE昆明)测序分析。
2.2高山栎根际潜在的AMF鉴定
2.2.1高山栎根际AMF分子克隆 为证明高山栎根系内外根际存在AMF,取-80℃冷冻保存的西藏、四川(GSL1-a,GSL4-a)以及香格里拉地区的高山栎根系(G)样本,置于流水下冲洗根系表面后,分别剪成1cm长的小段放入1.5 mL的离心管中,加入75%的酒精后剧烈震荡30 s,将根系取出至ddH2O下冲洗,后放入已灭菌的研钵加液氮速冻并研磨至粉末状。利用试剂盒(EZUP柱式植物基因组DNA抽提试剂盒,SANGONG),严格按照盒内使用说明书的操作步骤提取高山栎根系总DNA,使用AMF的特异上下游引物AML1,AML2对高山栎内外根际潜在的AM真菌DNA进行扩增。反应体系为50μL(ddH2O 24.8μL,TaqPCRMasterMix16.2μL, AML1、AML2各2.5μL,DNA 4μL)。步骤为94℃预变性4 min,94℃变性30s,54℃复性1min,72℃退火2 min,其中变性、复性、退火进行35个循环,后72℃延伸10 min。之后经凝胶电泳(同2.1.3)检测后,利用PCR产物纯化回收试剂盒,纯化回收产物,使用克隆试剂盒(零背景TOPO-TA克隆试剂盒)严格按照使用说明将回收的DNA插入质粒载体。于37℃在LB液体培养基中培养1h(将液体培养基放入摇床180~200 rpm震荡培养)。培养完成后在超净工作台下取200μL菌液涂布于提前加入氨苄青霉素(AMP)的LB固体培养基上,待培养基吸收后封存,37℃恒温培养12~16h。
在超净工作台下将培养好的菌落用无菌的移液器吸头(量程为20μL)挑人提前加装10μL ddH2O的PCR管并抽吸混匀,利用AML1和AML2引物对DNA模板进行扩增。反应体系为50μL(ddH2O22.8μL, Taq PCR Master Mix 20.2μL, AML1、AML2各2.5μL,DNA2μL)。94℃预变性2min,94℃变性45s,65℃复性1 min,72℃退火45 min,其中变性、复性、退火进行35个循环,后72℃延伸10 min。经凝胶电泳检测后将扩增结果良好的样本送至测序公司(SanGong昆明)测序。
2.2.2高山栎根系AMF染色观察 分别将2次采集的根系须根样本剪成0.5~1 cm的小段,置入盛有10% KOH溶液的试管于水浴锅90℃脱色处理,直至根系颜色变淡,用蒸馏水反复冲洗后加入0.5%的苯胺蓝染液继续90℃染色1 h,重复冲洗步骤用3%乳酸、甘油脱色2~3 d至半透明后,置于显微镜下观察根系内的AMF泡囊丛枝结构。
2.3数据处理
利用Chromas2.22、观察序列峰图、DNAman 8剪贴与拼接序列。将序列提交至NCBI基因数据库比对并下载同源序列。使用Mega X多序列比对并筛选建树模型,选择参数值最高的推荐模型,利用最大似然法1000次迭代循环检验构建系统发育树。
运用EXCEL2016统计孢子密度数据及扩增样本序列比对数据。
3结果与分析
3.1几种高山栎土壤AMF孢子形态及土壤孢子密度特征
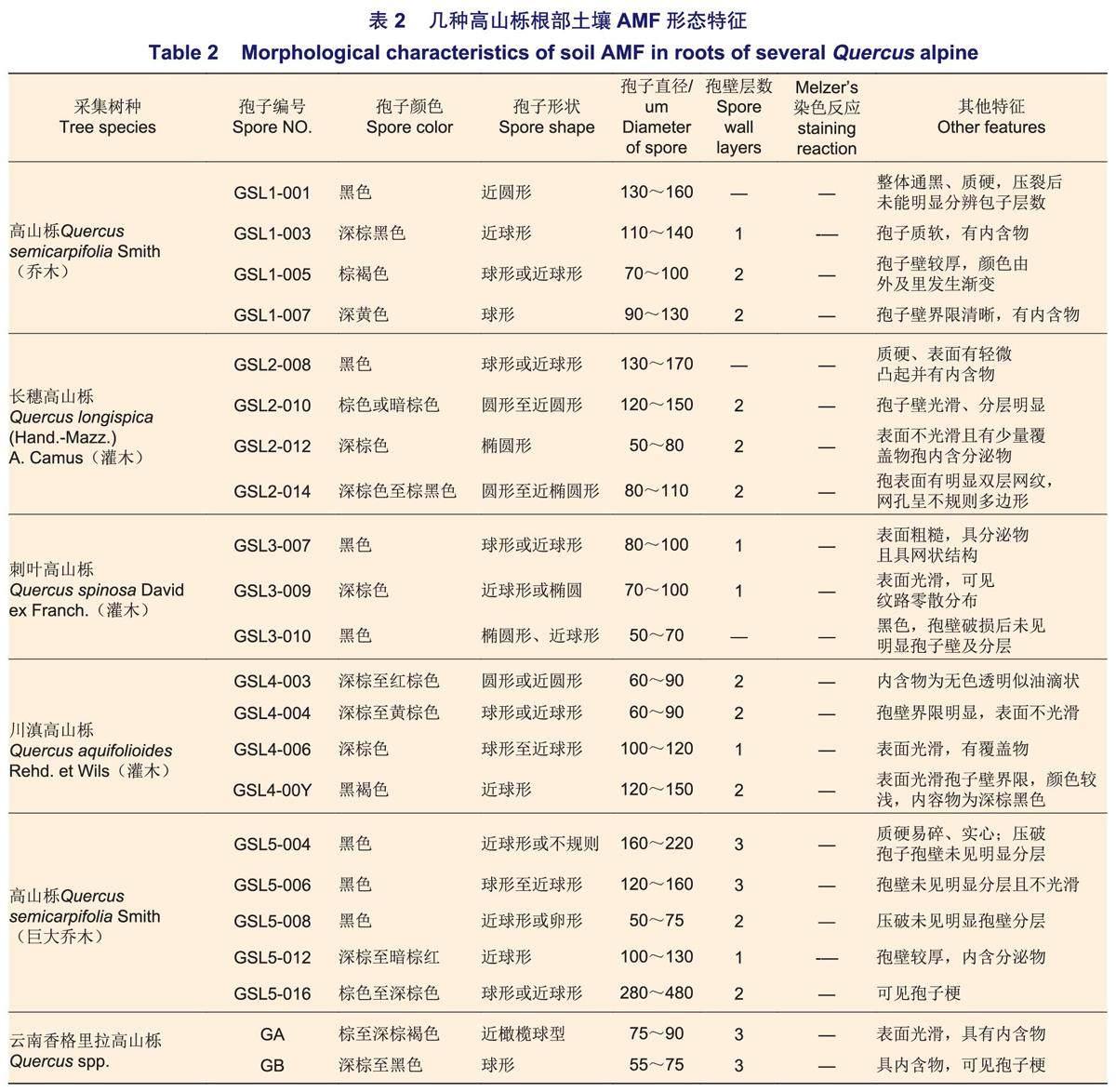
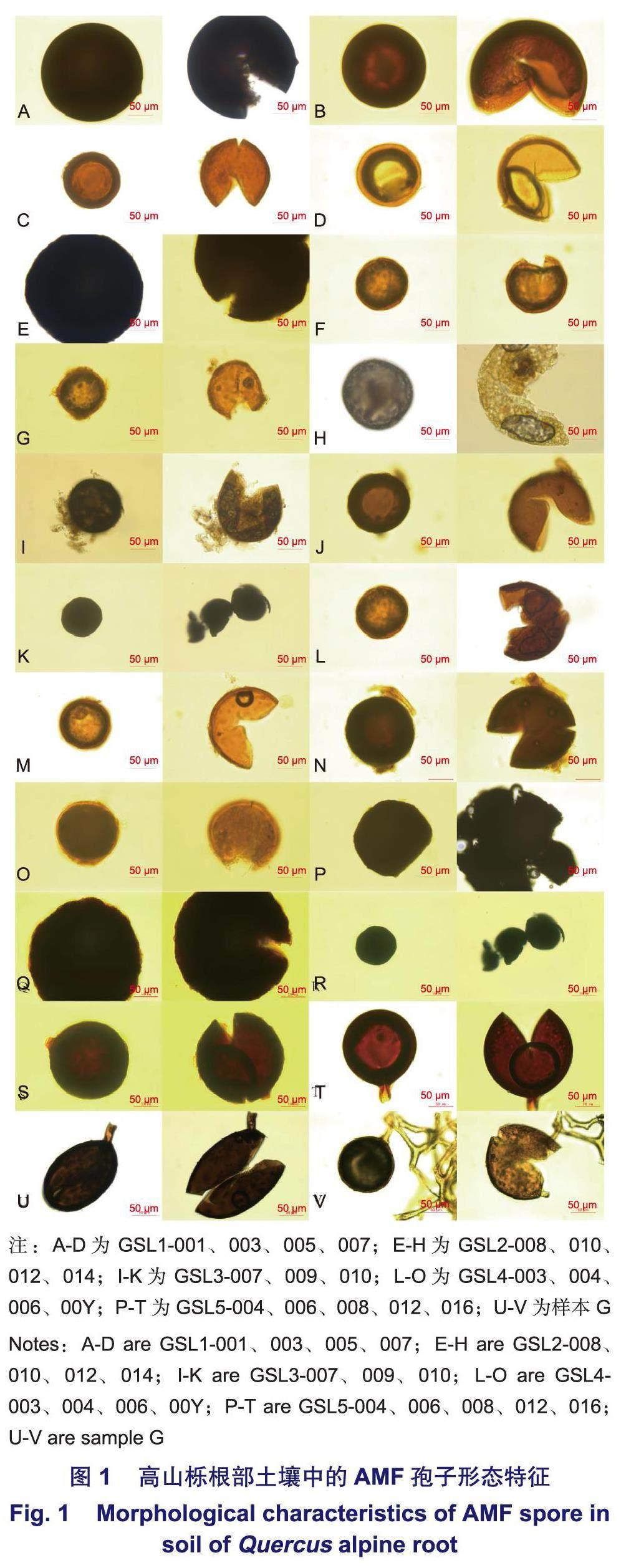
对高山栎根部10~30cm土壤的筛取结果表明:各高山栎样地下均有大量AMF孢子存在,孢子直径为50~220μm,形状以球形、近球形为主。颜色多以黑色和深棕色出现,偶见棕黄或深棕红,其中,部分孢子呈黑色,该类孢子在显微镜下压裂未见明显孢壁层数,部分孢子有分泌物渗出(表2,图1)。目前,经实验观察的孢子均未见Melzer's染液染色反应。5种高山栎根系土壤样本中孢子密度分别为GSL2(205.49)>GSL4(178.90)>GSL1(88.39)>GSL3(43.84)>GSL5(16.16)个·g-1,不同高山栎土壤样本具有明显差异,且呈乔木高山栎大于灌木的趋势(图2),其中,GSL3为灌木但表现出孢子密度相对较低的特征。各样本孢子100目下(直径>165μm)以黑色硬质孢子为主,多数孢子密集分布于300目筛(50~74μm)内,呈深棕色。
3.2结合形态学和分子生物学手段对高山栎林下菌塘AMF孢子及根系AMF克隆的鉴定
对西藏、四川各高山栎根围土壤中的AMF分子鉴定结果表明:横断山脉不同海拔地区采集的高山栎土壤AMF均与类球囊霉科(Paraglomeraceae)类球囊霉属(Paraglomus)具有较近的亲缘关系(表3)。经西弗吉尼亚大学孢子比对网站(occultum|Davis-INVAM|West Virginia University (wvu.edu))比对发现,Paraglomus属下目前收录的菌种仅有巴西类球囊霉(Paraglomus brasilianum(Spain&J.Miranda)J.B.Morton&D.Redecker)和隐类球囊霉(Paraglomus occultum (C.Walker)J.B. Morton&D.Redecker),但这2种AM孢子在颜色、质地、孢壁层数与Melzer's染液反应效果与目标菌种均明显不同。利用Mycobank检索AMF Paraglomus属,选取Gosling等和Mello等发表的AMF Paraglomus属的几种序列以及MAARJAM (ut.ee)中与本研究孢子相似度高于90%(相似度为90.9%~99.2%)的序列对几种高山栎林下AMF孢子进行系统发育树构建。结果表明:明确到种的Paraglomus序列聚为一支,MAARJAM (ut.ee)中ParaglomeraceaeParaglomus sp.属序列与样本GSL2-014聚为一支(图3),其余所有孢子与根系AMF克隆样本能够单独聚为一支,其中,同源序列相似度高于97%的个体极有可能为类球囊霉属内某种真菌。
3.3云南香格里拉高山栎根际AMF孢子和根系AMF的分子克隆
利用AMF特异引物AML1、AML2对香格里拉地区的高山栎根系潜在AMF的ITS片段DNA克隆,结果表明:经75%浓度酒精对高山栎根系表面消毒30s后,其根系表面仍存在AMF的DNA。通过MAARJAM (ut.ee)网站比对发现,存在真菌普遍与球囊霉属Glomus在Genbank中的标准序列相似度较高,部分目标菌种序列与Genbank中的序列对比有相似度较高的类球囊霉属Paraglomus序列存在(表4),但其在覆盖度(Query coverage)或最大识别度(Max identity)2个指标并非最高。利用Bio-edit软件检验克隆所得目标AM菌种同源性,发现17个菌种均为同一菌株,故选择G1为代表,与该样本下AMF孢子序列(GA、GB)一同构建系统发生演化树(图4),分析表明:目标菌种样品G1、GA和GB与Glomus versiforme(Y17651.1)聚为一支,说明其亲缘关系与该属较近,置信度可达98%,推测高山栎能够和与Glomus versiforme同源性较高的AMF形成共生关系,且其与林下菌塘孢子类似,二者均未能鉴定到种。说明能够与香格里拉地区高山栎根系共存的AMF极可能为球囊霉属和类球囊霉属,或与其并列的某一新属真菌。
3.4几种高山栎根系AMF泡囊丛枝结构观察
几种高山栎根系苯胺蓝染色结果表明:100~200倍放大时可见明显的类泡囊和丛枝结构,此类结构在高山栎根系内主要呈圆形或近圆形(图5a、b),部分呈椭圆形,部分泡囊分布密集,并伴随“向无规则方向伸展”的横向菌丝结构,推测其为高山栎根系于AMF共生所形成的泡囊和丛枝。
4讨论
4.1高山栎根围土AMF的验证
自然界中能够独立生存的生物少之又少,几乎所有生物之间普遍存在共生关系。AM作为一种重要的功能型土壤微生物,其与宿主植物间形成的共生体系能够使宿主植物在群落构成及其对外界生境在生态适应性层面产生深远影响。调查野生生境中的AMF不仅能够扩充AMF菌种资源库,有利于发掘AMF在不同宿主植物根系下的群落构成及多样性,且在探究其对于生态系统平衡稳定的可持续发展层面具重要意义。
横断山脉一直以来是生物多样性研究的热点地区,不少学者研究认为,4000~5000万年前印度次大陆与欧亚板块碰撞导致的青藏高原隆起,随后该地区可能成为东亚北温带植物的避难所。杨钦周认为,横断山脉纵向深切及垂直气候带的明显分布促使硬叶栎类古老栎群的残遗保留和新生类群的分化形成。因此,选择古老的高山栎组植物对其根系潜在的AMF进行研究,从演化发育的角度能够更有助于理解并揭示该地区AMF的起源、营养类型、生活方式及分类问题。
本研究利用湿筛沉淀法从形态学和分子生物学结合的视角证实高山栎林下菌塘中存在AMF真菌孢子,这与杨淑娇等基于磷脂脂肪酸(RLFP)方法研究香格里拉高山栎林下菌塘微生物的结果一致,验证了AMF在野生条件下能够广泛存在于横断山脉亚高山地区高山栎林下的假设。西藏、四川等地各土壤样本中的孢子18S rRNA gene分子证据表明,所有孢子均与类球囊霉属Paraglomus的亲缘关系较接近,通过将各孢子的形态学特征与已证实或发表的孢子形态对比发现,其在颜色、质地、孢壁层数和Melzer's染液反应效果等方面均与目前已知的巴西类球囊霉、隐类球囊霉及其他几种该属下发表的新种具有明显差异,故认为该地区高山栎林下AMF很有可能为类球囊霉属下的未知种。由于其所处地理位置植被分布的古老与独特性,结合18S rRNA gene序列相似度比对分析认为,其或在漫长演化进程中在Glomeraceae和Paraglomeraceae科便已出现分化。基于系统发育树(图3)对横断山北部西藏四川等地区孢子的演化进行推测,GSL2-14的演化介于Paraglomus和Archeaspora之间,而GSL1-001、2-008、3-007、4-003等则独立分为一支,与前者呈并列关系,这与前人基于真菌分类学为“科”级别将Paraglomus和Archeaspora从Glomus中分离出去的分类学定位相吻合。
4.2高山栎根系AMF扩增结果的提示
由于目前AMF分子研究技术仍旧有一定的局限性,即缺乏一套通用的既能扩增所有AM家族,又能排除非AM真菌的引物。因此,为保证克隆质量,选择AML1和AML2作为引物扩增高山栎根系(样本GSL1-a、GSL4-a、G)AMF的18srRNA基因,发现与四川、西藏等地高山栎克隆菌株相似度较高的AMF均为类球囊霉属Paraglomus,与香格里拉地区高山栎克隆菌株相似度较高的AMF则均为球囊霉属Glomus。系统发育树构建结果表明:Glomus versiforme与后者AMF同源性极高(图4),西藏、四川与香格里拉等地高山栎根系AMF结果存在一定差异。这种现象出现的原因可能是AMF在长期演化过程中随地域环境变化(从西藏、四川到云南)和不同高山栎种(表1)而逐渐发生分化。同时,本研究克隆结果与张中峰等将摩西球囊霉和根内球囊霉接种至青冈栎幼苗的结果类似,说明栎属植物在非人为干扰的野生环境下根系也存在AMF。第二,PCR扩增过程中由于DNA模板中存在残留的酚类及腐殖酸等,此类物质难以去除并会对DNA扩增造成一定影响。引物不同,扩增过程中的靶向序列碱基对存在差异,并且扩增时碱基错配的概率也可能呈倍放大,从而造成序列比对时发生单孢提取与分子克隆出现结果上的差异。此外,高山栎根系、土壤样本均分别仅有一种AMF出现,可能提示不同高山栎同时仅与一种AMF在内外根际范围产生联系。有研究表明,碳源和植物内源激素能够对AM产孢能力产生重要影响,二者条件丰富的情况下孢子萌发率较高。同理,高山栎生长在半阳坡地区,当地气候、海拔及水热条件使得土壤生境中的碳源及高山栎宿主植物内源激素发生变化,进而一定程度干扰AMF产孢,而Paraglomus和Glomus在高山栎根际微生物的生态位竞争过程中占据了相对优势地位,以此来确保自身所需碳源的充分供给。
综合横断山脉亚高山带几种高山栎林下菌塘AMF孢子调查及其根际AMF的克隆结果发现,高山栎组植物作为典型的被子植物,在与外生菌根真菌发生共生现象的同时,极有可能在自然环境中保留了与AMF存在共生的现象。在喜马拉雅造山运动后,横断山区长时间与外界环境隔离,土壤微生物在漫长的演化进程中由于地理环境的相对封闭而发生分化,最终形成了现有存在的AMF孢子,而该类孢子随区域(从西藏、川西到云南)变化显示出一定的演化差异,具体体现在其形态及分子学方面的不同。因此,在系统发育进化关系的构树结果中,该类孢子以单独汇聚为一支呈现。
5结论
本研究利用形态学与分子生物学的手段证明,自然条件下横断山脉亚高山地区高山栎林下菌塘普遍存在AMF,利用分子克隆手段发现AMF可分布于高山栎植物根系,且发现西藏、四川等地该类孢子在形态上与已知AMF属种存在较大差异,极有可能为Paraglomus属下的新种。同时,云南香格里拉地区高山栎根系AM与Glomus属更接近,说明AM在长期演化过程中随地域迁移出现分化。本研究结果为揭示AMF对横断山脉亚高山带高山栎生态适应性机制的影响提供新的证据,为进一步了解横断山脉亚高山带高山栎林下AMF的形成与演化提供理论参考。

