肝肌信号强度比及血清标志物对慢性乙型肝炎肝纤维化的诊断价值
温雅 屈兆宇 鲁景楠 阴玮灵 黄晓旗


摘要:目的 結合ALT和肝脏硬度值水平分组,探讨磁敏感加权成像(SWI)的肝肌信号强度比(LMR)及血清标志物诊断慢性乙型肝炎纤维化严重程度的价值。方法 回顾性收集2018年10月—2021年9月就诊于延安大学附属医院的慢性乙型肝炎患者255例,将患者分为严重肝纤维化(SLF)组77例与非SLF组178例,SLF组定义为ALT水平在正常范围内且肝脏硬度大于9.0 kPa,或ALT水平高于正常值上限1~5倍且肝脏硬度大于12.0 kPa的患者。在SWI序列下测量肝脏的平均SWI值(SWIliver)及竖脊肌信号强度并计算LMR。正态分布的计量资料2组间比较采用t检验,非正态分布的计量资料2组间比较采用Mann-Whitney U检验。计数资料组间比较采用χ2检验。利用二元Logistic回归分析SLF的影响因素。采用受试者工作特征(ROC)曲线分析LMR及其联合血清学的诊断效能,使用DeLong检验比较不同AUC的差异。结果 SLF组较非SLF组的ALT(Z=-3.569, P<0.001)、AST(Z=-5.495, P<0.001)、透明质酸(HA)(Z=-6.746, P<0.001)、层粘连蛋白(LN)(Z=-5.459, P<0.001)、Ⅳ型胶原(Ⅳ-C)(Z=-8.470, P<0.001)、Ⅲ型前胶原(PCⅢ)(Z=-6.326, P<0.001)、APRI(Z=-9.004, P<0.001)、FIB-4(Z=-8.357, P<0.001)高,较非SLF组的PTA(t=10.088, P<0.001)、PLT(t=9.163, P<0.001)、SWIliver(t=2.347, P=0.02)、LMR×10(Z=-4.447, P<0.001)低。PTA、HA、Ⅳ-C、LMR×10为发生SLF的独立影响因素(P值均<0.05)。LMR×10诊断SLF的ROC曲线下面积(AUC)为0.675(95%CI:0.614~0.732),高于SWIliver的0.594(95%CI:0.531~0.655)(Z=3.984, P<0.001),PTA+HA+Ⅳ-C+LMR×10(AUC=0.937, 95%CI:0.896~0.966)的诊断效能优于PTA+HA+Ⅳ-C(AUC=0.905, 95%CI:0.858~0.941)(Z=2.228, P=0.026)。结论 LMR及血清标志物可较准确区分SLF,LMR为一项定量、客观的影像学指标,优于SWIliver,并可提升血清学标志物对临床判定SLF的诊断效能。
关键词:乙型肝炎, 慢性; 肝硬化; 磁共振成像; 生物标记; 肝肌比; 诊断
基金项目:延安市科学技术研究发展计划项目(2018KS-11)
Value of liver-muscle signal intensity and serum markers in diagnosis of chronic hepatitis B liver fibrosis
WEN Ya, QU Zhaoyu, LU Jingnan, YIN Weiling, HUANG Xiaoqi. (Department of Medical Imaging, Affiliated Hospital of Yanan University, Yanan, Shaanxi 716000, China)
Corresponding author:
HUANG Xiaoqi, 344653354@qq.com (ORCID:0000-0003-1365-759X)
Abstract:
Objective To investigate the value of liver/muscle ratio (LMR) on susceptibility-weighted imaging (SWI) and serum markers in the diagnosis of the severity of chronic hepatitis B liver fibrosis after grouping based on alanine aminotransferase (ALT) level. Methods A retrospective analysis was performed for 255 patients with chronic hepatitis B who attended Affiliated Hospital of Yanan University from October 2018 to September 2021, and the patients were divided into severe liver fibrosis group (SLF group) and non-severe liver fibrosis group (non-SLF group). The SLF group was defined as liver stiffness measurement (LSM) >9.0 kPa and ALT level within the normal range or LSM >12.0 kPa and ALT level greater than 1-5 times of the upper limit of normal. LMR was calculated by measuring the mean SWI value of the liver (SWIliver) and the signal intensity of the erector spinae. The t-test was used for comparison of normally distributed continuous data between two groups, and the Mann-Whitney U test was used for comparison of non-normally distributed continuous data between two group; the chi-square test was used for comparison of categorical data between two groups. The binary logistic regression analysis was used to investigate the influencing factors for SLF. The receiver operating characteristic (ROC) curve was used to analyze the diagnostic performance of LMR and its combination with serum markers, and the DeLong test was used to compare the difference in the area under the ROC curve (AUC). Results Compared with the non-SLF group, the SLF group had significantly higher ALT (Z=-3.569, P<0.001), aspartate aminotransferase (AST) (Z=-5.495, P<0.001), hyaluronic acid (HA) (Z=-6.746, P<0.001), laminin (LN) (Z=-5.459, P<0.001), type Ⅳ collagen (Ⅳ-C)(Z=-8.470, P<0.001), type Ⅲ procollagen (PCⅢ) (Z=-6.326, P<0.001), aspartate aminotransferase-to-platelet ratio index (Z=-9.004, P<0.001), and FIB-4 (Z=-8.357, P<0.001) and significantly lower prothrombin time activity (PTA) (t=10.088, P<0.001), platelet count (t=9.163, P<0.001), SWIliver (t=2.347, P=0.02), and LMR×10 (Z=-4.447, P<0.001). PTA, HA, Ⅳ-C, and LMR×10 were independent influencing factors for SLF. LMR×10 had an AUC of 0.675 (95% confidence interval [CI]: 0.614-0.732) in the diagnosis of SLF, which was significantly higher than that of SWIliver
(AUC=0.594, 95%CI: 0.531-0.655) (Z=3.984, P<0.001). PTA+HA+Ⅳ-C+LMR×10 and PTA+HA+Ⅳ-C had an AUC of 0.937 (95%CI: 0.896-0.966) and 0.905 (95%CI: 0.858-0.941), respectively, suggesting that PTA+HA+Ⅳ-C+LMR×10 had a better diagnostic performance than PTA+HA+Ⅳ-C (Z=2.228, P=0.026). Conclusion LMR and serum markers can accurately distinguish SLF after grouping based on ALT level. LMR is a quantitative and objective imaging indicator and is better than SWIliver, and it can also improve the diagnostic performance of serum markers for SLF in clinical practice.
Key words:
Hepatitis B, Chronic; Liver Cirrhosis; Magnetic Resonance Imaging; Biomarkers; Liver Muscle Ratio; Diagnosis
Research funding:
Science and Technology Research and Development Project of Yanan (2018KS-11)
全球约有2.57亿人感染HBV,持续病毒感染会导致肝纤维化、肝硬化和肿瘤发生[1],肝纤维化是慢性肝病从轻度肝炎发展到失代偿期肝硬化的中间阶段[2]。准确评估肝纤维化程度,有助于确定最佳治疗方案,从而尽可能延缓肝纤维化进展。虽然肝活检是评估肝纤维化分期的“金标准”,但作为一项侵入性检查,存在并发症[2]和取样代表性欠佳的问题。
瞬时弹性成像测量的肝脏硬度(liver stiffness measure,LSM)作为无创检查已被指南广泛推荐评估肝纤维化[1-4],但LSM在炎症下会过高评估纤维化分期[5-6],为了控制炎症对LSM的误判,本文参考既往研究[7],并根据欧洲肝病学会指南[4],以ALT是否升高来控制炎症对肝纤维化的影响。有研究[8]发现磁敏感加权成像(susceptibility weighted imaging, SWI)下肝肌信号强度比(liver to muscle signal intensity ratio, LMR)具有鉴别健康对照与慢性纤维化的价值,但在严重纤维化与轻中度纤维化间并未发现差异。HA、Ⅳ-C、LN、PCⅢ为肝纤维化的血清学标志物[9],本研究旨在控制炎症的影响因素下,探讨影像学及血清学在区分慢性乙型肝炎人群中严重肝纤维化(severe liver fibrosis, SLF)的诊断价值,并探讨LMR可否提高血清学诊断效能,更有效的辅助临床诊断。
1 资料与方法
1.1 研究对象 回顾性收集2018年10月—2021年9月就诊于本院的慢性乙型肝炎患者资料。纳入标准:(1)年龄>18岁;(2)HBsAg阳性连续>6个月;(3)LSM及磁共振SWI序列资料完整。排除标准:(1)肝癌或肝转移瘤;(2)其他非乙型肝炎导致的慢性肝病;(3)ALT>正常值上限5倍(200 U/L);(4)磁共振图像存在严重伪影者。根据欧洲肝病学会指南[4],将SLF定义为:ALT水平正常的患者,LSM>9.0 kPa,或ALT水平为正常值上限1~5倍的患者,LSM>12.0 kPa。将ALT水平正常,LSM<9 kPa的患者,或ALT水平在40~200 U/L,LSM<12.0 kPa的患者定义为非SLF。
1.2 血清学检测 收集患者入院时的体质量指数(BMI)、血小板计数(PLT)、血浆凝血酶原活动度(PTA)、AST、ALT、透明质酸(HA)、层粘连蛋白(LN)、Ⅳ型胶原(Ⅳ-C)、Ⅲ型前胶原(PCⅢ)。根据公式计算AST和PLT比率指数(APRI)和FIB-4。APRI=(AST/AST的正常值上限)/PLT×100;FIB-4=(年龄×AST)/(PLT×ALT1/2)[3]。
1.3 超声弹性成像检查 使用AIXPLORER超声工作站进行瞬时弹性成像检查。嘱患者检查前空腹6 h,用10次测量的中位数代表LSM[3]。
1.4 MRI檢查 使用3.0T联影磁共振成像系统,型号uMR 770, 嘱患者检查前空腹6 h,扫描时受试者呈仰卧位,使用腹部线圈,SWI序列参数为TR 120 ms,TE 10 ms,反转角30°,层厚6 mm,间距20 mm。
1.5 图像分析 在PACS系统中测量肝脏SWI信号强度,在同一平面中肝左叶内外段、肝右叶前后段放置4个圆形感兴趣区,大小为(102.35±7.35)mm2,避开血管、胆管、肝内良性占位,计算肝脏的平均SWI值(SWIliver)。同层面测量右侧竖脊肌的值,计算肝肌比(LMR)=SWIliver/SWI竖脊肌,为了放大不同纤维化程度LMR的差异,将LMR×10。由3位低年资医师测量,意见不统一时由高年资医师判定测量值(图1)。
1.6 统计学方法 使用SPSS 26.0及MedCalc软件进行统计学分析。正态分布的计量资料以x±s表示,2组间比较采用t检验,非正态分布的计量资料以M(P25~P75)表示,2组间比较采用Mann-Whitney U检验。计数资料2组间比较采用χ2检验。利用二元Logistic回归分析SLF的影响因素。绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),使用DeLong检验比较不同AUC的差异。P<0.05为差异有统计学意义。
2 结果
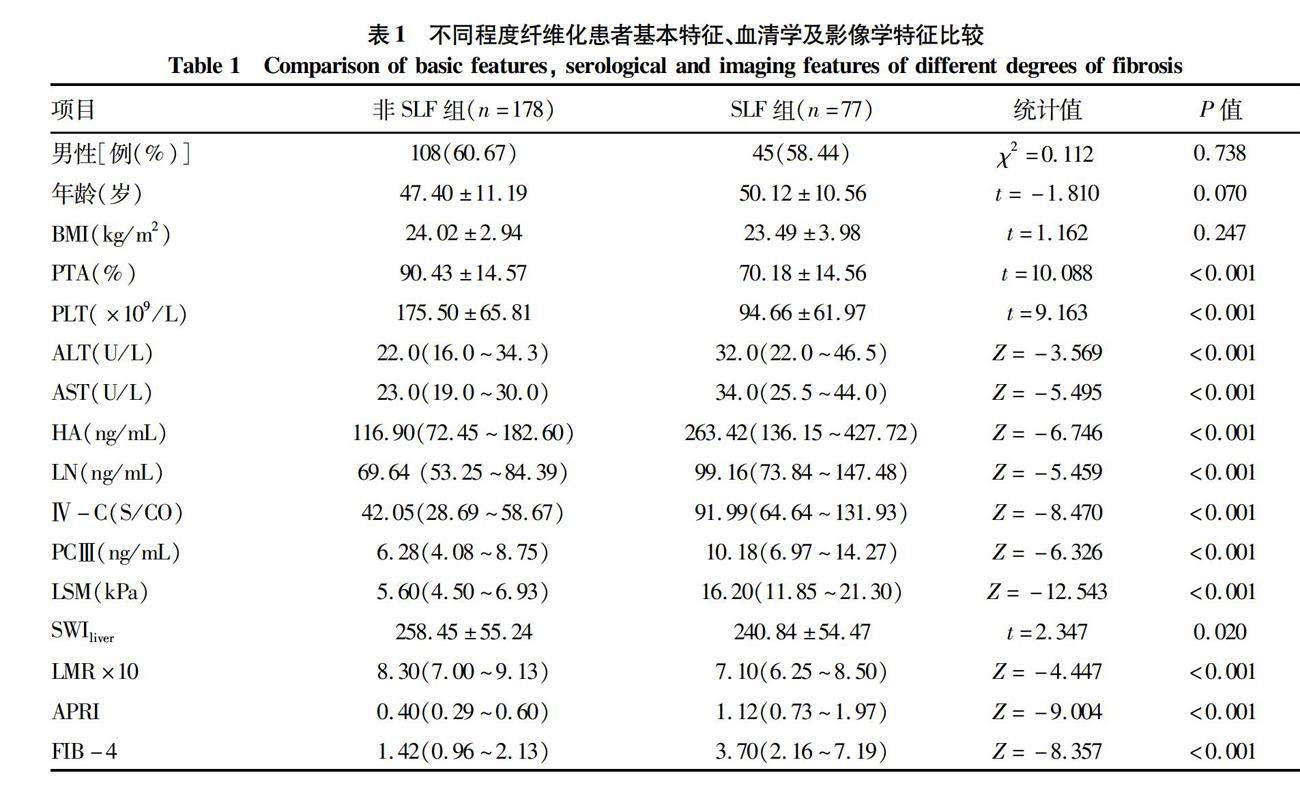
2.1 不同程度肝纤维化的基本特征 共收集255例患者,其中男153例,女102例,平均(48.22±0.69)岁,平均BMI为(23.86±0.21)kg/m2。非SLF组178例,LSM为5.60(4.50~6.93)kPa,SLF组有77例,LSM分布为16.20(11.85~21.30) kPa。SLF组较非SLF组ALT、AST、HA、LN、Ⅳ-C、PCⅢ、APRI、FIB-4升高,PTA、PLT降低(P值均<0.001),SLF组的SWIliver、LMR×10较非SLF组降低(P值均<0.05)(表1)。两组间SWIliver的均值差为-17.6,两组间LMR×10的均值差为-8.64 (图2)。
2.3 LMR、血清學联合LMR诊断SLF的效能 绘制SWI、LMR、PTA+HA+Ⅳ-C、PTA+HA+Ⅳ-C+LMR×10诊断SLF的ROC曲线。SWIliver的AUC为0.594(95%CI:0.531~0.655),LMR的AUC为0.675(95%CI:0.614~0.732),截断值为0.79,敏感度为64.94%,特异度为61.80%。DeLong检验结果显示,LMR×10与SWIliver的AUC有统计学差异(Z=3.984, P<0.001)。PTA+HA+Ⅳ-C的AUC为0.905(95%CI:0.858~0.941),PTA+HA+Ⅳ-C+LMR×10的AUC为0.937(95%CI:0.896~0.966),敏感度为86.15%,特异度为86.18%,DeLong检验结果显示,加入LMR后, 二者AUC有统计学差异(Z=2.228, P=0.026)(表3,图3)。
3 讨论
肝纤维化是慢性肝病肝脏组织的主要结构改变,纤维化范围及严重程度与发生肝硬化和肝脏相关并发症的风险密切相关,故准确评估肝纤维化程度在临床诊疗中有良好的指导作用[4]。非侵入性检查可全
面评估肝脏,尤其当纤维化分布不均匀时,瞬时弹性成像的LSM已常规应用评估肝纤维化程度[1-4,10]。但在相同病理纤维化分级下,观察到慢性乙型肝炎人群中LSM随着肝脏炎症的严重程度而逐渐增加[5]。Huang等[6]通过对比病理评分发现ALT水平≥5倍
正常值上限、肝脏炎症活动度>2与LSM误诊肝纤维化分期相关,故肝脏炎症状态会高估LSM值,肝脏炎症是常伴随状态,但鲜有研究在慢性乙型肝炎人群中控制肝脏炎症的情况下评价纤维化程度,本文根据欧洲肝病学会指南[4],以ALT是否升高来控制炎症对肝纤维化的影响后,再根据LSM分组,探讨在此分类下LMR、血清学标志物、血清学联合模型诊断肝纤维化严重程度的价值。
磁共振的SWI敏感反应磁化率信息的改变[11]。肝纤维化可造成肝细胞退化、坏死,致肝脏转化铁的功能降低,造成细胞内沉积铁蛋白,网状内皮系统沉积含铁血黄素,从而因顺磁性造成SWI信号减低[12]。肝实质最易受铁质沉积影响而肌肉很少受累,且肝脏信号强度通常比肌肉信号强,通过简单的视觉评估就能发现肝脏信号的轻微下降[13],另一方面肝脏与肌肉的信号比可排除患者的个体差异,本文结果表明LMR×10的AUC高于SWI,表明LMR具有更佳的诊断效能。有学者[12]在兔肝纤维化模型证实LMR与肝纤维化的分期呈负相关。在一项乙型肝炎占比5%的临床研究[14]中发现LMR和肝纤维化呈强相关(r=-0.81),和炎症(r=-0.52)、铁质沉积(r=-0.37)呈中度相关,肝脏纤维化及铁质沉积这两个因素解释了69% LMR值的变化。有研究[15]表明肝脏特异性对比剂肝胆期的LMR在诊断SLF的AUC为0.70,敏感度为43.3%,本文LMR的敏感度为64.94%,且SWI序列无需注射造影剂。程渝等[8]发现LMR在区分健康对照与明显纤维化(S2~S4期)、肝硬化(S4期)与S0~S3期有差异,但并未区分SLF。本文在慢性乙型肝炎人群中发现SLF组的SWIliver及LMR值较低,LMR×10的OR值为0.39(95%CI: 0.25~0.59),LMR每增加0.1个单位,SLF的风险降低了61%,表明控制炎症状态下LMR可有效区分SLF。
APRI和FIB-4是常规的血清学联合模型[16],中国肝纤维化指南[3]推荐FIB-4<1.45排除病理分级≥F3,FIB-4≥3.25诊断病理分级≥F3,本文非SLF组FIB-4中位数为1.42,SLF组中位数为3.70,与指南相符,在此分类下血清学模型也可较好的区分SLF,间接表明该分组适用于国内人群。PTA反应肝脏凝血因子的合成功能及肝脏储备功能[9],本文结果显示SLF组PTA较非SLF组低,OR为0.93(95%CI:0.90~0.97),PTA每增加一个单位,SLF的风险降低7%。
慢性肝病导致的肝纤维化为肝脏细胞外基质胶原、蛋白多糖等病理性沉积[2-3],HA反映肝内皮细胞功能,血清PCⅢ含量反映Ⅲ型胶原代谢的活性,Ⅳ-C是基底膜的主要成分[17],均为纤维化特异性血清学标志物。本文SLF组中HA、PCⅢ、Ⅳ-C、LN均比非SLF组高,HA的OR为1.01(95%CI:1.00~1.01),Ⅳ-C的OR为1.04(95%CI:1.02~1.06),表明HA、Ⅳ-C每升高一个单位,SLF的风险也随之增加。联合PTA、HA、Ⅳ-C、LMR×10诊断SLF的AUC达0.937,敏感度为86.15%,特异度为86.18%,高于PTA+HA+Ⅳ-C的AUC,表明在控制炎症状态分类下LMR可提升血清学标志物的诊断效能,具有一定的临床价值。
本文尚有以下局限性:未用病理结果作为诊断标准,故无法探讨LMR在鉴别轻度肝纤维化(F1)、进展期肝纤维化(F2~F3)、肝硬化(F4)之间的有效性。本文为单中心回顾性研究,不同设备的LMR截断值可略有不同,需进一步行前瞻性多中心研究探讨LMR诊断纤维化严重程度的效能。
综上所述,根据ALT水平进行分组下LMR及血清学可较准确区分SLF,LMR作为一项非侵入式检查在诊断SLF中具有一定的价值,并可提升血清学标志物的诊断效能,临床工作中根据此分类利用LMR及血清学标志物可辅助医师评判慢性乙型肝炎纤维化严重程度。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究果有关的利益冲突。
作者贡献声明:温雅、黄晓旗对研究的思路及设计有关键贡献;屈兆宇、鲁景楠参与了研究数据的获取分析解释过程;温雅、阴玮灵、黄晓旗参与起草并修改文章关键内容。
参考文献:
[1]
Chinese Society of Infectious Diseases, Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B[J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn. 1001-5256.2019.12.007.
中華医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
[2]SHIHA G, IBRAHIM A, HELMY A, et al. Asian-Pacific Association for the Study of the Liver (APASL) consensus guidelines on invasive and non-invasive assessment of hepatic fibrosis: a 2016 update[J]. Hepatol Int, 2017, 11(1): 1-30. DOI: 10.1007/s12072-016-9760-3.
[3]Chinese Society of Hepatology, Chinese Society of Gastroenterology, Chinese Society of Infectious Diseases,Chinese Medical Association. Consensus on the diagnosis and therapy of hepatic fibrosis(2019)[J]. J Clin Hepatol, 2019, 35(10): 2163-2172. DOI: 10.3969/j.issn.1001-5256.2019.10.007.
中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会感染病学分会. 肝纤维化诊断及治疗共识(2019年)[J]. 临床肝胆病杂志, 2019, 35(10): 2163-2172. DOI: 10.3969/j.issn.1001-5256.2019.10.007.
[4]European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis[J]. J Hepatol, 2015, 63(1): 237-264. DOI: 10.1016/j.jhep.2015.04.006.
[5]WANG L, ZHU M, CAO L, et al. Liver stiffness measurement can reflect the active liver necroinflammation in population with chronic liver disease: a real-world evidence study[J]. J Clin Transl Hepatol, 2019, 7(4): 313-321. DOI: 10.14218/JCTH.2019.00040.
[6]HUANG LL, YU XP, LI JL, et al. Effect of liver inflammation on accuracy of FibroScan device in assessing liver fibrosis stage in patients with chronic hepatitis B virus infection[J]. World J Gastroenterol, 2021, 27(7): 641-653. DOI: 10.3748/wjg.v27.i7.641.
[7]SETO WK, HUI R, MAK LY, et al. Association between hepatic steatosis, measured by controlled attenuation parameter, and fibrosis burden in chronic hepatitis B[J]. Clin Gastroenterol Hepatol, 2018, 16(4): 575-583.e2. DOI: 10.1016/j.cgh.2017.09.044.
[8]CHENG Y, GUO R, LIU MG, et al. Value of MRI and quantitative serological markers detection to the diagnosis of liver fibrosis [J]. J Chin Pract Diagn Ther, 2018, 32 (6): 589-593. DOI: 10.13507/j. ssn.1674-3474.2018.06.021.
程渝, 郭锐, 刘明国, 等. MRI与血清学定量指标检测对肝纤维化的诊断价值[J]. 中华实用诊断与治疗杂志, 2018, 32(6): 589-593. DOI: 10.13507/j.issn.1674-3474.2018.06.021.
[9]Chinese Society of Infectious Diseases, Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B (version 2019)[J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
中华医学会感染病学分会, 中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
[10]CHENG DY, LI B, JI SJ, et al. Application of transient elastography in noninvasive diagnosis of liver fibrosis[J/CD]. Chin J Liver Dis (Electronic Version), 2021, 13(4): 9-13. DOI: 10.3969/j.issn.1674-7380.2021.04.003.
程丹颖, 李贲, 纪世博, 等. 瞬时弹性成像技术在肝纤维化无创诊断中的应用[J/CD]. 中国肝脏病杂志(电子版), 2021, 13(4): 9-13. DOI: 10.3969/j.issn.1674-7380.2021.04.003.
[11]OBMANN VC, MARX C, BERZIGOTTI A, et al. Liver MRI susceptibility-weighted imaging (SWI) compared to T2* mapping in the presence of steatosis and fibrosis[J]. Eur J Radiol, 2019, 118: 66-74. DOI: 10.1016/j.ejrad.2019.07.001.
[12]JIANG JZ, DENG LB, RUAN JY, et al. Value of susceptibility weighted imaging in hepatic fibrosis staging by using MR in a rabbit model[J]. J Chin Med, 2016, 96(17): 1371-1376. DOI:10.3760/cma.j.issn.0376-2491.2016.17.015
江錦赵, 邓灵波, 阮继银, 等. 磁敏感加权成像在兔肝脏纤维化模型分期中的诊断价值[J]. 中华医学杂志, 2016, 96(17): 1371-1376. DOI: 10.3760/cma.j.issn.0376-2491.2016.17.015.
[13]GANDON Y, OLIVI D, GUYADER D, et al. Non-invasive assessment of hepatic iron stores by MRI[J]. Lancet, 2004, 363(9406): 357-362. DOI: 10.1016/S0140-6736(04)15436-6.
[14]BALASSY C, FEIER D, PECK-RADOSAVLJEVIC M, et al. Susceptibility-weighted MR imaging in the grading of liver fibrosis: a feasibility study[J]. Radiology, 2014, 270(1): 149-158. DOI: 10.1148/radiol.13122440.
[15]SHI DD, GUO R, LIU YH, et al. The value of gadoxetate disodium enhanced MRI in the quantitative assessment of liver fibrosis[J]. Chin J Radio, 2022, 56(3): 273-278. DOI: 10.3760 / cma.j.cn112149-20210316-00236.
师丹丹, 郭然, 刘月华, 等. 钆塞酸二钠增强MRI定量评估肝纤维化的价值[J]. 中华放射学杂志, 2022, 56(3): 273-278. DOI: 10.3760/cma.j.cn112149-20210316-00236.
[16]LI GP, ZHANG HX, ZHANG L, et al. HA, Ⅳ-C, APRI and Fib-4 for diagnosis of liver fibrosis effect after hepatitis B[J]. J Clin Exp Med, 2021, 20(13): 1385-1388.
李广平, 张红心, 张蕾, 等. 透明质酸、Ⅳ型胶原、APRI及纤维蛋白原-4对乙型肝炎后肝纤维化的诊断价值[J]. 临床和实验医学杂志, 2021, 20(13): 1385-1388.
[17]YANG XZ, GEN AW, XIAN JC, et al. Diagnostic value of various noninvasive indexes in the diagnosis of chronic hepatic fibrosis[J]. Eur Rev Med Pharmacol Sci, 2018, 22(2): 479-485. DOI: 10.26355/eurrev_201801_14198.
收稿日期:
2022-08-01;录用日期:2022-09-06
本文编辑:朱晶

