早期血清前S1抗原(PreS1)对干扰素α治疗的HBeAg阳性慢性乙型肝炎儿童HBsAg阴转的预测价值
樊佩瑶 王福川 高银杰 徐志强 董漪 闫建国 曹丽丽 冯丹妮 钟彦伟 张敏

摘要:目的探討血清前S1抗原(PreS1)水平作为预测干扰素α(IFN-α)治疗48周的HBeAg阳性慢性乙型肝炎(CHB)儿童HBsAg转阴指标的价值。方法纳入2016年6月—2020年1月接受IFN-α治疗48周的88例1~16岁HBeAg阳性CHB患儿,每3个月评估患儿的HBsAg定量(qHBsAg)、HBV DNA定量、ALT等,并采用磁微粒化学发光免疫分析法(双抗体夹心法)检测PreS1水平。根据IFN-α治疗48周终点时HBsAg是否转阴分为转阴组(n=17)和未转阴组(n=71)。计量资料的两组间比较采用Mann-Whitney U检验,计数资料的两组间比较采用χ2检验或Fisher精确检验。用Spearman秩相关检验评估PreS1水平和其他生物标志物之间的关系。用受试者工作特征曲线下面积(AUC)评估不同标志物对IFN-α治疗48周终点HBsAg转阴的预测价值。结果PreS1水平与血清qHBsAg、HBV DNA水平呈正相关(r值分别为0.912、0.535,P值均<0.05)。基线时,PreS1/qHBsAg比值(AUC=0.694)较PreS1水平(AUC=0.530)和qHBsAg水平(AUC=0.514)具有较好的48周HBsAg转阴预测价值。治疗12周的PreS1水平(AUC=0.867,P<0.001)和PreS1/qHBsAg比值下降量(AUC=0.800,P=0.002)均对48周终点时HBsAg转阴有很好的预测作用。治疗24周的PreS1水平、qHBsAg水平和HBV DNA均可有效预测第48周的HBsAg转阴,AUC分别为0.917、0.949和0.762(P值均<0.001)。结论治疗12周时血清PreS1水平和PreS1/qHBsAg比值下降量是预测IFN-α治疗期间CHB患儿HBsAg转阴的候选标志物。
关键词:PreS1; 生物标记; 乙型肝炎, 慢性; 儿童; 干扰素α
基金项目:国家科技重大专项 (2018ZX10301404); 北京市科技计划项目 (Z201100005520048); 首都临床诊疗技术研究及转化应用项目 (Z201100005520048)
Value of serum PreS1 in early prediction of HBsAg clearance after IFN-α treatment in children with HBeAg-positive chronic hepatitis B
FAN Peiyao WANG Fuchuan GAO Yinjie XU Zhiqiang DONG Yi YAN Jianguo CAO Lili FENG Danni ZHONG YanweiZHANG Min(1. Peking University 302 Clinical Medical School, Beijing 100191, China; 2. Department of Liver Diseases, The Fifth Medical Center of Chinese PLA General Hospital, Beijing 100039, China)
Corresponding author:ZHANG Min, gcmw2001@163.com (ORCID:0000-0003-2497-6748)
Abstract:ObjectiveTo investigate the value of PreS1 level in predicting HBsAg clearance in children with HBeAg-positive chronic hepatitis B (CHB) after 48 weeks of IFN-α treatment. MethodsA total of 88 children with HBeAg-positive CHB, aged 1-16 years, who received 48 weeks of IFN-α treatment from June 2016 to January 2020 were enrolled. HBsAg quantification (qHBsAg), HBV DNA quantification, and alanine aminotransferase were measured every three months, and magnetic particle chemiluminescence immunoassay (double-antibody sandwich) was used to measure the level of PreS1. According to whether HBsAg clearance was achieved at the end of IFN-α treatment for 48 weeks, the 88 children were divided into HBsAg clearance group with 17 children and non-HBsAg clearance group with 71 children. The Mann-Whitney U test was used for comparison of quantitative data between the two groups, and the chi-square test or the Fishers exact test was used for comparison of qualitative data between the two groups. The Spearman rank correlation test was used to evaluate the correlation of PreS1 level with other biomarkers, and the area under the ROC curve (AUC) was used to investigate the value of different markers in predicting HBsAg clearance at the end of 48-week IFN-α treatment. ResultsPreS1 level was positively correlated with the serum levels of qHBsAg and HBV DNA (r=0.912 and 0.535, both P<0.05), and baseline PreS1/qHBsAg ratio (AUC=0.694) had a better value than PreS1 level (AUC=0.530) and qHBsAg level (AUC=0.514) in predicting HBsAg clearance at week 48. PreS1 level (AUC=0.867, P<0.001) and the reduction in PreS1/qHBsAg ratio (AUC=0.800, P=0.002) at week 12 of treatment had a good value in predicting HBsAg clearance at week 48. PreS1 level, qHBsAg level, and HBV DNA at week 24 of treatment could effectively predict HBsAg clearance at week 48, with AUCs of 0.917, 0.949, and 0.762, respectively (all P<0.001). ConclusionSerum PreS1 level and the reduction in PreS1/qHBsAg ratio at week 12 of treatment can be used as candidate markers for predicting HBsAg clearance in children with CHB during IFN-α treatment.
Key words:PreS1; Biomarkers; Hepatitis B, Chronic; Child; Interferon-alpha
Research funding:the National Science and Technology Major Project of the Infectious Diseases (2018ZX10301404) ;Beijing Science and Technology Program (Z201100005520048); the Capital Clinical Diagnosis and Treatment Technology Research and Translational Application Program (Z201100005520048)
以HBsAg转阴为标志的临床治愈是慢性乙型肝炎(CHB)患者追求的理想终点。相比于成人[1],儿童CHB患者干扰素(IFN)抗病毒治疗1年后的HBsAg阴转率可达到20%以上[2],更可获得临床治愈。目前,预测CHB患儿抗病毒治疗后HBsAg转阴的因素并不十分明确。低龄[3-6]、低水平的HBsAg定量(qHBsAg)[4,7-8]、女孩[5]可能是HBsAg转阴的优势应答因素,近年来一些新型HBV标志物如抗-HBc定量[4,9]、HBV RNA[10]和HBV核心相关抗原[1]等对CHB患者临床结局的预测价值也有相关报道。血清前S1抗原(PreS1)作为一种经典HBV生物标志物,在预测CHB成人患者的临床结局中起着重要作用[11-14],但是过去由于检测方法的缺陷(多为ELISA的半定量检测),PreS1的应用受到了限制。近年来随着检测技术的进步与提高[15-16],PreS1定量检测方法也得到了发展,所以重新评估PreS1的临床应用价值很有必要。最近一项关于CHB儿童患者PreS1的探索性研究[4]表明, PreS1可能是CHB儿童接受抗病毒治疗后HBsAg转阴的良好预测指标,然而PreS1定量在预测CHB患儿HBsAg转阴中的具体作用仍不明确。本研究评估了血清PreS1定量在HBeAg阳性CHB患儿IFN-α治疗期间HBsAg转阴的预测价值,以期为CHB患儿的临床治疗决策提供依据。
1资料与方法
1.1研究对象收集2016年6月—2020年1月就诊于解放军总医院第五医学中心的88例CHB患儿的基本信息和临床资料。CHB患儿的诊断标准主要参照《慢性乙型肝炎防治指南(2019年版)》[17],纳入标准:(1)1~16岁;(2)血清HBsAg阳性持续6个月以上;(3)血清HBeAg阳性,抗-HBe阴性;(4)血清HBV DNA>20 000 IU/mL;(5)ALT>60 U/L;(6)肝组织活检或无创性检查结果显示有中度或重度炎症坏死,伴或不伴纤维化。排除标准:(1)曾因CHB感染接受过抗病毒治疗;(2)失代偿期肝硬化;(3)合并感染HAV、HCV、HDV或HEV、EB病毒、巨细胞病毒或人类免疫缺陷病毒等;(4)合并其他肝脏疾病,如自身免疫性肝炎、药物性肝损伤或Wilson病等;(5)有精神疾病史;(6)其他严重的疾病。
1.2研究方法收集患者入院时的基线资料,包括年龄、性别、清晨空腹实验室指标(ALT、HBsAg定量、HBV DNA定量、HBV基因型等)以及85例患儿入院时的肝组织活检病理报告(炎症活动度和纤维化程度分期主要参照Scheuer標准[18])。88例患儿均接受了48周的IFN-α治疗[19-20](肌肉或皮下注射,300~500万单位/m2体表面积,隔天1次),并完成了每3个月1次的规律随访,每次随访时收集患儿的实验室指标以及不良反应情况等,留取血清采用磁微粒化学发光免疫分析法(双抗体夹心法)进行PreS1蛋白的定量检测,检测试剂盒由山东威高生物科技有限公司(山东省威海市)提供,检测下限为0.01 ng/mL。
1.3统计学方法使用R软件(4.2.0版)和MedCalc软件(20.110版)进行数据分析。呈偏态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验,计数资料两组间比较采用χ2检验或Fisher精确检验。生物标志物数值进行了对数转换,并使用Spearman秩相关检验来评估PreS1蛋白定量和其他生物标志物之间的关系。计算受试者工作特征曲线下面积(AUC)来分析预测HBsAg转阴的准确性。P<0.05为差异有统计学意义。
2结果
2.1一般资料在IFN-α治疗48周后,19.3%(17/88)的患者实现了HBsAg转阴(<0.05 IU/mL),38.6%(34/88)的患者实现了HBeAg转阴(<1 COI),63.6%(56/88)的患者实现了HBV DNA转阴(<40 IU/mL)。根据48周IFN-α治疗后患儿是否HBsAg转阴将88例患儿分为转阴组(n=17)和未转阴组(n=71),转阴组的年龄低于未转阴组(P=0.006),除年龄外,两组患儿在基线特征上差异均无统计学意义(表1)。
2.2PreS1与其他HBV指标的相关性分析基线时,血清PreS1水平与qHBsAg水平(r=0.912,P<0.001)强相关,与HBV DNA水平(r=0.535,P<0.001)中等程度相关,与年龄、ALT水平弱相关(r值分别为-0.280、-0.223,P值均<0.05)(图1)。在85例接受肝组织活检的患儿中,基线PreS1水平、qHBsAg水平、PreS1/qHBsAg比值与炎症活动度、纤维化程度无明显相关(P值均>0.05)。
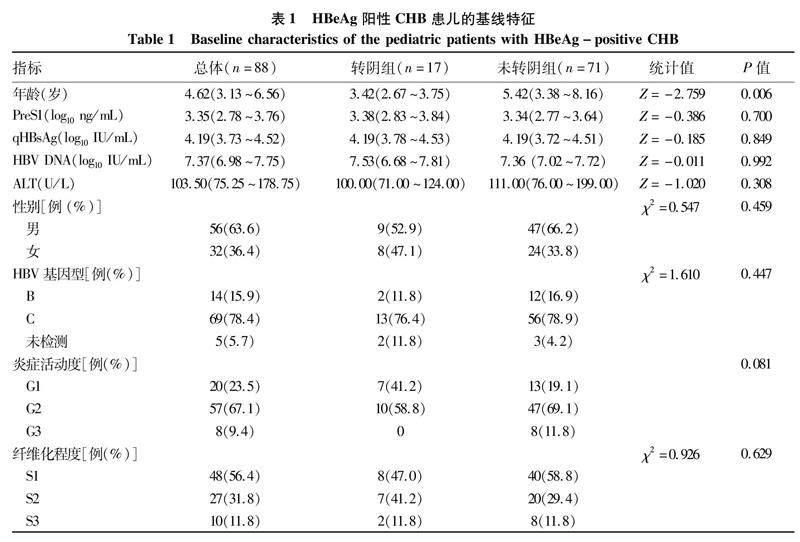
2.3基线各指标对CHB患儿HBsAg转阴的预测价值基线时,PreS1/qHBsAg比值(AUC=0.694)较PreS1水平(AUC=0.530)和qHBsAg水平(AUC=0.514)具有较好的48周HBsAg转阴预测价值。cut-off 值>0.073 8时,阳性预测值和阴性预测值分别为30.95% 和91.30%,敏感度和特异度分别为76.47%和59.15%(图2)。
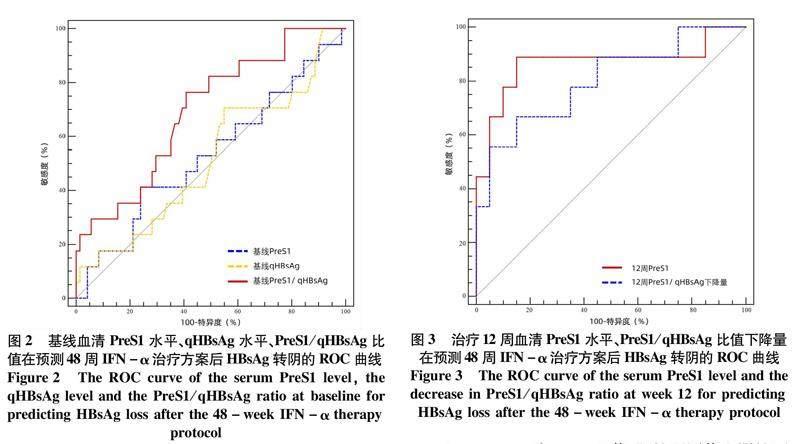
2.4治疗12周各指标对CHB患儿HBsAg转阴的预测价值IFN-α治疗第12周的PreS1水平以及PreS1/qHBsAg比值下降量(从基线到第12周的下降量)均可有效预测第48周的HBsAg转阴,AUC分别为0.867和0.800(图3),以第12周的PreS1水平≤1.91 log10 ng/mL为cut-off值,阳性预测值和阴性预测值分别为72.73%和94.44%,敏感度和特异度分别为88.89% 和85.0%。以PreS1/qHBsAg比值下降量>0.045 5为cut-off值,阳性预测值和阴性预测值分别为66.68%和85.01%,敏感度和特异度分别为66.67%和85.0%。
2.5治疗24周各指标对CHB患儿HBsAg转阴的预测价值在IFN-α治疗的第24周,PreS1水平、qHBsAg水平和HBV DNA均可有效预测第48周的HBsAg转阴,AUC分别为0.917、0.949和0.762(P值均<0.001)。
2.6IFN-α治疗的不良反应在2年的随访期间,88例CHB患儿均未出现严重的不良反应。59例患儿出现发热,5例患儿出现恶心、纳差,均能自行缓解;57例患儿出现中性粒细胞数减少(<2.0×109/L),给予对症处理后不影响治疗,IFN-α停药后自行缓解。
3讨论
CHB患儿抗病毒治疗后HBsAg转阴的有效预测指标对于治疗决策有着重要指导意义。而PreS1作为HBV感染性颗粒的特征性指标,其意义依旧引人关注。近年来随着PreS1蛋白定量检测技术的进步,重新评估PreS1蛋白的临床应用价值受到了很大的关注。已有德国学者[15]证实在成人CHB患者中,抗病毒治疗3个月的PreS1水平(AUC=0.839)是治疗终点HBsAg转阴的有力预测指标。然而,目前PreS1水平在CHB儿童抗病毒治疗中的预测作用尚无数据。本研究首次评估了PreS1水平在预测CHB患儿48周IFN-α治疗后HBsAg转阴中的作用,结果显示:在IFN-α治疗的第12周,PreS1水平和PreS1/qHBsAg比值的下降量对治疗终点(48周)的HBsAg转阴具有良好的预测作用。
HBsAg由三种表面蛋白组成,即小(SHB)、中(MHB)和大(LHB)表面蛋白。LHB包含S、PreS2和PreS1结构域,PreS1结构域仅存在于LHB中,HBV通过LHB的PreS1结构域与牛磺胆酸钠共转运多肽结合感染肝细胞[21],PreS1诱导免疫反应作用较强[22]。在基线时,血清PreS1水平与qHBsAg、HBV DNA水平呈正相关,这与既往文献[11-13]报道基本一致,研究结果略有差异表明了建立PreS1(LHB)和HBsAg水平检测国际化标准的必要性。血清PreS1水平与qHBsAg水平呈正相关,因为PreS1蛋白只存在于LHB中[23],是HBsAg的重要成分之一;PreS1和HBV DNA存在相关性也有理论依据,因为PreS1主要存在于Dane颗粒中,并包含病毒入侵肝细胞所必需的受体结合域[21]。PreS1和其他HBV标志物之间的良好相关性进一步表明PreS1可能成为评估HBV感染的潜在生物标志物。
本研究显示,基线PreS1/qHBsAg比值高的患者容易实现HBsAg转阴,推测是由于PreS1对B淋巴细胞和T淋巴细胞都有很强的免疫原性,基线PreS1/qHBsAg比值较高的宿主对HBV的PreS1域产生了更强的病毒特异性免疫反應,更有利于清除HBV并防止HBV感染/再感染肝细胞[22]。这进一步支持了笔者关于PreS1/qHBsAg比值从基线到第12周的下降量对第48周HBsAg转阴有预测作用的发现。PreS1/qHBsAg比值从基线到第12周的下降量越大,病毒特异性免疫反应越强,越容易实现HBsAg转阴。既往也有文献[24]报道血清PreS1/qHBsAg比值反映了肝纤维化的程度,但是本研究未得出此结论,可能与研究对象为儿童有关。此外,第12周的低PreS1水平对HBeAg阳性CHB患儿的HBsAg转阴也有很高的预测价值,推测是PreS1诱导了CD4+T淋巴细胞反应,在外周循环中产生了抗-PreS1以清除病毒,导致血清PreS1下降[22]。值得注意的是,第12周的PreS1水平比qHBsAg水平具有更高的预测价值,支持其作为HBsAg转阴的一个早期预测因素。PreS1和qHBsAg在第24周的预测作用都强于第12周,且24周时qHBsAg预测作用略强于PreS1,然而第12周的检验指标预测HBsAg转阴能够早期指导CHB治疗。值得一提的是,本研究发现基线PreS1和qHBsAg水平对HBsAg转阴没有预测作用,这与基线qHBsAg水平可以预测HBsAg转阴的文献报道相悖[8]。但是两项研究均存在样本量较小、回顾性研究等局限,未来还需进行大样本前瞻性研究,以得出确切的结论。综上所述,早期(12周)血清PreS1水平和PreS1/qHBsAg比值下降量是HBeAg阳性CHB儿童在IFN-α治疗期间HBsAg转阴的良好预测指标,可为CHB患儿的临床治疗决策提供参考,及时调整治疗方案以规避不良事件的发生。
此外,在纳入的研究对象中,转阴组的患儿较未转阴组的患儿年龄更小,这与以往的文献[3-4]报道一致。可能的原因有低龄患儿的HBV感染持续时间尚短、低龄患儿(1~3岁)的免疫系统具有特殊性、外周血淋巴细胞比例更高、肝细胞处于生长分裂期可能会有cccDNA的丢失以及生长激素对HBV的拮抗作用等[25]。
本研究结果表明血清PreS1水平在预测CHB患儿抗病毒治疗期间HBsAg转阴方面具有临床价值,可为儿童肝病医生提供临床管理的启示。然而本研究尚存在一定的局限性,如采用回顾性观察研究方法、纳入的样本例数较少、研究对象单一,且为单中心研究。简而言之,本研究结论需要进行国际多中心的前瞻性大队列研究来进一步验证,进一步阐明早期(12周)血清PreS1水平和PreS1/qHBsAg比值下降量对IFN-α治疗期间CHB患儿的HBsAg转阴有较强的预测作用的潜在机制,为CHB患儿的临床抗病毒治疗决策提供理论依据。
综上所述,早期(12周)血清PreS1水平和PreS1/qHBsAg比值下降量对IFN-α治疗期间CHB患儿的HBsAg转阴有较强的预测作用,对CHB患儿的临床决策具有重要的指导意义。
伦理学声明:本研究方案于2020年4月经由解放军总医院第五医学中心伦理委员会审批,批号:2020048D,患者监护人均签署知情同意书。 利益冲突声明:本文不存在任何利益冲突。 作者贡献声明:王福川、高银杰、徐志强、董漪、闫建国、曹丽丽和冯丹妮负责收集数据和初步统计分析;樊佩瑶负责数据统计分析和撰写初稿;张敏、钟彦伟负责课题设计,拟定写作思路,指导撰写文章并最后定稿。
参考文献:
[1]BRAKENHOFF SM, de KNEGT RJ, OLIVEIRA J, et al. Levels of antibodies to hepatitis B core antigen are associated with liver inflammation and response to peginterferon in patients with chronic hepatitis B[J]. J Infect Dis, 2022, 227(1): 113-122. DOI: 10.1093/infdis/jiac210.
[2]LIU YH, LI H, YAN XH, et al. Long-term efficacy and safety of peginterferon in the treatment of children with HBeAg-positive chronic hepatitis B[J]. J Viral Hepat, 2019, 26(Suppl 1): 69-76. DOI: 10.1111/jvh.13154.
[3]FAN HM, LIN LP, JIA SJ, et al. Interferon alpha treatment leads to a high rate of hepatitis B surface antigen seroconversion in Chinese children with chronic hepatitis B[J]. J Viral Hepat, 2019, 26(Suppl 1): 77-84. DOI: 10.1111/jvh.13165.
[4]PAN J, WANG HY, YAO TT, et al. Clinical predictors of functional cure in children 1-6 years-old with chronic hepatitis B[J]. J Clin Transl Hepatol, 2022, 10(3): 405-411. DOI: 10.14218/JCTH.2021.00142.
[5]ZHU SS, DONG Y, XU ZQ, et al. A retrospective study on HBsAg clearance rate after antiviral therapy in children with HBeAg-positive chronic hepatitis B aged 1-7 years[J]. Chin J Hepatol, 2016, 24(10): 738-743. DOI: 10.3760/cma.j.issn.1007-3418.2016.10.005.朱世殊, 董漪, 徐志強, 等. 1~7岁慢性乙型肝炎HBeAg阳性儿童经抗病毒治疗HBsAg清除率的回顾性研究[J]. 中华肝脏病杂志, 2016, 24(10): 738-743. DOI: 10.3760/cma.j.issn.1007-3418.2016.10.005.
[6]WANG LM, ZHAO JF, LIU JY, et al. Long-term benefits of interferon-α therapy in children with HBeAg-positive immune-active chronic hepatitis B[J]. J Viral Hepat, 2021, 28(11): 1554-1562. DOI: 10.1111/jvh.13598.
[7]REN Y, BIAN DD, LIANG C, et al. Predictive value of serum sphingolipids combined with HBsAg quantification in HBsAg clearance of chronic hepatitis B patients treated with nucleos(t)ide analog add-on pegylated interferon α[J]. Translat Med J, 2023, 12(1): 15-21. DOI: 10.3969/j.issn.2095-3097.2023.01.004.任艳, 卞丹丹, 梁晨, 等. 血清鞘脂联合定量HBsAg对核苷(酸)类似物经治慢性乙型肝炎患者加用聚乙二醇干扰素α后HBsAg阴转的预测价值[J]. 转化医学杂志, 2023, 12(1): 15-21. DOI: 10.3969/j.issn.2095-3097.2023.01.004.
[8]ZHONG YW, SHI YM, CHU F, et al. Prediction for HBsAg seroconversion in children with chronic hepatitis B[J]. BMC Infect Dis, 2021, 21(1): 1211. DOI: 10.1186/s12879-021-06883-1.
[9]WANG WX, JIA R, GAO YY, et al. Quantitative anti-HBc combined with quantitative HBsAg can predict HBsAg clearance in sequential combination therapy with PEG-IFN-α in NA-suppressed chronic hepatitis B patients[J]. Front Immunol, 2022, 13: 894410. DOI: 10.3389/fimmu.2022.894410.
[10]WU WK, YUAN XJ, ZHANG WL, et al. Clinical significance of novel biomarkers to predict the natural course of hepatitis B infection[J]. Front Public Health, 2022, 10: 1037508. DOI: 10.3389/fpubh.2022.1037508.
[11]RINKER F, BREMER CM, SCHRDER K, et al. Quantitation of large, middle and small hepatitis B surface proteins in HBeAg-positive patients treated with peginterferon Alfa-2a[J]. Liver Int, 2020, 40(2): 324-332. DOI: 10.1111/liv.14298.
[12]ZHU XJ, GONG QM, YU DM, et al. Early serum hepatitis B virus large surface protein level: A stronger predictor of virological response to peginterferon Alfa-2a than that to entecavir in HBeAg-positive patients with chronic hepatitis B[J]. J Clin Virol, 2013, 57(4): 318-322. DOI: 10.1016/j.jcv.2013.04.003.
[13]WANG NY, ZHANG D, ZHAO W, et al. Hepatitis B virus large surface protein in serum as a candidate biomarker for evaluating hepatitis B virus infection[J]. Clin Biochem, 2011, 44(14-15): 1199-1204. DOI: 10.1016/j.clinbiochem.2011.07.002.
[14]LIU C, WU WN, SHANG HY, et al. Prediction value of serum HBV large surface protein in different phases of HBV infection and virological response of chronic hepatitis B patients[J]. Clin Chimica Acta, 2018, 481: 12-19. DOI: 10.1016/j.cca.2018.02.015.
[15]PFEFFERKORN M, SCHOTT T, BHM S, et al. Composition of HBsAg is predictive of HBsAg loss during treatment in patients with HBeAg-positive chronic hepatitis B[J]. J Hepatol, 2021, 74(2): 283-292. DOI: 10.1016/j.jhep.2020.08.039.
[16]PFEFFERKORN M, BHM S, SCHOTT T, et al. Quantification of large and middle proteins of hepatitis B virus surface antigen (HBsAg) as a novel tool for the identification of inactive HBV carriers[J]. Gut, 2018, 67(11): 2045-2053. DOI: 10.1136/gutjnl-2017-313811.
[17]Chinese Society of Infectious Diseases, Chinese Medical Association; Chinese Society of Hepatology, Chinese Medical Association.Guidelines for the prevention and treatment of chronic hepatitis B (version 2019) [J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969 /j.issn.1001-5256.2019.12.007.中華医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. DOI: 10.3969 /j.issn.1001-5256.2019.12.007.
[18]SCHEUER PJ. Classification of chronic viral hepatitis: A need for reassessment[J]. J Hepatol, 1991, 13(3): 372-374. DOI: 10.1016/0168-8278(91)90084-0.
[19]CUI AX, DOU XG, DING Y. Antiviral therapy for pregnant women and children with chronic HBV infection[J]. J Clin Hepatol, 2022, 38(11): 2448-2451. DOI: 10.3969/j.issn.1001-5256.2022.11.003.崔傲雪, 竇晓光, 丁洋. 慢性HBV感染孕妇和儿童的抗病毒治疗药物选择及疗效评价[J]. 临床肝胆病杂志, 2022, 38(11): 2448-2451. DOI: 10.3969/j.issn.1001-5256.2022.11.003.
[20]CLEMENTE MG, ANTONUCCI R, SOTGIU G, et al. Present and future management of viral hepatitis B and C in children[J]. Clin Res Hepatol Gastroenterol, 2020, 44(6): 801-809. DOI: 10.1016/j.clinre.2020.02.010.
[21]YAN H, ZHONG GC, XU GW, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J]. eLife, 2012, 1: e00049. DOI: 10.7554/eLife.00049.
[22]BIAN YJ, ZHANG Z, SUN ZC, et al. Vaccines targeting preS1 domain overcome immune tolerance in hepatitis B virus carrier mice[J]. Hepatology, 2017, 66(4): 1067-1082. DOI: 10.1002/hep.29239.
[23]ZHUANG H. Clinical significance of determining the serum levels of large, middle, and small hepatitis B virus surface proteins[J]. J Clin Hepatol, 2022, 38(3): 528-531. DOI: 10.3969/j.issn.1001-5256.2022.03.007.庄辉. 血清HBV大、中、小表面蛋白检测的临床意义[J]. 临床肝胆病杂志, 2022, 38(3): 528-531. DOI: 10.3969/j.issn.1001-5256.2022.03.007.
[24]NISHIDA Y, IMAMURA M, TERAOKA Y, et al. Serum PreS1 and HBsAg ratio reflects liver fibrosis and predicts the development of hepatocellular carcinoma in chronic hepatitis B patients[J]. J Viral Hepat, 2021, 28(9): 1304-1311. DOI: 10.1111/jvh.13557.
[25]ZHANG M, LI J, WANG FS. Antiviral therapy and clinical cure for chronic hepatitis B in children: Progress and challenges[J]. Chin J Hepatol, 2021, 29(12): 1218-1223. DOI: 10.3760/cma.j.cn501113-20210628-00303.张敏, 李静, 王福生. 儿童慢性乙型肝炎抗病毒治疗与临床治愈: 进展与挑战[J]. 中华肝脏病杂志, 2021, 29(12): 1218-1223. DOI: 10.3760/cma.j.cn501113-20210628-00303.
收稿日期:2022-12-07;录用日期:2023-01-16
本文编辑:王莹
引证本文:FAN PY, WANG FC, GAO YJ, et al. Value of serum PreS1 in early prediction of HBsAg clearance after IFN-α treatment in children with HBeAg-positive chronic hepatitis B[J]. J Clin Hepatol, 2023, 39(8): 1825-1831.

