血清壳多糖酶3样蛋白1(CHI3L1)对肝硬化患者发生失代偿事件风险的预测价值
杨航 赵黎莉 韩萍 陈庆灵 文君 刘洁 程晓静 李嘉

摘要:
目的 預测失代偿事件以采取积极的预防措施,是提高肝硬化患者生存期的关键。本文旨在探索血清壳多糖酶3样蛋白1(CHI3L1)对肝硬化患者发生失代偿事件风险的预测价值。方法 纳入2019年1月—2021年5月于天津市第二人民医院诊疗的305例肝硬化患者,进行病例对照研究。其中基线时处于代偿期肝硬化的患者200例,处于失代偿期肝硬化的患者105例。将305例肝硬化患者,以1年内是否发生失代偿事件进行分组,其中发生失代偿事件组79例,未发生失代偿事件组226例;将200例代偿期肝硬化患者,以1年内是否发生首次失代偿事件进行分组,其中发生首次失代偿事件组43例,未发生首次失代偿事件组157例。符合正态分布的计量资料两组间比较采用成组t检验或Mann-Whitney U检验;计数资料两组间比较采用Wilcoxon秩和检验或χ2检验。采用二分类Logistic回归分析各变量与失代偿事件之间的相关性;采用受试者工作特征曲线(ROC曲线)下面积(AUC)来评价各变量对失代偿事件的预测价值,采用约登指数最大值来确定最佳临界值。结果 1年内发生失代偿事件患者的基线血清CHI3L1水平高于未发生患者[243.00(136.00~372.00)ng/mL vs 117.50(67.75~205.25)ng/mL, U=4 720.500, P<0.001];1年内发生首次失代偿事件患者的基线血清CHI3L1水平高于未发生患者[227.98(110.00~314.00)ng/mL vs 90.00(58.00~168.50)ng/mL,U=1 681.500,P<0.001]。基线血清CHI3L1水平较高的肝硬化患者,1年内发生失代偿事件的风险增加(OR=1.004,95%CI:1.002~1.006,P<0.001);基线血清CHI3L1水平较高的代偿期肝硬化患者,1年内发生首次失代偿事件的风险增加(OR=1.006,95%CI:1.003~1.008,P<0.001)。使用基线血清CHI3L1水平预测代偿期肝硬化患者发生首次失代偿事件风险的AUC为0.751,最佳临界值为95.5 ng/mL,敏感度和特异度分别为90.7%和55.4%;联合血清CHI3L1和Child-Pugh分级建立预测模型,AUC为0.809,约登指数最大时敏感度和特异度分别为72.1%和77.1%。结论 血清CHI3L1可做为代偿期肝硬化患者发生首次失代偿事件风险的有效预测因子,且在联合Child-Pugh分级后具有更高的预测价值。
关键词:肝硬化; 壳多糖酶3样蛋白质1; 危险因素
基金项目:
天津市医学重点学科(专科)建设项目(TJYXZDXK-059B); 天津市自然科学基金(20JCYBJC01150); 天津市卫生健康科技项目(TJWJ2021MS034)
Value of serum chitinase-3-like protein 1 in predicting the risk of decompensation events in patients with liver cirrhosis
YANG Hang1, ZHAO Lili2, HAN Ping1, CHEN Qingling1, WEN Jun2, LIU Jie2, CHENG Xiaojing2, LI Jia2. (1. Clinical School of The Second Peoples Hospital, Tianjin Medical University, Tianjin 300070, China; 2. Department of Hepatology, Tianjin Second Peoples Hospital, Tianjin 300192, China)
Corresponding author:LI Jia, 18622663700@163.com (ORCID:0000-0003-0100-417X)
Abstract:
Objective To investigate the value of serum chitinase-3-like protein 1 (CHI3L1) in predicting the risk of decompensation events in patients with liver cirrhosis, since prediction of decompensation events and adoption of active preventive measures are the key to improving the survival time of patients with liver cirrhosis. Methods A case-control study was conducted for 305 patients with liver cirrhosis who were diagnosed and treated in Tianjin Second Peoples Hospital from January 2019 to May 2021, among whom there were 200 patients with compensated liver cirrhosis and 105 patients with decompensated liver cirrhosis at baseline. According to whether decompensation events occurred within 1 year, the 305 patients with liver cirrhosis were divided into decompensation group with 79 patients and non-decompensation group with 226 patients; according to whether decompensation events occurred for the first time within 1 year, the 200 patients with compensated liver cirrhosis were divided into first-time decompensation group with 43 patients and non-first-time decompensation group with 157 patients. The independent samples t-test or the Mann-Whitney U test was used for comparison of normally distributed continuous data between groups, and the Wilcoxon rank-sum test or the chi-square test was used for comparison of categorical data between groups. The binary logistic regression analysis was used to investigate the association between each variable and decompensation events; the receiver operating characteristic (ROC) curve and the area under the ROC curve (AUC) were used to investigate the value of each variable in predicting decompensation events, and the maximum value of Youden index was used to determine the optimal cut-off value. Results The patients who experienced decompensation events within 1 year had a significantly higher baseline serum level of CHI3L1 than those who did not experience such events [243.00 (136.00-372.00) ng/mL vs 117.50 (67.75-205.25) ng/mL, U=4720.500, P<0.001], and the patients who experienced decompensation events for the first time within 1 year had a significantly higher baseline serum level of CHI3L1 than those who did not experience such events [227.98 (110.00-314.00) ng/mL vs 90.00 (58.00-168.50) ng/mL, U=1 681.500, P<0.001]. Patients with cirrhosis with higher baseline CHI3L1 levels had an increased risk of decompensation events within 1 year (OR=1.004,95%CI: 1.002-1.006, P<0.001); Patients with compensated cirrhosis with higher baseline serum CHI3L1 levels had an increased risk of first decompensated event within 1 year (OR=1.006,95%CI: 1.003-1.008, P<0.001). The baseline serum level of CHI3L1 had an AUC of 0.751 in predicting the risk of first-time decompensation events, with a sensitivity of 90.7% and a specificity of 55.4% at the optimal cut-off value of 95.5 ng/mL. The predictive model based on the combination of serum CHI3L1 level and Child-Pugh class had an AUC of 0.809, with a sensitivity of 72.1% and a specificity of 77.1% at the maximum value of Youden index. Conclusion Serum CHI3L1 level can be used as an effective predictive factor for the risk of first-time decompensation events in patients with compensated liver cirrhosis, and its combination with Child-Pugh class shows a higher predictive value.
Key words:Liver Cirrhosis; Chitinase-3-Like Protein 1; Risk Factors
Research funding:
Tianjin Key Medical Subject Construction Project (TJYXZDXK-059B); Tianjin Natural Science Fund (20JCYBJC01150); Tianjin Health Science Project (TJWJ2021MS034)
慢性肝病的共同病理结局是肝纤维化/肝硬化。根据既往是否发生并发症,肝硬化可分为代偿期肝硬化和失代偿期肝硬化,进展至失代偿期肝硬化后,患者死亡风险增加[1]。失代偿事件中,食管胃底静脉曲张破裂出血(esophageal variceal bleeding,EVB)尤为凶险[2-3]。预测失代偿事件以采取积极的预防措施,是提高肝硬化患者生存期的关键。血清壳多糖酶3样蛋白1(chitinase-3-like protein 1,CHI3L1)是一种检测纤维化进展的无创指标,可预测ALT正常或轻度升高的患者中、重度肝纤维化[4]。本研究对CHI3L1预测肝硬化患者出现失代偿事件和代偿期肝硬化患者出现首次失代偿事件风险的临床价值进行回顾性病例对照研究,探索CHI3L1对失代偿事件发生风险的评估价值,以便合理指导治疗,提高肝硬化患者生存期。
1 资料与方法
1.1 研究对象 收集2019年1月—2021年5月于天津市第二人民医院诊疗的肝硬化患者中,符合纳排标准的患者的人口学特征、临床资料和随访1年内失代偿事件的发生情况。以随访1年内失代偿事件的发生情况进行分组,进行病例对照研究。失代偿事件定义为显性腹水、EVB或显性肝性脑病[1]。纳入标准:(1)肝硬化诊断符合《肝硬化诊治指南》[5];乙型肝炎诊断符合《慢性乙型肝炎防治指南(2019年版)》[5];丙型肝炎诊断符合《丙型肝炎防治指南(2019年版)》[6];非酒精性脂肪性肝病诊断符合《非酒精性脂肪性肝病防治指南(2018更新版》[7];酒精性肝病符合《酒精性肝病防治指南(2018更新版)》[8];自身免疫性肝炎诊断符合《自身免疫性肝炎诊断和治疗指南(2021)》[9];原发性胆汁性胆管炎诊断符合《原发性胆汁性胆管炎的诊断和治疗指南(2021)》[10];(2)随访时间>1年或随访期间发生终点事件。排除标准:(1)ALT>2倍正常值上限;(2)合并恶性肿瘤;(3)有严重的肺心肾等系统疾病;(4)接受过降低门静脉高压的预防手段(预防性内镜套扎或硬化剂、经颈静脉肝内门体分流术或口服非选择性β受体阻滞剂)。
1.2 检测方法 血清CHI3L1水平检验采用Microlab STAR IVD ELISA全自动酶联免疫分析仪(瑞士哈美顿博纳图斯有限公司)及CHI3L1酶联免疫法检测试剂盒(杭州普望生物技术有限公司)测定;肝生化指标采用HITACHI全自动生物化学仪-7180及配套试剂(日本东京日立有限公司)测定;血常规采用Sysmex XN-2000血液分析仪及配套试剂(日本希森美康有限公司)测定;凝血指标采用STAGO Compact血凝仪及配套试剂(法国思塔高有限公司)测定。样本测定均由专职人员按照规范流程进行操作。
1.3 统计学方法 采用SPSS 28.0软件对数据进行描述和分析。采用Kolmogorov-Smirnov检验和Shapiro-Wilk 检验来检验连续变量是否符合正态分布。符合正态分布的计量资料采用x±s表示,不符合正态分布采用M(P25~P75),两组间比较采用成组t检验或Mann-Whitney U检验;计数资料两组间比较采用Wilcoxon秩和检验或χ2检验。采用二分类Logistic回归分析各变量与失代偿事件之间的相关性;采用受试者工作特征曲线(ROC曲线)下面积(AUC)来评价各变量对失代偿事件的预测价值,采用约登指数最大值来确定最佳临界值。P<0.05为差异有统计学意义。
2 结果
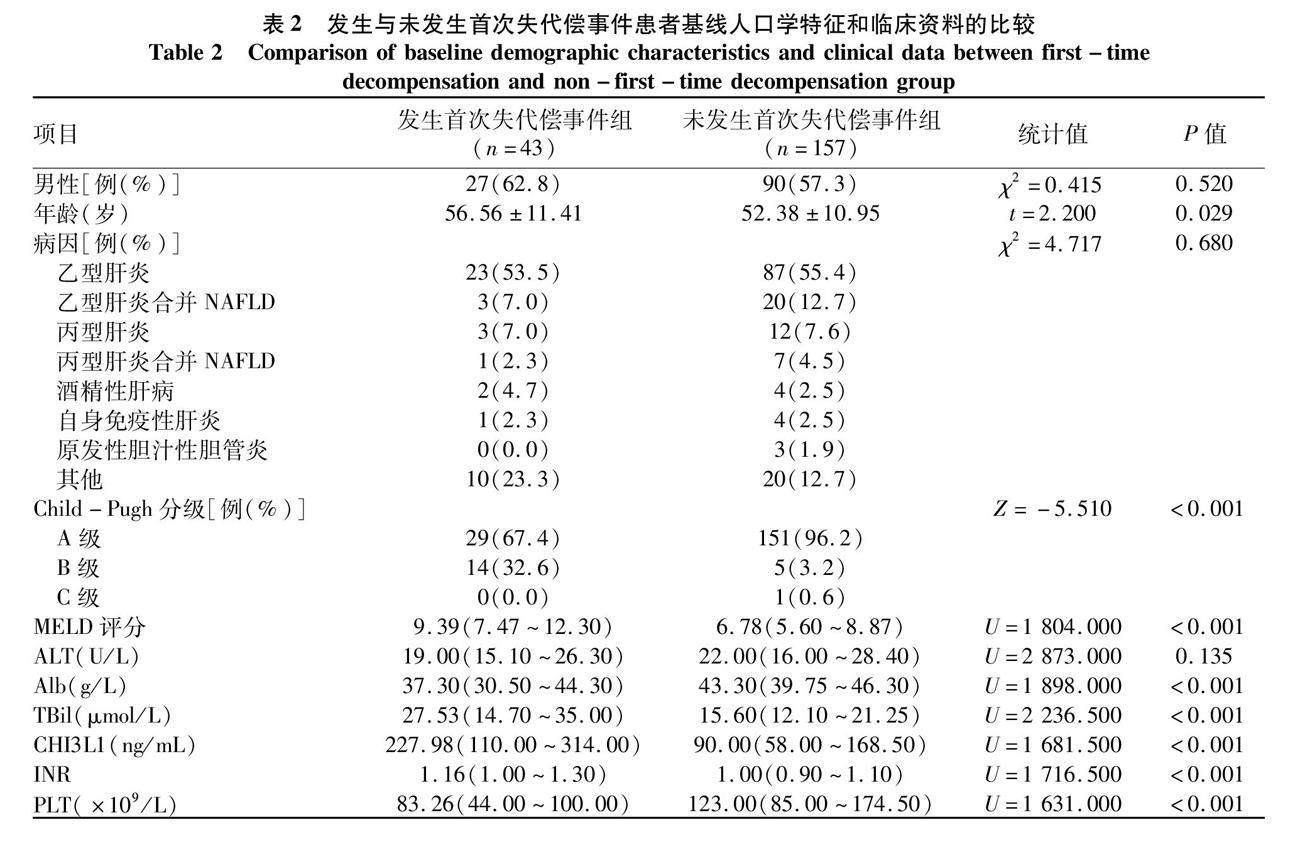
2.1 一般情况 本研究共纳入305例肝硬化患者,其中男176例,女129例;年龄(55.15±11.32)岁;基线时处于代偿期肝硬化患者200例,处于失代偿期肝硬化患者105例。将305例肝硬化患者,以1年内是否发生失代偿事件进行分组,发生失代偿事件组79例,未发生失代偿事件组226例;将200例代偿期肝硬化患者,以1年内是否发生首次失代偿事件进行分组,其中发生首次失代偿事件组43例,未发生首次失代偿事件组157例。两组患者基线人口学特征和临床资料均无缺失。
2.2 基线资料比较
2.2.1 1年内发生与未发生失代偿事件组间比较 发生失代偿事件组的男性占比较高、年龄较大、基线Child-Pugh分级水平较高、基线MELD评分较高、基线Alb水平较低、基线TBil水平较高、基线CHI3L1水平较高、基线INR较高且基线PLT水平较低,差异均有统计学意义(P值均<0.05),两组患者的病因、基线ALT水平差异均无统计学意义(表1)。
2.2.2 1年内发生与未发生首次失代偿事件组间比较 发生首次失代偿事件组的基线年龄较大、基线Child-Pugh分级较高、基线MELD评分较高、基线Alb水平较低、基线TBil水平较高、基线CHI3L1水平较高、基线INR较高且基线PLT水平较低,差异均有统计学意义(P值均<0.001);两组患者的性别、病因和基线ALT的差异均无统计学意义(表2)。
2.3 二分类Logistic回归分析
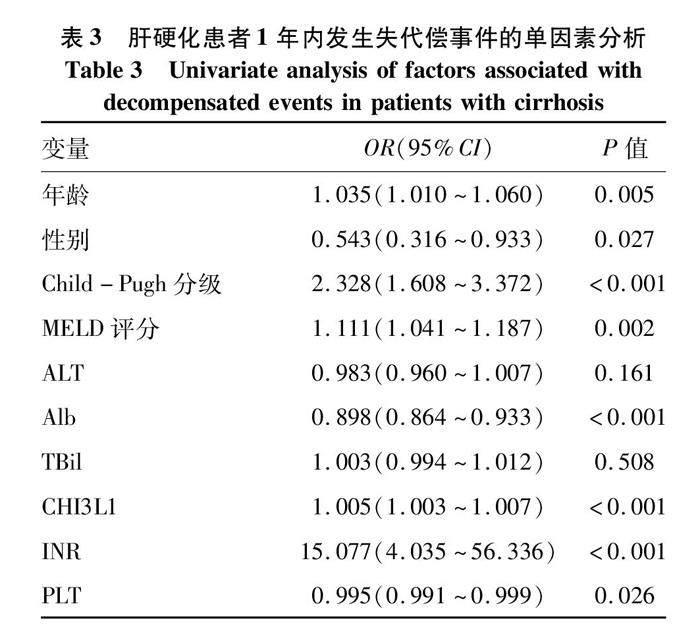
2.3.1 以1年内发生失代偿事件为结局进行二分类Logistic回归分析 单因素回归分析中,患者的年龄、性别、基线Child-Pugh分级、MELD评分、Alb水平、CHI3L1水平、INR和PLT水平是患者1年內发生失代偿事件的影响因素(P值均<0.05)(表3)。将以上因素纳入多因素回归分析,结果显示基线Child-Pugh分级(OR=1.722,95%CI:1.151~2.577,P=0.008)和CHI3L1水平(OR=1.004,95%CI:1.002~1.006,P<0.001)均为患者1年内发生失代偿事件的独立影响因素。
2.3.2 以1年内发生首次失代偿事件为结局进行二分类Logistic回归分析 单因素回归分析中,患者的年龄、基线Child-Pugh分级、MELD评分、Alb水平、TBil水平、CHI3L1水平、INR和PLT水平是患者1年内发生首次失代偿事件的影响因素(P值均<0.05)(表4)。将以上因素纳入多因素回归分析,结果显示基线Child-Pugh分级(OR=7.184,95%CI:2.573~20.056,P<0.001)和CHI3L1水平(OR=1.006,95%CI:1.003~1.008,P<0.001)均為患者1年内发生首次失代偿事件的独立影响因素。
2.4 预测效能评估 对于肝硬化患者,以1年内失代偿事件的发生情况为状态变量,以CHI3L1为检验变量,绘制ROC曲线。结果显示AUC为0.736(95%CI:0.673~0.798,P<0.001),最佳临界值为206.5 ng/mL时,敏感度和特异度分别为62.0%和76.1%(图1a)。以CHI3L1为检验变量,分别预测1年内腹水、EVB和显性肝性脑病发生风险的AUC(表5)。
对于代偿期肝硬化患者,以1年内首次失代偿事件的发生情况为状态变量,以血清CHI3L1水平为检验变量,绘制ROC曲线。结果显示AUC为0.751(95%CI:0.671~0.831,P<0.001),最佳临界值为95.5 ng/mL时,敏感度和特异度分别为90.7%和55.4%;以Child-Pugh分级为检验变量,绘制ROC曲线。结果显示AUC为0.643(95%CI:0.538~0.746,P=0.004)。联合Child-Pugh分级和CHI3L1为检验变量建立预测模型,Logit(P)=-4.492+0.006×CHI3L1+1.972×Child-Pugh分级,得到的Logit模型具有统计学意义(χ2=36.855,P<0.001);绘制ROC曲线,结果显示AUC为0.809(95%CI:0.737~0.882,P<0.001),该模型能够正确分类82.0%的研究对象,约登指数最大时敏感度和特异度分别为72.1%和77.1%(图1b)。
3 讨论
CHI3L1是一种含383个氨基酸的单体糖基化蛋白,分子量约40 kD。编码CHI3L1的基因位于人染色体1q32.1的一个8 kb的DNA上。CHI3L1由包括肝巨噬细胞在内的多种类型的细胞以不同模式分泌,与血管生成、炎症反应、组织重塑和纤维化进展等多种病理过程有关,可通过激活TGF-β1、MAPK、ERK和PI3K/AKT等信号通路来发挥作用,但其在疾病进展中确切的作用机制暂未完全明确[11]。CHI3L1在肝硬化的病程中可通过抑制肝巨噬细胞的凋亡来加剧肝硬化的进程,在肝病领域,现阶段针对CHI3L1的研究主要集中在对肝纤维化/肝硬化程度和对肝癌发生风险的预测[12],这一指标还未被用于对肝硬化患者失代偿事件发生风险的预测。本研究尝试使用CHI3L1对代偿期肝硬化患者发生失代偿事件的风险和对代偿期肝硬化患者发生首次失代偿事件的风险进行预测。
肝硬化患者的中位生存期约12年,发生首次失代偿事件后,中位生存期约2年[13]。为提高肝硬化患者的生存期,需要预测失代偿事件以采取积极的预防措施。笔者团队[14]联合血小板和使用瞬时弹性成像检查测得的肝硬度数据建立了预测首次失代偿事件发生风险的模型,但是这一模型涉及的瞬时弹性成像检查在很多地区暂未开展,这一模型还未在临床普及应用。本研究发现,将患者血清CHI3L1用于对首次失代偿事件的预测时,AUC为0.751;反映肝脏储备功能的Child-Pugh分级所包含的多项指标是肝硬化患者发生失代偿事件的重要影响因素,将血清CHI3L1与Child-Pugh分级进行联合建立的预测模型,AUC可达0.809,具有一定的临床应用价值,为预测首次失代偿事件提供了新的可选手段。
失代偿事件中,EVB可危及生命。我国的《肝硬化门静脉高压食管胃静脉曲张出血的防治指南》[15]建议结合胃镜和Child-Pugh分级来判断肝硬化患者EVB的风险,以决定进一步的预防和治疗方案。但胃镜属于侵入性检查,患者接受程度较差,且长期随访困难。作为现阶段临床关注的焦点,很多研究在探索可用于对肝硬化患者发生EVB风险进行预测的模型,但现有的模型存在应用病因范围狭窄和涉及的侵入性检查难以用于随访等诸多问题,仍有必要进行进一步研究[16-17]。血清学指标相对易获得,本研究使用血清CHI3L1对肝硬化患者发生EVB的风险进行预测时,AUC为0.824,可用于对肝硬化患者发生EVB风险进行非侵入性的评估,以便针对性地指导肝硬化患者的预防和治疗方案。
综上,本研究纳入了多种病因导致肝硬化的患者共305例,结合患者1年的随访数据,发现血清CHI3L1拥有无创评估肝硬化患者发生首次失代偿事件这一显著影响生存期事件的风险的前景,可作为针对代偿期肝硬化患者预测首次失代偿事件的预测因子。且对于代偿期肝硬化人群发生EVB的风险已具有较好的预测价值,具有较好的临床应用前景。本研究为单中心回顾性研究,由于回顾性和病因构成复杂而存在偏倚问题,需要进一步在外部队列中进行验证。但是本研究所使用的血清学指标方便获得,可重复性强,且避免了影像学检查所存在的主观因素影响。同时作为使用试剂盒即可进行检测的方案,成本较低,易于推广。尤其在瞬时弹性成像检查还未开展的地区,迫切需要一些利于随访的血清学指标[18]。门静脉高压是肝硬化患者发生失代偿事件的主要驱动因素[19],新生血管的生成在门静脉高压的发生和发展中起至关重要的作用[20]。CHI3L1参与血管生成的病理进程[10],考虑其血清学水平可能反映了肝硬化患者门静脉高压的进展程度,进而实现了对患者发生失代偿事件风险的预测效能,但具体机制仍待基础实验和进一步临床研究探索。
伦理学声明:本研究方案于2021年10月13日经由天津市第二人民医院伦理委员会审批,批号:津二人民伦审字[2021]54号,患者均签署知情同意书。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:李嘉、赵黎莉对研究的思路或设计有关键贡献;杨航、韩萍、文君、刘洁、程晓静参与了研究数据的获取、分析和解释过程;杨航、陈庆灵参与起草或修改文章的关键内容。
参考文献:
[1]
de FRANCHIS R, BOSCH J, GARCIA-TSAO G, et al. Baveno VII - Renewing consensus in portal hypertension[J]. J Hepatol, 2022, 76(4): 959-974. DOI: 10.1016/j.jhep.2021.12.022.
[2]GINS P, KRAG A, ABRALDES JG, et al. Liver cirrhosis[J]. Lancet, 2021, 398(10308): 1359-1376. DOI: 10.1016/S0140-6736(21)01374-X.
[3]KOUANDA A, BINMOELLER K, HAMERSKI C, et al. Safety and efficacy of EUS-guided coil and glue injection for the primary prophylaxis of gastric variceal hemorrhage[J]. Gastrointest Endosc, 2021, 94(2): 291-296. DOI: 10.1016/j.gie.2021.01.025.
[4]Chinese Society of Hepatology, Chinese Medical Association. Chinese guidelinesonthe management of liver cirrhosis[J]. J Clin Hepatol, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006.
中華医学会肝病学分会. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006.
[5]Chinese Society of Infectious Diseases,Chinese Medical Association;Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B(version 2019)[J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
中华医学会感染病学分会, 中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
[6]Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for hepatitis C (2019 version)[J]. J Clin Hepatol, 2019, 35(12): 2670-2686. DOI: 10.3969/j.issn.1001-5256.2019.12.008.
中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2670-2686. DOI: 10.3969/j.issn.1001-5256.2019.12.008.
[7]National Workshop on Fatty Liver and Alcoholic Liver Disease, Chinese Society of Hepatology, Chinese Medical Association: Fatty Liver Expert Committee, Chinese Medical Doctor Association. Guidelines of prevention and treatment for nonalcoholic fatty liver disease: a 2018 update[J]. J Clin Hepatol, 2018, 34(5): 947-957. DOI: 10.3969/j.issn.1001-5256.2018.05.007.
中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34(5): 947-957. DOI: 10.3969/j.issn.1001-5256.2018.05.007.
[8]Fatty Liver Expert Committee, Chinese Medical Doctor Association; National Workshop on Fatty Liver and Alcoholic Liver Disease,Chinese Society of Hepatology,Chinese Medical Association. Guidelines of prevention and treatment for alcoholic liver disease:a 2018 update[J]. J Clin Hepatol, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006.
中国医师协会脂肪性肝病专家委员会, 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 酒精性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006.
[9]Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of autoimmune hepatitis (2021)[J]. J Clin Hepatol, 2022, 38(1): 42-49. DOI: 10.3969/j.issn.1001-5256.2022.01.008.
中华医学会肝病学分会.自身免疫性肝炎诊断和治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38(1): 42-49. DOI: 10.3969/j.issn.1001-5256.2022.01.008.
[10]Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of primary biliary cholangitis(2021)[J]. J Clin Hepatol, 2022, 38(1): 35 -41. DOI: 10.3969/j.issn.1001-5256.2022.01.007.
中华医学会肝病学分会. 原发性胆汁性胆管炎的诊断和治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38(1): 35-41. DOI: 10.3969/j.issn.1001-5256.2022.01.007.
[11]OBER C, TAN Z, SUN Y, et al. Effect of variation in CHI3L1 on serum YKL-40 level, risk of asthma, and lung function[J]. N Engl J Med, 2008, 358(16): 1682-1691. DOI: 10.1056/NEJMoa0708801.
[12]HUANG X, ZHUANG J, YANG Y, et al. Diagnostic value of serum chitinase-3-like protein 1 for liver fibrosis: A Meta-analysis[J]. Biomed Res Int, 2022, 2022: 3227957. DOI: 10.1155/2022/3227957.
[13]GARCIA-TSAO G, ABRALDES JG. Nonselective beta-blockers in compensated cirrhosis: Preventing variceal hemorrhage or preventing decompensation?[J]. Gastroenterology, 2021, 161(3): 770-773. DOI: 10.1053/j.gastro.2021.04.077.
[14]LIU Y, LIU C, LI J, et al. Risk stratification of decompensation using liver stiffness and platelet counts in compensated advanced chronic liver disease (CHESS2102)[J]. J Hepatol, 2022, 76(1): 248-250. DOI: 10.1016/j.jhep.2021.10.006.
[15]Chinese Society of Hepatology. Chinese Medical Association; Chinese Socie ty of Gastroenterology, Chinese Medical Association; Chinese Society of Endoscopy. Chinese Medical Association Guidelines for the diagnosis and treatment of esophageal and gastric variceal bleeding in cirrhotic portal hypertensio[J]. J Clin Hepatol, 2016, 32(2): 203-219. DOI: 10.3969/j.issn.1001-5256.2016.02.002.
中華医学会肝病学分会,中华医学会消化病学分会, 中华医学会内镜学分会. 肝硬化门静脉高压食管胃静脉曲张出血的防治指南[J]. 临床肝胆病杂志, 2016, 32(2): 203-219. DOI: 10.3969/j.issn.1001-5256.2016.02.002.
[16]LIU H, SUN J, LIU G, et al. Establishment of a non-invasive prediction model for the risk of oesophageal variceal bleeding using radiomics based on CT[J]. Clin Radiol, 2022, 77(5): 368-376. DOI: 10.1016/j.crad.2022.01.046.
[17]ZHAO L, WANG T, GUO C, et al. Modified and alternative Baveno VI criteria based on age for ruling out high-risk varices in patients with compensated cirrhosis[J]. Hepatol Int, 2022, 16(4): 936-943. DOI: 10.1007/s12072-022-10359-y.
[18]LUO YX, ZHOU T. Value of systemic immune inflammatory index on predicting the proanosis of patients with decompensated liver cirrhosis[J/CD]. Chin J Liver Dis(Electronic Version) 2021, 13(1): 52-58. DOI: 10.3969/j.issn.1674-7380.2021.01.009.
罗永祥, 周涛. 全身免疫炎症指数对失代偿期肝硬化患者预后的评估价值[J/CD]. 中国肝脏病杂志(电子版), 2021, 13(1): 52-58. DOI: 10.3969/j.issn.1674-7380.2021.01.009.
[19]COSTA D, SIMBRUNNER B, JACHS M, et al. Systemic inflammation increases across distinct stages of advanced chronic liver disease and correlates with decompensation and mortality[J]. J Hepatol, 2021, 74(4): 819-828. DOI: 10.1016/j.jhep.2020.10.004.
[20]COULON S, HEINDRYCKX F, GEERTS A, et al. Angiogenesis in chronic liver disease and its complications[J]. Liver Int, 2011, 31(2): 146-162. DOI: 10.1111/j.1478-3231.2010.02369.x.
收稿日期:
2022-11-11;錄用日期:2023-01-02
本文编辑:王亚南
引证本文:
YANG H, ZHAO LL, HAN P, et al.
Value of serum chitinase-3-like protein 1 in predicting the risk of decompensation events in patients with liver cirrhosis
[J]. J Clin Hepatol, 2023, 39(7): 1578-1585.
杨航, 赵黎莉, 韩萍, 等.
血清壳多糖酶3样蛋白1(CHI3L1)对肝硬化患者发生失代偿事件风险的预测价值[J]. 临床肝胆病杂志, 2023, 39(7): 1578-1585.

