LncRNA XIST靶向miR-543对胶质瘤细胞增殖凋亡的作用机制研究
兰伟途 王万宏 武峰 兰文达 何建昌

【摘要】 目的 探討长链非编码RNA(LncRNA)XIST通过miR-543对胶质瘤细胞增殖凋亡的作用及机制。方法 RT-PCR检测胶质瘤细胞株U251、T98G、U87-MG、A172、SW1783中XIST表达水平及si-XIST转染U251细胞后XIST与miR-543表达;在胶质瘤细胞U251中敲低XIST后,MTT法、流式细胞术检测胶质瘤细胞的增殖和凋亡情况;用双荧光素酶报告基因验证LncRNA XIST与miR-543的靶向关系。结果 XIST在U251细胞中表达水平(0.79±0.08)最高,故以U251细胞进行后续实验;与XIST组[(2.35±0.17)、(0.37±0.05)]相比,si-XIST组U251细胞XIST表达水平(0.25±0.19)较低,miR-543表达水平(3.15±0.36)较高(P<0.05);与XIST组[(0.57±0.09)、(0.81±0.01)、(1.15±0.04)]相比,si-XIST组胶质瘤U251细胞A570在24、48、72 h[(0.22±0.02)、(0.31±0.03)、(0.55±0.04)]明显降低(P<0.05)。与XIST组(1.12±0.56)%相比,si-XIST组细胞凋亡率(35.64±4.31)%较高(P<0.05)。共转染XIST-wt和miR-543处理组中相对荧光素酶活性显著下降[(1.15±0.22)vs(0.22±0.03)](P<0.05)。结论 干扰LncRNA XIST可通过靶向负调控miR-543表达,抑制胶质瘤细胞增殖、诱导细胞凋亡。
【关键词】 LncRNA XIST;miR-543;胶质瘤细胞;增殖;凋亡
【中图分类号】 R734.2 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0158-05
Abstract: Objective To investigate the effect and mechanism of long non coding RNA(LncRNA) XIST on proliferation and apoptosis of glioma cells through miR-543. Methods RT-PCR was used to detect the expression of XIST in U251, T98G, U87-MG, A172 and SW1783 glioma cell lines and the expression of XIST and miR-543 in U251 cells transfected with si-XIST. After knocking down XIST in U251 glioma cells, MTT assay and flow cytometry were used to detect the effects on proliferation and apoptosis of glioma cells. Double luciferase reporter gene was used to verify the targeting relationship between LncRNA XIST and miR-543. Results The expression level of XIST in U251 cells was(0.79±0.08), so U251 cells were used for follow-up experiments. Compared with XIST group[(2.35±0.17),(0.37±0.05)], the expression level of XIST in U251 cells in si-XIST group(0.25±0.19) was lower, miR-543(3.15±0.36) is highly expressed(P<0.05). Compared with XIST group[(0.57±0.09), (0.81±0.01), (1.15±0.04)], A570 of glioma U251 cells in si-XIST group decreased significantly at 24, 48 and 72 h[(0.22±0.02), (0.31±0.03), (0.55±0.04)](P<0.05). Compared with XIST group(1.12±0.56)%, the apoptosis rate of si-XIST group was(35.64±4.31)% (P<0.05). The relative luciferase activity was significantly decreased in the co-transfected XIST-wt and mir-543 groups[(1.15±0.22)vs(0.22±0.03)](P<0.05), these results suggested that there was a targeted relationship between XIST and miR-543 and XIST negatively regulates the expression of miR-543. Conclusion Silencing LncRNA XIST can negatively regulate the expression of miR-543 inhibit the proliferation and induce apoptosis of glioma cells, which may be a molecular target of glioma.
Key words: LncRNA XIST; miR-543; glioma cell; proliferation; apoptosis
基金项目:河北省2020年度医学科学研究课题计划(20200172)
作者单位:061000 沧州,河北省沧州市人民医院医专院区神经外科(兰伟途,武峰,兰文达,何建昌);唐山市丰南区医院神经外科(王万宏)
胶质瘤为中枢系统最常见恶性肿瘤,因其浸润性生长方式造成致残率、死亡率较高,患者经常规治疗后中位生存时间仅15个月[1]。故研究抑制胶质瘤的分子机制,探索潜在的精准治疗靶点已成为相关领域研究热点。研究发现长链非编码RNA(long non-coding RNA,LncRNA)可能与microRNA(miRNA)互相作用,影响胶质瘤进展[2]。LncRNA XIST为染色体失活特异转录物(X-inactivation-specific transcript X,XIST)基因产物,被证实是有生物学功能的LncRNA[3]。研究表明,LncRNA XIST在胶质瘤细胞中呈高表达,可促进胶质瘤细胞生长、侵袭,且与患者生存时间及预后相关,可作为胶质瘤生物标记物[4]。miRNA与肿瘤之间的关系已成为肿瘤学研究热点之一,miR-543是一种促癌基因,Zhang等[5]报道,miR-543在胶质瘤发展中发挥关键作用。然而,关于LncRNA XIST、miR-543在胶质瘤中的相互作用机制尚不清楚。本研究通过敲低XIST表达,探讨XIST对胶质瘤细胞增殖、凋亡的影响及机制。现报告如下。
1 资料与方法
1.1 细胞株与主要试剂 人胶质瘤细胞株U251、T98G、U87-MG、A172、SW1783购自美国典型培养物保藏中心。XIST干扰剂(si-XIST)及其阴性对照(si-XIST-NC)、miR-543模拟物及其阴性对照(miR-543-NC)(海吉玛制药技术有限公司),实时定量PCR试剂盒、逆转录试剂盒、Lipofectamine 2 000转染试剂盒、荧光素酶报告检测试剂盒(美国ThermoFisher公司),实验所用引物由上海科华生物工程股份有限公司合成。
1.2 细胞培养 用含有10%胎牛血清和0.1%的青霉素和链霉素的DMEM培养基培养U251、T98G、U87-MG、A172、SW1783,培养环境为5% CO2、37 ℃,隔天换液1次,细胞融合率达到85%以上时传代,传代浓度1×104个/mL。
1.3 RT-PCR检测不同胶质瘤细胞株中XIST表达水平 用Trizol试剂提取胶质瘤细胞株U251、T98G、U87-MG、A172、SW1783及用si-XIST转染后的U251细胞总RNA,定量分析后,每组取等量RNA,根据逆转录试剂盒说明书合成cDNA,用PCR仪扩增,用实时定量PCR试剂盒进行定量分析。反应程序:95 ℃ 60 s、95 ℃ 15 s、60 ℃ 60 s、72 ℃ 30 s,循环40次。用2-△△Ct法定量分析各细胞系中XIST相对表达量。
1.4 细胞分组与转染 将细胞分组为对照组、XIST组、XIST-NC组、si-XIST组、si-XIST-NC组,接种于6孔板,培养24 h后,参考转染试剂盒说明书用XIST、XIST-NC、si-XIST、si-XIST-NC分別转染XIST组、XIST-NC组、si-XIST组、si-XIST-NC组细胞,对照组加入等量载体处理。转染6 h后更换为正常细胞培养液培养,待后续检测使用。
1.5 MTT法检测胶质瘤细胞增殖活性 取si-XIST转染U251细胞48 h后的对数生长期细胞制成单细胞悬液,2×103/孔接种于96孔板,每组设置8个平行孔。转染培养后24、48、72 h取出培养板,加入20 μL MTT液培养4 h,吸出上清液加入150 μL二甲基亚砜振荡溶解,酶联免疫检测仪在570 nm波长检测各细胞的吸光度值。
1.6 流式细胞术检测胶质瘤细胞凋亡率 取各组转染后对数生长期的U251细胞接种于6孔板内,继续培养48 h,收集细胞洗涤2次,根据凋亡试剂盒说明书操作,用400 μL标记缓冲液重悬细胞,加入5 μL Annexin V-FITC、10 μL碘化丙啶(propidium iodide,PI),用流式细胞仪检验细胞凋亡率。
1.7 RT-PCR检测XIST与miR-543表达水平 收集转染后U251细胞,提取细胞总RNA,反转录合成cDNA,以cDNA为模板进行Real-time PCR反应合成XIST与miR-543,XIST以GAPDH为内参,miR-543以U6为内参。反应程序:95 ℃ 5 min、94 ℃ 40 s、59 ℃ 40 s、72 ℃ 40 s,35个循环。引物见表1。用2-△△Ct法定量分析U251细胞中XIST、miR-543相对表达量。
1.8 双荧光素酶报告基因验证XIST与miR-543靶向关系 经生物信息预测XIST与miR-543的结合片段,用PCR扩增,插入荧光素酶报告酶载体,构建XIST野生型(wild type,wt)质粒。用基因突变技术对XIST序列上与miR-543结合位点上个别核苷酸进行突变,构建XIST突变型(mutant type,mut)质粒。用miR-543模拟物及阴性对照与XIST-wt或XIST-mut共同转染U251细胞,24 h后检验荧光素酶活性,以海肾荧光素酶活性作为内参,计算相对萤火虫荧光素酶活性。
1.3 统计学分析 采用SPSS 22.0统计软件分析本次实验数据,XIST、miR-543相对表达量等计量资料以均数±标准差(x-±s)表示,多组间比较进行单因素方差分析,进一步两两比较进行LSD-t分析。以P<0.05认为差异有统计学意义。
2 结 果
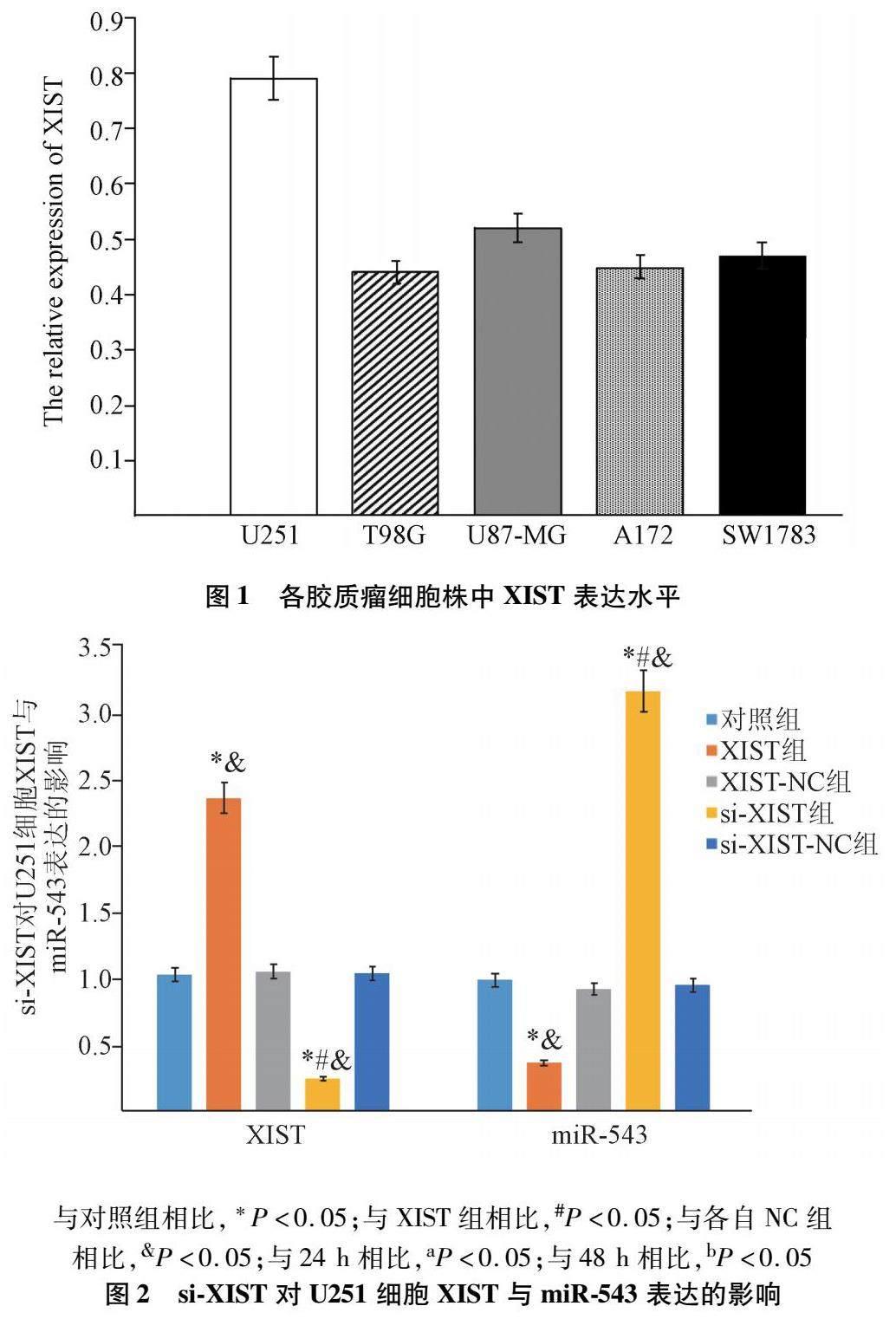
2.1 各胶质瘤细胞株中XIST表达水平 如图1所示,XIST在多种胶质瘤细胞株中表达水平以U251细胞最高,故选择U251细胞进行后续实验。
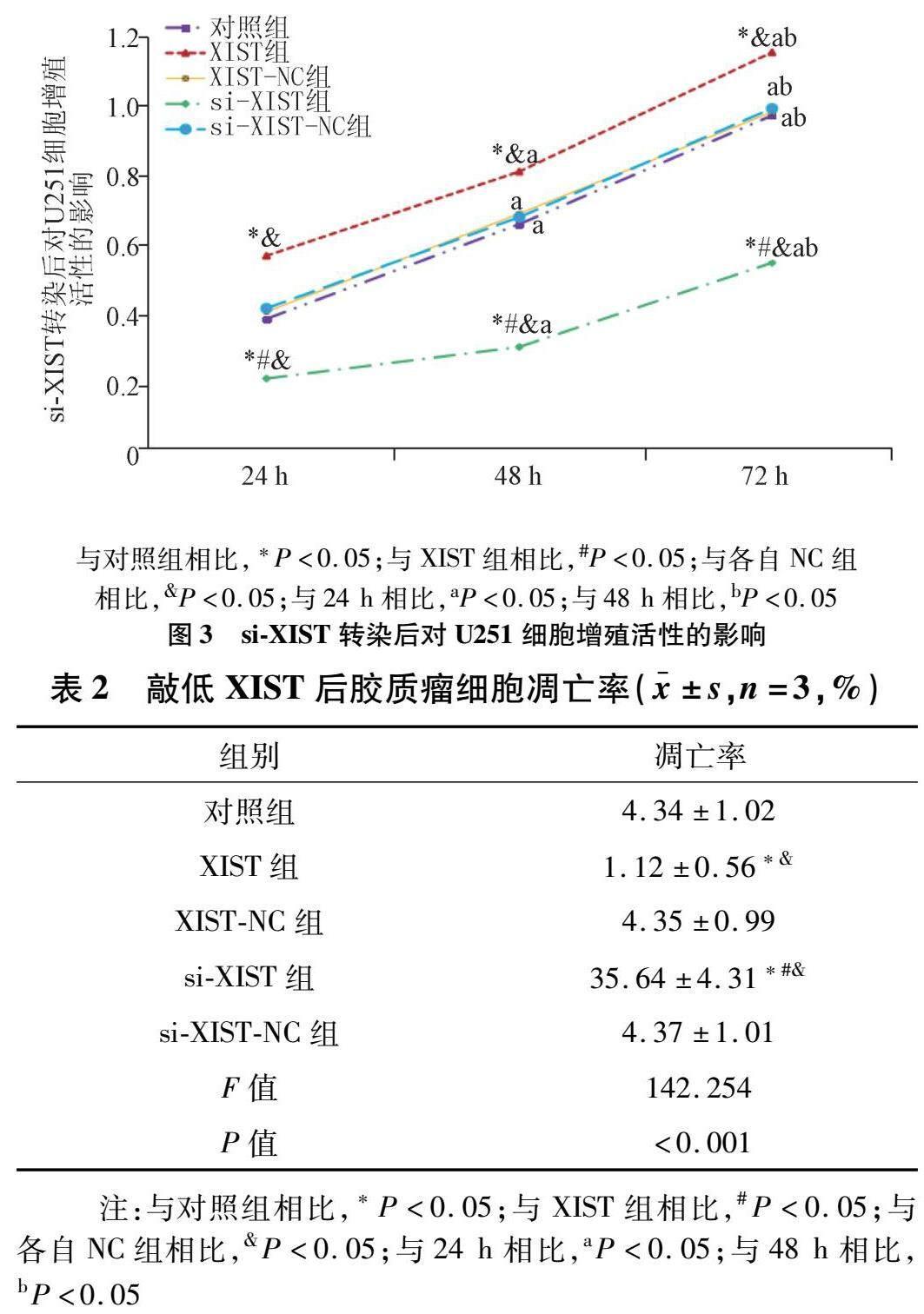
2.2 U251细胞XIST与miR-543表达情况 与对照组及各自NC组相比,XIST组U251细胞XIST表达水平较高,miR-543表达水平较低,si-XIST组U251细胞XIST表达水平较低,miR-543表达水平较高(P<0.05);与XIST组相比,si-XIST组U251细胞XIST表达水平较低,miR-543表达水平较高(P<0.05)。见图2。
2.3 敲低XIST抑制胶质瘤细胞增殖活性 敲低XIST表达后,各组胶质瘤U251细胞A570随时间延长而升高。与对照组及各自NC组相比,XIST组胶质瘤U251细胞A570在24、48、72 h较高(P<0.05),si-XIST组胶质瘤U251细胞A570在24、48、72 h较低(P<0.05);与XIST组相比,si-XIST组胶质瘤U251细胞A570在24、48、72 h明显降低(P<0.05),表明敲低XIST可抑制胶质瘤U251细胞增殖。见图3。
2.4 敲低XIST促进胶质瘤细胞凋亡 敲低XIST表达后,与对照组及各自NC组相比,XIST组细胞凋亡率较低(P<0.05),si-XIST组细胞凋亡率较高(P<0.05),与XIST组相比,si-XIST组细胞凋亡率较高(P<0.05),表明敲低XIST可诱导U251细胞凋亡。见表2、图4。
2.5 XIST与miR-543的靶向关系 生物信息预测结果显示,XIST序列中含有与miR-543互补的序列(图3A所示)。双荧光素酶报告实验显示(图3B所示),共转染XIST-wt和miR-543处理组中相对荧光素酶活性显著下降(P<0.05),表明XIST与miR-543有结合关系;转染XIST-MUT和miR-543的处理组中相对荧光素酶活性未受影响,差异无统计学意义(P>0.05)。见图5。
3 讨 论
肿瘤发生发展是多通路活化或抑制、多因子参与、多步骤的生物学过程,基因异常表达与失调在肿瘤微环境创建及其发生发展中占据重要地位。据了解,人类基因组基本上都可转录LncRNA,与编码基因相比,LncRNA的转录方式不同[6]。据报道,LncRNA有干扰转录、诱导染色体重塑、改变细胞结构等功能,可通过与miRNA、蛋白质分子或其组合相互作用,发挥着抑癌或促癌作用[7]。最近,LncRNAs和miRNAs之间的相互作用引起了很多关注。多项研究报道,LncRNA异常表达不但会影响真核细胞基因表达,还可通过调控细胞增殖使其获得无限增殖能力,提升癌症发生率,并诱导癌症转移与恶化[8-9]。Luo等[10]发现LncRNA CASC11可通过miRNA-150促进膀胱癌细胞的增殖。Liu等[2]报道,LncRNA参与了胶质瘤血管生成过程。因此研究LncRNA在胶质瘤中分子作用机制十分必要,可为胶质瘤临床治疗提供新思路。
XIST最早在1991年被发现,后续研究表明其在多种癌症病理进程中呈异常表达。Salama等[11]报道,XIST在乳腺癌中表达明显上调。Liu等[12]发现,XIST下调可抑制非小细胞肺癌发展。XIST参与了X染色体灭活启动阶段,同时参与了细胞全部过程,影响癌症增殖与凋亡[13];可见,XIST在胶质瘤中也发挥了相同作用。为此,本研究首先检验了XIST在几种胶质瘤细胞株中的表达水平,结果发现U251细胞中XIST表达水平最高,故选择U251细胞行后续实验。细胞无限增殖为癌症基本特征之一,抑制癌细胞增殖、诱导癌细胞凋亡是临床治疗癌症的主要途径。经MTT与流式细胞术检验发现,敲低XIST表达后,胶质瘤U251细胞A570在24、48、72 h均明显降低,细胞凋亡率明显升高,提示敲低XIST可抑制胶质瘤U251细胞增殖活性,并诱导其凋亡。Luo等[14]发现XIST在胶质瘤中也发挥癌基因功能,对胶质瘤增殖、迁移等生物学行为均有影响,本研究与其结果存在一致性。这些结果证明了XIST在胶质瘤中所扮演的癌基因角色以及对胶质瘤生物学行为的影响情况,而这一项研究结果为加深本研究对XIST在胶质瘤细胞生物学行为中潜在机制的理解提供了新的思路。
miR-543在人类14号染色体DLK1-DIO3区域,含有较大的非编码RNA群,可通过调控各种靶基因影响癌症的发生与转移。Fan等[15]发现,miR-543可通过靶向KRAS、MTA1和HMGA2抑制结直肠癌的生长和转移,因此认为miR-543是一种候选肿瘤抑制分子。但近几年报道发现,miR-543也可发挥促癌基因的作用;Chen等[16]報道miR-543对肾细胞癌的增殖与转移有促进作用;Wang等[17]表明miR-543可在口腔鳞状细胞癌中充当新型致癌基因。由此可知,miR-543在不同肿瘤类型中发挥的作用不同,在胶质瘤细胞中发挥何种作用尚不明确。本研究通过RT-PCR检测发现,敲低XIST后,U251细胞中XIST表达下调、miR-543表达上调,结合敲低XIST对U251细胞增殖、凋亡的影响研究结果可知,miR-543在胶质瘤中扮演促癌基因的角色。由此可见,miR-543表达上调对胶质瘤发生发展有促进作用,应高度重视胶质瘤诊断中miR-543的检测,且在胶质瘤治疗期间可通过干扰miR-543表达从而达到治疗目的,但上述想法在临床上是否可行,有待进一步研究证明。根据XIST与miR-543可能存在的结合位点构建包含miR-543在内的XIST-wt、XIST-mut基因报告载体,经双荧光素酶报告基因实验发现,XIST与miR-543存在靶向关系,由此可见,XIST可能是胶质瘤的分子靶点。
综上所述,XIST在胶质瘤发展中发挥了致癌作用,敲低胶质瘤细胞U251细胞株中XIST表达,可抑制胶质瘤细胞增殖,并诱导其凋亡,XIST可通过靶向负调控miR-543影响胶质瘤细胞的生物学行为,可能是胶质瘤分子靶点,靶向XIST/miR-543可能是治疗胶质瘤的新兴方法,这对临床治疗胶质瘤而言是有意义的发现。但本研究亦存在一些缺陷,比如仅从敲低XIST了解其对胶质瘤细胞生物学行为的影响,未能从过表达XIST方面验证本研究的结论,且单纯观察了胶质瘤细胞增殖活性、凋亡率,未能观察敲低XIST对胶质瘤细胞侵袭、迁移等生物学行为的影响,这些未来会进一步完善。
[參 考 文 献]
[1]王雅宁,王月坤,孔梓任,等.老年高级别胶质瘤的临床特点和治疗[J].中华神经外科杂志,2020,36(2):146-150.
[2]Liu ZZ,Tian YF,Wu H,et al.LncRNA H19 promotes glioma angiogenesis through miR-138/HIF-1α/VEGF axis[J].Neoplasma,2020,67(1):111-118.
[3]Chen YK,Yen Y.The ambivalent role of lncRNA Xist in carcinogenesis[J].Stem Cell Rev Rep,2019,15(2):314-323.
[4]Cheng ZH,Luo C,Guo ZL.LncRNA-XIST/microRNA-126 sponge mediates cell proliferation and glucose metabolism through the IRS1/PI3K/Akt pathway in glioma[J].J Cell Biochem,2020,121(3):2170-2183.
[5]Zhang Y,An JY,Pei YC.LncRNA SNHG6 promotes LMO3 expression by sponging miR-543 in glioma[J].Mol Cell Biochem,2020,472(1-2):9-17.
[6]赵念念,冯榕,张丽,等.LncRNA/hnRNP在调控基因表达中的机制及功能[J].生命的化学,2020,40(10):1815-1824.
[7]Xu LG,Huan L,Guo TA,et al.LncRNA SNHG11 facilitates tumor metastasis by interacting with and stabilizing HIF-1α[J].Oncogene,2020,39(46):7005-7018.
[8]Yang X,Zhang S,He CY,et al.METTL14 suppresses proliferation and metastasis of colorectal cancer by down-regulating oncogenic long non-coding RNA XIST[J].Mol Cancer,2020,19(1):46.
[9]Huang RL,Zhu LJ,Zhang YL.XIST lost induces ovarian cancer stem cells to acquire taxol resistance via a KMT2C-dependent way[J].Cancer Cell Int,2020,20(9):436.
[10]Luo HR,Xu CD,Le W,et al.lncRNA CASC11 promotes cancer cell proliferation in bladder cancer through miRNA-150[J].J Cell Biochem,2019,120(8):13487-13493.
[11]Salama EA,Adbeltawab RE,El Tayebi HM.XIST and TSIX:novel cancer immune biomarkers in PD-L1-overexpressing breast cancer patients[J].Front Oncol,2020,9(1):1459.
[12]Liu JL,Yao L,Zhang MY,et al.Downregulation of LncRNA-XIST inhibited development of non-small cell lung cancer by activating miR-335/SOD2/ROS signal pathway mediated pyroptotic cell death[J].Aging(Albany NY),2019,11(18):7830-7846.
[13]Deng CK,Hu XL,Wu K,et al.Long non-coding RNA XIST predicting advanced clinical parameters in cancer:a meta-analysis and case series study in a single institution[J].Oncol Lett,2019,18(3):2192-2202.
[14]Luo CX,Quan ZP,Zhong B,et al.lncRNA XIST promotes glioma proliferation and metastasis through miR-133a/SOX4[J].Exp Ther Med,2020,19(3):1641-1648.
[15]Fan CN,Lin YC,Mao YB,et al.MicroRNA-543 suppresses colorectal cancer growth and metastasis by targeting KRAS,MTA1 and HMGA2[J].Oncotarget,2016,7(16):21825-21839.
[16]Chen ZY,Du Y,Wang L,et al.MiR-543 promotes cell proliferation and metastasis of renal cell carcinoma by targeting Dickkopf 1 through the Wnt/β-catenin signaling pathway[J].J Cancer,2018,9(20):3660-3668.
[17]Wang LP,Chen WH,Zha J,et al.miR-543 acts as a novel oncogene in oral squamous cell carcinoma by targeting CYP3A5[J].Oncol Rep,2019,42(3):973-990.
(收稿2021-12-28 修回2022-04-14)