术中冰冻病理在立体定向脑深部病变活检中的应用
陈志杰 林涛 刘妲 邓斌 张旭标 曾永亲 邓少勇 罗似亮 李海南 成白杰
【摘要】 目的 探讨术中冰冻病理检查在立体定向脑病变活检的应用价值。方法 回顾性分析2015年6月—2021年10月收治的44例接受神经外科机器人辅助立体定向活检的脑深部病变患者临床资料。所有患者行术中冰冻病理,必要时行术中冰冻免疫组化检查。常规病理结果作为诊断金标准,判断冰冻结果的确诊率、延迟诊断率和误诊率,分析术中冰冻病理的诊断阳性率、诊断符合率及其影响因素。结果 44例患者接受46次活检手术,有9例患者首次术中冰冻结果为阴性,其中7例调整穿刺深度再次活检后取得冰冻阳性结果。23例患者通过术中免疫组化及时判断肿瘤类别。最终44例患者(96.65%)术中冰冻结果阳性,诊断符合率91.3%(35例确诊+7例延迟诊断)。穿刺活检结果为胶质瘤27例(WHO Ⅰ-Ⅱ级6例,WHO Ⅲ-Ⅳ级21例),淋巴瘤12例,生殖细胞瘤4例,淀粉样变性1例。结论 虽然术中冰冻病理会导致手术耗时增多,但能快速判断立体定向活检标本的性质,避免了过度取材,提高手术效率,减少活检损伤,可应用在神经外科机器人引导下脑病变活检手术中。
【关键词】 立体定向;脑活检术;精确诊断;术中冰冻;诊断阳性率
【中图分类号】 R651;R602 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0135-06
Abstract: Objective To explore the application value of intraoperative frozen section analysis in stereotactic biopsy of brain lesions. Methods The clinical data of 44 patients with brain lesions from June 2015 to October 2021 were analyzed retrospectively. Intraoperative frozen pathology analysis was applied in all 46 procedures,immunohistochemical examination was applied if necessary. Regular pathological results were used as the gold standard for diagnosis, and the diagnostic rate, delayed diagnostic rate and misdiagnosis rate of frozen results were judged. The diagnostic positive rate, diagnostic coincidence rate and influencing factors of frozen pathology during operation were analyzed. Results Of the 44 patients who underwent 46 biopsies, 9 patients had negative results in the first intraoperative freezing, and 7 of them had positive results after adjusting the depth of puncture and re-biopsy. 23 patients were diagnosed by intraoperative immunohistochemistry. In the end, 44 patients(96.65%) had positive intraoperative freezing results, and the diagnostic accuracy rate was 91.3%(35 cases were confirmed+7 cases were delayed). The results of puncture biopsy included 27 cases of glioma(6 cases of WHO grade Ⅰ- Ⅱ, 21 cases of WHO grade Ⅲ - Ⅳ), 12 cases of lymphoma, 4 cases of germinoma, and 1 case of amyloidosis. Conclusions Although intraoperative frozen pathology leads to more operation time consuming, it can quickly uncover the pathology of biopsy specimens, avoid excessive sampling, improve operation efficiency and reduce surgical complications. Intraoperative frozen pathology can be applied in robot-assisted stereotactic brain lesion biopsy.
Key words: brain biopsy; intracranial tumor; stereotactic biopsy; intraoperative frozen-section; diagnostic yield
基金項目:广东省医学科学技术研究基金项目(A2020505);广东省医学科学技术研究基金项目(B2023418)
作者单位:510510 广州,广东三九脑科医院神经外二科(陈志杰,林涛,刘妲,邓斌,张旭标,曾永亲),外七科(邓少勇,罗似亮),病理科(李海南,成白杰)
通信作者: 林涛
立体定向活检在脑内病变活检具有微创和精准的优势,临床医生能依据病理结果做出合适的诊疗策略。神经外科机器人是立体定向活检技术的常用设备,但是在实际操作中穿刺脱靶后会出现漏诊或者误诊。文献报道的脑立体定向活检确诊率在72.8%~100%,其中采用术中冰冻病理的确诊率均在87.6%以上[1-4],应用术中冰冻能够保证活检标本的可靠性。但有学者认为术中冰冻耗时且增加取材[5]。鉴于术中冰冻的优势和潜在不足的一些争议,本研究回顾性分析2015年6月—2021年10月广东三九脑科医院收治的44例脑深部病变活检患者资料,探讨术中冰冻病理在神经外科机器人引导的无框架立体定向脑深部病变活检中的应用价值。
1 资料与方法
1.1 一般资料 共纳入44例患者,其中男26例,女18例;年龄7~76岁,平均(42.52±19.47)岁。有2例患者首次活检常规病理诊断阴性,各行第二次机器人辅助下活检,故共行46次活检手术。采用2016年美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级标准进行术前风险评估,其中ASA Ⅰ-Ⅱ级37例,ASA Ⅲ级6例,ASA Ⅳ级1例。所有的病变均在脑内深部,多发或者弥漫性(累及多个脑叶)病变者16例,单发病变28例。病变平均直径为(4.46±2.52)cm (1.5~11.47 cm)。所有患者术前完善头颅CT及MRI(T1、T2、T2 FLAIR及增强扫描)检查,部分患者行PET-CT、MRS和ASL等检查,必要时行腰椎穿刺做脑脊液检查。纳入标准:(1)深部病变且影像诊断困难;(2)病变位于功能区,手术风险极高;(3)影像诊断相对明确,放疗前行病理确诊,如生殖细胞瘤;(4)病变恶性程度高或者良性肿瘤术后复发并提示恶化,家属拒绝再次开颅手术切除;(5)颅内肿瘤综合治疗后需鉴别肿瘤进展或放射性坏死;(6)患者及家属同意行机器人辅助下活检。排除标准:(1)患者存在基础疾病,全身情况不能耐受麻醉或手术,ASA为Ⅳ级或以上;(2)凝血功能存在手术禁忌;(3)影像提示脑疝形成;(4)患者及家属拒绝使用机器人辅助下活检[6]。
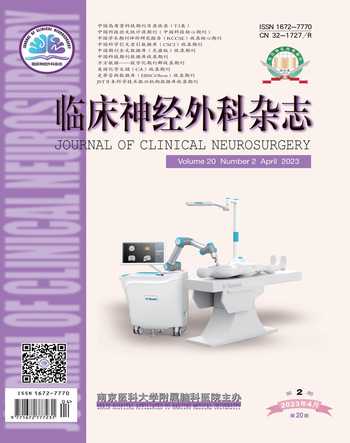
1.2 术前准备与规划 术前共为20例患者组织由神经外科、神经内科、影像科、肿瘤放疗科和病理科参加的多学科讨论,为26例患者组织神经外科科内术前疑难病例讨论。单个巨大占位或者多发占位的活检部位优先选择在非功能区的病变作为活检靶点。具体手术操作步骤参见本研究前期文献[6]。本研究中,16 次手術由ROSA神经外科机器人(法国,Medtech)辅助下完成穿刺活检,30次手术由SINO神经外科机器人(北京华科精准)辅助下完成穿刺活检。见图1。
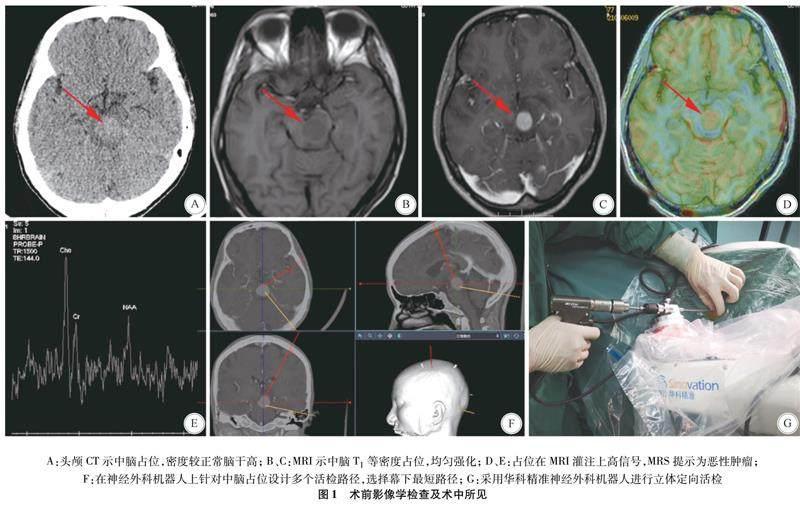
1.3 标本送检和冰冻病理方法 穿刺获得标本后观察其性质和颜色,先送检1~2条约0.1 cm×1 cm大小的外观异常(一般为胶冻样,鱼肉状,图2)的标本行术中冰冻病理检查。在等待术中冰冻结果时继续穿刺活检,留取2~4条标本作为常规病理,留取标本后在穿刺针的末端滴注生理盐水,借助水压对病灶压迫止血。常规病理检查如无法确诊,则补充行基因检测包括荧光原位杂交(fluorescence in situ hybridization,FISH)检测、基因重排等。
术中冰冻的处理采取0.2 cm间隔的书页状平行方式切开,仔细关注标本形态。仪器采取冰冻切片机(LEICA CM1950,德国徕卡),温度设置成-19~-20 ℃,切片厚度为4 μm,1个组织切片2~3张,HE染色后用光镜予以观察。如冰冻HE染色诊断困难,立即补充行免疫组化;剩余的组织行石蜡切片处理。
1.4 指标观察 本研究以常规病理整合诊断(组织学表型和基因表型)以及炎症诊断结果为金标准,比较术中冰冻病理在机器人立体定向活检中的诊断价值。结果分为三种:(1)确诊:术中冰冻病理诊断和整合诊断的结果符合或基本符合的,术中和术后均符合炎症诊断的;(2)延迟诊断:术中冰冻判断肿瘤WHO分级与常规病理不一致;(3)误诊:术中冰冻切片诊断出现假阳性结果、假阴性结果。其中确诊和延迟诊断归类为诊断符合。肿瘤患者病理诊断依据2016版WHO中枢神经系统肿瘤分类标准。如多靶点活检病理结果相同,则合并为一个结果;如患者同时存在高级别胶质瘤和低级别胶质瘤,则诊断为高级别胶质瘤。
1.5 统计学分析 采用统计学软件SPSS 21.0进行检验,合计数值采取例数(n)或率(%)表示,行χ2检验,以P<0.05 认为差异具有统计学意义。
2 结 果
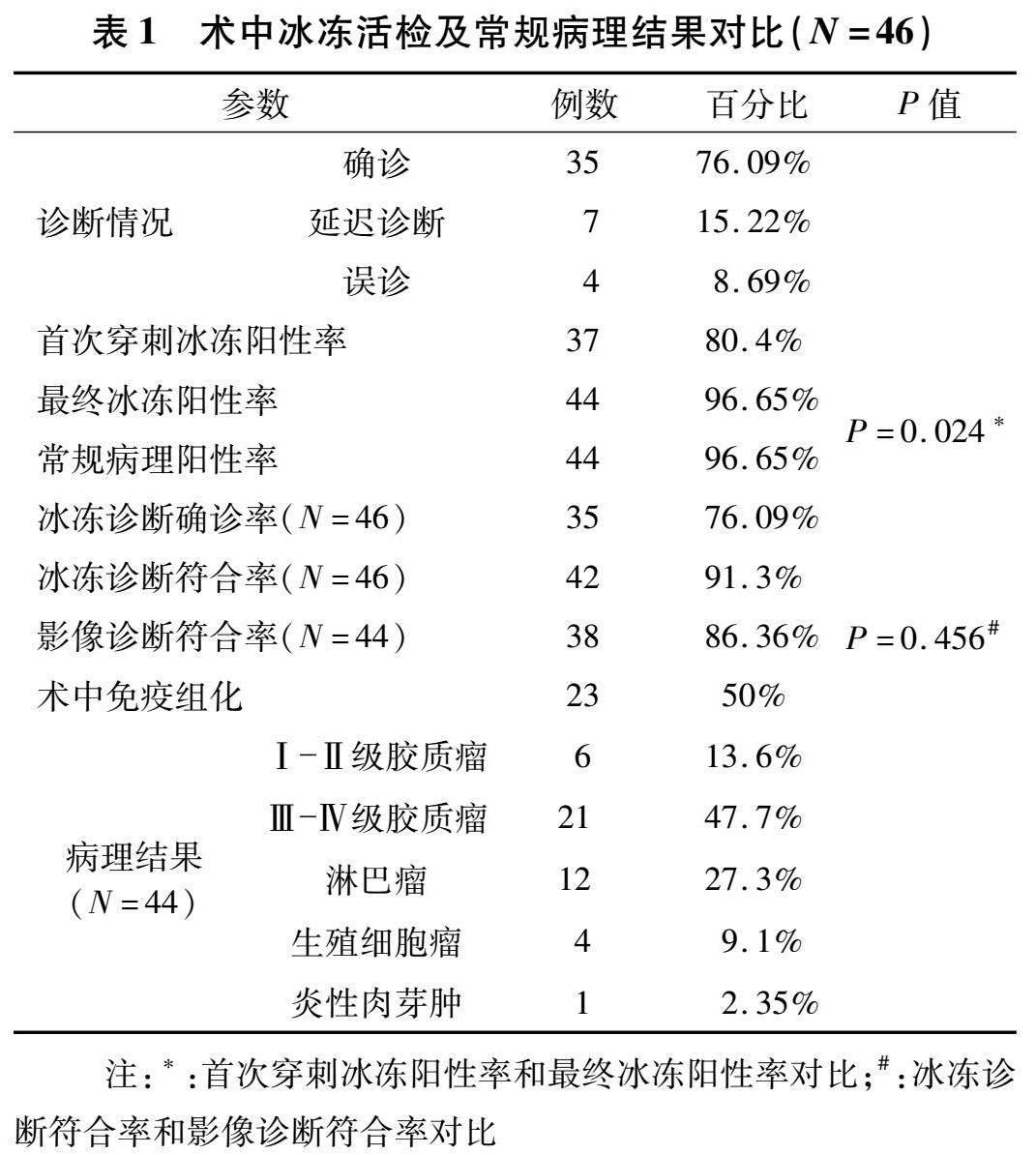
2.1 手术情况和术中冰冻结果 44例患者共接受46次手术,行52个靶点的穿刺活检,术中冰冻病理平均耗时(26±5.6)min (20~41 min)。有9例(19.56%)患者首次术中冰冻结果为阴性,其中7例术中调整穿刺深度或更换靶点后取得阳性结果,另有2例患者再次术中冰冻病理仍为阴性,术后通过常规病理和(或)基因重排得到确诊。每例患者送检术中冰冻1~4次(中位数1次),共行60次穿刺活检行术中冰冻病理检查。单次手术术中冰冻阳性率从80.44%(37/46)提高到95.65%(44/46),具有明显差异(P=0.024,表1)。将术中冰冻与常规病理对比,诊断符合率91.3%(35例确诊+7例延迟诊断),误诊4例(包含2例术中冰冻阴性)。另外,共有23例患者的冰冻切片做了术中免疫组化进一步明确病变性质。6例患者术后出现术区血肿,包括5例患者出现无症状性小出血和1例严重迟发性脑出血导致死亡。除这例脑出血致死亡患者外,其余患者均未发生手术相关性神经功能障碍或者颅内感染,并接受下一步的专科治疗。见表1。
2.2 术后病理结果 病理整合诊断结果为胶质瘤27例(WHO Ⅰ-Ⅱ级6例,WHO Ⅲ-Ⅳ级21例),淋巴瘤12例,生殖细胞瘤4例,淀粉样变性1例。其中1例患者术中连续送检4次冰冻病理均为阴性,最终依靠基因测序诊断为胶质母细胞瘤 WHO Ⅳ级。
3 讨 论
神经外科机器人国内的应用达20多年,进口品牌ROSA和国产品牌包括SINO、Tirobot Cranial、睿米(Remebot)机器人等已广泛应用在神经外科的多种手术中[7-9],包括立体定向活检手术。因受到取材、制片、阅片等相关因素的影响会出现假阴性和假阳性诊断,很多立体定向活检手术并未采用术中冰冻病理(表2)。Shooman等[5]认为术中冰冻不会提高诊断率,反而会导致手术时间延长,并增加脑出血和功能障碍的发生率。本研究者认为,在无术中冰冻病理的情况下为了保证常规诊断阳性率,术者可能会过度取材,从而增加并发症的发生率。因此本研究在开展神经外科机器人立体定向脑深部病变活检手术中,均采用了术中冰冻病理来及时判断病变性质。
本研究中的首次穿刺活检术中冰冻阳性率为80.4%(37例次),通过调整靶点或者穿刺深度,最终单次手术术中冰冻病理阳性率提高到96.65%(44例次)。出现首次穿刺阴性的原因是很多病变在重要功能区(如脑干、丘脑和基底节等),所以在设计活检靶点的时候偏于保守,有时将靶点定位在病变周边导致穿刺标本缺少病变特征。本研究的最终常规病理阳性率达96.65%,如无术中冰冻病理协助判断活检组织性质的话,诊断阳性率可能会低于此。
很多研究为提高立体定向活检的诊断阳性率做了很多的尝试,包括术中冰冻病理、术中组织涂片、增加活检标本量以及采用机器人辅助手术等[10]。术中冰冻病理检查在开颅脑病变切除手术中应用广泛,但是在立定定向活检中的还比较有限。限制该技术的原因包括,病损组织少,对冰冻切片技术要求比较高。有研究认为单个靶点至少4条活检标本方能确保诊断的准确性[11]。本研究中,如果术中冰冻结果阳性,则留取2~4条标本送常规病理(图2),避免了过度取材。本研究总结了近15年来各类技术实施的立体定向活检的文献,发现只有6个(6/22)研究采用了术中冰冻病理检查,其中仅有2个研究的所有病例均采用该方法[2,12](表2)。上述研究的术中冰冻病理活检阳性率在70.1%~97.2%之间,最终的常规病理结果阳性率达87.6%~98.7%[1-3,13-14]。Verploegh等[15]认为随着操作的熟练和经验的积累,术者可以不依赖术中冰冻病理,但是本研究认为,患者及家属在决定接受立体定向活检手术时,便对手术结果有很大的期待,应尽量在单次手术即获得正确的病理诊断。
本研究单次手术术中冰冻诊断符合率为91.3%(42/46)。近15年来,国内外文献报道立体定向活检的术中冰冻的诊断符合率在70%~81%之间(表2),这些研究的手术设备包括机器人、框架和非机器人的无框架立体定向仪器等[2-3,13]。在不采用术中冰冻切片情况下,为了提高诊断阳性率,有学者建议采用多个靶点活检提高阳性率[2-3,5],但这种方法耗时会更多,而且增加脑出血的风险。如果采用框架行多个靶点活检时调整靶点的操作较为繁杂,则会耗时更多,神经外科机器人操作简化,适合多靶点活检并行术中冰冻病理检查。此外,本组中有1例误诊患者的术中冰冻结果阳性,但是常规病理结果为阴性,究其原因可能是冰冻标本和常规病理标本不是同一条穿刺标本。后来,本研究改进了这种送检方法,穿刺活检的单个标本一半送术中冰冻切片,另一半送常规病理检查。将2~3条标本的各一半合起来送术中冰冻检查,既能保证充足的标本量,又能保证常规病理和术中冰冻病理的一致性。
广东三九脑科医院影像科对所有的患者术前影像进行了定性诊断,诊断符合率为72.73%(32/44,表2)。得益于影像科的高确诊率,本研究及時调整了治疗方法,让很多被误诊为自身免疫性脑炎或脱髓鞘的患者接受立体定向活检。此外,通过合理安排,术前1 d和病理科同事预约术中冰冻事宜,以便他们做好工作安排尽早作出诊断。这些患者通过活检明确脑肿瘤后,转至肿瘤科行综合治疗。
虽然神经外科机器人定位精准,但实际操作中仍有可能出现偏差,和其他立体定向活检一样出现脱靶的情况[5]。脱靶是导致术中冰冻病理漏诊或者误诊的主要因素,出现该情况的原因包括:(1)病变过小,活检针侧切口没有正对病变组织;(2)操作者对影像的解读不到位,将非典型区域定位为靶点;(3)操作者为了避开重要功能区而选择周边的靶点;(4)机器人操作不当。一旦术中冰冻的结果为阴性,术者应马上分析原因,立即调整靶点深度或更改靶点。本研究中,有3例患者的病变小于2 cm,最小的病变约1.5 cm,对这类小病灶进行穿刺时,如果活检针侧切口没有正对病变组织,那术中冰冻的结果可能就是阴性的。术中在对小病灶进行活检时,应当尽量穿刺到病灶中心,如冰冻结果阴性,则活检针侧切口方向即可,不需要调整穿刺深度。有研究认为深部病变活检是影响诊断率的重要因素[2],而有研究则认为是浅部病变容易脱靶[16],这可能和术者操作不同的活检设备有关。
标本不合格和病理医生阅片错误,是术中冰冻病理结果阴性两个重要主观因素。标本不合格包括送检不合格标本(外科医生取出了多份标本,但送检了脑组织部分)和病理科技师处理标本不合格。一般脑肿瘤标本呈鱼肉状,这与乳白色的脑组织有明显的外观差异,术者应当观察后选择合适的标本送检。病理医生对的标本解读具有较强的主观性,阅片失误在所难免,建议术中冰冻病理由多位有经验的病理医生共同阅片诊断。
由于部分淋巴瘤和胶质瘤的形态学上不易区分,本研究中出现诊断困难时病理科医生会立即做2~5项术中免疫组化,耗时约20~30 min。共有23例次的患者行术中免疫组化及时为肿瘤定性,其中3例为低级别胶质瘤,10例为高级别胶质瘤, 9例为淋巴瘤,1例为生殖细胞瘤。通过做免疫组化获得较为准确的病理结果(图2),术者能够在手术当天告知患者家属病理结果,并且尽早为淋巴瘤患者开始化学治疗,可改善患者生存质量和延长生存期[17]。有研究者总结2005年以前的文献发现,术中冰冻的诊断符合率约为73 % (51%~91 %)[4]。本研究中,对定性诊断困难的标本采用了术中免疫组化检查,虽然耗时增多,但最终诊断符合率达91.3%,达到理想的诊断阳性率和诊断符合率。
本研究为回顾性分析,所有患者均行术中冰冻病理检查,未设立无术中冰冻组作为对照研究。本研究中,首次术中冰冻病理阴性率较高,平均耗时较多,需要术者今后在手术中提高手术技巧。虽然术中冰冻病理会导致手术耗时增加,但能快速判断立体定向活检标本的性质,及时行下一步治疗,避免了过度取材,提高手术效率,减少活检损伤,可应用在神经外科机器人引导下脑病变活检手术中。
[参 考 文 献]
[1]Zanello M,Roux A,Senova S,et al.Robot-assisted stereotactic biopsies in 377 consecutive adult patients with supratentorial diffuse gliomas:diagnostic yield,safety,and postoperative outcomes[J].World Neurosurg,2021,148(4):e301-e313.
[2]Woodworth GF,McGirt MJ,Samdani A,et al.Frameless image-guided stereotactic brain biopsy procedure:diagnostic yield,surgical morbidity,and comparison with the frame-based technique[J].J Neurosurg,2006,104(2):233-237.
[3]Taweesomboonyat C,Tunthanathip T,Sae-Heng S,et al.Diagnostic yield and complication of frameless stereotactic brain biopsy[J].J Neurosci Rural Pract,2019,10(1):78-84.
[4]Khatab S,Spliet W,Woerdeman PA.Frameless image-guided stereotactic brain biopsies:emphasis on diagnostic yield[J].Acta Neurochir(Wien),2014,156(8):1441-1450.
[5]Shooman D,Belli A,Grundy PL.Image-guided frameless stereotactic biopsy without intraoperative neuropathological examination[J].J Neurosurg,2010,113(2):170-178.
[6]刘妲,陈志杰,山常国,等.神经外科机器人辅助立体定向活检在脑深部病变的应用(附26例临床分析)[J].立体定向和功能性神经外科杂志,2021,34(1):4-8.
[7]吴世强,焦利武,肖群根,等.Remebot机器人辅助下立体定向活检术的临床应用[J].中国临床神经外科杂志,2017,22(11):751-753.
[8]王逸鹤,单永治,赵国光,等.ROSA机器人辅助下立体定向活检术在脑内病变诊断中的作用[J].中国临床神经外科杂志,2017,22(1):11-13.
[9]刘德峰,王秀,张勇,等.Tirobot Cranial立体定向手术机器人辅助脑深部电极植入定位精度的研究[J].临床神经外科杂志,2018,15(2):81-84.
[10]Jain D,Sharma MC,Sarkar C,et al.Correlation of diagnostic yield of stereotactic brain biopsy with number of biopsy bits and site of the lesion[J].Brain Tumor Pathol,2006,23(2):71-75.
[11]Brainard JA,Prayson RA,Barnett GH.Frozen section evaluation of stereotactic brain biopsies:diagnostic yield at the stereotactic target position in 188 cases[J].Arch Pathol Lab Med,1997,121(5):481-484.
[12]楊帆,董超,汤其华,等.立体定向活检术在丘脑病变诊断的作用[J].中国微侵袭神经外科杂志,2021,26(8):384-385.
[13]Mader MMD,Rotermund R,Martens T,et al.The role of frameless stereotactic biopsy in contemporary neuro-oncology:molecular specifications and diagnostic yield in biopsied glioma patients[J].J Neurooncol,2019,141(1):183-194.
[14]Legnani FG,Franzini A,Mattei L,et al.Image-guided biopsy of intracranial lesions with a small robotic device(iSYS1):a prospective,exploratory pilot study[J].Oper Neurosurg(Hagerstown),2019,17(4):403-412.
[15]Verploegh ISC,Volovici V,Haitsma IK,et al.Contemporary frameless intracranial biopsy techniques:might variation in safety and efficacy be expected?[J].Acta Neurochir(Wien),2015,157(11):2011-2016.
[16]赵思源,刘娟,张剑宁,等.384例立体定向脑活检术诊断率的影响因素分析[J].立体定向和功能性神经外科杂志,2014,27(6):327-330.
[17]梁肖欢,杨超,林佳平,等.63例原发性颅内恶性淋巴瘤临床分析[J].临床神经外科杂志,2016,13(4):272-275,280.
[18]Dammers R,Schouten JW,Haitsma IK,et al.Towards improving the safety and diagnostic yield of stereotactic biopsy in a single centre[J].Acta Neurochir(Wien),2010,152(11):1915-1921.
[19]Dlaka D,Sˇvaco M,Chudy D,et al.Frameless stereotactic brain biopsy:a prospective study on robot-assisted brain biopsies performed on 32 patients by using the RONNA G4 system[J].Int J Med Robot,2021,17(3):e2245.
[20]王俊文,吳世强,赵恺,等.Remebot机器人辅助立体定向活检术诊断率的影响因素分析[J].中国耳鼻咽喉颅底外科杂志,2021,27(3):321-324.
[21]Wu SQ,Wang JW,Gao P,et al.A comparison of the efficacy,safety,and duration of frame-based and Remebot robot-assisted frameless stereotactic biopsy[J].Br J Neurosurg,2021,35(3):319-323.
[22]Terrier L,Gilard V,Marguet F,et al.Stereotactic brain biopsy:evaluation of robot-assisted procedure in 60 patients[J].Acta Neurochir(Wien),2019,161(3):545-552.
[23]Dawes W,Marcus HJ,Tisdall M,et al.Robot-assisted stereotactic brainstem biopsy in children: prospective cohort study[J].J Robot Surg,2019,13(4):575-579.
[24]Georgiopoulos M,Ellul J,Chroni E,et al.Efficacy,safety,and duration of a frameless fiducial-less brain biopsy versus frame-based stereotactic biopsy:a prospective randomized study[J].J Neurol Surg A Cent Eur Neurosurg,2018,79(1):31-38.
[25]Carai A,Mastronuzzi A,De Benedictis A,et al.Robot-assisted stereotactic biopsy of diffuse intrinsic pontine glioma:a single-center experience[J].World Neurosurg,2017,101(2):584-588.
[26]De Benedictis A,Trezza A,Carai A,et al.Robot-assisted procedures in pediatric neurosurgery[J].Neurosurg Focus,2017,42(5):E7.
[27]Nishihara M,Takeda N,Harada T,et al.Diagnostic yield and morbidity by neuronavigation-guided frameless stereotactic biopsy using magnetic resonance imaging and by frame-based computed tomography-guided stereotactic biopsy[J].Surg Neurol Int,2014,5(Suppl 8):S421-S426.
[28]Gempt J,Buchmann N,Ryang YM,et al.Frameless image-guided stereotaxy with real-time visual feedback for brain biopsy[J].Acta Neurochir(Wien),2012,154(9):1663-1667.
(收稿2022-04-10 修回2022-07-14)