ATRX、P53表达的相关性及联合多因素对胶质瘤预后的意义
许儒 阴鲁鑫 华磊 陈洋 朱天霸 赵光 王星淇 高文昌
【摘要】 目的 探討脑胶质瘤患者中ATRX失表达与P53过表达的相关性,并分析二者与临床多因素在胶质瘤诊断及预后中的意义。方法 收集2014年1月—2020年12月徐州医科大学附属医院神经外科收治的术后病理诊断为胶质瘤的患者92例,其中包括星形细胞瘤(WHO Ⅱ、Ⅲ级)30例、少突胶质细胞瘤(WHO Ⅱ、Ⅲ级)50例、胶质母细胞瘤(WHO Ⅳ级)12例,并使用免疫组织化学染色法检测ATRX与P53表达情况,并统计不同年龄、性别与二者间的关系;χ2检验分析ATRX失表达、P53过表达与不同病理类型脑胶质瘤的关系且二者表达之间的关系用Spearman等级相关分析法检验;Kaplan-Meier生存曲线分析二者对胶质瘤患者预后的影响,其他临床因素纳入多因素Cox回归分析。结果 ATRX与P53表达与胶质瘤病理类型相关(P<0.05);相关性分析显示,胶质瘤中ATRX与P53表达呈负相关(r=-0.580,P<0.01);多因素分析表明,胶质瘤患者的年龄≥60岁、病理分级WHO Ⅲ-Ⅳ级、术前KPS评分<60分、术后无放化疗、肿瘤直径≥5 cm、肿瘤非全切、ATRX失表达、P53过表达是预后不良的独立危险因素(P<0.05)。结论 在人脑胶质瘤患者中,ATRX失表达与P53过表达密切相关,与临床其他多因素联合可更好地对胶质瘤患者的预后进行评估。
【关键词】 脑胶质瘤;ATRX;肿瘤抑制蛋白质P53;免疫组化;预后
【中图分类号】 R739.41 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0153-06
Abstract: Objective To explore the correlation between the loss of expression of alpha thalassemia with mental retardation syndrome gene(ATRX) and over expression of P53 in patients with glioma and to analyze the clinical significance of the two gene expression and multi-factors in the diagnosis and prognosis of glioma. Method The clinical data of 92 patients were collected, including 30 patients with astrocytoma of grade Ⅱ/Ⅲ(WHO), 50 with oligodendroglioma of grade Ⅱ/Ⅲ(WHO) and 12 with glioblastoma of grade Ⅳ(WHO). The Chi-square test was applied to analyze the relationship between the two gene expression and different pathological types of glioma. The Spearman's rank correlation analysis was used to analyze the correlation between their different expression. Kaplan-Meier survival curve was designed to investigate the clinical value of their different expression in prognosis of patients with glioma. The other contributing factors were analyzed in the multivariate Cox regression analysis. Results There was a correlation between the different expression of ATRX and P53 and the pathological types of glioma(P<0.05). The correlation analysis showed that the loss of expression of ATRX and over expression of P53 in glioma were negative correlated(r=0.426,P<0.01). The multivariate analysis showed that the age over 60 years old, grade Ⅲ/Ⅳ(WHO), preoperative KPS scores below 60 points, lack of postoperative radiotherapy and chemotherapy, and lost expression of the ATRX were independently risk factors for poor prognosis. Conclusion In patients with glioma, the loss of expression of ATRX and over expression of P53 were closely related to one another, and they together with other clinical factors can better evaluate the prognosis of glioma patients.
Key words: glioma; ATRX; tumor suppressor protein P53; immunohistochemistry; prognosis
基金项目:江苏省自然科学基金面上项目(BK20181152)
作者单位:221000 徐州,徐州医科大学附属医院神经外科
通信作者:高文昌
脑胶质瘤是颅内最常见的恶性肿瘤,占颅内原发肿瘤的40%~60%[1]。根据肿瘤的恶性程度分为WHO Ⅰ-Ⅱ低级别胶质瘤,Ⅲ-Ⅳ级高级别胶质瘤。高级别肿瘤与低级别相比,一般患者生存期更短,预后较差。现在更多基因和染色体被发现与人脑胶质瘤的发生、发展及预后有着高度的联系[2],有学者发现,胶质瘤患者的预后状况与细胞的凋亡有关,而细胞的凋亡又与基因或蛋白的调控相关联[3]。自2016年WHO发布了胶质瘤的第四版本的诊断标准,胶质瘤就进入了“组织学+分子病理”的診断模式,其中异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)的野生型与突变型作为分类的首个分子标记物,对于胶质瘤的诊断有着极其重要的意义,其次是α地中海贫血伴智力低下综合征基因(alpha-thalassemia/mental retardation syndrome X-linked,ATRX)与P53,1p/19q,其中ATRX与1p/19q的突变不会同时发生,把胶质瘤的常见类型分为弥漫星形细胞瘤IDH突变型、少突胶质细胞瘤IDH突变,1p/19q共缺失、弥漫性星形细胞瘤,IDH野生型、少突胶质细胞瘤、NOS等。然而ATRX基因异常表达的致病机制仍不十分明确,其治疗靶向的可处理机制也不清楚。ATRX作为端粒维持基因,与肿瘤细胞发生端粒替代延长机制(ALT)有关,而P53对端粒酶的作用也有一定的影响[4]在胶质瘤的发展进程中同样起重要作用。本研究回顾性分析2014年1月—2020年12月在徐州医科大学附属医院神经外科初次行手术切除并经病理检查确诊的胶质瘤标本92例,使用免疫组织化学方法对上述标本进行处理,分析ATRX失表达及P53过表达情况并分析二者在胶质瘤发展过程中的某条或多条途径中的共同作用及联合临床其他多因素对于胶质瘤预后的关系。
1 资料与方法
1.1 一般资料 共纳入92例脑胶质瘤患者标本,其中男50例,女42例;年龄22~74岁,平均年龄48.5岁;星形细胞瘤(WHO Ⅱ、Ⅲ级)30例,少突胶质细胞瘤(WHO Ⅱ、Ⅲ级)50例,胶质母细胞瘤(WHO Ⅳ级)12例;对患者本人或家属进行电话随访,随访内容包括患者术后是否进行放化疗,是否死亡及死亡时间。随访时间自患者手术日开始,截止日期为2020年12月。纳入标准:(1)原发脑胶质瘤;(2)病理检查确诊为胶质瘤;(3)初次行手术治疗;(4)术后联合放化疗;(5)患者资料完善可进行有效随访,并取得患者知情同意。排除标准:(1)合并其他系统的原发肿瘤;(2)入院前对胶质瘤有其他治疗;(3)入院前肝肾功能、电解质、凝血功能明显异常;(4)入院前近期有慢性或急性感染病史。
1.2 试剂 ATRX多克隆抗体、P53单克隆抗体均购自北京中杉金桥公司,DAB显色剂、EDTA(PH8.4)修复液、PBS缓冲液、二抗均购自罗氏(上海)公司。
1.3 标本制作 手术切除肿瘤组织均经10%中性福尔马林固定,HE染色;石蜡包埋,4 μm厚连续切片,每个切片均行HE染色。
1.4 免疫组织化学染色 切片脱蜡后分别滴加ATRX多克隆抗体、P53单克隆抗体行免疫组化EnVision法染色,染色步骤严格按试剂盒说明书进行:DAB显色、苏木精复染、返蓝、乙醇脱水、二甲苯透明、中性树胶封固,以PBS缓冲液代替一抗作为阴性对照。
1.5 判断标准 结果由两位有经验的病理医师阅片后,取得一致意见。以肿瘤周围正常细胞作为内对照,免疫组化结果以肿瘤细胞核棕褐色为阳性细胞。光镜下随机选择数个高倍视野,记录每个视野中阳性细胞所占的百分率,采用染色判定标准[5-7]。肿瘤细胞中,ATRX阳性肿瘤细胞数>10% 即ATRX表达,ATRX阳性细胞数≤10%即ATRX失表达;P53阳性细胞数>10% 即P53过表达,P53阳性细胞数≤10% 即P53阴性。
1.6 统计学方法 采用SPSS 26.0软件进行数据统计分析;χ2检验分析ATRX、P53表达与不同类型胶质瘤的关系;ATRX与P53表达之间的关系用Spearman等级相关分析法检验;ATRX与P53表达与胶质瘤患者生存时间的关系用Kaplan-Meier生存曲线表示,再采用多因素Cox回归分析,以P<0.05为差异有统计学意义。
2 结 果
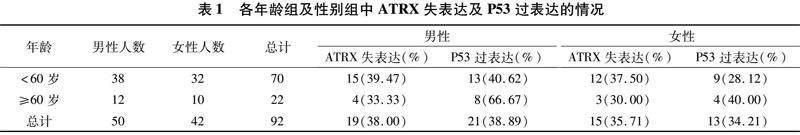
2.1 人口学统计结果 在<60岁患者中,男性患者ATRX失表达与P53过表达的发生率分别是39.47%、40.62%,女性患者中为37.50%、28.12%;在≥60岁患者中, 男性患者ATRX失表达与P53过表达的发生率分别是33.33%、66.67%,女性患者中分别为30.00%、40.00%,ATRX失表达与P53过表达更加倾向于年轻患者,而在不同性别中无明显差别,P<0.05(表1)。
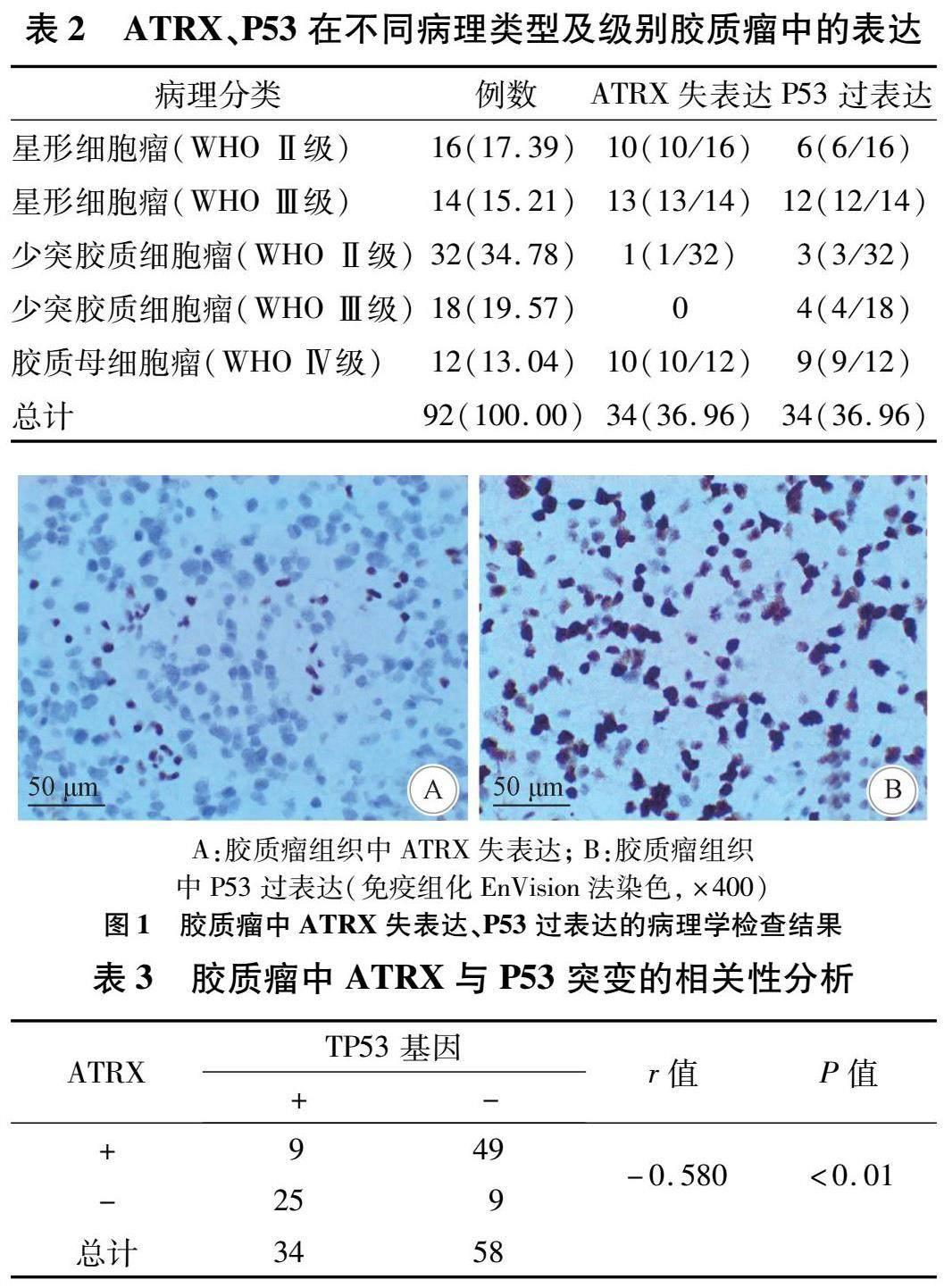
2.2 ATRX失表达、P53过表达与不同病理类型胶质瘤的关系 ATRX失表达、P53过表达与胶质瘤病理类型及级别有关。ATRX失表达情况:(1)不同病理类型肿瘤中,星形细胞瘤(WHO Ⅱ、Ⅲ级)
ATRX失表达百分比为76.67%(23/30),少突胶质细胞瘤(WHO Ⅱ、Ⅲ级)中为2.00%(1/50),ATRX突变在二者中的差异具有统计学意义(P<0.05);(2)不同级别肿瘤中,WHO Ⅱ级ATRX失表达百分比为22.91%(11/48),WHO Ⅲ级中为40.62%(13/32),WHO Ⅳ级中为83.33%(10/12)(P<0.05,表2,图1A)。P53过表达情况:(1)在星形细胞瘤(WHO Ⅱ、Ⅲ级)中P53过表达百分比为60.00%(18/30),少突胶质细胞瘤(WHO Ⅱ、Ⅲ级)中为14.00%(7/50),P53过表达在二者中的差异具有统计学意义(P<0.05);(2)不同级别肿瘤中,WHO Ⅱ级P53过表达百分比为18.75%(9/48),WHO Ⅲ级中为45.71%(16/32),WHO Ⅳ级中为75.00%(9/12)(P<0.05,表2,图1B)。
2.3 ATRX与P53表达之间的关系 本研究进一步对ATRX与P53表达情况进行分析,发现Spearman相关系数r=-0.580,P<0.01,二者存在负相关系(表3)。
2.4 K-M曲线分析ATRX与P53表达对胶质瘤患者预后的影响 ATRX失表达患者预后差于ATRX表达的患者,其生存时间少于ATRX表达的患者,P<0.05。P53过表达患者的预后差于P53阴性的患者,其生存时间少于P53阴性的患者,P<0.05(图2)。
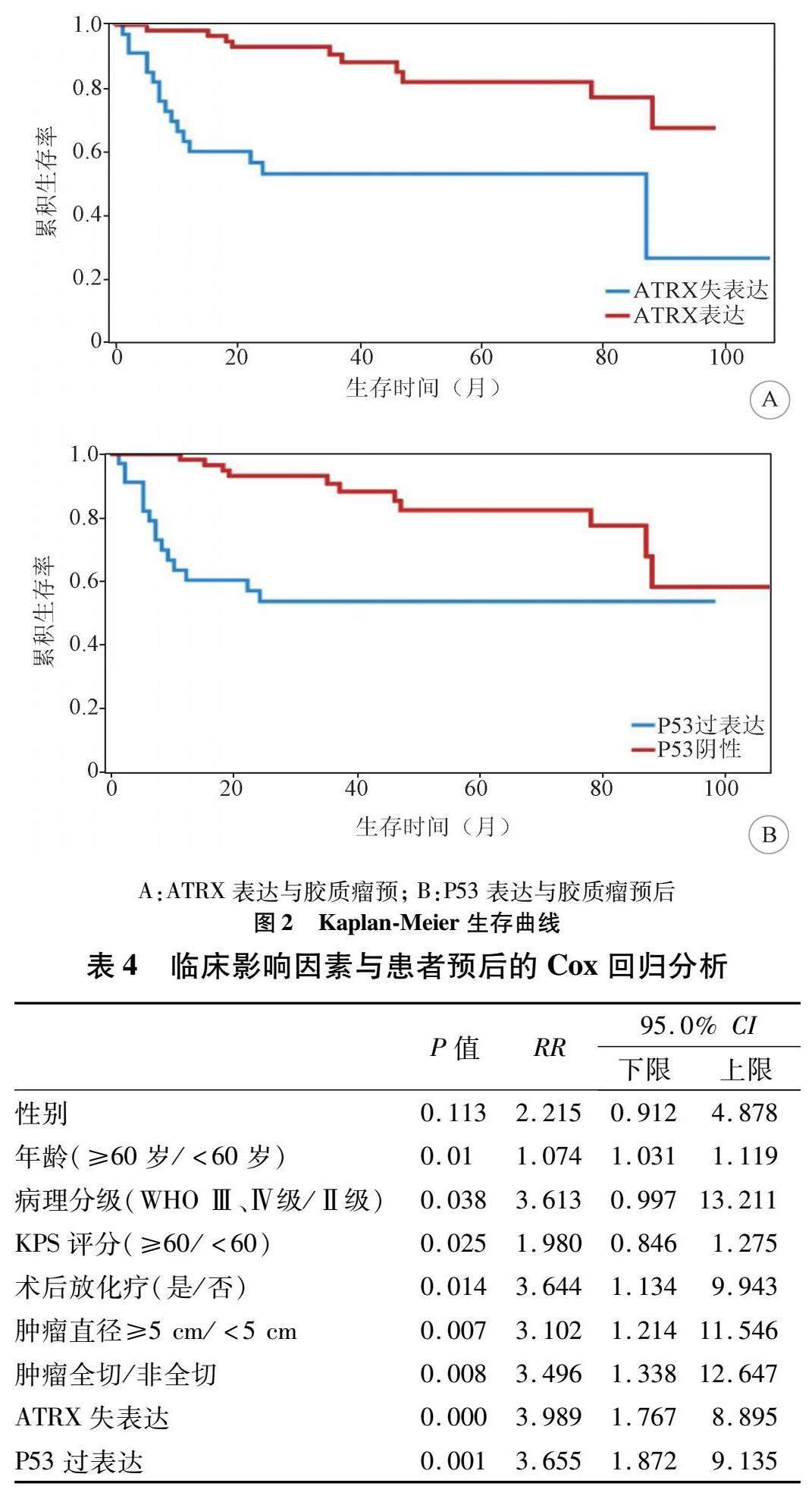
2.5 影响胶质瘤患者预后的多因素回归分析Cox回归分析显示,胶质瘤患者的年龄≥60岁,病理分级WHO Ⅲ级、Ⅳ级,术前KPS评分<60分,术后无放化疗、肿瘤直径≥5 cm、肿瘤非全切、ATRX失表达、P53过表达是预后不良的独立危险因素(P<0.05)。而患者的性别不是危险因素。见表4。
3 讨 论
近年来,越来越多的研究都揭示了端粒维持基因对于胶质瘤患者预后的重要性,其中就包括ATRX。ATRX是位于Xq21.1上,编码280 kDa的核蛋白,已被证明涉及广泛的细胞功能,如DNA重组、修复和转录调控。P53基因可分为野生型及突变型,野生型P53可以抑制正常细胞发生癌变,一般情况下会使细胞的分裂增殖正常进行,若细胞受到不可恢复的损伤,P53将会使受损伤的细胞发生凋亡。P53是多种抗增殖功能的主要调节因子,P53的突变和/或失活对肿瘤发生至关重要[7]。在胶质瘤中,P53有较高的突变率以维持肿瘤细胞的活性[8]。有关研究认为,P53过表达的患者与P53阴性的患者相比,预后更差[9]。
通常,ATRX突变会导致蛋白截断和蛋白表达消失[5],且ATRX突变状态与表达水平相关,内皮细胞、皮层神经元和浸润性炎症细胞普遍阳性,作为内阳性对照[6],所以免疫组化法是可靠的,可以代替基因检测来评估ATRX基因突变。 有研究通過荟萃分析及系统性回顾等方法来探究P53免疫组化作为TP53测序替代物的诊断准确性,结果显示P53的免疫组化是TP53测序的高度准确替代品[10],因此在本研究中,用免疫组化方法对于检测ATRX及P53突变具有研究意义。有研究提出[11],在脑肿瘤的形成过程中,ATRX作为基因改变的终末事件,发生于IDH、P53之后,三个致癌基因共同通过阻断神经干细胞的分化来导致胶质瘤的发展。ATRX缺失会引起端粒功能的障碍,且内源性端粒酶活性是无法代偿的[12],因此,ATRX突变细胞被迫采用基于DNA修复的ALT代替端粒酶激活,作为永生化的代偿性端粒延伸机制;此外,也有学者认为ATRX失表达可诱导微核形成[13]。因此,ATRX缺失诱导的ALT也可在胶质瘤中诱发基因组的不稳定。另一方面,有研究显示[14]:ALT细胞中固有的DNA损伤会诱导低水平的P53表达,虽不足以启动凋亡相关基因的转录,但足以刺激mTORC2关键成分的表达,进而导致AKT的磷酸化,而活化的AKT(p-AKT)可由此刺激下游抗凋亡事件的发生,P53和AKT是抑制ALT细胞自发凋亡的关键因素。因此,P53基因的突变在ALT通路中也同样扮演了重要作用[15]。由此可知,ATRX与P53共同在ALT通路中产生影响,使肿瘤细胞进一步进展。有研究表明[16-18],ATRX定位于早幼粒细胞白血病(promyelocytic leukemia,PML)核体以及其他部位,因此,ATRX可能在基因表达调控中产生重要影响,且死亡结构域蛋白DAXX可将ATRX招募到PML核体中发挥作用[17],因此,若ATRX基因异常表达则使PML的抑制肿瘤作用发生改变。相关研究显示[19],PML核体(NBs)的形成受到细胞应激的刺激,并依赖于蛋白质-蛋白质之间的相互作用,从而建立PML蛋白质网络,该网络能够招募肿瘤抑制基因P53以及其他P53修饰物,从而控制P53的翻译后的修饰及其活性,进而调节细胞过程。因此,ATRX与P53也可以通过PML共同调控细胞相关的生理过程。另外,ATRX-DAXX复合物通过在端粒和中心异染色质及其他DNA重复区域沉积H3.3,在维持基因组稳定性方面发挥关键作用,因此,ATRX的丢失使H3.3沉积消失,导致细胞中特定位点染色质的变性,这些都表现了ATRX作为癌症驱动因素的作用[13]。Wang等[20]研究发现,ATRX失表达可能通过G4介导的相关机制导致DNA损伤或者染色体结构改变。而且,G4结构的化学稳定性也选择性地促进了ATRX缺陷环境下的细胞死亡。一个ATRX缺陷的基因工程胶质瘤模型也表明,ATRX的失表达降低了中位生存期,增加了遗传不稳定性[13]。
本研究表明,ATRX突变失表达多发生于星形胶质瘤,但少见于少突胶质细胞瘤(表2),对于星形细胞瘤的诊断及鉴别具有意义,ATRX失表达患者的生存期比ATRX表达患者有变差的趋势(图2A),而对于P53过表达的患者预后也差于P53阴性患者(图2B),对于预测患者的预后有一定的意义。且本研究进一步对ATRX与P53表达情况进行分析,发现Spearman相关系数r=-0.580,P<0.01,二者存在负相关系(表3),这与相关研究认为ATRX与P53基因异常表达在Ⅱ级星形细胞瘤中常见这一观点保持一致[21]。有研究[22-23]也认为ATRX失表达与P53过表达在星形细胞瘤中多于少突胶质细胞瘤,并有助于星形细胞瘤的诊断(表2),所以P53可以联合ATRX对星形细胞瘤进行诊断和鉴别。但在既往研究中有结论显示,ATRX失表达可以延长患者总生存时间,这可能是因为在临床中存在IDH2突变而使用免疫组化不能检测使结果存在偏差,所以结果还需进一步进行研究讨论。以上结果显示,ATRX失表达、P53过表达在胶质瘤的发生、发展过程中有一定的影响,对于患者预后也有一定的预测作用。
其他临床因素也会对胶质瘤患者的预后产生一定的影响,本研究结果发现(表4),患者年龄,肿瘤病理级别,术前KPS评分,术后放化疗,肿瘤直径,肿瘤切除程度也是影响胶质瘤患者预后的因素。有研究表明[24], 相对于年轻患者,年龄较大患者预后更差,可能与某些基因随着年龄的增加而出现较大的突变风险有关。术前KPS评分在患者术前的身体健康状态评估方面有一定的作用;在患者病理类型确定的情况下,越是低级别的胶质瘤,细胞的异型性就越小,肿瘤细胞的侵袭与进展的可能性越低,患者预后越好。在胶质瘤的患者中,放化疗可以有效延长患者生存期[25]。患者术后放化疗可增加患者恢复的速度,减少肿瘤的早期转移可能性和减缓肿瘤后期进展速度。目前,手术切除仍是脑胶质瘤的主要治疗方式,手术的切除程度与患者的预后息息相关。本研究结果显示,肿瘤全切对于患者预后优于非全切的患者,结果与目前研究结论一致[26-28]。因此,对于行手术治疗的患者, 最大范围的进行安全切除仍作为一线治疗[29]。
綜上所述,ATRX与P53的表达与胶质瘤病理类型有关,且二者呈负相关,联合检测ATRX、P53及临床多因素有利于判断胶质瘤病理类型、恶性程度及预测患者生存时间,从而给胶质瘤的鉴别诊断、预后判断和精准诊疗提供更加可靠的理论支持。
[参 考 文 献]
[1]吴维宁,吴有志,刘振,等.高级别胶质瘤患者生存期的影响因素分析[J].临床神经外科杂志,2020,17(6):669-674.
[2]李卓,朴月善,张立彦,等.ATRX在胶质瘤诊断及患者预后评估中的应用[J].中华病理学杂志,2017,46(10):690-694.
[3]张国栋,鞠海涛,黄平,等.脑胶质瘤的基因治疗与病毒治疗研究进展[J].临床神经外科杂志,2021,18(2):237-240.
[4]Benslimane Y,Sánchez-Osuna M,Coulombe-Huntington J,et al.A novel p53 regulator,C16ORF72/TAPR1,buffers against telomerase inhibition[J].Aging Cell,2021,20(4):e13331.
[5]Reuss DE,Sahm F,Schrimpf D,et al.ATRX and IDH1-R132H immunohistochemistry with subsequent copy number analysis and IDH sequencing as a basis for an“integrated”diagnostic approach for adult astrocytoma,oligodendroglioma and glioblastoma[J].Acta Neuropathol,2015,129(1):133-146.
[6]Wiestler B,Capper D,Holland-Letz T,et al.ATRX loss refines the classification of anaplastic gliomas and identifies a subgroup of IDH mutant astrocytic tumors with better prognosis[J].Acta Neuropathol,2013,126(3):443-451.
[7]Takami H,Yoshida A,Fukushima S,et al.Revisiting TP53 mutations and Immunohistochemistry—a comparative study in 157 diffuse gliomas[J].Brain Pathol,2015,25(3):256-265.
[8]Lou JC,Hao YC,Lin KF,et al.Circular RNA CDR1as disrupts the p53/MDM2 complex to inhibit gliomagenesis[J].Mol Cancer,2020,19(1):138.
[9]Yang ZX,Ling F,Ruan SB,et al.Clinical and prognostic implications of 1p/19q,IDH,BRAF,MGMT promoter,and TERT promoter alterations,and expression of Ki-67 and p53 in human gliomas[J].Cancer Manag Res,2021,13:8755-8765.
[10]Raffone A,Travaglino A,Cerbone M,et al.Diagnostic accuracy of p53 immunohistochemistry as surrogate of TP53 sequencing in endometrial cancer[J].Pathol Res Pract,2020,216(8):153025.
[11]Modrek AS,Golub D,Khan T,et al.Low-grade astrocytoma mutations in IDH1,P53,and ATRX cooperate to block differentiation of human neural stem cells via repression of SOX2[J].Cell Rep,2017,21(5):1267-1280.
[12]Li F,Deng Z,Zhang L,et al.ATRX loss induces telomere dysfunction and necessitates induction of alternative lengthening of telomeres during human cell immortalization[J].EMBO J,2019,38(19):e96659.
[13]Haase S,Garcia-Fabiani MB,Carney S,et al.Mutant ATRX:uncovering a new therapeutic target for glioma[J].Expert Opin Ther Targets,2018,22(7):599-613.
[14]Ge YL,Wu S,Zhang ZP,et al.Inhibition of p53 and/or AKT as a new therapeutic approach specifically targeting ALT cancers[J].Protein Cell,2019,10(11):808-824.
[15]Macha SJ,Koneru B,Burrow TA,et al.Alternative lengthening of telomeres in cancer confers a vulnerability to reactivation of p53 function[J].Cancer Res,2022,82(18):3345-3358.
[16]Stilp AC,Scherer M,Knig P,et al.The chromatin remodeling protein ATRX positively regulates IRF3-dependent type I interferon production and interferon-induced gene expression[J].PLoS Pathog,2022,18(8):e1010748.
[17]Lovejoy CA,Takai K,Huh MS,et al.ATRX affects the repair of telomeric DSBs by promoting cohesion and a DAXX-dependent activity[J].PLoS Biol,2020,18(1):e3000594.
[18]Han MQ,Napier CE,Frlich S,et al.Synthetic lethality of cytolytic HSV-1 in cancer cells with ATRX and PML deficiency[J].J Cell Sci,2019,132(5):jcs222349.
[19]Liebl MC,Hofmann TG.Regulating the p53 tumor suppressor network at PML biomolecular condensates[J].Cancers(Basel),2022,14(19):4549.
[20]Wang YX,Yang J,Wild AT,et al.G-quadruplex DNA drives genomic instability and represents a targetable molecular abnormality in ATRX-deficient malignant glioma[J].Nat Commun,2019,10(1):943.
[21]許金金,耿良元,刘翔,等.AEG-1与P53、Ki67在胶质瘤中表达的相关性及临床意义[J].临床神经外科杂志,2017,14(5):331-334.
[22]Sonoda Y,Yokoo H,Tanaka S,et al.Practical procedures for the integrated diagnosis of astrocytic and oligodendroglial tumors[J].Brain Tumor Pathol,2019,36(2):56-62.
[23]Andrews C,Prayson RA.1p/19q co-deleted fibrillary astrocytomas:not everything that is co-deleted is an oligodendroglioma[J].Ann Diagn Pathol,2020,46:151519.
[24]Jean-Quartier C,Jeanquartier F,Ridvan A,et al.Mutation-based clustering and classification analysis reveals distinctive age groups and age-related biomarkers for glioma[J].BMC Med Inform Decis Mak,2021,21(1):77.
[25]Scarpelli DB,Jaboin JJ.Exploring the role of resection post-radiation therapy in gliomas[J].Int J Radiat Oncol Biol Phys,2022,113(1):11.
[26]Mladenovsk M,Valkov I,Ovcharov M,et al.High grade glioma surgery-clinical aspects and prognosis[J].Folia Med (Plovdiv),2021,63(1):35-41.
[27]He KS,Chi CW,Li DL,et al.Resection and survival data from a clinical trial of glioblastoma multiforme-specific IRDye800-BBN fluorescence-guided surgery[J].Bioeng Transl Med,2020,6(1):e10182.
[28]江涛,晋强,张忠,等.1 828例成人初发大脑半球胶质瘤患者的预后影响因素分析及术后长期随访研究[J].中华神经外科杂志,2020,36(7):706-711.
[29]Laviv Y.Diffuse low grade glioma:personalized adaptation of surgical resection in an era of targeted oncological therapy[J].Harefuah,2019,158(9):601-606.
(收稿2021-07-09 修回2022-01-24)