一种新型快速检测冰冻免疫组织化学的染色方法
刘青清 梁青春 欧阳若芸
摘 要:目的 术中快速病理诊断是目前重要的辅助诊断手段之一,有助于外科医生实施更精准的手术治疗方案。术中快速病理常常基于冰冻标本完成并且需要高效的染色、检测流程。本研究旨在开发一项耗时短、效率相对更高的新型冰冻免疫组织化学的染色方法。方法 通过对比观察初步验证冰冻免疫组织化学的染色可行性以及有效性,进一步在不同类型的冰冻切片中对多种标志物进行染色从而观察染色效果。结果 冰冻免疫组织化学在手术切除标本中初步表现出较好的染色效果,同时能在较短的时间内完成;部分通过苏木精-伊红(hematoxylin-eosin,HE)染色无法较好鉴别诊断的手术标本通过冰冻免疫组织化学能进一步判断特异性标志物的表达水平,从而明确病灶性质。结论 本研究提出的新型染色方法能够对术中冰冻标本切片进行较好的染色,这为术中判断病变性质、肿瘤类型、病变的边界提供了较大的帮助,从而优化患者的个体诊疗。
关键词:快速免疫组织化学;冰冻切片标本;术中病理诊断
中图分类号:R446.8
文献标志码:A
A novel rapid immunohistochemical staining method on frozen sections
LIU Qingqing LIANG Qingchun OUYANG Ruoyun
(1. Department of Pulmonary and Critical Care Medicine, The Second Xiangya Hospital, Central South University, Changsha 410011, China; 2. Research Unit of Respiratory Disease, Central South University, Changsha 410011, China; 3. Treatment Center of Respiratory Disease, Changsha 410011, China;
4. Department of Pathology, The Second Xiangya Hospital, Central South University,Changsha 410011, China)
Abstract: Objective The rapid and accurate pathological diagnoses have been considered as a significant assistance intraoperatively which will lead to more precise surgical decisions. These diagnoses mainly base on rapid staining procedures of frozen sections. This study aims to develop a novel and efficient method, which is time-consuming and relatively more efficient. Methods The application and efficacy of this method was explored by comparison; furthermore, the performance of this method was observed on different slices originating from frozen surgical samples by staining several biomarkers. Result The incipient performance of the immunohistochemical staining on frozen slices was good and was accomplished within a short time. Some surgical samples which were difficult to be differentiated by HE staining were determined the expression levels of the specific biomarkers through frozen immunohistochemistry, thereby clarifying the lesion property. Conclusion The novel immunostaining method proposed in this study, can penform better staining on frozen slices, which provide assistance in identifing malignancies, the type of the tumors, and their margins, therehy optimizing individualized treatments.
Key words: rapid immunostaining; frozen section; intraoperative pathological diagnosis
術中病理诊断对手术术式可能产生较大影响,因此在外科手术中具有重要地位。准确并且高效的术中病理诊断方法是研究重点之一。目前临床广泛应用的传统免疫组织化学(immunohistochemistry,IHC)技术已经拥有成熟的方法和流程,可通过对特定的生物标志物染色从而判断病变的良恶性、边界以及肿瘤种类,但术中获取的冰冻标本切片无法通过传统技术进行有效地染色分析。同时,包括标本固定、抗原修复、抗体等多方面原因均能对染色结果产生明显的影响[1]。
IHC技术通过检测生物标志物表达水平辅助病理诊断。细胞角蛋白(cytokeratin,CK)是细胞骨架中间纤维的组成成分,以往常常用于乳腺癌的诊断[2-3]。不同类型的CK在乳腺癌类型鉴别中具有重要的作用。甲状腺转录因子1(thyroid transcription factor-1,TTF-1)蛋白调节甲状腺功能并且在不同类型甲状腺癌中有不同程度的表达[4-5],此外CK19在甲状腺恶性肿瘤中特异性表达[5]。
本研究旨在开发出一种新型的基于冰冻标本切片进行快速IHC的检测方法,为辅助术中快速病理诊断提供依据。
1 材料与方法
1.1 标本来源、手术标本的处理
选择来自2017年12月至2023年3月中南大学湘雅二医院外科手术标本。所有标本均进行了术中快速病理检测以及后续传统IHC染色。手术获取的同一大体标本均分为不同组织块进行石蜡包埋或冰冻处理。冰冻标本在-80 ℃条件下进行初步冻存,依不同的组织类型在-25 ℃~-16 ℃条件下完成冰冻切片,切片厚度为5~8 μm。获得冰冻切片后立即开始染色处理流程。石蜡组织块切片进行苏木精-伊红(hematoxylin-eosin,HE)染色后初步对细胞形态进行判断,并且进行IHC染色,冰冻组织切片经染色用于评估其染色效果。
1.2 石蜡组织块制作与传统IHC染色
从术中标本中切除相应部分于10%的多聚甲醛中固定,包埋后进行常规石蜡切片以及HE染色和IHC学染色。
1.3 快速冰冻IHC染色
冰冻IHC步骤描述如下:获取冰冻组织标本切片后立即浸入固定液固定30~60 s,流水下冲洗后使用IHC笔圈出组织范围随后滴加封闭剂;封闭约30 s后再次清洗滴加一抗,孵育约3~4 min,清洗后滴加二抗,孵育4 min后清洗玻片;滴加含二氨基联苯胺的显色液进行显色,显色后立即清洗,滴加苏木素孵育15~20 s并清洗后封片,最后于显微镜下观察判断。冰冻切片全程处理流程耗时约15 min。冰冻IHC染色使用的一抗包括:广谱CK抗体(AE1/AE3,鼠单抗)、 CK5/6(C6H1/C1C8,鼠单抗)、TTF-1(C7H7,鼠单抗)、CK19(A53-B/A2.26,鼠单抗)。所有试剂和抗体均由赛诺特生物技术(苏州)有限公司提供。
1.4 数据收集和分析
所有切片判读均由两位病理科医生独立完成。其中一位基于石蜡切片的HE染色进行形态学诊断,通过传统IHC方法对不同瘤种特异性生物标志物进行染色判读作为后续“金标准”对照,另一位完成冰冻IHC染色操作并且对结果进行判读。
2 结果
2.1 冰冻IHC有效性的初步验证
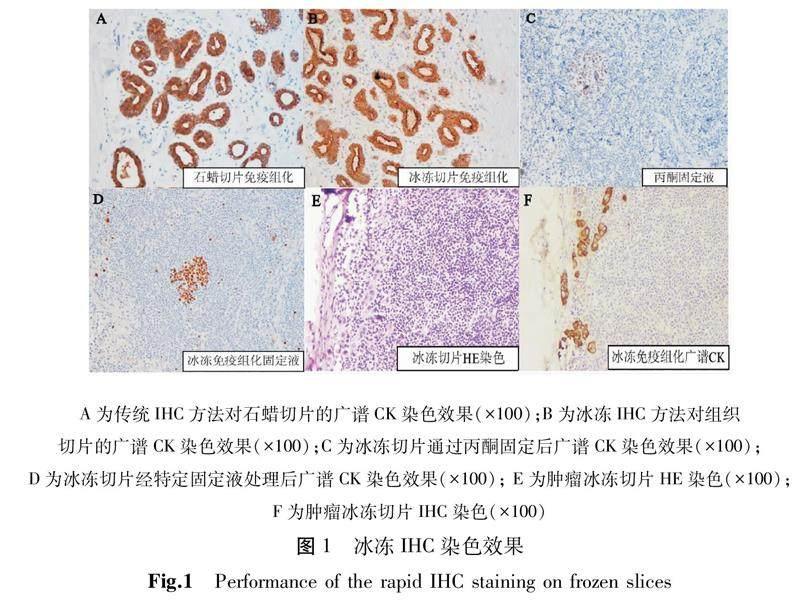
在同一组织标本上,冰冻IHC对于阳性表达的标志物染色效果(图1B)接近于传统IHC染色(图1A)。在淋巴结组织中,相较于丙酮固定标本(图1C),使用冰冻IHC配套固定液染色效果有所改善(图1D)。冰冻切片HE染色对乳腺癌微小病灶范围判断较为困难(图1E),同一标本进行广谱CK IHC染色能快速区分肿瘤病灶以及邻近正常组织(图1F)。
2.2 冰冻IHC对良恶性病变的鉴别诊断作用
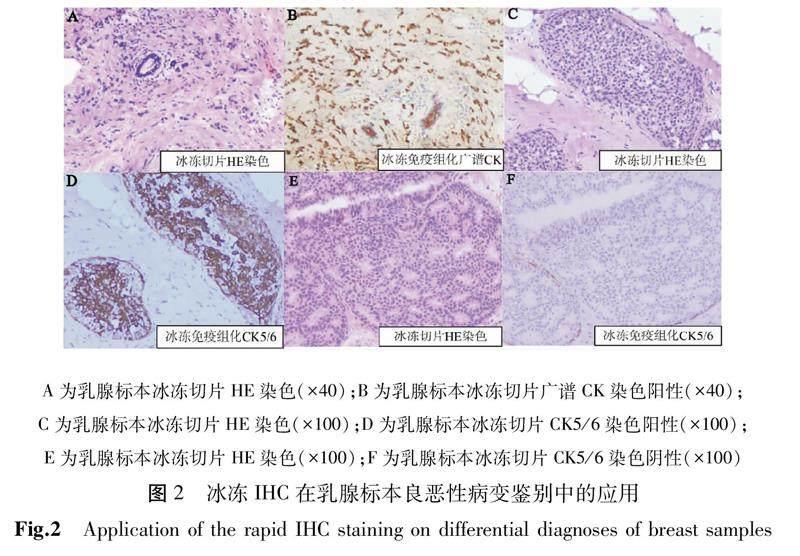
手术切除的乳腺来源标本:1例进行冰冻切片HE染色镜下所见病灶内细胞体积较小无法与炎性病变完全区分(图2A),加做广谱CK冰冻IHC后该蛋白表达阳性提示病变性质为恶性并且镜下能更好观察肿瘤细胞侵及范围(图2B)。另外1例冰冻切片HE染色见乳腺上皮实性、筛状增生,与低级别导管内癌无法鉴别(图2C),加做CK5/6冰冻IHC表现为马赛克样阳性(图2D),提示病变为乳腺导管上皮普通型增生;第3例冰冻切片HE染色亦可见乳腺上皮实性、筛状增生(图2E),而CK5/6冰冻IHC结果为阴性(图2F),提示病变为低级别导管内癌。
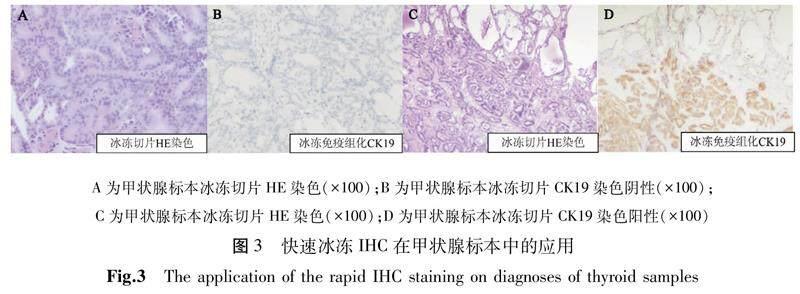
手术切除的甲状腺来源标本:冰冻切片HE染色镜下表现为乳头状增生可能(图3A、3C),通过CK19冰冻IHC染色判读其中1例为阴性,考虑为良性乳头状增生(图3B),另一例表达为阳性,考虑为甲状腺癌(图3D)。
A为传统IHC方法对石蜡切片的广谱CK染色效果(×100);B为冰冻IHC方法对组织切片的广谱CK染色效果(×100);C为冰冻切片通过丙酮固定后广谱CK染色效果(×100);D为冰冻切片经特定固定液处理后广谱CK染色效果(×100); E为肿瘤冰冻切片HE染色(×100);F为肿瘤冰冻切片IHC染色(×100)
2.3 冰冻IHC对手术切除标本来源的辅助诊断
术中切除甲状腺后方肿块标本:组织来源不明,冰冻切片HE染色镜下组织特点缺乏特异性(图4A),通过冰冻IHC染色提示甲状旁腺素表达阳性(图4B),并且TTF-1表达阴性(图4C),排除肿块为甲状腺来源可能。
3 讨论
外科手术切除标本经冰冻处理后应用于快速病理诊断,基于冰冻标本的正确判识对手术决策具有关键性的作用,然而,常规IHC染色步骤应用于冰冻切片时常伴随细胞组织正常结构破坏、靶蛋白不显色等问题[6-7],以往研究直接对冰冻切片进行IHC染色效果欠佳且耗时较长。本研究建立一套基于冰冻切片的IHC染色方法,用于术中快速病理分型以及病灶识别,该方法使用了改良的固定液和清洗液使得切片中靶蛋白更易显色,具有高效的特点。
相对于冰冻切片HE染色形态学特征,CK蛋白及其家族成员蛋白表达水平在肿瘤淋巴结转移、原位癌的识别中具有重要意义[8-9]。乳腺手术切除标本是病理诊断的主要来源之一,但因为冰冻切片存在细胞肿胀以及冷冻结晶等问题使得直接进行IHC染色效果欠佳,同时术中快速IHC染色需要在有限的时间内完成[10],因此,本研究建立了一套有效的冰冻IHC染色方法并且初步探讨了其应用效果。CK家族蛋白表达水平可在一定程度上预示乳腺癌的预后[11],这提示广谱CK IHC染色结果可能对肿瘤个体化治疗产生影响。此外,术中淋巴结病理诊断尤其是前哨淋巴结的判断对乳腺癌患者的分期以及后续治疗有决定性作用[12],CK家族蛋白表达水平同样能够辅助更加准确判断淋巴结是否被乳腺肿瘤细胞浸润[13],在将来的研究中應当纳入更多淋巴结标本验证该方法的诊断效力。CK家族另一成员CK19在甲状腺肿瘤中表达明显升高[14-15],CK19阳性表达联合镜下组织特点能进一步提高甲状腺癌诊断率[16]。不仅如此,既往研究提出CK19蛋白水平可能与甲状腺癌类型以及是否复发相关[17-18],该研究还对甲状腺来源组织中的CK19进行了检测,结果提示该方法较好地评估了CK19的水平从而辅助判断病变性质。TTF-1蛋白是一种转录调控因子,对多种器官的发育具有关键意义[19],TTF-1敲除的个体中甲状腺的形成受到了严重影响[20]。TTF-1被证实在甲状腺滤泡中表达[21],本研究对甲状腺后方切除的肿块进行了TTF-1的冰冻IHC染色,结合其他标志物更有助于明确肿块的组织来源。
總之,冰冻IHC技术能够对手术标本进行更精准的病理诊断,从而实现患者个体化诊疗的提升。本研究提出的针对冰冻切片的新型IHC染色方法,能够对选定的标志物进行较好的染色。但仅限于小样本中,未来应当纳入更多临床标本进行检测并且与传统IHC方法对比,进一步验证其特异性和敏感性,同时研发出更多抗体以拓宽临床应用。
参考文献:
[1]DANESHTALAB N, DOR J J, SMEDA J S. Troubleshooting tissue specificity and antibody selection: procedures in immunohistochemical studies[J]. Journal of Pharmacological and Toxicological Methods, 2010, 61(2): 127-135.
[2]TRASK D K, BAND V, ZAJCHOWSKI D A, et al. Keratins as markers that distinguish normal and tumor-derived mammary epithelial cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(6): 2319-2323.
[3]VORA H H, PATEL N A, RAJVIK K N, et al. Cytokeratin and vimentin expression in breast cancer[J]. International Journal of Biological Markers, 2009, 24(1): 38-46.
[4]ORDEZ N G. Thyroid transcription factor-1 is a marker of lung and thyroid carcinomas[J]. Advances In Anatomic Pathology, 2000, 7(2): 123-127.
[5]BEJARANO P A, NIKIFOROV Y E, SWENSON E S, et al. Thyroid transcription factor-1, thyroglobulin, cytokeratin 7, and cytokeratin 20 in thyroid neoplasms[J]. Applied Immunohistochemistry & Molecular Morphology, 2000, 8(3): 189-194.
[6]PREETI A, SAMEER G, KULRANJAN S, et al. Intra-operative frozen sections: experience at A tertiary care centre[J]. Asian Pacific Journal of Cancer Prevention, 2016, 17(12): 5057-5061.
[7]JAAFAR H. Intra-operative frozen section consultation: concepts, applications and limitations[J]. The Malaysian Journal of Medical Sciences, 2006, 13(1): 4-12.
[8]PEREZ A A, ROCHA R M, BALABRAM D, et al. Immunohistochemical profile of high-grade ductal carcinoma in situ of the breast[J]. Clinics (Sao Paulo), 2013, 68(5): 674-678.
[9]DABBS D J, CHIVUKULA M, CARTER G, et al. Basal phenotype of ductal carcinoma in situ: recognition and immunohistologic profile[J]. Modern Pathology, 2006, 19(11): 1506-1511.
[10]LIU M, ZHAO S Q, YANG L, et al. A direct immunohistochemistry (IHC) method improves the intraoperative diagnosis of breast papillary lesions including breast cancer[J]. Discovery Medicine, 2019, 28(151): 29-37.
[11]VRANES V, VUJASINOVIC' T, RAJKOVIC' N, et al. Analysis of spatial distribution and prognostic value of different pan cytokeratin immunostaining intensities in breast tumor tissue sections[J]. International Journal of Molecular Sciences, 2020, 21(12): 4434.
[12]HARRISON B. Update on sentinel node pathology in breast cancer[J]. Seminars in Diagnostic Pathology, 2022, 39(5): 355-366.
[13]SUN X, ZHANG Y, WU S, et al. Intra-operative molecular diagnosis of sentinel lymph node and prediction of non-sentinel lymph node metastasis in breast cancer patients[J]. Chinese Medical Journal, 2020, 133(2): 237-239.
[14]IDOWU S A, OLANIYI O O, OLUWOLE K A. Cytokeratin 19 (CK19) expression by thyroid neoplasms in a Nigerian tertiary health centre[J]. The Pan African Medical Journal, 2023, 44: 176.
[15]ELSERS D, HUSSEIN M, OSMAN M, et al. Challenge in the pathological diagnosis of the follicular-patterned thyroid lesions[J]. Asian Pacific Journal of Cancer Prevention, 2021, 22(10): 3365-3376.
[16]DOMAGALA P, DOMAGALA W. Nuclear CK19-immunopositive pseudoinclusions as a new additional objective diagnostic feature of papillary thyroid carcinoma[J]. Polish Journal of Pathology, 2020, 71(1): 1-6.
[17]WA KAMMAL W S, YAHAYA A, SHAH S A, et al. The diagnostic utility of cytokeratin 19 in differentiating malignant from benign thyroid lesions[J]. Malaysian Journal of Pathology 2019, 41(3): 293-301.
[18]VIANA A O R, GONALVES FILHO J, FRANCISCO A L N, et al. Ki-67 and CK-19 are predictors of locoregional recurrence in papillary thyroid carcinoma[J]. Acta Otorhinolaryngologica Italica, 2020, 40(3): 190-197.
[19]MIO C, BALDAN F, DAMANTE G. NK2 homeobox gene cluster: functions and roles in human diseases[J]. Genes & Diseases, 2023, 10(5): 2038-2048.
[20]LPEZ-MRQUEZ A, CARRASCO-L?PEZ C, FERNNDEZ-MNDEZ C, et al. Unraveling the complex interplay between transcription factors and signaling molecules in thyroid differentiation and function, from embryos to adults[J]. Frontiers in Endocrinology (Lausanne), 2021, 12: 654569.
[21]GUAN L, ZHAO X, TANG L, et al. Thyroid transcription factor-1: structure, expression, function and its relationship with disease[J]. BioMed Research International, 2021, 2021: 1-10.

