猪圆环病毒3 型TB Green Ⅱ实时荧光定量PCR 检测方法的建立和应用
李 鹏,孙延举,王寅彪,金前跃,梁晓晓,银 梅,王选年,刘兴友,王利平
(1.新乡学院 生命科学与基础医学学院,河南 新乡 453003;2.河南科技学院 动物科技学院,河南 新乡 453003;3.新乡医学院 公共卫生学院,河南 新乡 453003;4.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;5.河南农业大学 动物科技学院,河南 郑州 450002)
猪圆环病毒3 型(Porcine circovirus 3,PCV3)是一种单链环状DNA 病毒,基因组全长约2 000 bp,与 PCV1、PCV2、PCV4 同 属 环 状 病 毒 科(Circoviridae)环状病毒属(Circovirus)[1-2]。PCV3 有3个主要开放阅读框(Open reading frame,ORF),分别为与病毒复制相关的ORF1、编码衣壳蛋白的ORF2 和逃避宿主天然免疫反应相关的ORF3[3-4]。该病毒已在世界范围内广泛传播,美洲、欧洲和亚洲的数十个国家和地区报道在猪群中检测到PCV3存在[5]。国内学者通过流行病学调查发现,已有近30省市检测到PCV3的流行[6-7]。该病毒可引起猪的皮炎和肾病综合征、心脏和多系统炎症、母猪繁殖障碍等猪圆环病毒相关疾病(Porcine circovirus associated diseases,PCVAD)[8]。前人研究结果显示,PCV3 常与PCV2、猪繁殖和呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)等混合感染[9-11]。还有报道指出,感染PCV3 的猪可能不表现出任何临床体征[12]。混合感染和潜伏感染使得PCV3 临床诊断难度提高,无法准确制定防治策略,对养猪业的发展造成不利影响。因此,需要建立一种快速、灵敏、特异的PCV3检测方法。
目前,主要通过病毒接种细胞进行PCV3 分离培养,利用免疫学的方法对其诊断和病原学研究。陈秋艳等[13]分别以PCV3 猪阳性血清和PCV3 核衣壳蛋白(Cap)的小鼠多克隆抗体作为免疫荧光检测法(IFA)的一抗,羊抗猪或羊抗鼠FITC-IgG 作为二抗,分析PK-15 细胞在接种病毒后的病毒增殖情况,通过IFA检测方法,证实PCV3可以在PK15细胞中增殖;并在电子显微镜下观察到病毒粒子,对其进行鉴定。现今尚无用于检测PCV3 的国家标准,仅山东省兽医协会和中国兽医协会在2020 年分别发布了PCV3 常规PCR 检测方法和基于TaqMan 探针的实时荧光定量(qPCR)检测方法。TB Green 是荧光定量PCR常用的荧光指示染料,与DNA双链结合后可发出荧光信号,同常规PCR 相比灵敏度更高,操作更加便捷,与TaqMan 法相比无需设计探针,检测成本相对更低[14]。
由于PCV3 与PCV1、PCV2 基因同源性较高,通过比对PCV1、PCV2 与PCV3 全基因组序列,确定PCV3 特异性保守区域,设计针对PCV3 的特异性引物,以建立PCV3 TB Green ⅡqPCR 检测方法,旨在为PCV3 的鉴别诊断和早期防控提供快速、可靠的方法。
1 材料和方法
1.1 病料
猪瘟病毒(CSFV)、PRRSV、PPV、PCV2 和PCV3阳性病料均由新乡学院动物疫病分子诊断河南省工程实验室保存提供。待检的132 临床样品为2021年1月—2022年1月采集自新乡周边猪场的疑似CSFV、PCV2、PRRSV 等感染发病猪脾脏、淋巴结等组织样品,-20 ℃冰箱保存。
1.2 主要试剂
胶回收试剂盒、质粒提取试剂盒购自OMEGA公司;PremixTaq酶、DL2000 DNA Marker、Goldview核酸染料、pMD19-T载体、E.coliDH5α感受态细胞、TB Green ⅡqPCR 试剂、病毒核酸提取试剂盒均购自TaKaRa公司。
1.3 主要仪器
荧光定量PCR 仪(Q5)、梯度PCR 仪、离心机购自Thermo公司;凝胶成像系统购自Protein Simple公司;凝胶电泳仪购自北京六一仪器厂。
1.4 引物设计与合成
从GenBank 上获得国内外PCV3 流行株的全基因组序列(登录号:MG778698.1),使用DNAMAN 软件进行序列比对,确定高度特异且保守区域,利用Primer 5.0 软件针对其设计1 对特异性引物PCV3-R-F(5′-TGCTACGAGTGTCCTGAAGA-3′)、PCV3-R-R(5′-CAATAGATTCCCACTCGGTC-3′),预期扩增产物大小为125 bp,引物由生工生物工程(上海)股份有限公司合成。
1.5 病毒基因组核酸的提取
取适量有疑似PCV3 临床症状的淋巴结样品,加入1mL PBS 研磨,反复冻融3 次,按照TaKaRa 公司的病毒RNA/DNA 快速纯化试剂盒操作说明提取病毒DNA,于-80 ℃保存备用。
1.6 PCV3标准质粒的制备
以提取的疑似PCV3 临床症状淋巴结DNA 为模板,使用引物PCV3-R-F 和PCV3-R-R 进行PCR扩增,将扩增片段回收纯化后连接到pMD19-T 载体,转化到E.coliDH5α 感受态细胞,涂布于含Amp+的LB 固体培养基,37 ℃过夜培养。经菌液PCR 鉴定后,使用质粒提取试剂盒提取质粒,并进行双酶切和测序鉴定。使用微量分光光度计测定标准质粒的质量浓度,计算拷贝数,作为阳性标准品。
1.7 标准曲线的建立
参考TB Green Premix ExTaqⅡ试剂盒的操作说 明,扩 增 体 系:2×TB Green Premix ExTaqⅡ10 μL,PCV3-R-F(10 μmol/L)0.5 μL,PCV3-R-R(10 μmol/L)0.5 μL,ROX 0.4 μL,模板DNA 1 μL,补加无菌水至20 μL。选取4.74×102—4.74×107拷贝/μL的PCV3标准质粒作为模板,每个浓度设置3个重复进行qPCR 试验。反应条件:95 ℃预变性30 s;95 ℃变性5 s,64 ℃退火延伸30 s,40 个循环。依据反应结果,建立PCV3 TB Green ⅡqPCR 检测方法的标准曲线。
1.8 特异性试验
按照1.7 中的反应体系和反应程序,使用引物PCV3-R-F 和PCV3-R-R 对CSFV、PRRSV、PPV、PCV2、PCV3 DNA 或cDNA 以及ddH2O 进行PCR 扩增,以确定建立的PCV3 TB Green ⅡqPCR 检测方法的特异性。
1.9 敏感性试验
以10 倍梯度稀释101—109拷贝/μL 的PCV3 标准质粒为模板,按照1.7 中的反应体系和反应程序,使用引物PCV3-R-F 和PCV3-R-R 对建立的PCV3 TB Green ⅡqPCR 检测方法进行敏感性试验,并与PCV3常规PCR方法比对。
1.10 重复性试验
分别选取4.74×104、4.74×105、4.74×106拷贝/μL的PCV3 标准质粒作为模板,进行组间和组内重复性试验,各做3 组重复。根据每个样品组间或组内的平均Ct值及变异系数进行重复性判定。
1.11 临床样品检测
使用建立的PCV3 TB Green ⅡqPCR 检测方法,对收集的132 份临床样品进行PCV3 病原检测,同时设置阴性对照(H2O)和阳性对照(标准质粒)。根据陈秋艳等[13]分离PCV3 的方法,将PCV3 常规PCR检测呈阴性、PCV3 TB Green ⅡqPCR检测呈阳性的样品接种PK15 细胞,待病毒增殖72 h 后,收获病毒液,反复冻融3次后,提取病毒DNA,进行PCV3常规PCR 扩增,验证PCV3 TB Green ⅡqPCR 检测方法的准确性。
2 结果与分析
2.1 PCV3标准质粒构建
以PCV3 DNA 为模板,使用引物PCV3-R-F 和PCV3-R-R 进行PCR 扩增,琼脂糖凝胶电泳结果显示,有125 bp 的目的条带(图1),符合预期,双酶切结果如图2所示。测序结果显示,扩增产物同PCV3的同源性为100%。对鉴定正确的PCV3 标准质粒,使用超微量分光光度计测得质量浓度为146.4 ng/μL,换算成拷贝数为4.74×1010拷贝/μL,按1∶10的比例稀释后作为标准质粒。

图2 PCV3标准质粒的双酶切鉴定Fig.2 Identification of PCV3 standard plasmid by double digestion
2.2 PCV3 TB Green ⅡqPCR标准曲线建立
选取4.74×107—4.74×102拷贝/μL 的PCV3 标准质粒作为模板,采用1.7中的反应体系和反应程序建立标准曲线,表达式为y=-3.134 lgx+ 34.772,其中R2=0.999,扩增效率为108.5%(图3)。各梯度样品的扩增曲线间距相当,且呈现出典型的S形(图4)。
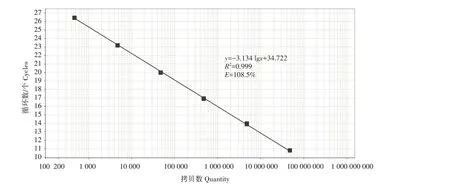
图3 PCV3标准质粒TB Green ⅡqPCR标准曲线Fig.3 TB Green ⅡqPCR standard curve of PCV3 standard plasmid
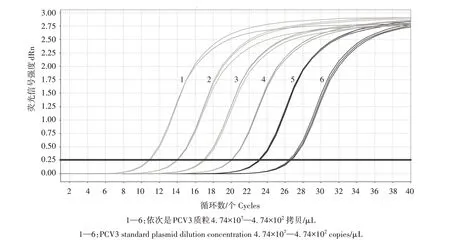
图4 PCV3标准质粒TB Green ⅡqPCR扩增曲线Fig.4 TB Green ⅡqPCR amplification curve of PCV3 standard plasmid
2.3 PCV3 TB Green ⅡqPCR特异性试验结果
以CSFV、PRRSV、PPV、PCV2、PCV3 DNA 或cDNA以及ddH2O为模板,采用TB Green ⅡqPCR方法进行检测。结果显示,仅有PCV3 出现阳性扩增,其余样品均无扩增曲线出现,表明建立的PCV3 TB Green ⅡqPCR检测方法具有良好的特异性(图5)。

图5 PCV3 TB Green ⅡqPCR特异性试验结果Fig.5 TB Green ⅡqPCR specificity test results of PCV3
2.4 PCV3 TB Green ⅡqPCR敏感性试验结果
从图6 可以看出,构建的PCV3 TB Green ⅡqPCR 检出限可低至10 拷贝/μL,PCV3 常规PCR 最低检出限为104拷贝/μL(图7),证明建立的PCV3 TB Green ⅡqPCR方法具有良好的敏感性。
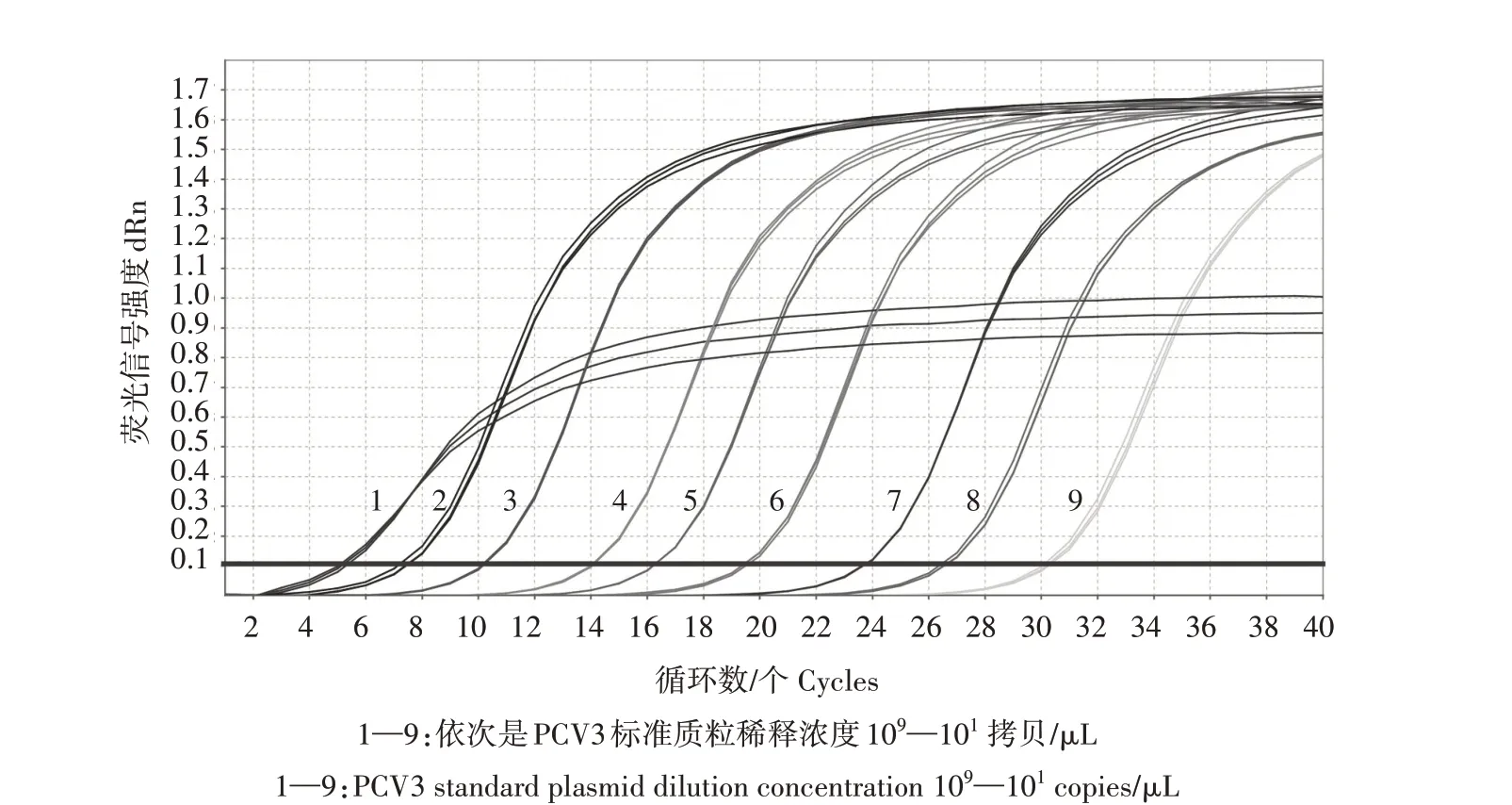
图6 PCV3 TB Green ⅡqPCR敏感性试验结果Fig.6 TB Green ⅡqPCR susceptibility test results of PCV3

图7 PCV3常规PCR敏感性试验结果Fig.7 Conventional PCR sensitivity test results of PCV3
2.5 PCV3 TB Green ⅡqPCR重复性试验结果
2.6 PCV3 TB Green ⅡqPCR对临床样品检测结果
采用建立的PCV3 TB Green ⅡqPCR 检测方法,对收集的132 份猪的临床病料组织样品进行PCV3 TB Green ⅡqPCR 检 测,同 时 和PCV3 常 规PCR 进行比较,检测结果见表2。结果显示,PCV3常规PCR 检测出阳性样品6 份,检出率为4.55%;PCV3 TB Green ⅡqPCR 检出阳性样品12 份,检出率为9.10%。经测序验证,均为PCV3 的基因组序列。表明建立的PCV3 TB Green ⅡqPCR 检测方法可有效检测临床样品中的PCV3。
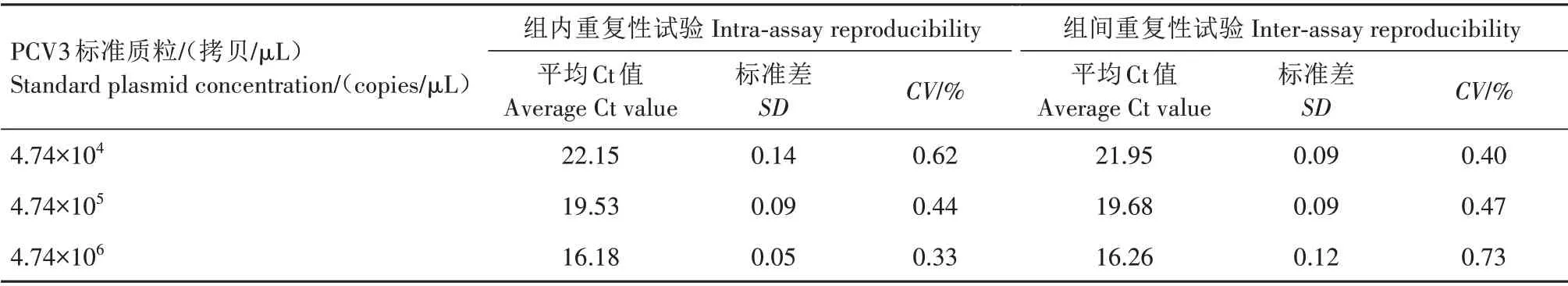
表1 PVC3 TB Green ⅡqPCR重复性试验结果Tab.1 TB Green ⅡqPCR repeatability test results of PCV3
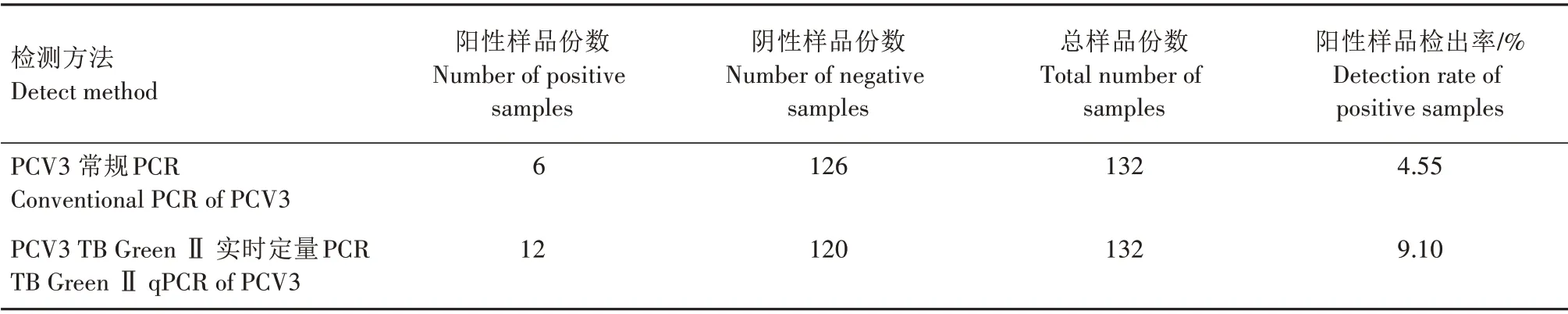
表2 PCV3临床样品TB Green ⅡqPCR方法和常规PCR方法检测结果Tab.2 Detection results of PCV3 clinical samples by TB Green ⅡqPCR method and conventional PCR method
2.7 PCV3接种PK15细胞病毒分离结果
将PCV3 常规PCR 检测阴性、PCV3 TB GreenⅡqPCR 检测阳性的样品,取20 mg 加入1 mL PBS研磨,反复冻融3 次后,12 000 r/min 离心,取上清,用0.22 μm 一次性滤器过滤,待PK-15 细胞长至单层后,接种到PK15细胞,待病毒增殖72 h,取出细胞培养瓶,反复冻融3 次,裂解细胞并12 000 r/min 离心收集细胞毒液。提取病毒DNA 进行PCV3 常规PCR 扩增,结果显示,经PCV3 常规PCR 未检出的临床样品,在接种PK15 细胞培养后,PCV3 常规PCR检测为阳性(图8)。

图8 PCV3接种PK15细胞PCR检测结果Fig.8 PCR detection results of PCV3 inoculated PK15 cells
3 结论与讨论
PCV3 是近年来新发现的一种病毒,自2016 年于美国发现PCV3 后,目前已在国内外广泛流行,由于尚无针对PCV3 的疫苗和药物,使该病的防控难以有效执行,造成严重的经济损失。PCV3 常混合感染其他病原,与多种疾病相关,如心脏和多系统炎症、皮炎和肾病综合征、繁殖障碍、呼吸道疾病和腹泻等,且偶有无症状感染猪出现,使临床确诊PCV3 难度增加,对全球养猪业构成严重威胁[15]。PCV3 除感染家猪外,还可在野猪、牛、驴等动物中传播,增加了PCV3 的临床诊断和防控难度[16-18]。基于PCV3 广泛流行的现状,考虑控制检测成本和便于批量检测,以在基层养殖场应用和推广,建立高效、特异、快速和经济有效的PCV3 检测方法至关重要。
qPCR 是检测病原体基因组DNA 的重要研究工具,可对动物体内的病原体做定量分析,为疾病诊断提供支持[19]。qPCR 依据荧光产生方式不同分为2 种类型,分别为以TaqMan 探针为主的探针法和使用TB Green 等荧光染料的染料法[20]。荧光染料可与DNA双链结合发出荧光信号,未结合双链的荧光染料无信号,并可通过设置熔解曲线判断扩增结果是否具有特异性[21]。与探针法qPCR 相比,基于TB Green 的qPCR 检测成本相对较低,可用于临床诊断和批量样品检测。目前,该方法已被广泛应用于多个领域,如YIN 等[22]建立了针对非洲猪瘟病毒A137R基因的SYBR Green ⅡqPCR 方法;KNIGHT等[23]针对可引起甜菜褐斑病的甜菜尾孢菌建立了探针法qPCR。
本研究对PCV1、PCV2、PCV3 全基因组序列进行比对,选取PCV3特异性保守区域设计qPCR 特异性引物,建立PCV3 TB Green ⅡqPCR 检测方法。建立的PCV3 TB Green ⅡqPCR 可特异性扩增PCV3,与引起PCV3 相似症状的猪群常见病原体均不产生交叉反应。该qPCR 检测方法的灵敏度可达10拷贝/μL,是PCV3常规PCR的1 000倍,同已报道的TaqMan 探针法qPCR[24](11.80 拷贝/μL)和SYBR Green Ⅰ染料法qPCR[25](42.40 拷贝/μL)相近,表明建立的qPCR 具有较高的灵敏度。在重复性试验中,组内和组间变异系数均小于1%。此外,在132份猪临床样品检测中,PCV3 TB Green ⅡqPCR的检出率(9.10%)高于PCV3常规PCR(4.55%)。
综上,本研究成功建立用于PCV3 检测的TB Green ⅡqPCR 方法。该方法敏感性高,特异性好,可为PCV3 的实验室诊断、流行病学监测和防疫措施的制定提供技术支持。

