短小芽孢杆菌过渡态调节因子AbrB的功能特征
李 茜,徐云帆,张长斌,覃 佳,黄 宇,汤必聪,王海燕
(四川大学生命科学学院生物资源与生态环境教育部重点实验室,成都 610065)
【研究意义】短小芽孢杆菌是一种可形成内生孢子的土壤细菌,能够产生多种胞外蛋白质,例如碱性蛋白酶[1]、脂肪酶[2]和漆酶[3]等,其中碱性蛋白酶已经应用于化学、洗涤业以及制革工业[4]。此外,短小芽孢杆菌天然存在于植物根系,由于能够分泌几丁质酶[5]以及具有抗菌活性的抗菌肽[6]、表面活性素[7]等次级代谢物质,可以作为生防菌对某些作物病菌产生拮抗作用。短小芽孢杆菌重要胞外酶及代谢物通常在特定生长阶段产生,代谢过程受到一系列调控因子直接或间接调控。因此,对胞外酶及代谢物合成代谢研究有助于促进短小芽孢杆菌在工业和生物防治方面的应用。【前人研究进展】在模式生物枯草芽孢杆菌中,控制生长期依赖性基因表达的调节蛋白被称为“过渡态调节因子(Transition state regulators)”。AbrB是其中重要一员,它调节细菌从生长活跃期到稳定期的转变。AbrB从细菌生长停滞期开始到对数期阶段被大量合成,当生长进入稳定期时,其表达水平下降。AbrB在细菌对数生长期的高表达,可以阻止部分特异性基因在稳定期过早表达,包括参与芽孢形成、降解酶合成、氨基酸利用和抗生素生成的基因[8]。在枯草芽孢杆菌中的研究表明,AbrB可以直接调节100多个基因的转录并间接影响数百个基因的表达[9]。值得注意的是,尽管AbrB可以调控大量基因的表达,但它似乎并没有可识别的共有DNA序列[10]。研究人员已经在枯草芽孢杆菌、解淀粉芽孢杆菌、地衣芽孢杆菌和炭疽芽孢杆菌等芽孢杆菌中构建了abrB基因突变菌株,研究表明,AbrB对次级代谢物产生及生物防治效应等方面具有重要的影响[11-15]。AbrB是一类高度保守的蛋白质,在NCBI中查询短小芽孢杆菌abrB基因,发现其核苷酸序列与枯草芽孢杆菌的相似性为84.88%,氨基酸序列相似性为93.75%,差异氨基酸全部位于蛋白质的C-端,一般认为不同菌种间C-端差异性可能与AbrB物种特异性的功能有关[10]。【本研究切入点】AbrB在短小芽孢杆菌中参与调节的生物学功能并不十分清楚。短小芽孢杆菌(B.pumilus)SCU11是生物资源与生态环境教育部重点实验室从野生型菌株BA06经过紫外线、亚硝基胍及60Co辐照等方法复合诱变得到的一株高产碱性蛋白酶的菌株,其在生物制革领域有很好的应用前景[16]。【拟解决的关键问题】为便于对短小芽孢杆菌(B.pumilus)SCU11菌株进行遗传改造,遗传学课题组成员前期在SCU11的基础上构建了尿嘧啶磷酸核糖转移酶(Uracil phosphoribosyl transferase,UPRT)基因敲除菌株SCU12[17],结合反向筛选标记可以实现对其基因组的连续无痕改造。为研究短小芽孢杆菌AbrB如何影响其生理功能,特别是胞外蛋白酶的产生,本研究拟构建abrB基因无痕敲除突变株并进行相关功能分析。
1 材料与方法
1.1 菌株、质粒与引物
本研究中使用的菌株和质粒如表1所示,所用引物根据短小芽孢杆菌SCU11基因组设计如表2所示。

表1 本研究所用的菌株和质粒Table 1 Strains and plasmids used in the study
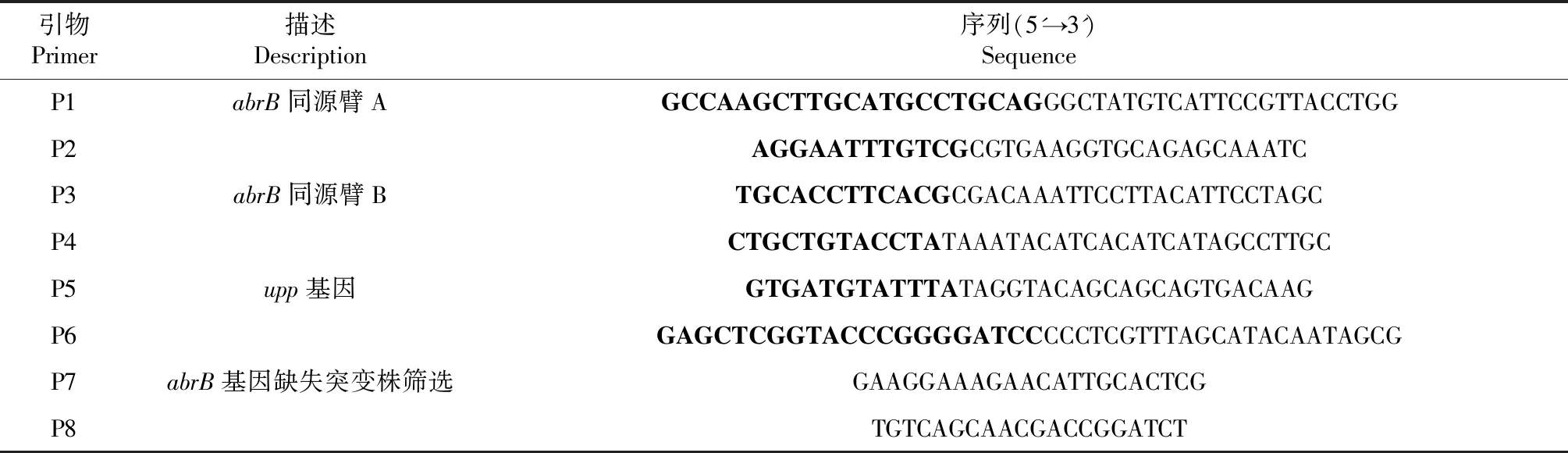
表2 本研究所用的引物Table 2 Primers used in the study
1.2 主要酶及试剂
Taq DNA聚合酶、Prime Star MAX高保真DNA聚合酶、多片段克隆连接InFusion®HD Cloning Kit、T4 DNA ligase等购自TaKaRa(大连)公司;限制性内切酶购自Fermentas (Thermo)公司;胶回收和纯化试剂盒购自OMEGA公司;酪素购自Sigma公司;福林酚购自科伦公司;其余试剂均为国产分析纯试剂。
1.3 培养基制备
①M9基本培养基:Na2HPO417.096 g/L,KH2PO43 g/L,NaCl 0.5 g/L,NH4Cl 1 g/L,MgSO40.24 g/L,CaCl20.011 g/L,葡萄糖0.2%。②LB培养基:蛋白胨10 g/L,葡萄糖5 g/L,NaCl 10 g/L。③蛋白酶发酵培养基:黄豆粉20 g/L,麸皮25 g/L,酵母粉3 g/L,NaH2PO40.4 g/L,K2HPO44 g/L,CaCO33 g/L。④群集运动(Swarming motility)培养基:LB培养基中补加0.5%葡萄糖和0.6%琼脂粉。⑤泳动(Swimming motility)培养基:1%蛋白胨,0.25% NaCl和0.3%的琼脂粉。
1.4 敲除质粒的构建
以SCU12基因组DNA为模板,利用引物P1/P2、P3/P4、P5/P6分别扩增abrB基因两端同源臂和全长upp基因,通过重叠PCR将3片段连接获得具有反向筛选标记的敲除单元。采用BamHⅠ/PstⅠ双酶切pUCETs质粒使其线性化,最后使用In-Fusion®HD Cloning Kit将敲除单元与线性化质粒载体连接。连接产物转化大肠杆菌DH5ɑ,挑取转化子提质粒,经限制酶酶切初步验证正确后送公司测序,以确定abrB基因无痕敲除载体(pUCETs-ΔabrB)是否成功构建。
1.5 短小芽孢杆菌电转化
短小芽孢杆菌SCU12的电转化参考王超等[18]建立的高渗透压电转化方法,但将电压调整至2000~2200 V。
1.6 abrB基因敲除突变体筛选
敲除突变体的筛选分两步进行。第一步为单交换共整合重组子的筛选:挑取含有敲除载体的SCU12转化子菌落置于无抗的液体LB培养基中30 ℃过夜培养,按1%的接种量转种于新鲜的无抗LB培养液中,42 ℃培养12 h,重复2次。将稀释至合适浓度的菌液涂布于含有5 μg/mL红霉素LB平板上,42 ℃培养过夜。利用引物P7/P6筛选单交换共整合重组子。第二步为无痕敲除突变体的筛选:将第一步验证正确的共整合重组子菌落接种于无抗LB液体培养基中42 ℃过夜培养,将稀释至合适浓度的菌液涂于含有50 μg/mL 5-氟尿嘧啶(5-FU)的M9固体培养基上,并在42 ℃培养过夜。待菌落长至合适大小后挑取菌落点至红霉素平板并且影印于5-FU M9平板,挑取红霉素敏感且5-氟尿嘧啶抗性菌落,使用同源臂外侧引物P7/P8筛选无痕敲除突变菌株。
1.7 生长曲线绘制
菌株划线于相应抗性平板活化后,挑取单菌落接种于含有5 mL液体LB培养基的试管中37 ℃过夜培养。将菌液OD600 nm值调整为1.0,分别按照1%的接种量接种于含有25 mL LB或M9培养液的锥形瓶中,37 ℃、200 r/min培养,分别于3、6、9、12、24、36、48、60、72 h取样,稀释至合适浓度后,用紫外分光光度计测量在600 nm下的吸光值,将测量结果乘以稀释倍数得到实际吸光值,绘制菌株生长曲线。
1.8 菌落形态观察
菌液OD600 nm值调整为1.0,各取1 μL菌液点种于M9固体培养基置于37 ℃培养12 h,设置3个平行实验。观察菌落形态的差异并拍照记录。
1.9 生物膜形成的测定
菌液OD600 nm值调整为1.0,取1 μL菌液接种于含有5 mL液体LB培养液的6孔板中,37 ℃静置培养,设置3个平行实验。观察生物膜形成情况并拍照记录。
1.10 细菌运动性检测
菌液OD600 nm值调整为1.0,取1 μL菌液接种于同一运动性检测平板,37 ℃静置培养,设置3个平行实验。观察测量细菌扩散的直径并拍照记录。利用Swarming培养基检测细菌的群集运动能力,Swimming培养基检测细菌的泳动能力。
1.11 蛋白酶活性测定
菌液OD600 nm值调整为1.0,按照4%的接种量转种至含有50 mL蛋白酶发酵培养基的250 mL锥形瓶中,34 ℃、200 r/min培养,分别在36、48、54和72 h取样,13 000 r/min,4 ℃离心10 min,取上清测定蛋白酶活力,每个样品做3个重复,酶活力测定方法参照张长斌等[17]的方法。
2 结果与分析
2.1 AbrB氨基酸序列同源性分析
将短小芽孢杆菌中AbrB序列和其他芽孢杆菌中的序列进行比对,以分析序列保守性和同源性。由于短小芽孢杆菌SCU12由短小芽孢杆菌BA06诱导而来,2个菌株的AbrB序列相同(结果未显示),故此处直接用BA06中的AbrB序列进行分析。所有查找到的序列都编码94或96个氨基酸。由图1可知,多序列比对显示,AbrB和DNA互作的N-端高度保守,而C-端相对不保守。除了前2个预测的N-残基外,短小芽孢杆菌和枯草芽孢杆菌的AbrB序列有5个氨基酸的差别,而芽孢杆菌属AbrB序列差别集中在C-端的26个残基上。一些AbrB C-端结构域替换实验数据表明,部分AbrB残基影响了DNA结合的活性和多聚化功能。本研究推测短小芽孢杆菌AbrB的主要功能和枯草芽孢杆菌168中的类似,而C-端结构域的差别决定了AbrB的种特异性。
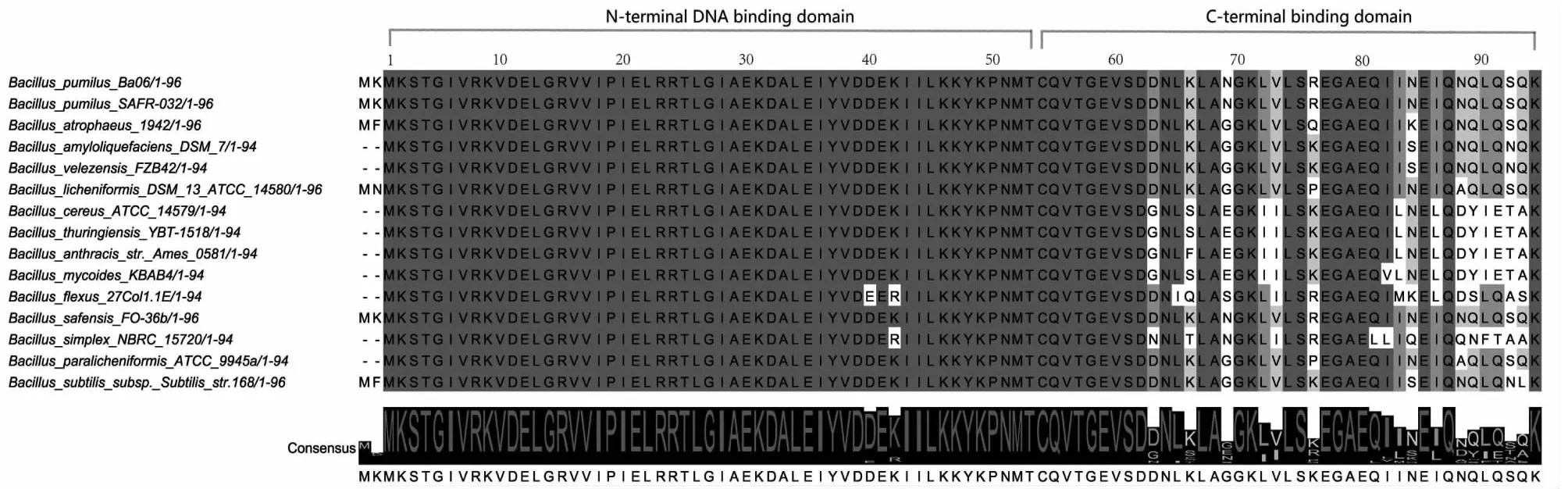
图1 来自各种芽孢杆菌属的AbrB的氨基酸比对Fig.1 Amino acid alignment of AbrB from various Bacillusspecies
2.2 abrB基因敲除突变体构建
为研究AbrB在短小芽孢杆菌中的生物学功能,首先需要构建abrB基因敲除突变菌株。将用于abrB基因无痕敲除的重组载体pUCETs-ΔabrB电转化SCU12,验证获得正确的转化子后,采用两步筛选策略(质粒整合与删除)以获得abrB基因无痕敲除菌株(图2)。
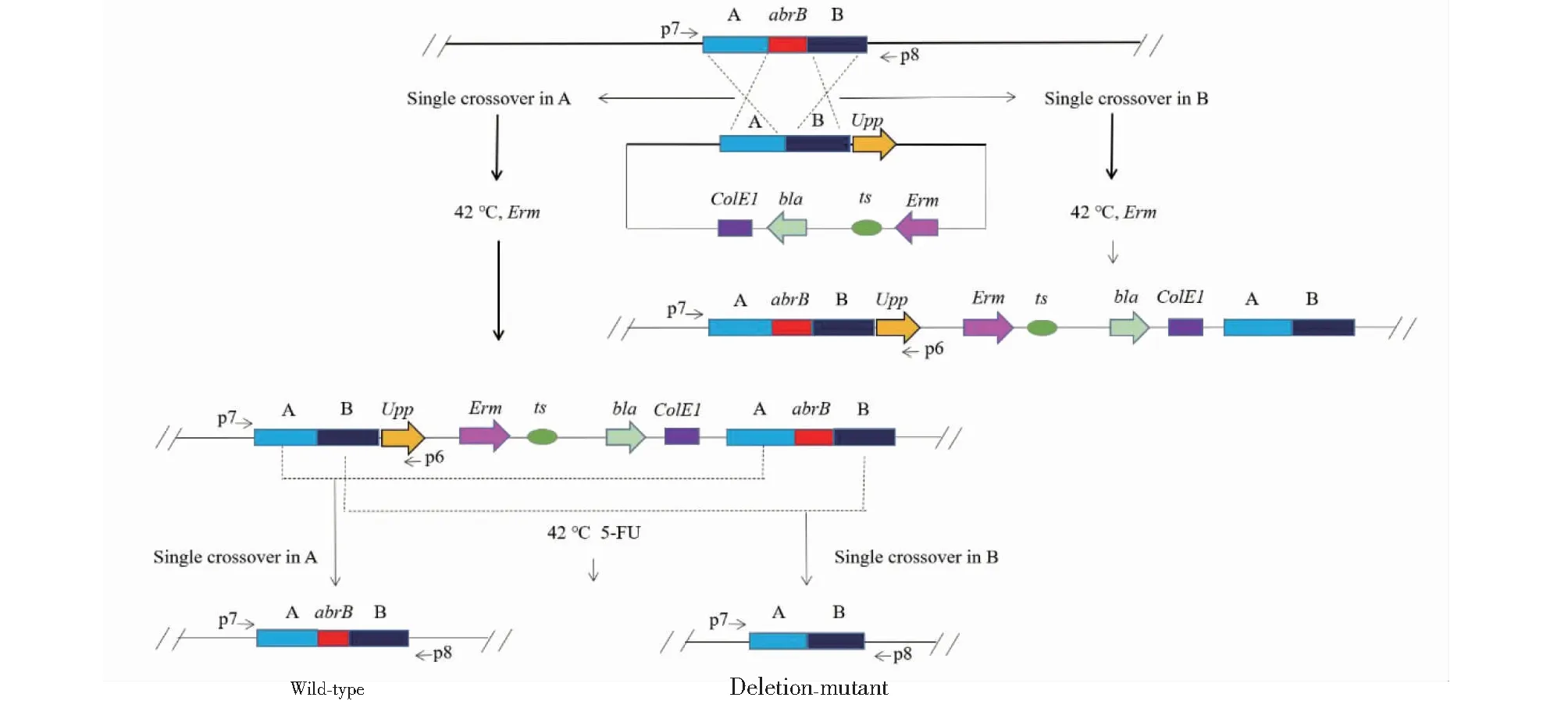
图2 基于无痕修饰系统的基因敲除策略Fig.2 Gene deletion strategy based on markerless modification system
在第一步筛选平板上挑取12个菌落使用abrB基因同源臂外侧引物P7与upp基因引物P6筛选单交换共整合菌株(图3-A),12个单菌落均能扩增出目的条带,但3#、8#、10#、12#比其余8个样品扩增条带稍大一些,这是由于单交换发生的位置不同引起的,若第一次交换发生在同源臂A区,则扩增条带大小为2546 bp;若发生在同源臂B区,则扩增条带大小为2829 bp(两者相差一个待敲除abrB序列大小283 bp)。因此,挑选单交换发生在同源臂A区的菌落进行敲除突变体的筛选。
在第二步筛选平板上挑取15个菌落使用同源臂外侧引物P7/P8进行abrB基因敲除突变体的筛选,该引物对扩增亲本菌株与敲除型菌株的预期扩增条带大小分别为1722和1439 bp(图3-B)。其中2#、3#、7#以及13#菌落PCR条带单一且大小和敲除突变体预期大小1439 bp一致,推测这4个菌落为敲除突变体菌落。5#菌落出现2个条带,大小分别和亲本菌株及敲除型菌株预期大小一致,推测为亲本型和敲除型混合菌落。其余泳道条带大小均和亲本型菌株一致,为亲本型菌落。将2#菌落对应的PCR产物测序,结果表明,abrB基因编码区总共283 bp的区域已被无痕敲除,将该菌株命名为SCU12(ΔabrB)。
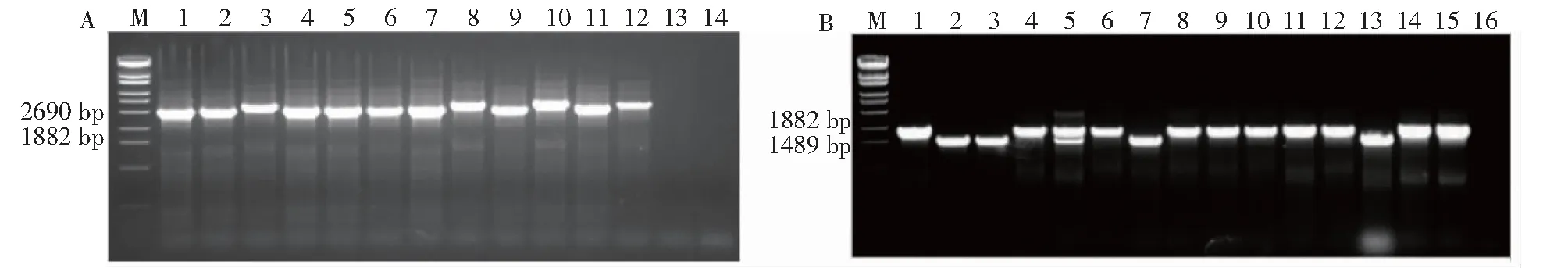
A.筛选单交换共整合转化子。PCR引物使用P6/P7。泳道M:λ-EcoT14 DNA marker;泳道1~12:候选共整合转化子;泳道13:SCU12基因组DNA;泳道14:阴性对照。B.筛选abrB敲除突变体。PCR引物为P7/P8。泳道M:λ-EcoT14 DNA marker;泳道1~15:候选突变体;泳道16:阴性对照。A.Screen single crossing-over cointegrants.PCR primer pairs were P6/P7.Lane M:λ-EcoT14 DNA marker;Lane 1-12:Candidate co-integrator transformer;Lane 13:SCU12 genomic DNA;Lane 14:Negative control.B.Screen abrBdeletion mutants.PCR primer pairs were P7/P8.Lane M:λ-EcoT14 DNA marker;Lane 1-15:Candidate mutants;Lane 16:Negative control.图3 PCR鉴定abrB敲除突变体的琼脂糖凝胶电泳Fig.3 Identification of abrB-deletion mutants by PCR for agarose gel electrophoresis
2.3 abrB基因敲除对细菌生长和形态的影响
在LB和M9基本培养基中分别测定亲本菌株SCU12和突变菌株SCU12(ΔabrB)的生长状况,2个菌株在不同培养基的生长曲线如图4-A所示,无论是丰富培养基LB中,或是营养匮乏的M9培养基中,敲除突变体SCU12(ΔabrB)的生长均明显慢于亲本菌株SCU12。在LB培养基中前4个测量时间点2个菌株的生长不存在显著差异,但是在M9培养基中每个时间点都存在显著差异。推测这是由于在M9培养基中营养物质匮乏,因此将突变菌株的生长劣势放大。结果表明短小芽孢杆菌abrB基因敲除影响菌株的生长。
在M9固体培养基上过夜培养的SCU12和SCU12(ΔabrB),菌落形态如图4-B所示,SCU12为白色油滴状中间凸起,而SCU12(ΔabrB)为偏黄色粗糙凹陷型。表明,abrB敲除影响了菌株的菌落形态及色素合成。
2.4 abrB基因敲除对细菌运动性和生物膜形成的影响
芽孢杆菌属细菌具有鞭毛,能够依靠鞭毛进行各种形式的运动,例如群集运动和泳动[19]。群集运动是细菌以群体形式在培养基表面从接种点开始向四周运动,泳动是单个细菌在液体或半固体培养基表面的迁移运动,使用不同琼脂浓度的平板可以研究这2种运动类型(图5-A,5-B)。群集运动实验表明,培养24 h后,亲本菌株群体运动明显,而突变菌株SCU12(ΔabrB) 几乎不运动。泳动实验显示,2种菌株在培养到48 h时运动均较弱,但统计分析表明,2种菌株的泳动能力在统计学上存在显著差异。表明,abrB基因敲除导致菌株群集运动能力显著下降,对菌株的泳动能力也产生一定程度的影响。
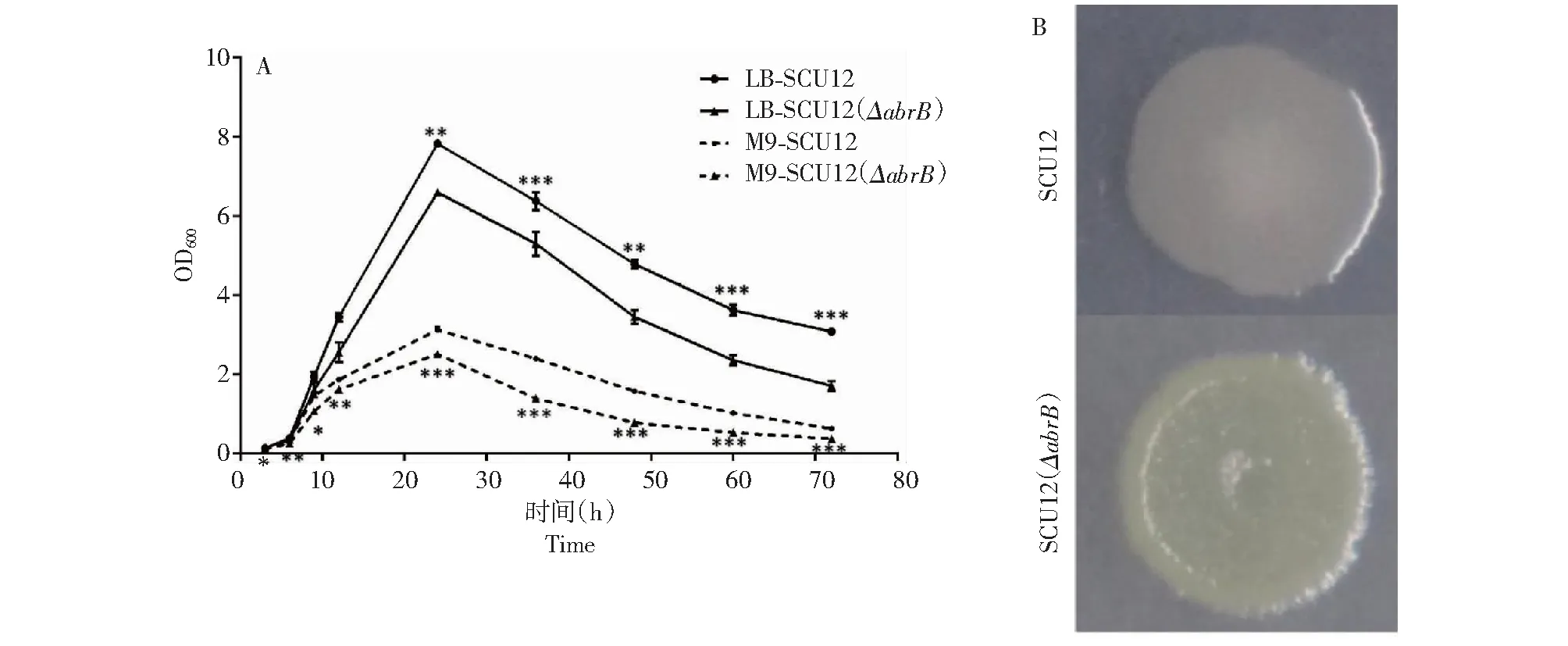
A.abrB敲除突变体(▲)和亲本菌株(●)在LB(__)和M9培养基(- - -)的生长曲线。P<0.05 (*),P<0.01 (**),P<0.001 (***);B.abrB敲除突变体和亲本菌株SCU12在M9培养基的菌落形态,下同。A.Growth curves of abrBnull mutant (▲) and parent strain SCU12 (●) in LB medium (__) and M9 medium (- - -).P<0.05 (*),P<0.01 (**),P<0.001 (***).B.Colony morphology of ΔabrBmutant and parent strain SCU12 in M9 medium,the same as below.图4 abrB敲除突变体对菌株生长和菌落形态的影响Fig.4 Effects of abrBnull mutation on bacterial growth and morphology
细菌的运动性与生物膜的形成密切相关。生物膜是一种微菌落聚集体,主要成分包括蛋白质和胞外多糖,可以帮助细菌抵御外界不良环境[20]。在LB培养基中静置培养2个菌株,观察生物膜的形成(图5-C)。经过18 h的静置培养,SCU12培养物表面产生轻微的絮凝,没有明显的生物膜形成,但突变株在表面产生一层清晰的淡黄色生物膜。然而,当培养持续到48 h,SCU12也形成了一层清晰的淡黄色生物膜,且两种菌株的生物膜厚度非常相近(数据未显示)。表明,abrB的敲除使突变菌株生物膜形成时间提前。
2.5 abrB基因敲除对细菌胞外蛋白酶酶活的影响
蛋白酶是短小芽孢杆菌生长稳定期以后胞外蛋白的主要成分,其生理功能是降解细胞外蛋白,为细菌的生长提供营养。将亲本菌株和突变株菌株接种于蛋白酶发酵培养基中,在不同时间点收集培养上清液,测定胞外蛋白酶活性(图6)。2个菌株在36 h的蛋白酶活性均较低,差异不大。在48 h突变体菌株的产酶量明显增加,酶活性显著高于亲本菌株。在54 h胞外蛋白酶活达到最高值,SCU12为4891 U/mL,SCU12(ΔabrB)为7759 U/mL,此时突变菌株的蛋白酶活性是亲本菌株的1.59倍。说明abrB基因敲除提高了菌株胞外蛋白酶酶活。
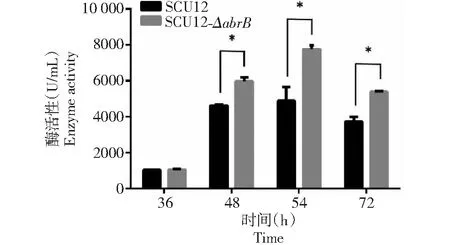
图6 abrB敲除突变对细菌胞外蛋白酶酶活的影响Fig.6 The effect of abrBdeletion mutation on extracellular protease activity of bacteria

A、B.测量运动范围的直径并进行定量评估;C.在LB培养基中静置培养18 h后生物膜形成情况。A,B.The diameters of the motility areas were measured for quantitative assessment;C.Biofilm formation after 18 hours static cultivation in LB medium.图5 abrB敲除突变体对细菌运动性和生物膜形成的影响Fig.5 Effects of abrBnull mutation on bacterial motility and biofilm formation
3 讨 论
AbrB作为重要的过渡态调节因子,在枯草芽孢杆菌中功能研究较多,但在短小芽孢杆菌中的功能尚不明确。通过在NCBI上进行nblast比对,本研究发现短小芽孢杆菌和枯草芽孢杆菌AbrB的基因序列和氨基酸序列高度相似,但在蛋白C-端存在差异,这些差异可能与AbrB物种特异性的功能相关。本研究发现abrB基因敲除后突变菌株的生长显著降低,证明abrB对细菌的正常生长有促进作用。在枯草芽孢杆菌[21]和地衣芽孢杆菌中也发现,abrB敲除后对细菌的生长有负面影响[12]。此外,M9基本培养基平板上突变菌株菌落形态的变化,暗示abrB敲除影响了菌株的菌落形态及色素合成,这在以往的研究中尚未见报道,其影响的机制还有待进一步研究。
芽孢杆菌属细菌具有鞭毛,能够依靠鞭毛进行各种形式的运动,有助于细菌向营养物质处前进,并且逃离有害环境,对细菌的生存有重要的意义[19]。群集运动和泳动实验分析显示,abrB敲除菌株运动性降低,其中对菌株群集运动能力影响较明显。Kassem等[22]在枯草芽孢杆菌中也发现abrB敲除导致运动能力下降。细菌的运动性和生物膜的形成紧密相关,都对细菌的生存有重要作用。本研究还发现AbrB可以抑制生物膜的形成。研究人员在枯草芽孢杆菌和解淀粉芽孢杆菌也发现AbrB可以抑制生物膜的形成,并且揭示了AbrB可以通过抑制生物膜形成相关基因表达从而抑制生物膜的形成[14]。一般认为AbrB和SinR是芽孢杆菌在生物膜和游离生存状态之间转化的关键因素,细菌为响应外部环境压力,在生物膜形成初期,abrB和sinR基因被上调,增强细胞运动性并抑制胞外多聚物的分泌以阻止生物膜的形成;当细菌在气-液界面聚集时,abrB和sinR都被下调,降低细胞运动性并增加胞外多聚物的分泌,从而使生物膜迅速形成[23]。而在蜡状芽孢杆菌中,abrB表达被发现和生物膜形成呈正相关[24]。这些结果表明,AbrB对细菌运动和生物膜形成有不同的调控效果。
短小芽孢杆菌在生长后期产生大量重要的胞外酶及次级代谢物,本研究发现亲本菌株和突变菌株间酶活有明显差异,且突变菌株的胞外蛋白酶活性较亲本明显提高,说明abrB基因的表达和胞外蛋白酶活性呈负相关。作为过渡态调节因子,AbrB主要在对数期抑制蛋白酶基因(如aprE)的表达,但有研究显示,abrB敲除并不会在对数期导致aprE启动子驱动的报告基因的高表达[25]。然而,也有研究表明,尽管枯草芽孢杆菌转录抑制因子CodY和ScoC的双突变体在对数生长期没有导致2种主要胞外蛋白酶AprE和NprE的高水平表达,但AbrB的进一步敲除则导致对数期蛋白酶高水平表达[26],然而这些研究结果均没有检测敲除突变体在稳定期及以后的蛋白酶水平。遗传学课题组前期转录组数据分析显示,AbrB在短小芽孢杆菌BA06(SCU11的原始菌株)培养到48 h时表达量降低,在48 h之前表达量较高,而在48 h后表达量逐渐降低[27]。而本研究结果显示,短小芽孢杆菌abrB敲除菌株在培养到生长后期,即48 h时胞外蛋白酶酶活才呈现出显著差异。在枯草芽孢杆菌中,转录抑制因子AbrB、ScoC、CodY和SinR可以结合到aprE基因启动子区域抑制转录的起始[25-26,28],并且它们在aprE启动子的结合区域部分重叠。在短小芽孢杆菌BA06中,Liu等[29]也预测AbrB是aprE的抑制剂。本研究推测在短小芽孢杆菌发酵早期,由于AbrB、ScoC、CodY和SinR等转录抑制因子表达水平较高,过饱和地抑制aprE的转录从而造成胞外蛋白酶酶活较低,即使abrB基因敲除后在这个时间段其它调控因子还是可以强烈地抑制aprE的表达,最终表现为在发酵到36 h时亲本菌株和突变菌株之间酶活无显著差异。当菌株发酵培养到后期这些转录抑制因子表达水平下降,对aprE的抑制作用逐步解除,胞外蛋白酶酶活逐渐增加,abrB基因敲除的效应得以体现,最终导致发酵后期突变菌株酶活高于亲本菌株。
4 结 论
本研究首先通过反向筛选的方法对abrB基因进行无痕敲除,获得abrB基因敲除突变体SCU12 (ΔabrB)。其次,生长曲线测定结果显示,abrB基因敲除后突变株生长显著降低,证明abrB对细菌的正常生长有促进作用。在M9基本培养基平板培养中观察菌落形态,发现突变菌株菌落表面变得粗糙且颜色偏黄。群集运动和泳动实验分析显示,abrB敲除菌株运动性降低,其中对菌株群集运动能力影响较大。此外,abrB敲除突变体菌株形成生物膜的时间提前,说明AbrB可以抑制生物膜的形成。最后,蛋白酶活性测定结果显示,在发酵培养48 h后亲本菌株和突变菌株间酶活表现出显著差异,2个菌株的酶活都在54 h达到最高值,突变菌株的胞外蛋白酶活性是亲本菌株的1.59倍,说明abrB基因的表达和胞外蛋白酶活性呈负相关。综上所述,abrB基因在短小芽孢杆菌多个生理过程中扮演着关键的调节作用,特别是AbrB可调节重要的胞外酶及次级代谢物的表达,abrB基因的破坏显著增加了胞外蛋白酶的产生,为改善工业酶生产菌株提供了新途径。

